La toxocariasis es una infección parasitaria producida por un helminto que en el ser humano no alcanza su estadio adulto. El hombre es para sus especies, Toxocara canis y Toxocara cati, un hospedador paraténico. Dicha infección puede producir el síndrome de larva migrans visceral, el síndrome de larva migrans ocular y la toxocariasis inaparente. En el síndrome de larva migrans visceral el compromiso de órganos puede incluir hígado, pulmón, piel, sistema nervioso, musculoesquelético, riñón y corazón. Sobre este último, cada vez se reconoce más la importancia que pueden tener las manifestaciones cardiovasculares de la toxocariasis y la relevancia clínica de considerarlas. En el presente artículo, haciendo una búsqueda sistemática de información, se revisan los principales aspectos clinicopatológicos de las manifestaciones cardiovasculares de la toxocariasis incluyendo su fisiopatología, hallazgos de laboratorio, diagnóstico y opciones terapéuticas, con el objeto de llamar la atención acerca de la importancia de esta zoonosis y su relevancia para la medicina cardiovascular en adultos y en niños.
Toxocariasis is a parasitic infection produced by helminths that cannot reach their adult stage in humans. For their etiological species (Toxocara canis and Toxocara cati), man is a paratenic host. Infection by such helminths can produce a variety of clinical manifestations, such as: visceral larvae migrans syndrome, ocular larvae migrans syndrome and covert toxocariasis. In the visceral larvae migrans syndrome, the organs that are mainly involved include liver, lungs, skin, nervous system, muscles, kidneys and the heart. Regarding the latter, the importance of cardiovascular manifestations in toxocariasis, as well as its clinical relevance, has increasingly begun to be recognized. The current article is based on a systematic information search, focused mainly on the clinical and pathological aspects of cardiovascular manifestations in toxocariasis, including its pathophysiology, laboratory findings, diagnosis and therapeutical options, with the objective of highlighting its importance as a zoonosis and its relevance to the fields of cardiovascular medicine in adults and children.
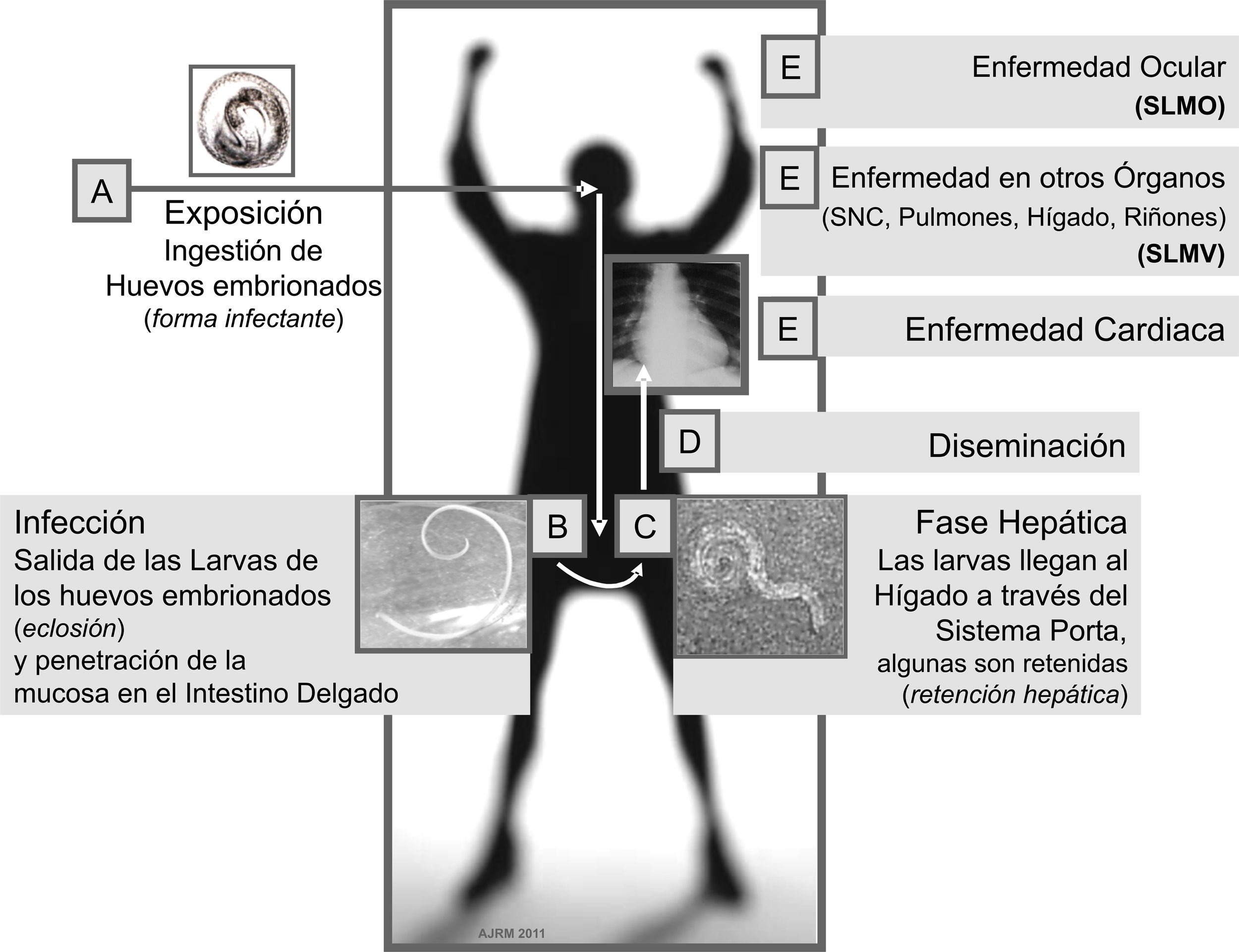
La toxocariasis (o toxocariosis) (codificada en la Clasificación Internacional de Enfermedades como CIE-9 128.0; CIE-10 B83.0) es una zoonosis parasitaria derivada de la infección que en los seres humanos produce Toxocara canis (T. canis) y en menor medida Toxocara cati (T. cati), 2 ascáridos del género Toxocara spp. que en su estado adulto viven en el intestino delgado del perro y el gato, respectivamente, y cuyos huevos larvados, al ser ingeridos accidentalmente por el ser humano, eclosionan en el intestino en donde pueden sobrevivir en su estadio larvario y migrar así durante años a través de los diferentes órganos y tejidos (fig. 1), pudiendo causar desde reacciones inflamatorias locales con poca relevancia clínica hasta complejos cuadros orgánicos ó sistémicos que pueden conducir incluso a la muerte1–3.
Clínicamente se reconocen 3 grandes formas de presentación: el síndrome de larva migrans visceral (SLMV), caracterizado por comprometer órganos tales como el hígado4, los pulmones5, la piel6, el sistema nervioso y el musculoesquelético7, el corazón8 y los riñones;9 el síndrome de larva migrans ocular en el cual los ojos y los nervios ópticos son las principales estructuras afectadas (fig. 1) y finalmente la toxocariasis inaparente o encubierta (covert toxocariasis), forma más leve, que comprende un espectro clínico que va desde una infección casi asintomática hasta la migración de larvas a órganos blanco específicos1,2,10,11. No obstante, las manifestaciones clínicas y el pronóstico de la enfermedad no solo dependen del órgano en el cual se localice la larva migrante sino que, además, su evolución estará determinada por la cantidad del inóculo, la frecuencia de reinfecciones y la respuesta inmunológica del individuo, entre otros factores actualmente en estudio, tales como la constitución inmunogenética e inmunosusceptibilidad del hospedador1,2.
Desde su descripción, hecha por primera vez por Heleanor Campbell Wilder en 1950, en el Departamento de Patología Ocular del Instituto de Patología de las Fuerzas Armadas de los Estados Unidos de América (Armed Forces Institutes of Pathology)11, múltiples reportes informaron no solo acerca del compromiso ocular y hepático, como principales lugares de afección. Además de manera creciente se reconoce la importancia que puede tener en otras estructuras anatómicas y sistemas, inclusive el ámbito cardiovascular12,13. Por ejemplo, algunos autores refieren que la miocarditis podría presentarse en un 10 a 15% de los casos de SLMV, lo que enfatiza la importancia de considerar este tipo de manifestaciones cardiovasculares de la toxocariasis8,13.
En el presente artículo se ha realizado una búsqueda sistemática de información en las bases de datos Index Medicus/MEDLINE (www.pubmed.com), Scopus (www.scopus.com), SciELO (www.scielo.org), IMBIOMED (www.imbiomed.com) y LILACS (www.bireme.br), bajo los términos (en inglés Medical Subject Headings, MeSH; en español Descriptores en Ciencias de la Salud, DeCS) «toxocariasis», «Toxocara», «cardiac», «cardiovascular», sin restricción inicial del lenguaje, considerando particularmente artículos en inglés, español y portugués, con el fin de revisar los principales aspectos clinicopatológicos de las manifestaciones cardiovasculares de la toxocariasis inclusive su fisiopatología, hallazgos de laboratorio y opciones terapéuticas, con el objeto de llamar la atención acerca de la importancia de esta zoonosis y su relevancia para la medicina cardiovascular en adultos y en niños, en especial porque hasta donde nosotros sabemos no existen artículos de revisión previos sobre estas manifestaciones.
Al hacer la búsqueda en MEDLINE se encontraron inicialmente 91 artículos, de los cuales se seleccionaron 40 que correspondían exclusivamente a seres humanos. Al buscar en Scopus se encontraron 15 referencias adicionales, de las cuales se seleccionaron 5 artículos. En SciELO se localizaron 20 referencias, pero no se encontraron referencias adicionales, distintas a las ya seleccionadas en la base MEDLINE. En IMBIOMED, de un total de 17 referencias no se seleccionó ninguna para la revisión. Al final se seleccionaron 45 artículos para su detallada revisión e inclusión en el presente trabajo, de los cuales 22 conciernen a los aspectos cardiovasculares de la toxocariasis. Además se tomaron en cuenta otras referencias complementarias generales sobre los aspectos clínicos, epidemiológicos, diagnósticos, terapéuticos y preventivos de la toxocariasis14–83.
EpidemiologíaLa toxocariasis es una enfermedad de distribución mundial. En América Latina las seroprevalencias van del 1.8 al 66.6%1. Su amplia presencia se relaciona con la constante necesidad del hombre de vivir rodeado de mascotas (perros y gatos) lo cual ha facilitado su persistencia1,14. Los niños en edad escolar suelen ser el grupo de mayor ocurrencia debido a sus hábitos higiénicos, la geofagia o pica, su frecuente contacto con animales, la exposición a lugares de juego contaminados (cajas de arena desprotegidas en parques públicos) y el consumo de vegetales y frutas mal lavadas14–18. Debido a la viabilidad de las larvas durante largos períodos en los tejidos humanos y a la posibilidad de reinfecciones, la seropositividad podría aumentar a medida que avanza la edad14.
Así como en otras enfermedades parasitarias, la población más afectada por la toxocariasis es aquella con un bajo nivel socioeconómico debido a las precarias condiciones a las cuales se suelen someter a sus habitantes11,14,18–22. Sin embargo, aun en países desarrollados, incluso cuando la prevalencia de enfermedades parasitarias suele ser baja, la toxocariasis es una de las helmintiasis más frecuentes14. Su seroprevalencia puede variar entre el 2 y el 14% en áreas urbanas22,23, hasta el 37% en zonas rurales10,14; en países en desarrollo, fuera de América Latina, se han reportado datos que van desde menos del 2% hasta cifras del 93% de prevalencia14,17,24,25. Aun así, debido a que en muchos países esta enfermedad es infrecuente y no se notifica adecuadamente y a que muchos de los casos cursan de manera asintomática, los valores reales de prevalencia, incidencia, morbilidad y mortalidad se desconocen para la mayoría de los territorios afectados1,3,14. En ningún país de América Latina se lleva registro de notificación de toxocariasis, incluso a pesar de existir casos fatales del SLMV50,67,77; rara vez se encuentran casos reportados en los registros de mortalidad.
Ciclo de vidaEn el perro, hospedador definitivo de T. canis, la infección por el parásito puede producirse por diferentes mecanismos26,27. Una vez los huevos embrionados son ingeridos, estos pasan al intestino en donde liberan las larvas, las cuales a su vez penetran la mucosa intestinal y por vía circulatoria llegan a los pulmones en donde después de alcanzar el árbol bronquial son deglutidas y llegan de nuevo al intestino en donde alcanzan su estadio adulto entre los 60 y 90 días después de su liberación1,11,26,28. Posteriormente se lleva a cabo el proceso de fecundación a partir del cual una hembra de T. canis puede producir hasta 200.000 huevos no embrionados por día para que estos sean eliminados en las heces del animal1,11,26–29.
El hombre, hospedador paraténico del parásito, puede adquirir la infección al entrar en contacto con suelos contaminados con huevos embrionados de Toxocara spp. o con menor frecuencia al usar como fuente de alimento otro hospedador en cuyos tejidos se encuentren las larvas del parásito (por ejemplo, aves como el pato, el pollo o la gallina)1,26,27,30–35.
En el hospedador paraténico (el hombre y otros animales, diferentes al perro y al gato) las larvas son liberadas en el estómago e intestino delgado a partir de la ingesta de huevos embrionados, para luego penetrar la mucosa duodenal y tras acceder a la circulación enterohepática poder alcanzar la circulación general desde donde tienen la capacidad de acceder a casi cualquier órgano (fig. 1)1,11. No obstante, el hígado suele verse comprometido con mayor frecuencia quizá debido a que, como se mencionó, es el primer órgano en donde potencialmente podrían alojarse las larvas una vez que salen del intestino32. Ya en el hígado, la larva puede continuar su migración con la posibilidad de acceder a otros órganos o verse enfrentada a una respuesta inmunológica a partir de la cual puede ser destruida o permanecer latente durante largos períodos que pueden ir de meses a años, con oportunidad de que luego pueda llegar a reactivarse y producir enfermedad1. No obstante, en muchos casos la infección no conlleva alteraciones1,10.
FisiopatologíaComo ya se mencionó, varios factores han sido implicados en la fisiopatogenia de la toxocariasis: el estado inmunológico del hospedador, el tamaño del inóculo, la sensibilización del hospedador a los antígenos propios de las larvas así como a los productos de secreción y/o excreción liberados por las mismas y, por último, la reacción inflamatoria que se desencadena por la presencia de las larvas en los diferentes tejidos en los cuales pudieran encontrarse26. Esta reacción inflamatoria suele caracterizarse por la formación de un granuloma eosinofílico alrededor de la larva, el cual, al mismo tiempo que tiene la capacidad de eventualmente detener su migración y causar su muerte, es responsable en gran medida de la enfermedad producida en el hospedador1.
El SLMV suele observarse con mayor frecuencia en niños menores de 5 años de edad y se encuentra asociado a una mayor cantidad de larvas de Toxocara spp.11,26. El grado de afección producida en el hospedador así como los signos y síntomas varían en relación con el tejido invadido11. De esta forma, en pacientes con compromiso hepático puede aparecer hepatomegalia, dolor abdominal, hiporexia, y agitación, entre otros signos como la alteración del perfil bioquímico hepático (transaminasas, fosfatasa alcalina, deshidrogenasa láctica, entre otras)28. En aquellos con compromiso del sistema nervioso se han descrito manifestaciones como vasculitis cerebral, neuritis óptica, epilepsia, meningitis, encefalitis y mielitis eosinofílica cuando hay daño del sistema nervioso central, y radiculitis, afecciones musculoesqueléticas y compromiso de pares craneales (por ejemplo, del séptimo par) cuando la lesión se produce a nivel del sistema nervioso periférico7,36. A nivel pulmonar T. canis ha sido propuesto como un factor de riesgo ambiental para el asma1,11,37–39. La migración de las larvas puede producir tos y sibilancias acompañadas de infiltrados pulmonares28,33; de igual forma se han descrito casos de SLMV pulmonar asociados a derrame pleural eosinofílico40 y neumonía eosinofílica crónica5. En piel, hay evidencia disponible que relaciona Toxocara spp. con afecciones como prurigo y urticaria11. Asimismo se han reportado casos de celulitis eosinofílica y exantema como manifestaciones cutáneas asociadas a esta parasitosis6,41. En el riñón la respuesta inflamatoria asociada a la invasión de la larva ha sido implicada en casos de síndrome nefrótico9. T. canis también ha sido sugerido como una de las posibles causas de los trastornos funcionales intestinales11 y otros casos reportados han informado sobre otras afecciones gastrointestinales asociada a ascitis29. Por último, hay evidencia que sugiere una alta probabilidad de que algunos casos de artritis eosinofílica sean secundarios a infección por Toxocara spp.42.
El síndrome de larva migrans ocular suele presentarse en personas mayores de 5 años de edad y, a diferencia del SLMV, puede con frecuencia asociarse con una menor cantidad de larvas de Toxocara spp.1,11,43.
La respuesta inmunológica ante la infección por Toxocara spp. suele caracterizarse por un aumento de las inmunoglobulinas IgG, IgM e IgE, acompañado de una marcada eosinofilia periférica1,11.
En la literatura se han descrito con detalle las características histopatológicas de los granulomas1,11,71–73.
Manifestaciones cardiovascularesAunque en toxocariasis con frecuencia se hace referencia a la posibilidad de la migración larvaria al corazón1,8,11–13, han sido relativamente pocos los casos publicados en donde dicho compromiso ha sido evidente44–68,77. Sin embargo, debe recordarse también lo poco que se investiga la toxocariasis en comparación con otras enfermedades infecciosas que pueden afectar el sistema cardiovascular. Por ejemplo, en la base de datos MEDLINE existen 29.519 registros de artículos sobre «endocarditis»; 11.401 para «enfermedad de Chagas» (Chagas disease), pero solo 2.207 para «toxocariasis» (al 31 de enero de 2012). De esta forma, a pesar de que algunos autores han descrito que del 10 al 15% de los pacientes con SLMV podría presentar miocarditis, la verdadera frecuencia, de esta y otras afecciones cardíacas, asociada a infección por Toxocara spp. aún se desconoce8,13.
Las principales afecciones cardíacas asociadas a toxocariasis, descritas hasta el momento, incluyen: endomiocarditis, miocarditis, pericarditis, pericarditis eosinofílica, derrame pericárdico y seudotumores cardíacos12,31,44–53. Estas lesiones pueden ser producto de la invasión larvaria al tejido cardíaco o ser secundarias a la lesión producida por la reacción inflamatoria subsecuente1,13,44. De igual forma, algunos autores han propuesto que la obstrucción de los vasos sanguíneos al paso de las larvas, que conlleva isquemia, podría explicar en parte el daño miocárdico, sin embargo no hay pruebas contundentes que respalden dicha hipótesis13. A pesar de ello es importante tener presente una potencial peor evolución de la toxocariasis con compromiso cardiovascular en aquellos pacientes con otras enfermedades cardiovasculares de base (arteriosclerosis, cardiopatía isquémica, disfunción endotelial, entre otras)13.
En estudios experimentales llevados a cabo en ratones a los cuales se ha inoculado el parásito para observar las lesiones producidas a nivel miocárdico, se ha observado que tras una semana de infección los primeros cambios histológicos muestran una infiltración lineal de células localizada entre los miocitos, compuesta por eosinófilos e histiocitos/linfocitos sin evidencias de daño miocárdico ni presencia aparente de larvas13. Estos infiltrados se encontraron distribuidos de manera focal y predominante a nivel miocárdico. Tras 2 semanas de haber inducido la infección se empezaron a observar granulomas distribuidos equitativamente en endocardio, miocardio y pericardio, acompañados de microabscesos con desechos nucleares y pequeños fragmentos de miocitos acompañados de un marcado aumento de la eosinofilia en las células infiltradas entre las fibras musculares. De igual forma, en ese momento se lograron observar estructuras pertenecientes a una larva, las cuales se encontraban rodeadas por una mínima reacción inflamatoria. A partir de la tercera semana los niveles de eosinofilia continuaron en aumento y se empezó a observar fibrosis en la periferia de los granulomas, la cual se hizo cada vez más prominente hasta reemplazar en casi su totalidad a los granulomas en el día 42, momento en el cual los niveles de eosinofilia descendieron mucho. A lo largo del estudio se formaron de nuevo múltiples granulomas en los corazones infectados con un comportamiento similar al descrito con anterioridad, lo cual según los autores indica la continua migración de la larva a lo largo del tejido. Al cabo del estudio, que en total tuvo una duración de 8 semanas, no hubo evidencia de fibrosis difusa endotelial o endocárdica, sin embargo, debido a la constante formación de granulomas que se continúa a partir de ese momento, existe un alto riesgo de fibrosis miocárdica grave con el avance del tiempo13.
Es bien conocido que una de las características típicas del SLMV es un alto conteo de eosinófilos en sangre (eosinofilia periférica, mayor del 4% de las células blancas o leucocitos y/o >500 cél/mm3), que en algunos casos puede alcanzar cifras tan altas como 26.000 cél/mm3 en asociación con la miocarditis eosinofílica por T. canis (valores relativos >30% y/o >1.500 cél/mm3 se corresponden con hipereosinofilia)1,8,11. La endomiocarditis eosinofílica forma parte del grupo de complicaciones que siguen al síndrome hipereosinofílico45,46. De tal forma, como lo indican los resultados antes descritos, la capacidad de los eosinófilos de infiltrar el endomiocardio puede traer graves consecuencias en el mismo, y puede generarse necrosis de los cardiomiocitos y fibrosis miocárdica focal13,45,46. Existen informes sobre pacientes en quienes se ha producido la muerte debido a miocarditis aguda fulminante secundaria a necrosis miocárdica severa asociada a depósitos de proteína básica mayor y otras sustancias propias de la degranulación de eosinófilos a nivel del miocardio46. Asimismo, en experimentos con ratones, se ha demostrado que la infiltración de eosinófilos entre las fibras miocárdicas es suprimida por la administración de anticuerpos monoclonales anti-CD18 y anti-VLA-4, al mismo tiempo que la fibrosis focal del músculo cardíaco se suprime con la administración combinada de anticuerpos monoclonales anti-CD18 y anti-ICAM-145. Estos hallazgos, podrían explicar en parte la lesión miocárdica que sobreviene después de una infección por Toxocara spp. y abren las puertas a un campo de estudio interesante sobre la fisiopatogenia de este tipo de lesiones.
Derrame pericárdicoEl derrame pericárdico ha sido reportado como un signo clínico asociado a la infección por Toxocara spp., y se encontró en varios de los casos de toxocariasis con compromiso cardíaco8,31,48. En una mujer de 31 años de edad hospitalizada debido a un síncope de 1min de duración y dolor abdominal de 3 días de evolución asociado a diarrea acuosa y cifras de presión arterial de 78/42mmHg (presión arterial sistólica y diastólica), se descubrió un derrame pericárdico moderado en el ecocardiograma y la tomografía axial computarizada, acompañado de derrame pleural y aumento de los valores de péptido natriurético cerebral. En la radiografía de tórax se evidenció un aumento del índice cardiotorácico y el conteo de células sanguíneas mostró leucocitosis con eosinofilia. Después de descartar otras posibles etiologías, su diagnóstico fue confirmado por títulos séricos elevados de IgG contra T. canis, tras lo cual se inició manejo con metilprednisolona 3mg/día durante 3 días y albendazol 600mg/día durante 7 semanas, con mejoría total del cuadro y recuperación de los niveles de eosinófilos durante 9 meses de seguimiento31.
Miocarditis eosinofílicaEs posible que la miocarditis sea la afección cardíaca que con mayor frecuencia se asocia a toxocariasis y, al igual que en las manifestaciones de otros órganos, suele acompañarse de eosinofilia8,47. Un hombre de 26 años de edad se presentó con disnea, dolor torácico, palpitaciones y fatiga. Al examen físico fue evidente pulso paradójico, taquicardia y ritmo de galope. El electrocardiograma mostró una elevación del segmento ST en todas las derivaciones a excepción de aVR, V1 y V2, y en el ecocardiograma se observó derrame pericárdico e hipocinesia del ventrículo izquierdo con aumento en el espesor de sus paredes. El conteo de células sanguíneas mostró leve leucocitosis y eosinofilia. Asimismo se encontraron niveles elevados de creatinfosfocinasa (679 UI/l), proteína C reactiva (1.4mg/dl), lactato deshidrogenasa (733 UI/l), alanino aminotransferasa (182 UI/l) y aspartato aminotransferasa (124 UI/l). Su diagnóstico inicial fue de miocarditis de etiología desconocida y al cabo de 2 semanas sus síntomas tuvieron mejoría gradual y se normalizaron los hallazgos en el electrocardiograma. Sin embargo, un nuevo conteo de células sanguíneas evidenció un marcado aumento del número de eosinófilos hasta 26.000 cél/mm3, acompañado de un incremento de los niveles de lactato deshidrogenasa hasta 1.069 UI/l. Su diagnóstico fue confirmado por la presencia de anticuerpos contra T. canis, tras lo cual el paciente refirió haber consumido carne cruda en diferentes ocasiones. Fue tratado con albendazol y prednisolona, y se observó disminución progresiva de los eosinófilos y una resolución total del cuadro 3 meses después de finalizado el tratamiento8.
Otro paciente de 19 años de edad comenzó con dolor torácico47. De manera similar al paciente anteriormente descrito, tuvo elevación del segmento ST en todas las derivaciones del electrocardiograma a excepción de aVR. La radiografía de tórax mostró cardiomegalia, congestión pulmonar y derrame pleural izquierdo. Tras su ingreso tuvo choque cardiogénico por lo cual le administraron dopamina. Se hizo diagnóstico de mio/pericarditis de etiología desconocida por lo cual fue trasladado a otra institución, en donde ingresó con taquicardia, hipotensión y pulso paradójico. Al examen físico se hizo audible un tercer ruido cardíaco y se evidenció ingurgitación yugular. El conteo de células sanguíneas mostró neutrofilia (22.900 cél/mm3) con eosinofilia (1.053 cél/mm3). Tuvo niveles elevados de proteína C reactiva (4mg/dl) y proteína catiónica eosinofílica (54.9 ng/ml; valores normales <14.7ng/ml). El ecocardiograma mostró marcada hipocinesia y engrosamiento de las paredes del ventrículo izquierdo con fracción de eyección del 23.8% y derrame pericárdico. La angiografía coronaria no reveló ninguna alteración. Se realizó biopsia endomiocardica del ventrículo derecho en la cual se evidenció edema, acompañado de infiltrado inflamatorio intersticial difuso compuesto de eosinófilos con degranulación parcial y necrosis miocárdica. No se hallaron larvas en la biopsia. El diagnóstico fue hecho por la presencia de anticuerpos IgG contra T. canis. Este paciente también refirió haber comido carne de venado cruda una semana antes de la presentación del cuadro. Al final se hizo diagnóstico de miocarditis eosinofílica secundaria a reacción de hipersensibilidad por SLMV. El paciente fue tratado con metilprednisolona y albendazol, con resolución total del cuadro y normalización del conteo de eosinófilos47.
En Argentina, en el año 2003, se publicó un estudio en el cual se describieron los hallazgos clínicos y de laboratorio de 54 niños en edad escolar con toxocariasis. En este reportaron un paciente con miocarditis, con completa recuperación clínica a quien le practicaron una biopsia endomiocárdica en la cual se evidenció la presencia de granulomas eosinofílicos10.
Pericarditis eosinofílicaAl parecer, de manera similar a lo ocurrido en los estudios experimentales con ratones, la infección por Toxocara spp. en el ser humano puede afectar el endocardio, el miocardio y el pericardio13,48. Un paciente de 50 años de edad que acudió con disnea y derrame pleural izquierdo y un conteo de eosinófilos de 600 cél/mm348. Al examen físico existía taquicardia, taquipnea y disminución tanto en los ruidos cardíacos como en los respiratorios. La radiografía de tórax mostró derrame pleural bilateral con aumento de la silueta cardíaca. Un nuevo conteo de células sanguíneas evidenció neutrofilia (15.400 cél/mm3) y eosinofilia (2.200 cél/mm3). Las enzimas hepáticas se encontraron levemente elevadas. La electroforesis de proteínas séricas fue normal y la velocidad de sedimentación globular fue de 42mm en la primera hora. Pocas horas después de iniciados los signos y síntomas el paciente desarrolló taponamiento cardíaco tras lo cual fue intervenido con pericardiotomía subxifoidea en la cual drenaron 800ml de líquido pericárdico que contenía 45g/L de proteínas y cuyas células se encontraban compuestas por eosinófilos en un 20%. De manera similar se drenaron 1.500ml del espacio pleural con un 7% de eosinófilos. Se realizó biopsia pleural y pericárdica en las cuales se evidenció inflamación subaguda inespecífica con escasa infiltración de eosinófilos. Los niveles de IgE fueron 149 kUI/L (normal <150 kUI/L). El diagnóstico se realizó por la presencia de anticuerpos contra Toxocara spp. tras lo cual fue tratado con ivermectina con posterior descenso del conteo de eosinófilos y resolución total del cuadro. El paciente fue seguido durante un año, al cabo del cual tenía buenas condiciones de salud48.
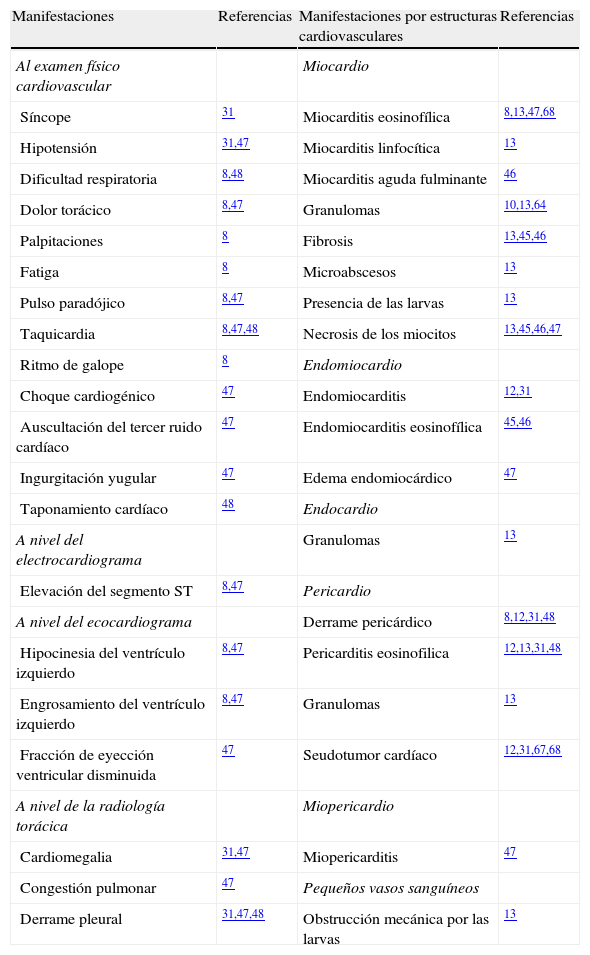
En resumen, como se puede apreciar en la tabla 1, el espectro de compromiso y manifestaciones cardiovasculares en la toxocariasis puede ser bastante amplio.
Manifestaciones cardiovasculares de la toxocariasis
| Manifestaciones | Referencias | Manifestaciones por estructuras cardiovasculares | Referencias |
| Al examen físico cardiovascular | Miocardio | ||
| Síncope | 31 | Miocarditis eosinofílica | 8,13,47,68 |
| Hipotensión | 31,47 | Miocarditis linfocítica | 13 |
| Dificultad respiratoria | 8,48 | Miocarditis aguda fulminante | 46 |
| Dolor torácico | 8,47 | Granulomas | 10,13,64 |
| Palpitaciones | 8 | Fibrosis | 13,45,46 |
| Fatiga | 8 | Microabscesos | 13 |
| Pulso paradójico | 8,47 | Presencia de las larvas | 13 |
| Taquicardia | 8,47,48 | Necrosis de los miocitos | 13,45,46,47 |
| Ritmo de galope | 8 | Endomiocardio | |
| Choque cardiogénico | 47 | Endomiocarditis | 12,31 |
| Auscultación del tercer ruido cardíaco | 47 | Endomiocarditis eosinofílica | 45,46 |
| Ingurgitación yugular | 47 | Edema endomiocárdico | 47 |
| Taponamiento cardíaco | 48 | Endocardio | |
| A nivel del electrocardiograma | Granulomas | 13 | |
| Elevación del segmento ST | 8,47 | Pericardio | |
| A nivel del ecocardiograma | Derrame pericárdico | 8,12,31,48 | |
| Hipocinesia del ventrículo izquierdo | 8,47 | Pericarditis eosinofilica | 12,13,31,48 |
| Engrosamiento del ventrículo izquierdo | 8,47 | Granulomas | 13 |
| Fracción de eyección ventricular disminuida | 47 | Seudotumor cardíaco | 12,31,67,68 |
| A nivel de la radiología torácica | Miopericardio | ||
| Cardiomegalia | 31,47 | Miopericarditis | 47 |
| Congestión pulmonar | 47 | Pequeños vasos sanguíneos | |
| Derrame pleural | 31,47,48 | Obstrucción mecánica por las larvas | 13 |
La cursiva de la 3.a columna indica las subcategorías.
El diagnóstico etiológico certero de la toxocariasis suele ser difícil de realizar1–3. Deben tomarse en cuenta los antecedentes epidemiológicos de importancia. En el caso del SLMV, los hallazgos de laboratorio más consistentes son eosinofilia, leucocitosis y disminución de la relación albúmina/globulina. El estudio imagenológico suele ser de importancia, el cual con las técnicas de ultrasonido de alta resolución puede revelar áreas hipoecoicas en el hígado, y dado su carácter no invasivo, es preferible al uso de la biopsia hepática11,12.
La demostración de la larva, en un tejido, es diagnóstico definitivo de la infección, pero suele ser muy difícil de realizar1. Pueden observarse en muestras de tejidos como larvas completas o porciones de ella en el centro de los granulomas en material post-mortem o en biopsias hepáticas11.
Dadas las limitaciones actuales, el diagnóstico de la toxocariasis suele apoyarse en técnicas inmunológicas1,3, como el ELISA, la técnica actual de elección en la mayoría de los países1–3,11, con una sensibilidad y especificidad que va del 78 al 91% y del 86 al 93%, respectivamente1,11,74.
Adicionalmente se han empleado otros métodos como alternativas, aun en evaluación, tales como el Western-blot28, el Multiple Antigen Binding Assay (MABA)82 o ensayo de unión múltiple de antígenos, incluyendo antígenos de T. canis,1 y más recientemente la técnica de ELISA-Avidez anti-T. canis65,83.
Otras nuevas técnicas en desarrollo incluyen la prueba dot-ELISA75, así como pruebas que incluyen la clonación de antígenos recombinantes para uso serológico1. Finalmente, se han empezado a evaluar técnicas basadas en métodos moleculares con el fin de determinar la presencia de antígenos de T. canis (por ejemplo, polymerase chain reaction-restriction fragment lenght polymorphism [PCR-RFLP]), aunque su uso a gran escala todavía está por determinarse1,11.
TratamientoEn general hay carencia de estudios sobre el manejo específico de las afecciones cardíacas de la toxocariasis debido a que, como se ha mencionado, este tipo de manifestaciones suelen darse con poca frecuencia. Sin embargo, en el manejo etiológico el albendazol es el medicamento de elección, recomendado a dosis de 400mg vía oral 2 veces al día durante 5 días1,7,11. Se sugiere que su administración para las infecciones tisulares se acompañe de alimentos, debido a que con ello su absorción mejora de manera significativa1. No obstante, se recomienda el uso alternativo de otros medicamentos como el mebendazol, la dietilcarbamazina y el tiabendazol1,7.
Para las afecciones cardíacas como la miocarditis eosinofílica aun no se ha establecido un tratamiento estándar debido a la dificultad de estudiar manifestaciones infrecuentes de la enfermedad49. Sin embargo, la evidencia disponible hasta el momento sugiere que el manejo etiológico temprano sumado a la administración de glucocorticoides puede ser efectivo debido a la fisiopatogenia inmunológica de la miocarditis eosinofílica8,47,49. En general, en muchos casos de SLMV, inclusive aquellos con compromiso cardíaco, el uso de glucocorticoides es fundamental, dado que pueden ocurrir casos de síndromes de respuesta inflamatoria sistémica o síndromes de activación macrofágica que pueden ser fatales50. En un estudio japonés reciente se muestran resultados positivos en 6 de 7 pacientes (de 36 a 83 años de edad) con miocarditis eosinofílica de etiología variable, quienes además del manejo etiológico recibieron prednisolona 1mg/kg/día en la fase aguda y dosis de mantenimiento de 5-10mg/día con el fin de evitar posibles recaídas49. No obstante, en este estudio uno de los pacientes en quien se determinó etiología parasitaria solo recibió albendazol debido a que la miocarditis eosinofílica fue leve49. Este paciente se recuperó y tras 621 días de seguimiento se encontraba con vida, lo que de alguna manera significa que en algunos casos de miocarditis eosinofílica no siempre es obligatoria la administración de corticosteroides49,51, aun cuando hay casos en los cuales es precisamente la respuesta inflamatoria severa la que podría llevar a la muerte del paciente50.
En los pacientes con grandes derrames pericárdicos el manejo con pericardiocentesis está indicado debido a que se ha demostrado que este procedimiento conlleva que se disminuyan mucho los signos y síntomas en el paciente al igual que disminuye el riesgo de taponamiento cardíaco52,53. Por tanto, es importante atender a los signos y síntomas que indiquen presencia de líquido en la cavidad pericárdica como taquicardia, pulso paradójico, hipotensión, disociación electromecánica en el electrocardiograma y aumento de la silueta cardíaca en la radiografía de tórax8,31,48.
Por último, sobre las nuevas medicinas en evaluación, vale la pena mencionar que existen estudios que han encontrado considerable actividad parasitaria específica contra T. canis, con la ivermectina1,54, tribendimidina1,55, la unión de PEG 6000 al albendazol56, o microesferas de albendazol57, que también parece podrían mejorar la eficacia terapéutica en la toxocariasis. Existen en la actualidad estudios que evalúan la actividad anti-T. canis de productos naturales (como Chenopodium ambrosioides), que podrían prometer también nuevas alternativas terapéuticas58. Recientemente se ha encontrado que una cepa de Enterococcus faecalis (CECT7121) tiene actividad larvicida contra T. canis, lo cual podría tener implicaciones terapéuticas futuras, una vez se sintetice el compuesto específico de la bacteria que logra dicho efecto59.
ConclusionesLa toxocariasis es una enfermedad distribuida en todo el mundo que afecta predominantemente a niños y personas de bajo nivel socioeconómico, que puede llegar a causar diferentes tipos de síndromes y comprometer la vida de quienes los padecen50,67–77.
Se deben establecer estrategias de prevención dirigidas a disminuir la defecación indiscriminada de perros y gatos en lugares públicos, dadas sus implicaciones y consecuencias1,18,20,21,26,37,60. Las autoridades en salud de los diferentes países afectados deben implementar normas que permitan un adecuado registro en términos de morbimortalidad, con el fin de poder comprender la epidemiología y el comportamiento de la enfermedad en estos territorios1,11,19,24,25,60,76.
En el ámbito cardiovascular, como se ha expuesto, existe evidencia disponible que pone de manifiesto los diferentes tipos de afecciones que se pueden desarrollar a nivel de las distintas estructuras cardíacas, por lo cual esta infección debe ser considerada en el diagnóstico diferencial de pacientes que tengan miocarditis eosinofílica, o derrames pericárdicos de etiología desconocida, y dada la globalización se pueden encontrar casos en viajeros o migrantes procedentes de zonas de alta endemicidad o seropositividad frente a T. canis, que llegan a áreas donde existe baja seroprevalencia del mismo61–80.
Aun cuando en algunos países el diagnóstico de la toxocariasis es limitado, y reside en pruebas serológicas1,65,83, deben tenerse presente las características epidemiológicas de esta infección e incluirla entre los diagnósticos diferenciales74, en especial en niños con sospecha de SLMV, eosinofilia y tenencia de perros y gatos, entre otros elementos asociados a dicha parasitosis, que como se ha resumido puede comprometer no solo estructuras hepáticas y oculares, sino que además puede conllevar importante afección cardiovascular e incluso la muerte1,11,45,66,79. Son necesarios más estudios a dicho nivel a fin de diagnosticar, tratar y prevenir mejor el curso de la enfermedad basados en una mejor evidencia80, particularmente en América Latina donde la misma puede alcanzar altas seroprevalencias1,81.