Se trata de un estudio de revisión de datos publicados en literatura médica relacionada con el cribado usado para la detección temprana de cardiopatías congénitas complejas en recién nacidos aparentemente sanos en diversas ciudades del mundo, incluyendo los reportados en México, desde aquellos en los que se realiza el cribado por el conocimiento de la fisiopatologìa de datos indirectos de hipoxia, observación de cianosis diferencial y la consecuente diferencia en los valores de la pulsioximetría pre- y posductal derivada de la dependencia ductal y/o de comunicación interauricular de diversas cardiopatías congénitas graves, hasta aquellos estudios de investigación realizados de forma masiva y reportados como multicéntricos, justificando la utilidad de la práctica para su implementación cotidiana y obligada de forma extensa a nivel internacional. Asimismo se citan tópicos legislativos en nuestro país como parte de los esfuerzos para establecer la obligatoriedad del cribado en toda la República Mexicana.
A review is presented of data published in medical literature related to the screening used for the early detection of complex congenital heart disease in apparently healthy newborns in several cities of the world, including those reported in Mexico. The screening was performed due to the knowledge of the pathophysiology of indirect hypoxia data, observation of differential cyanosis and the consequent difference in the values of pre- and post-ductal pulse oximetry derived from the ductal and/or atrial septal defect dependence of several severe congenital heart diseases. Multicentre research studies have also been carried out on a massive scale, thus justifying the usefulness of the practice for its daily implementation and at international level. Additionally, legislative topics are cited in our country as part of the efforts to establish the mandatory nature of the screening throughout the Mexican Republic.
Son sabidas las implicaciones clínicas, psicológicas y económicas derivadas del tratamiento de los recién nacidos (RN) portadores de cardiopatías congénitas complejas (CCC), por lo que desde los años 90 se vienen ensayando técnicas como las pruebas de hiperoxia y posteriormente la oximetría de pulso para medir saturaciones pre- y posductales que se traduzcan en diferencias negativas y por lo tanto en hipoxemia en aquellos RN en los cuales se presenta cortocircuito a través de conducto arterioso con el fin de la preservación de la circulación sistémica o pulmonar, según sea el caso y que al momento de obliterarse, por lo tanto, el neonato presentará datos inminentes de choque que derivarán en daño severo a órganos blanco o al fallecimiento a corto plazo. Estas técnicas se han venido estudiando a lo largo de los años y se ha observado que hay diferencias detectables aun cuando el RN clínicamente se encuentra estable en el cunero fisiológico y en vías de darse de alta a su domicilio. Esas observaciones derivaron en las propuestas y puestas en marcha de un estudio oximétrico bien fundamentado y de acuerdo a algoritmos, para detección específica de CCC y que a su vez ha sido útil en la detección temprana de otras enfermedades. A raíz de lo anterior, en diversos países del orbe se han puesto en marcha políticas para generalizar y establecer la obligatoriedad de la práctica, misma que se está difundiendo cada vez más fuertemente en nuestro país, sin embargo aún se requieren esfuerzos económicos, políticos e institucionales para normarla como una práctica que debe realizarse a todo RN aparentemente sano, equiparándolo con estudios como el cribado metabólico.
MétodoEste es un estudio de revisión de datos publicados a nivel internacional que ha sido motivado por la observación de las complicaciones ocurridas en pacientes cuya detección de CCC se ha realizado de forma tardía y cuyo desenlace es desfavorable, intentando a la vez incentivar a la población de médicos dedicados a la práctica pediátrica a una revisión detallada de todos los RN que se atienden en los cuneros de hospitales tanto públicos como privados para evitar consecuencias fatales derivadas de un diagnóstico y tratamiento retardado de este tipo de enfermedades.
ResultadosLas cardiopatías congénitas, de acuerdo a la definición propuesta por Mitchell et al.1, son anomalías estructurales evidentes del corazón o de los grandes vasos intratorácicos con una repercusión real o potencial y representan la primera causa de mortalidad neonatal precoz (40%) y la segunda en la mortalidad infantil (32%)2,3.
Este tipo de malformaciones congénitas son consideradas como las más frecuentes al nacimiento, estimándose una prevalencia de 6/1,000 RN vivos y una incidencia de 8/1,000 RN vivos4–8, de acuerdo a diversos autores. Sin embargo, estos datos subestiman cifras reales de cardiopatías en fetos, ya que muchos terminan en abortos espontáneos o mortinatos, reflejando CCC o alteraciones cromosómicas asociadas con defectos cardíacos9, estimándose la incidencia antenatal a más del doble de la reportada en RN3,10.
Para fines de estudio de implicaciones clínicas podemos dividir las malformaciones cardiovasculares en cardiopatías congénitas simples, asociadas y complejas.
Desde la década de 1980 se difunde el examen ecográfico de detección de malformaciones congénitas en la etapa prenatal que se realiza por médicos capacitados, sin embargo, diversos estudios reportan que aun cuando la ecografía fetal se realiza rutinariamente durante el embarazo, menos del 50% de los casos de CCC se identifican, mismas que requieren una intervención temprana al nacimiento11–13.
Las CCC en RN se suelen diagnosticar por varias vías como los hallazgos a la exploración física de soplos cardíacos, taquipnea o cianosis estando en cuneros, sin embargo estas manifestaciones suelen hacerse evidentes después del alta hospitalaria, que en ocasiones se lleva a cabo antes de las 48h de vida. Se estima que aproximadamente el 25% de los RN con CCC se diagnostican posterior al egreso del cunero, con una mediana de edad al momento del diagnóstico de 6 semanas. Esta situación se explica por el hecho de que, en su mayoría, las CCC en los RN son ducto-dependientes, sea para mantener el flujo sistémico o el flujo pulmonar, y el compromiso hemodinámico se establece con el cierre del conducto arterioso; asimismo dependen de la disminución de las resistencias vasculares pulmonares. De ahí la importancia de detectar este tipo de malformaciones desde las primeras horas de vida, ya que al ocurrir el colapso circulatorio los órganos blancos son afectados, ensombreciendo el pronóstico funcional y de vida de estos pacientes13–15.
Un común denominador de las CCC es la presencia de hipoxemia manifestada como cianosis, sin embargo no en todos los RN va a ser notoria a simple vista por diferencias en la pigmentación de la piel y por la concentración de hemoglobina en correlación con la saturación de oxígeno13,16.
La oximetría de pulso se desarrolló a principios de los años setenta con base en los diferentes espectros de absorción entre hemoglobina oxigenada y desoxigenada. La hemoglobina desoxigenada absorbe luz en la banda roja (600-750nm), mientras que la hemoglobina oxigenada absorbe luz en la banda infrarroja (1,000nm). La proporción de la absorbancia de la luz en estas 2 longitudes de onda se correlaciona con la saturación de la hemoglobina en los capilares. La oximetría de pulso tiene el potencial de identificar hipoxemia que podría no producir cianosis visible17,18.
A partir de la década de los 90 se estudia la utilidad de la oximetría de pulso para la detección temprana de las CCC en RN de término aparentemente sanos, coincidiendo varios autores en que el estudio antes de las 24h de vida puede arrojar hasta el 5% de falsos negativos, así como en un punto de corte de saturación del 95%13, con modificaciones de acuerdo a la altitud sobre el nivel del mar en el que se realice el estudio, ya que se detectó que por arriba de los 5,000 pies (1,524m) sobre el nivel del mar los RN tenían saturaciones de oxígeno menores con respecto a las registradas a nivel del mar19,20.
En el año 2009, y posterior a diversas propuestas basadas en evidencias para la implementación del cribado para detección de CCC mediante oximetría de pulso en los Estados Unidos, la American Academy of Pediatrics (AAP) y la American Heart Association (AHA) recomendarían su uso una vez que se sustentara la utilidad de la prueba a través de estudios poblacionales13,21–23, haciendo posteriormente del conocimiento de los organismos citados, el estudio Sueco de 200924 en el cual se incluyeron 39,821 RN entre el 1 de julio de 2004 y el 31 de marzo de 2007, además se comparó la efectividad de la oximetría de pulso con el examen físico realizado por neonatólogos calificados. En este estudio se concluyó que la introducción de la oximetría de pulso antes del alta del RN mejora la tasa de detección total de CCC dependientes del conducto arterioso hasta en un 92%, así como hace mención de la rentabilidad a largo plazo al prevenir la morbilidad neurológica y la reducción de la necesidad de cuidados intensivos neonatales preoperatorios. Y por otro lado se consideró el estudio prospectivo alemán25 de 2010 en el que se incluyen 41,445 RN; los autores de este estudio demuestran que este método tiene una sensibilidad del 77.7%, una especificidad del 99.9% y una valor predictivo positivo y negativo del 25.93 y 99.99%, respectivamente. En él consideran al cribado por oximetría de pulso (COP) como un complemento al diagnóstico prenatal, examen físico y observación clínica, encontrando que el porcentaje de RN con diagnóstico tardío de CCC fue del 4,4%, así el COP puede reducir sustancialmente la brecha diagnóstica posnatal en CCC, y los resultados falsos positivos que conducen a exámenes innecesarios, debiendo aplicarse en la atención posparto rutinaria.
Un estudio realizado en China entre los años 2011 y 2012 en el que se examinaron 122,738 RN demostró que el cribado entre las 6 y 24h de vida tenía un 10% de sensibilidad más alta en comparación con el estudio después de las 24h de vida, sin embargo, se observó una tasa más alta de falsos positivos26,que se reduce hasta 10 veces si el cribado es llevado a cabo después de 24h, con tasas estimadas de falsos positivos del 0.05%, después de las 24h hasta un estimado de falsos positivos del 0.5% antes de las 24h de vida extrauterina, de acuerdo al metaanálisis de Thangaratinam et al. (2012)27.
La información anterior indica que habrá aproximadamente de 2 a 12 resultados falsos positivos por cada 10,000 RN estudiados con el COP si se realiza después de las 24h de vida28.
En el año 2011 se emitió la recomendación por el Secretario de Salud y Servicios Humanos (HHS, por sus siglas en inglés) y con apoyo de la AAP sobre la incorporación de la oximetría de pulso a la evaluación del RN encaminado a la detección temprana de CCC, anexándose a las políticas de diversos estados para lograr la implemetación22, con una evaluación exhaustiva del desarrollo y reportes del cribado en enero de 201523, momento en el que se determinó la inclusión de 13 condiciones patológicas cardiovasculares (y no solo 7 como se propuso en el año 2009) y 7 condiciones no cardiovasculares relacionadas con hipoxemia, dentro de los objetivos del COP, dado que observaron que era posible detectar un 79% de condiciones anormales en el cribado relacionadas con hipoxemia; sin embargo, no todas eran alteraciones cardiovasculares (coartación de aorta, doble salida de ventrículo derecho, anomalía de Ebstein, síndrome de corazón izquierdo hipoplásico, interrupción de arco aórtico, atresia pulmonar, ventrículo único, tetralogía de Fallot, conexión anómala total de venas pulmonares, D-transposición de grandes arterias, atresia tricuspídea, tronco arterioso; otras lesiones críticas cianógenas no especificadas; hemoglobinopatía, hipotermia, infecciones incluida la sepsis, enfermedad pulmonar congénita o adquirida, defecto cardíaco congénito no crítico, hipertensión pulmonar persistente y otras condiciones hipoxémicas no especificadas).
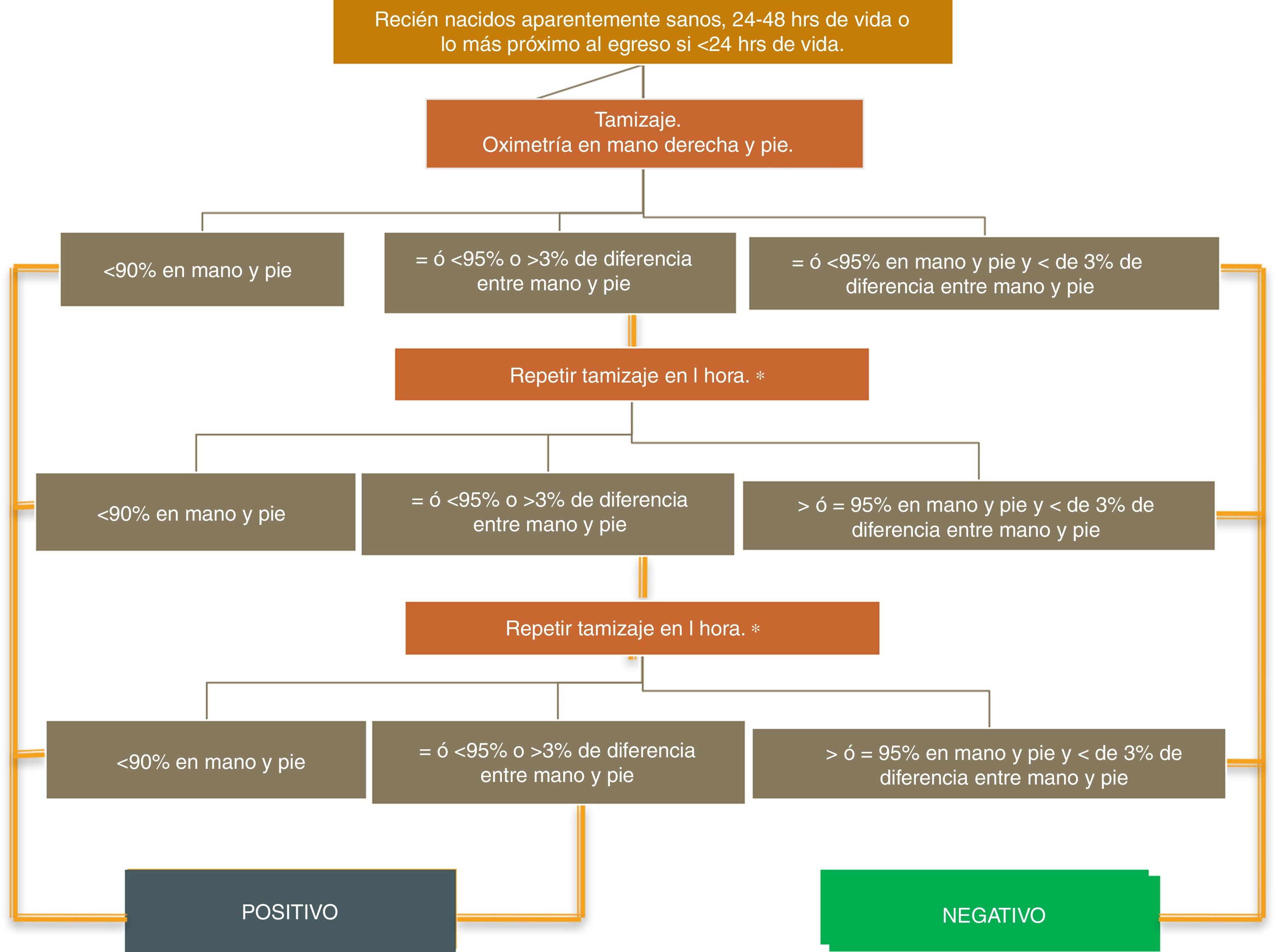
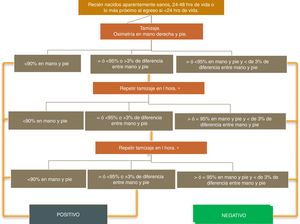
La prueba consiste en la medición de oximetría de pulso pre- y posductal (extremidad superior derecha y cualquier extremidad inferior), posterior a las 24h de vida, en el cunero fisiológico, en RN de término aparentemente sanos. Existen por lo menos 3 algoritmos para el cribado del CCC por COP como el algoritmo de la AAP, el de New Jersey y Tennessee modificados según las condiciones geográficas, fisiológicas y económicas consideradas en cada uno de ellos23. De acuerdo al algoritmo de la AAP, un resultado se consideraría positivo si (A) cualquier medida de saturación de oxígeno es<90%, (B) la saturación de oxígeno es<95% en ambas extremidades en 3 medidas separadas por 1h, o (C) hay una diferencia absoluta de>3% en la saturación de oxígeno entre la mano derecha y el pie en las 3 mediciones, cada una separada por 1h. Cualquier medición que sea>95% en cualquiera de las extremidades con una diferencia absoluta<3% en la saturación de oxígeno entre las extremidades superior e inferior sería considerada un resultado negativo y el examen terminaría21,23 (fig. 1).
Algoritmo de realización del cribado por oximetría de pulso de acuerdo al propuesto por la American Academy of Pediatrics. Fuente: Kemper et al.21.
Se deben considerar características puntuales del equipo de medición de oximetría de pulso como29:
- 1.
Cumplir con la norma de la Organización Internacional de Normalización y ser aprobado por la Food and Drug Administration (FDA) para uso hospitalario en RN.
- 2.
Tolerante al movimiento y contar con un rendimiento adecuado en circunstancias normales.
- 3.
Utilizar los sensores recomendados para su colocación en las extremidades neonatales y sin necesidad de medios de fijación que puede afectar la integridad de la piel. Los sensores para adultos no se deben utilizar en los RN.
- 4.
Garantizar el uso de los sensores indicados para cada monitor.
Al momento se dispone de 2 dispositivos de medición de oximetría de pulso que cuentan con los requisitos a seguir recomendados por la FDA que son el oxímetro Masimo SET® y el oxímetro Covidien Nellcor®29–31, sin embargo pocos centros en nuestro país cuentan con alguno de ellos en la actualidad.
Para la optimización del cribado se han tomado en cuenta diversos puntos en los cuales se hace énfasis durante el tiempo en el que se lleva a cabo la prueba, como la adecuada educación y adiestramiento del personal implicado en los estudios, las características del equipamiento y las modificaciones que se esperan de acuerdo al sitio geográfico en el que se realiza el estudio; así, se ha visto que debido a alteraciones en la disociación de oxihemoglobina con los cambios en la presión parcial de oxígeno, a mayor altitud los lactantes tienen una saturación de oxígeno menor que los que se encuentran a nivel del mar32,33. Esta diferencia tiene implicaciones importantes para el COP, especialmente en aquellos que están a más de 2,072m (6,800 pies), sobre el nivel del mar34,35, motivo por el cual en algunos hospitales se han realizado adaptaciones en los protocolos de COP, como la repetición de la prueba de oximetría de pulso cada 4h mientras se esperan los resultados del ecocardiograma; colocando al recién nacido una campana cefálica con aporte de oxígeno para replicar la tensión del oxígeno atmosférico del nivel del mar mientras se realiza la prueba y retrasando el cribado a 30h para permitir más tiempo para la transición cardiopulmonar, sin embargo son necesarias más investigaciones para evaluar la eficacia de dichas modificaciones23.
Es importante mencionar además los costos derivados del cribado cardiológico y los que conllevarían aquellos pacientes diagnosticados tempranamente y aquellos con diagnóstico tardío; así, observamos algunas cifras estimadas en Estados Unidos de América y Reino Unido quienes concluyen que la variabilidad en los costos es debida a los costos potenciales asociados con los equipos tecnológicos como pulsioxímetros y sensores (con costos menores para aquellos donde se usaron sensores reutilizables), personal-tiempo tanto médico como de enfermería, transporte y pruebas adicionales cuando se consideran necesarias. Los costos netos estimados variaron desde $ 14.09 (dólares americanos) por RN estudiado en Nueva Jersey hasta $ 5.10 por RN evaluado en Minnesota. El costo estimado de una prueba de detección falsa positiva que requirió transporte y ecocardiografía solo tuvo un incremento del 3% al costo neto por RN evaluado. El costo estimado por detectar un RN con CCC fue de $ 20,862, con una efectividad de costo favorable de $ 42,385 por año de vida si se evitaran 20 decesos pediátricos en la región de Nueva Jersey por año28,36–38.
A la fecha aún se toman en consideración las limitaciones del ultrasonido prenatal por una baja sensibilidad diagnóstica, como lo indican los datos reportados en un estudio en Alberta, Canadá, entre 2007 y 2010, en el que solo el 50% de los RN con CCC que necesitaron cirugía antes del año de edad fueron diagnosticados en un ultrasonido prenatal28,39, con una tasa de detección de aproximadamente el 85% si la anomalía era fácilmente detectable en una proyección ecocardiográfica de 4 cámaras, hasta el 29% en aquellas enfermedades que implican mayor pericia en su detección como por ejemplo la transposición de las grandes arterias, lo que traduce la importancia en la experiencia del operador28,40, situación que se vio reflejada en un reporte de 2016 de un centro hospitalario de tercer nivel en Irlanda donde se observó una tasa de detección de CCC prenatal del 91%28,41.
En nuestro país se han realizado diversos estudios en hospitales de segundo y tercer nivel para implementar y difundir la utilización del COP para CCC. Uno de ellos fue un estudio transversal realizado en el Instituto Mexicano del Seguro Social en León, Guanajuato, en 1,037 RN de término entre julio de 2010 y abril de 2011. La oximetría de pulso se determinó antes del alta hospitalaria. En aquellos RN con saturación posductal de oxígeno<95%, se realizó un ecocardiograma doppler. En 2 pacientes se detectó CCC, uno con atresia pulmonar con comunicación interventricular, y uno con anomalía de Ebstein. En 10 RN se detectó algún tipo de defecto cardíaco congénito no crítico. La prevalencia general de CC fue de 11,5 por 1,000 nacidos vivos, y la prevalencia de CCC fue de 3,9 por 1,000 nacidos vivos. Para los RN con enfermedad crítica, la oximetría de pulso tuvo una sensibilidad del 100%, una especificidad del 98,8%, un valor predictivo positivo del 14,2%, un valor predictivo negativo del 100% y una razón de verosimilitud positiva del 86,2. En el análisis de regresión, la saturación de oxígeno, la frecuencia respiratoria y la edad posnatal se relacionaron con CCC42, aunque cuenta con la limitante de haberse realizado entre las 6 y 12h de nacimiento.
En el año 2015 se reportó por la Academia Mexicana de Pediatría, la prueba piloto liderada por las doctoras Robledo Galván y Lima Rogel (neonatólogas) y cuyo trabajo fue realizado a manera de tesis de neonatología por Hernández-Martínez en el estado de San Luis Potosí, donde dan a conocer que se cribaron 1,011 neonatos, en 14 de ellos se realizó ecocardiografía, en 7 por diferencia entre la SpO2 pre- y posductal>3% y en los 7 restantes por sospecha clínica de cardiopatía. En los 14 pacientes sometidos a ecocardiograma se confirmaron los siguientes diagnósticos cardiológicos: persistencia del conducto arterioso, 5 (36%); coartación de la aorta, 4 (29%); ventrículo izquierdo hipoplásico,2 (14%); transposición de grandes arterias, uno (7%); comunicación interventricular, uno (7%) y canal auriculoventricular, uno (7%)43,44.
Ya que uno de los retos actuales es la estandarización del algoritmo del COP de las CCC en condiciones especiales, también en nuestro país se han realizado estudios que demuestran variaciones en las saturaciones de oxígeno según la altitud del sitio geográfico donde este se lleve a cabo, como el realizado por Orozco et al.45 en un hospital privado de la Ciudad de México (2,240m de altitud) en el año 2014; ahí se evaluaron 150 neonatos de los cuales 7 (4%) tuvieron un cribado cardiológico falso positivo, siendo más alto que lo informado en la literatura (0.14%)27, por lo que los pacientes se estudiaron durante un año para descartar alguna cardiopatía; los neonatos reanimados con aire ambiente mostraron una menor saturación de oxígeno y con mayor número de falsos positivos (5 de 7 neonatos).
Por otro lado y en pro de la detección específica y oportuna de CCC, González Ramos et al., en el estado de Sonora, en el año 2016, realizaron un cribado cardíaco directo a 511 RN clínicamente sanos mediante un ecocardiograma, momentos previos al egreso hospitalario en binomio en el que se evidenciaron 217 RN con foramen oval (42.5%), 161 (31.5%) con conducto arterioso, 12 con comunicación interventricular (2.3%), uno con coartación aórtica y uno con dextrocardia46.
Resultado de las observaciones mencionadas, en la República Mexicana se vienen realizando esfuerzos para legislar la obligatoriedad de la realización del COP de CCC o cribado cardiológico neonatal, como los realizados en colaboración de diferentes sectores tanto gubernamentales como la Secretaría de Salud de Baja California Sur, el Sistema para el Desarrollo Integral de la Familia (DIF) local y asociaciones civiles como la Asociación Civil Corazón de Niño, logrando que en el año 2014 se realizara el Proyecto de Decreto Único donde se reformaría el Artículo 60 de la Ley de Salud para el Estado de Baja California Sur, donde se incluye (de carácter obligatorio junto con el cribado metabólico, auditivo y visual) el cribado cardiológico neonatal; dicha reforma aparece asentada en el Boletín Oficial del Gobierno del Estado de Baja California Sur en septiembre de 201547,48.
Por otro lado, en febrero de 2016 apareció en la Gaceta del Senado de la República la propuesta, de un Grupo Parlamentario, del establecimiento prioritario del cribado neonatal para la detección de CCC, mediante la iniciativa del proyecto de adición de la Fracción IV Bis al Artículo 61 de la Ley General de Salud Senado de la República49,50; y más recientemente, asentada en la Gaceta Parlamentaria (Cámara de Diputados, México), se encuentra la propuesta, hecha por otro Grupo Parlamentario, de la reforma de la Fracción II del Artículo 61 de la Ley General de Salud cuya finalidad es establecer la aplicación de la prueba de cribado cardiológico para la detección de cardiopatías congénitas graves a todo recién nacido51. Estos temas legislativos fueron retomados a últimas fechas en el XXX Congreso Mexicano de Cardiología en el mes de noviembre de 2017, donde en su mayoría expertos en la materia confluyeron en la importancia de la obligatoriedad nacional del COP para detección de CCC, persiguiendo en fechas futuras además el hecho e importancia de contar en los hospitales del país con el COP (realizado con el equipo adecuado), además de contar con equipos de ecocardiografía y recursos humanos entrenados en la realización de los estudios a todos aquellos RN con pruebas positivas, así como el ideal de la realización de diagnósticos prenatales.
DiscusiónAun cuando en México la realización de la oximetría de pulso no es una política universal para el cribado de RN42, es necesaria la implementación de un cribado para CCC en esta población a nivel nacional, considerando la frecuencia internacional reportada para este tipo de malformaciones y los informes nacionales de mortalidad como los arrojados por el Instituto de Estadística y Geografía, en los que se dio a conocer que para el año 2015, en personas menores de un año de edad, hubo un total de 6,529 decesos por malformaciones congénitas, deformidades y anomalías cromosómicas, de los cuales 3,529 correspondieron a malformaciones congénitas del sistema circulatorio (CIE-10 47E), y 219 a defunciones por enfermedades de la circulación pulmonar y otras enfermedades del corazón52. De acuerdo al mismo organismo gubernamental mexicano (INEGI) en el año 2016 se registraron 2,293,708 nacimientos53; si consideramos las cifras internacionales de una incidencia de niños con cardiopatías congénitas críticas de 3/1,000 RN vivos28, entonces podemos estimar que en nuestro país, en el año 2016 nacieron 6,881 niños con este tipo de cardiopatías, conllevando, de acuerdo a lo estudiado, diagnósticos tardíos con repercusión funcional, vital y económica para la familia y las instituciones, estancias prolongadas en las terapias intensivas neonatales o fallecimientos neonatales sin diagnóstico preciso, resulta de suma importancia el aporte de información fidedigna sobre el tipo de enfermedades que nos ocupa, que a mediano plazo nos permitiría planificar los recursos materiales y económicos, detectando además áreas de oportunidad tanto en materia de recursos humanos como de tecnología, encaminadas a la optimización de la atención cardiológica neonatal y pediátrica tanto clínica como intervencionista y quirúrgica, persiguiendo uno de los grandes retos que debieran realizarse para detección actual de las CCC como la realización a todas las mujeres embarazadas de entre 18 y 22 semanas de gestación de un examen ultrasonográfico prenatal con un examen físico posterior en el recién nacido28, hasta llegar a las cifras ideales reportadas por Johnson et al. en un estudio realizado en el año 2013 en el que de 112 RN con diagnósticos de CCC, en el Hospital Brigham and Women's, 111 tenían un diagnóstico prenatal y ninguno fue diagnosticado inicialmente con oximetría de pulso54.
ConclusionesSe deben considerar las aportaciones, beneficios y perspectivas que traería la generalización del cribado para detección de CCC en RN aparentemente sanos en los hospitales de la República Mexicana donde ocurren nacimientos, como son:
- •
La detección temprana de CCC.
- •
Realización del cribado utilizando el equipo adecuado y de una manera rentable incluyendo la posesión conjunta de equipos de ecocardiografía.
- •
Tratamiento oportuno de CCC.
- •
Disminución de estancias hospitalarias por elevada morbilidad de RN con CCC.
- •
Disminución de gastos institucionales relacionados con alta morbilidad y estancias prolongadas en terapias intensivas secundarias a CCC.
- •
Educación del personal médico, paramédico y del familiar con respecto a las CCC y a la importancia del COP en RN.
- •
Determinar los desafíos a nivel institucional y estatal para la implementación y vigilancia de COP para CCC.
- •
Optimizar el algoritmo para el cribado según las condiciones geográficas y demográficas específicas de cada población.
- •
Realizar una comparación del diagnóstico temprano y de la morbimortalidad antes y después de la implementación del COP en los diferentes establecimientos de salud tanto públicos como privados.
- •
Retroalimentación interinstitucional.
- •
Dar pie a la realización de las guías de práctica clínica a nivel nacional.
- •
Proponer y sustentar la realización de la oximetría de pulso como una política universal para el cribado de RN.
- •
Promover el adiestramiento de recursos humanos en el diagnóstico prenatal de las cardiopatías complejas para una planeación oportuna de su tratamiento en centros médicos especializados.
- •
Proveer la información necesaria a médicos de primer contacto y familiares sobre el diagnóstico prenatal de las cardiopatías complejas.
Ninguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.