El bloqueo interauricular (BIA) es una entidad asociada con un mayor riesgo de presentar fibrilación auricular (FA), constituyendo el denominado síndrome de Bayés. El objetivo de nuestro estudio fue definir la prevalencia de BIA en pacientes menores de 65 años sometidos a cirugía cardiaca y determinar si existe una asociación entre la presencia de BIA y la aparición de FA postoperatoria.
MétodoSe incluyeron un total de 207 pacientes. Se definió BIA parcial como onda P>120ms. Se definió BIA avanzado como onda P>120ms con morfología bifásica en derivaciones inferiores. Se determinó la frecuencia de aparición de FA postoperatoria y se realizó un análisis comparativo entre los pacientes que presentaron y los que no presentaron esta arritmia.
ResultadosLa prevalencia de BIA fue del 78.3% (parcial, 66.2%; avanzado, 12.1%). La frecuencia de aparición de FA fue del 28.5% de forma global, siendo mayor en los pacientes con BIA avanzado (44%) comparado con pacientes con BIA parcial (27.7%) y sin BIA (24.4%). Los pacientes que presentaron FA fueron significativamente mayores, con niveles más elevados de NTproBNP y presentaron mayor prevalencia de dilatación auricular y de patología tiroidea. El análisis multivariable demostró una asociación independiente entre BIA avanzado y FA postoperatoria.
ConclusionesEl BIA es una entidad frecuente en pacientes sometidos a cirugía cardiaca. En nuestro estudio, el BIA avanzado se asocia de forma independiente con una mayor frecuencia de FA postoperatoria en pacientes menores de 65 años sometidos a cirugía cardiaca.
Interatrial block (IAB) is a well-known entity that is associated with an increased risk of atrial fibrillation (AF). This association is called Bayes’ syndrome. The aim of our study was to define the prevalence of IAB among patients younger than 65 years undergoing cardiac surgery and determine whether there is an association between the presence of interatrial conduction delay and postoperative atrial fibrillation (POAF).
MethodA total of 207 patients were enrolled. Partial IAB was defined as P-wave>120ms. Advanced IAB was defined as P-wave>120ms+biphasic morphology in the inferior leads. Ocurrence of POAF was assessed and a comparative analysis was conducted between patients that did and did not develop AF.
ResultsIAB prevalence was 78.3% (partial 66.2%, advanced 12.1%). POAF occurred in 28.5% of all patients, and was more frequent among patients with advanced IAB (44%) compared to 27.7% and 24.4% of POAF among patients with partial IAB and without IAB, respectively. Patients who developed POAF were significantly older, had significantly higher NTproBNP, higher prevalence of atrial enlargement and thyroid disease. After multivariate analysis, advanced IAB was found to be independently associated with POAF.
ConclusionsIAB is a frequent finding among patients undergoing cardiac surgery. According to our results, advanced IAB is independently associated with POAF in younger patients (<65 years) undergoing cardiac surgery.
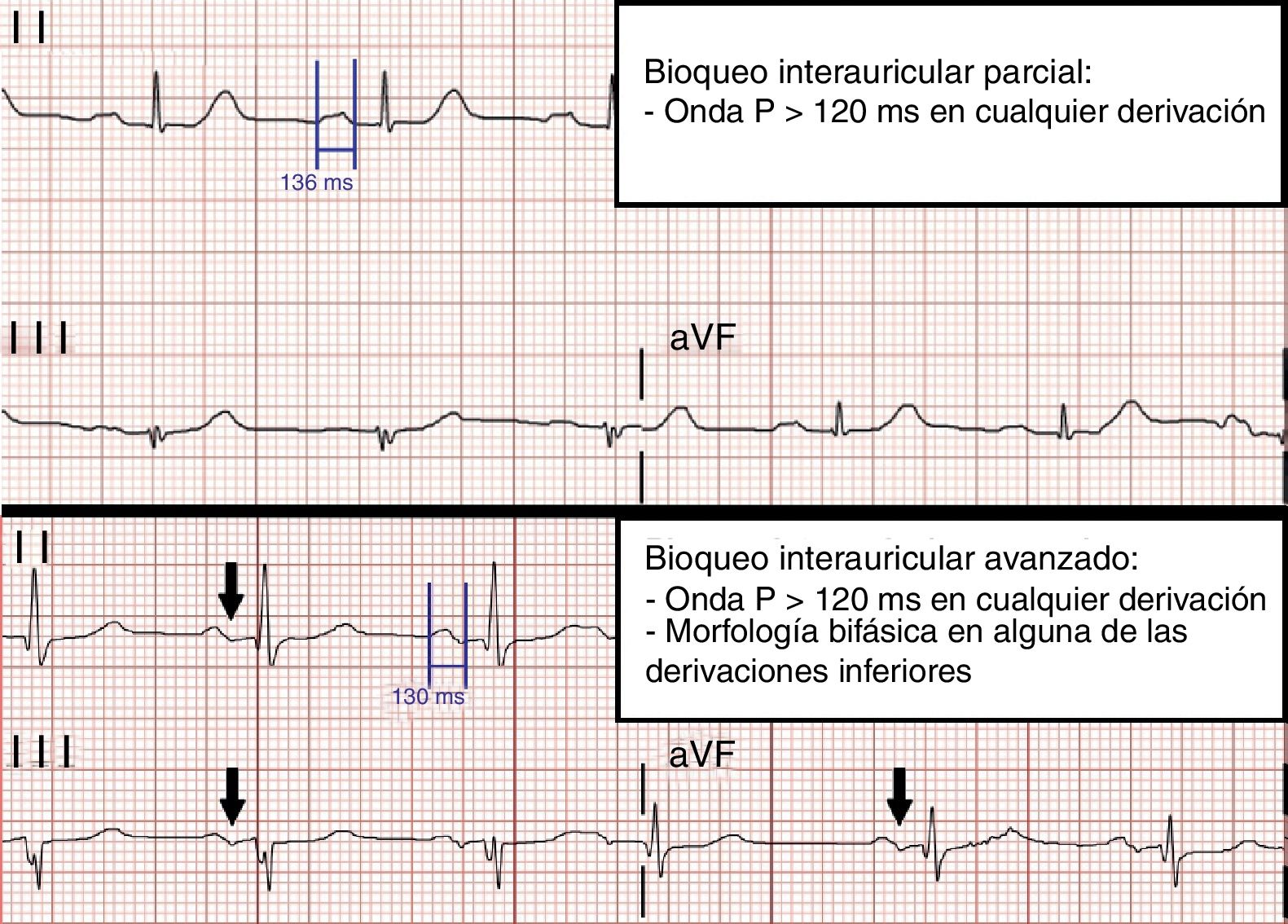
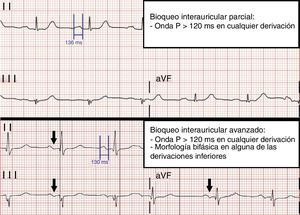
El bloqueo interauricular (BIA) consiste en un retraso en la conducción del estímulo eléctrico entre ambas aurículas. Este retraso de la conducción tiene lugar a nivel de unas fibras musculares que constituyen el haz de Bachmann y que conectan ambas aurículas en su parte superior1. El primer caso de BIA fue descrito por primera vez por George Bachmann en 19412. Sin embargo, no fue hasta el año 19793 cuando Bayés de Luna definió dos tipos de bloqueo en función de los hallazgos electrocardiográficos: el bloqueo interauricular parcial (BIA-P), que es aquel en el que se evidencia una onda P de más de 120ms de duración en cualquiera de las derivaciones, y el bloqueo interauricular avanzado (BIA-AV), que es aquel en el que además se objetiva una morfología bifásica de la onda P (con componente positivo-negativo) en alguna de las derivaciones de la cara inferior (II, III o aVF). Este trastorno de la conducción a nivel auricular ha sido ampliamente estudiado en las últimas décadas y se ha relacionado su presencia con la aparición de taquiarritmias auriculares, en concreto fibrilación auricular (FA) y flutter auricular. Esta asociación, descrita por primera vez en 19884, constituye un síndrome denominado síndrome de Bayés5,6. Por otro lado, también se ha sugerido en la literatura una posible relación entre la presencia de BIA y el riesgo de presentar eventos tromboembólicos, incluso en ausencia de FA o flutter auricular7-10.
El síndrome de Bayés ha sido estudiado en múltiples escenarios. Datos de nuestro grupo de trabajo objetivaron una elevada prevalencia de BIA en pacientes de edad avanzada sometidos a cirugía cardiaca, con una frecuencia de aparición de FA en estos pacientes que duplicaba a la de aquellos que no presentaban BIA11. Sin embargo, no fue posible demostrar en esta población una asociación independiente entre BIA y FA postoperatoria, probablemente por ser la edad un factor de confusión. Por ello, el objetivo del presente estudio ha sido analizar la prevalencia de BIA-P y BIA-AV en una población más joven (menores de 65 años) y su posible asociación con la aparición de FA en el periodo postoperatorio.
MétodosSe trata de un estudio observacional en el que se incluyeron pacientes sometidos a distintos tipos de cirugía cardiaca en nuestro centro y en el que los datos fueron recogidos de forma prospectiva.
Tras revisar su evolución durante el ingreso, se determinó si habían presentado o no episodios de FA postoperatoria documentada mediante registro electrocardiográfico, desde que finalizó la cirugía hasta el alta hospitalaria. Se consideró FA postoperatoria aquellos episodios de al menos 5min de duración incluyendo a quienes precisaron cardioversión urgente por inestabilidad hemodinámica. Se excluyó del análisis a todos aquellos pacientes que fallecieron durante la intervención quirúrgica.
Se midió la duración de la onda P de manera manual sobre el ECG de 12 derivaciones obtenido antes de la cirugía, utilizando el sistema de gestión y análisis de ECG TraceMasterVue (Phillips). Se recogió también su morfología en derivaciones inferiores. Estos datos fueron recogidos por un primer investigador (P.C.R.) y revisados posteriormente por un segundo investigador (E.G-I.J.). Toda esta información permitió clasificar a los pacientes en tres categorías: ausencia de BIA, BIA-P y BIA-AV (fig. 1).
Se analizaron datos demográficos (edad y sexo), clínicos (peso, talla, índice de masa corporal, hipertensión arterial, diabetes mellitus, dislipidemia, hábito tabáquico, enfermedad pulmonar obstructiva crónica, antecedente de patología tiroidea), parámetros ecocardiográficos (fracción de eyección de ventrículo izquierdo, volumen de aurícula izquierda), analíticos (NTproBNP antes de la cirugía) y tiempos relacionados con la cirugía (tiempo de isquemia, tiempo total de la cirugía). Se consideró el tipo de cirugía realizada para determinar la frecuencia de aparición de FA postoperatoria.
Las variables cualitativas fueron expresadas como porcentajes y las variables continuas fueron expresadas como medias (desviación estándar como medida de dispersión) y medianas (intervalo intercuartílico como medida de dispersión). Se utilizó la prueba Chi-cuadrado para comparar variables cualitativas y la pruebat de Student para comparar las medias de las muestras independientes. A fin de comparar las medianas de variables continuas que no seguían una distribución normal (NTproBNP) se utilizó la prueba U de Mann-Whitney. Para llevar a cabo el análisis multivariable se empleó un modelo de regresión logística binaria, incluyendo en el modelo las variables que obtuvieron significación estadística en la comparación univariable y las que podrían tener una relación clínica relevante.
Se utilizó el paquete de datos SPSS 23 (SPSS, Inc.; Chicago, Illinois, Estados Unidos) para llevar a cabo todo el análisis estadístico. Se consideró significativo un valor de p<0.05.
ResultadosSe incluyeron inicialmente un total de 898 pacientes sometidos a cirugía cardiaca entre enero de 2013 y septiembre de 2015. Se excluyeron aquellos pacientes que presentaban FA permanente, ritmo estimulado por marcapasos de base, pacientes sometidos a trasplante cardiaco, aquellos que fallecieron durante el procedimiento quirúrgico o en los que la onda P no era valorable en el ECG de superficie, quedando un total de 465 pacientes. Finalmente, se seleccionaron 207 pacientes cuya edad era menor de 65 años. Todos ellos contaban con un ECG previo a la cirugía en ritmo sinusal que permitió realizar el análisis de la onda P.
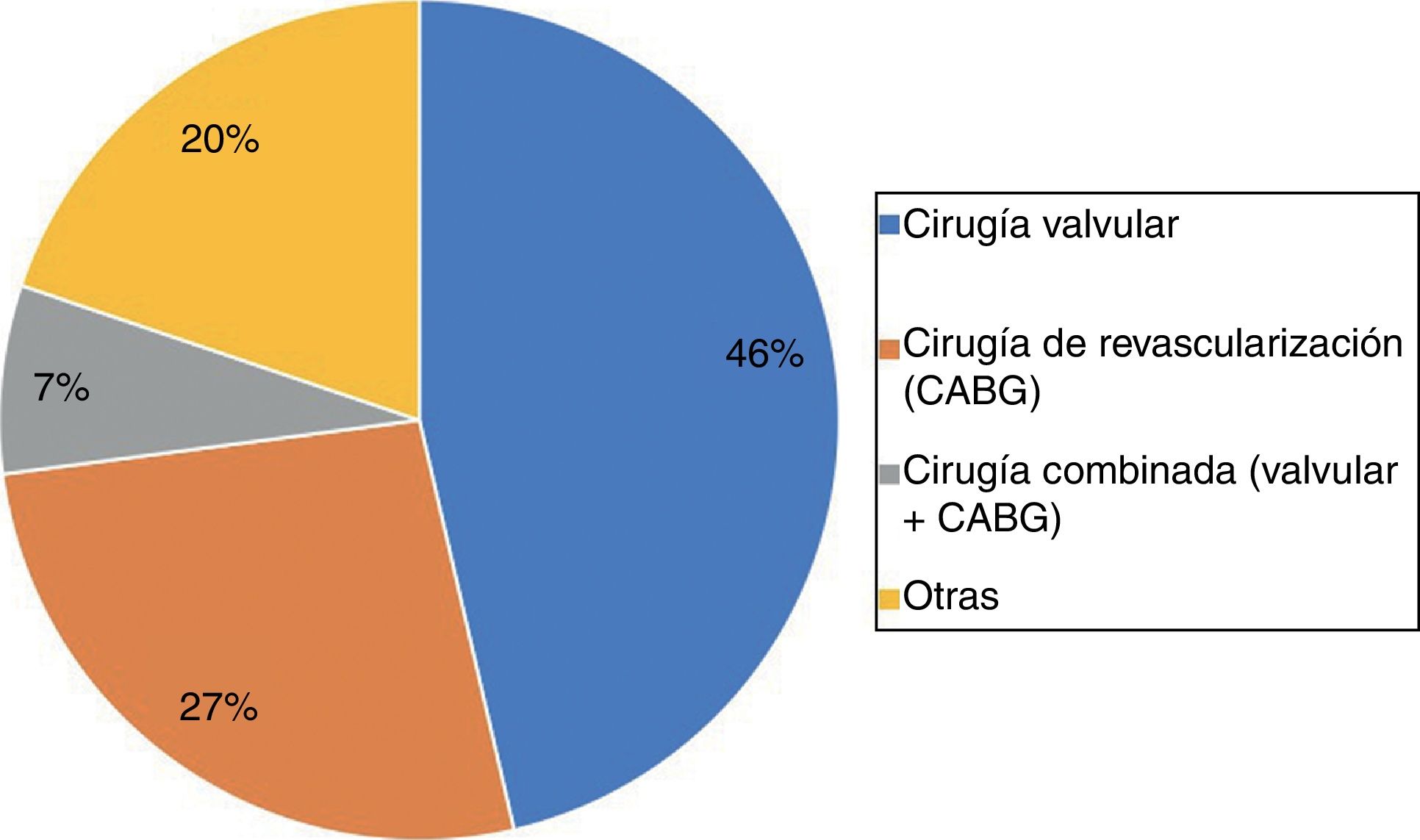
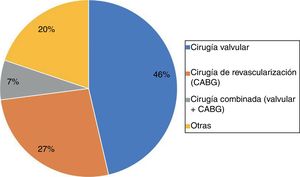
El tipo de cirugía más frecuente fue la cirugía valvular aislada, seguida de la cirugía de revascularización aislada, otros tipos de cirugía y, por último, la cirugía combinada valvular y de revascularización (fig. 2).
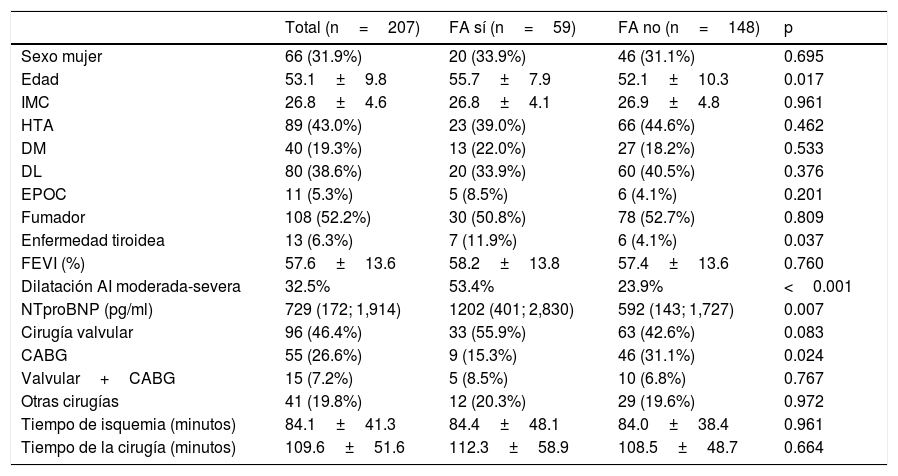
En forma global, se diagnosticó FA en el postoperatorio en 59 pacientes (28.5%). Se encontraron diferencias significativas en lo que respecta a la edad (mayor edad en pacientes que presentaron FA), patología tiroidea y dilatación de la aurícula izquierda (ambas más frecuentes en pacientes que presentaron FA). Se objetivaron también niveles significativamente más elevados de NTproBNP antes de la cirugía en pacientes que presentaron FA. No existieron diferencias significativas en lo que respecta a la incidencia de FA postoperatoria para el resto de variables, incluido el tiempo de isquemia y el tiempo total de cirugía. Los distintos tipos de cirugía se distribuyeron de forma homogénea en función del diagnóstico de FA postoperatoria, excepto el grupo de pacientes sometidos a cirugía de revascularización aislada. Este grupo se asoció de forma estadísticamente significativa con una menor frecuencia de aparición de FA (tabla 1).
Características de la población general y diferencias entre el grupo que presentó FA postoperatoria y el grupo que no presentó FA postoperatoria
| Total (n=207) | FA sí (n=59) | FA no (n=148) | p | |
|---|---|---|---|---|
| Sexo mujer | 66 (31.9%) | 20 (33.9%) | 46 (31.1%) | 0.695 |
| Edad | 53.1±9.8 | 55.7±7.9 | 52.1±10.3 | 0.017 |
| IMC | 26.8±4.6 | 26.8±4.1 | 26.9±4.8 | 0.961 |
| HTA | 89 (43.0%) | 23 (39.0%) | 66 (44.6%) | 0.462 |
| DM | 40 (19.3%) | 13 (22.0%) | 27 (18.2%) | 0.533 |
| DL | 80 (38.6%) | 20 (33.9%) | 60 (40.5%) | 0.376 |
| EPOC | 11 (5.3%) | 5 (8.5%) | 6 (4.1%) | 0.201 |
| Fumador | 108 (52.2%) | 30 (50.8%) | 78 (52.7%) | 0.809 |
| Enfermedad tiroidea | 13 (6.3%) | 7 (11.9%) | 6 (4.1%) | 0.037 |
| FEVI (%) | 57.6±13.6 | 58.2±13.8 | 57.4±13.6 | 0.760 |
| Dilatación AI moderada-severa | 32.5% | 53.4% | 23.9% | <0.001 |
| NTproBNP (pg/ml) | 729 (172; 1,914) | 1202 (401; 2,830) | 592 (143; 1,727) | 0.007 |
| Cirugía valvular | 96 (46.4%) | 33 (55.9%) | 63 (42.6%) | 0.083 |
| CABG | 55 (26.6%) | 9 (15.3%) | 46 (31.1%) | 0.024 |
| Valvular+CABG | 15 (7.2%) | 5 (8.5%) | 10 (6.8%) | 0.767 |
| Otras cirugías | 41 (19.8%) | 12 (20.3%) | 29 (19.6%) | 0.972 |
| Tiempo de isquemia (minutos) | 84.1±41.3 | 84.4±48.1 | 84.0±38.4 | 0.961 |
| Tiempo de la cirugía (minutos) | 109.6±51.6 | 112.3±58.9 | 108.5±48.7 | 0.664 |
Las variables cualitativas se expresan en número absoluto y porcentaje entre paréntesis. Las variables cuantitativas se expresan como media±desviación estándar, excepto NTproBNP que se expresa como mediana y rango intercuartílico.
AI: aurícula izquierda; CABG: cirugía de revascularización coronaria; DL: dislipidemia; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; FEVI: fracción de eyección de ventrículo izquierdo; HTA: hipertensión arterial; IMC: índice de masa corporal; NTproBNP: propéptido natriurético cerebral N-terminal.
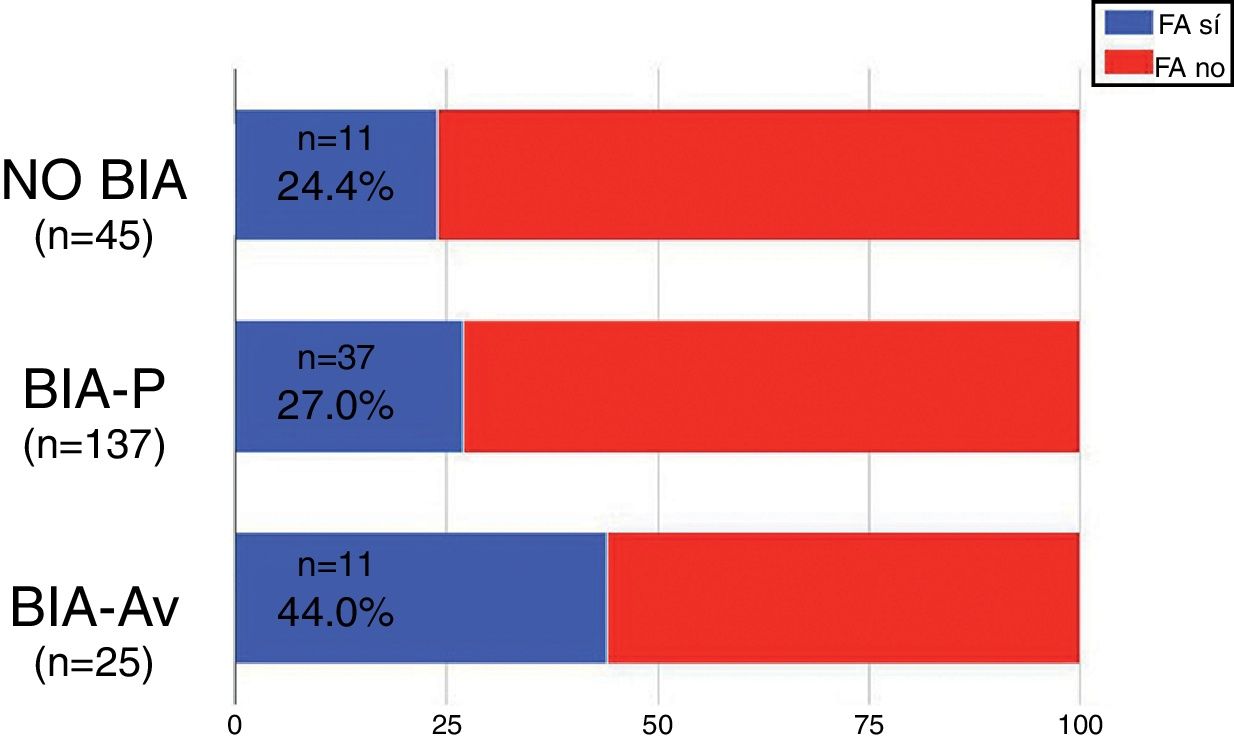
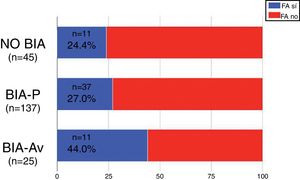
Se identificó BIA-P en 137 pacientes (66.2%) y BIA-AV en 25 pacientes (12.1%). El 24.4% de los pacientes sin BIA y el 27.7% de los pacientes con BIA-P presentaron FA en el postoperatorio. En el caso de los pacientes con BIA-AV, la presencia de FA fue más frecuente (44%), rozando esta diferencia la significación estadística (p=0.067) (fig. 3).
Se investigó también cuál era la distribución del BIA-AV en función de la presencia de crecimiento auricular significativo. Se evidenció que el 8.8% de los pacientes sin dilatación auricular presentaban BIA-AV frente al 20% de los pacientes con dilatación moderada o severa de la aurícula izquierda, siendo esta diferencia estadísticamente significativa (p=0.025).
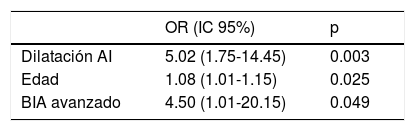
Con todos estos datos, se realizó un análisis multivariable, mediante regresión logística binaria, asociándose de forma independiente con la aparición de FA postoperatoria la edad, la dilatación auricular y la presencia de BIA-AV (tabla 2).
Variables asociadas de forma independiente y estadísticamente significativa con FA postoperatoria
| OR (IC 95%) | p | |
|---|---|---|
| Dilatación AI | 5.02 (1.75-14.45) | 0.003 |
| Edad | 1.08 (1.01-1.15) | 0.025 |
| BIA avanzado | 4.50 (1.01-20.15) | 0.049 |
AI: aurícula izquierda; BIA: bloqueo interauricular; FA: fibrilación auricular; IC: intervalo de confianza; OR: odds ratio.
La FA es una complicación postoperatoria frecuente de la cirugía cardiaca, con una incidencia cercana al 50% en pacientes sometidos a cirugía valvular12 e incluso superior (en torno al 60%) en cirugía valvular combinada con revascularización coronaria13, siendo estos los tipos de cirugía que más se asocian a FA en la mayoría de las series. El mecanismo etiopatogénico subyacente no es del todo conocido, aunque se sabe que la inflamación, el estrés oxidativo y especialmente la activación simpática desencadenada en la cirugía juegan un papel importante en la aparición de taquiarritmias auriculares en el periodo postoperatorio14.
Existen múltiples factores de riesgo descritos que se relacionan con una mayor incidencia de FA postoperatoria. Entre estos factores, cabe destacar la edad avanzada como uno de los principales predictores independientes que aparece de forma invariable en casi todas las series publicadas13,15-22. Por su parte, el BIA es una entidad cuya prevalencia aumenta con la edad, motivo por el que la edad constituye un factor de confusión positivo a la hora de estimar la asociación entre FA postoperatoria y BIA. Por ello, decidimos explorar esta misma asociación en sujetos más jóvenes, evidenciando que la presencia de BIA-AV, aun siendo una entidad menos frecuente en pacientes jóvenes, se asocia de forma independiente con la aparición de FA tras la cirugía cardiaca.
El síndrome de Bayés ha sido ampliamente estudiado en múltiples escenarios, incluyendo la cardioversión farmacológica de FA23, la ablación de venas pulmonares24 o la ablación del istmo cavotricuspídeo25, confirmando en todos ellos una asociación entre la presencia de BIA y la recurrencia o nueva aparición de FA. Se ha postulado también que la presencia de BIA constituye un factor de riesgo para presentar FA en pacientes con miocardiopatía hipertrófica26 o con miocardiopatía por enfermedad de Chagas27. Se ha sugerido también que la mayor prevalencia de BIA existente en pacientes con síndrome de apnea obstructiva del sueño podría justificar en cierta medida la mayor frecuencia de taquiarritmias auriculares en este grupo de pacientes28.
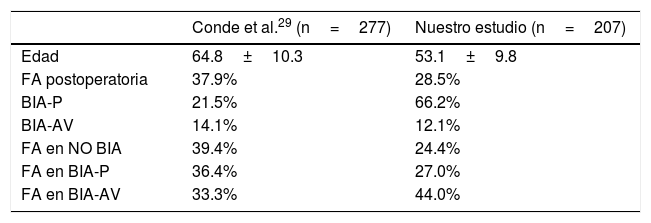
En el año 2014, Conde et al.29 investigaron la asociación de BIA y FA tras cirugía cardiaca. En este estudio, en el que se incluyeron un total de 277 pacientes sometidos a cirugía de revascularización coronaria (edad media de 64.8±10.3), la proporción de FA postoperatoria fue del 37.9%, sin encontrarse diferencias significativas entre el grupo de pacientes con BIA y el grupo de pacientes sin BIA (35.2% vs. 39.4%; p=0.504). Nuestro estudio, en cambio, incluyó pacientes sometidos a distintos tipos de cirugía cardiaca, con una proporción de FA postoperatoria algo menor, dato que podría justificarse por una menor edad media de nuestra población. Otra de las diferencias que se deben resaltar es la frecuencia BIA-P (3 veces mayor en nuestro estudio), si bien la frecuencia de BIA-AV fue similar. Con todo ello, la proporción de FA postoperatoria fue muy similar en pacientes sin BIA, con BIA-P y con BIA-AV en el estudio de Conde et al., mientras que en nuestro estudio la aparición de FA en pacientes sin BIA y con BIA-P fue comparable en ambos grupos y menor que en los mismos pacientes del mencionado estudio. Por otra parte, la presencia de BIA-AV se asoció claramente con una mayor proporción de FA postoperatoria en nuestros pacientes, hallazgo no objetivado en el estudio previamente citado. En la tabla 3 se muestran de forma comparativa los principales datos de ambos estudios.
Resultados comparativos entre estudios
| Conde et al.29 (n=277) | Nuestro estudio (n=207) | |
|---|---|---|
| Edad | 64.8±10.3 | 53.1±9.8 |
| FA postoperatoria | 37.9% | 28.5% |
| BIA-P | 21.5% | 66.2% |
| BIA-AV | 14.1% | 12.1% |
| FA en NO BIA | 39.4% | 24.4% |
| FA en BIA-P | 36.4% | 27.0% |
| FA en BIA-AV | 33.3% | 44.0% |
BIA-AV: bloqueo interauricular avanzado; BIA-P: bloqueo interauricular parcial; FA: fibrilación auricular; NO BIA: ausencia de bloqueo interauricular.
Uno de los puntos a discutir es la elevada prevalencia de BIA objetivada en nuestra muestra (78.3% del total de pacientes incluyendo BIA-P y BIA-AV). Según estudios observacionales previos llevados a cabo en población hospitalaria, un 47% de sujetos ingresados presentaban BIA, siendo esta prevalencia mayor en sujetos de más de 50 años (en torno a un 50-60%) y menor en sujetos jóvenes (10-20% en sujetos de entre 20 y 40 años de edad)30. Se sabe además que la prevalencia de su forma avanzada es prácticamente inexistente (menor del 1%) en población joven, mientras que en pacientes septuagenarios y centenarios en ritmo sinusal se han documentado frecuencias del 9 y 35%, respectivamente31. Por tanto, el aumento de prevalencia de BIA con la edad es un hecho constatado. Con todo ello, teniendo en cuenta que la edad media de nuestra muestra se encuentra entre los 50 y 60 años, y recalcando que la inmensa mayoría de estos pacientes presentan cardiopatía significativa de base, es esperable una prevalencia de BIA mayor que la reportada en otros estudios. Sin embargo, volviendo de nuevo a la comparación con el estudio de Conde et al., donde la frecuencia de BIA-P fue mucho menor que en nuestra población a pesar de contar con una mayor edad media, debe otorgarse un mayor peso a la afectación estructural cardiaca para poder explicar esta diferencia.
Es habitual la coexistencia de dilatación auricular y BIA. El aumento de la duración de la onda P sobre el ECG de superficie en pacientes con crecimiento auricular es consecuencia tanto de la presencia de BIA asociado como del aumento que se produce en la distancia que tiene que recorrer el impulso eléctrico para despolarizar ambas aurículas, teniendo probablemente este mecanismo menor relevancia que el primero32. Sin embargo, considerando que el BIA puede aparecer en pacientes sin dilatación auricular, que puede ser además un fenómeno transitorio y que se puede reproducir de forma experimental, es adecuado afirmar que se trata de una entidad diferenciada33. En nuestro estudio, aunque se observó una clara asociación entre la dilatación auricular y la presencia de BIA-AV, un 8.8% de los pacientes sin crecimiento significativo auricular presentaban BIA-AV, dato que apoya que la dilatación auricular y el trastorno en la conducción auricular constituyen entidades diferenciadas que con frecuencia coexisten.
En nuestros resultados, encontramos también una asociación entre los niveles de NTproBNP y la aparición de FA. Si bien no resultó asociarse de forma independiente con FA postoperatoria, este dato ya ha sido reflejado en la literatura: se trata de un parámetro que ha demostrado ser marcador independiente de la aparición de este tipo de arritmia en el postoperatorio de cirugía cardiaca34.
La FA postoperatoria se ha asociado a múltiples complicaciones, entre las que se incluye el ictus tras la cirugía; se ha relacionado también con una mayor mortalidad tanto a corto como a largo plazo e implica también un mayor tiempo de ingreso hospitalario13,35-39. Existen estudios que han demostrado una elevada incidencia de FA en el seguimiento posterior, con un riesgo de presentar episodios subsecuentes de FA que puede llegar a ser 8 veces mayor en comparación con pacientes que no tuvieron FA postoperatoria40,41. La incidencia de episodios de FA en el seguimiento a largo plazo de estos pacientes es aún mayor (algo más del 40% a 2 años) cuando se utilizan dispositivos de monitorización continua (Holter insertable)42. Por todo ello, es fundamental identificar a aquellos pacientes con un mayor riesgo de presentar esta arritmia postoperatoria e implementar las medidas preventivas necesarias de acuerdo con las guías de práctica clínica. Serán necesarios estudios para comprobar si la presencia de BIA supone un riesgo adicional para presentar nuevos episodios de FA y otras complicaciones asociadas en el seguimiento a largo plazo y para conocer el beneficio de las distintas estrategias que se utilizan en la prevención de esta arritmia en este grupo de pacientes.
LimitacionesSe trata de un estudio unicéntrico, hecho que puede limitar la validez externa de los resultados. Solo se reflejaron aquellos episodios de FA que acontecieron durante el ingreso sin haber registrado los que se pudieron haber producido tras el alta hospitalaria, por lo que es posible que la incidencia de FA postoperatoria esté infraestimada. No se ha recogido información acerca de la utilización de catecolaminas en el postoperatorio ni de fármacos que puedan reducir el riesgo de FA (betabloqueantes, fármacos antiarrítmicos).
ConclusionesEl BIA es una entidad frecuente en pacientes sometidos a cirugía cardiaca y de fácil diagnóstico mediante ECG de superficie. En su forma avanzada, se asocia de forma independiente con la aparición de FA después de la cirugía cardiaca en pacientes menores de 65 años.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.