Un trombo intracorononario largo reclasificado es un predictor independiente de resultados adversos y no reflujo en el infarto agudo de miocardio con elevación del ST. Pacientes con mayor carga de trombo residual tienen peor disfunción microvascular y mayor daño miocárdico.
MétodosEvaluamos retrospectivamente a 833 pacientes que fueron a angioplastia primaria entre enero del 2011 y junio del 2016. La carga de trombo residual final fue reclasificada tras realizar el cruce de la guía, predilatación con balón o tromboaspiración, para restaurar y estabilizar un flujo TIMI 2-3. Las estrategias de stent diferido vs. stent inmediato fueron comparadas, siendo el objetivo primario la incidencia de no reflujo (TIMI ≤ 2, o TIMI 3 con TMP < 2).
ResultadosCuarenta y siete pacientes (6.8%) presentaron una alta carga trombo residual reclasificado. La coronaria derecha fue la arteria culpable en 34 casos. Hubo mayor frecuencia de ectasia coronaria en el grupo de stent diferido (p = 0.005). Se encontraron menores tasas de no reflujo en el stent diferido (36% vs. 58%), con una mayor frecuencia de un TMP 3 (p = 0.005). Tras la nueva cateterización un 56% quedó libre de stent en el grupo diferido y la anticoagulación oral les fue más frecuentemente indicada (p = 0.031). La tasa de eventos cardiacos adversos mayores fue similar entre los grupos. Hubo una tendencia a una mejor función ventricular izquierda en el grupo diferido (p = 0.056).
ConclusionesEl stent diferido puede ser una alternativa eficiente en pacientes con IAM CEST y alta carga de trombo residual reclasificado, después de conseguir un flujo TIMI 2-3 estable.
Reclassification of a large thrombus burden is an independent predictor of major adverse cardiac events and no-reflow in patients with ST- segment elevation myocardial infarction (STEMI). Patients with a greater residual thrombus burden have worse microvascular dysfunction and greater myocardial damage.
MethodsA retrospective analysis was performed on 833 STEMI patients who underwent primary percutaneous coronary intervention. The final residual thrombus burden was reclassified after the lesion was wired, and a thrombus aspiration or balloon dilatation was performed to restore and stabilise a thrombolysis in myocardial infarction (TIMI) 2-3 flow. Deferred stenting (DEI) was compared with immediate stenting (ISI) group, and the primary outcome was the incidence of no-/slow-reflow (TIMI ≤ 2, or TIMI 3 with myocardial blush grade < 2).
ResultsOverall, 47 patients (6.8%) had a residual large thrombus burden reclassified. The right coronary artery was the culprit vessel in 34 cases. More patients had coronary ectasia in the DSI group (P=.005). Fewer patients in the DSI had no-/slow-reflow (36% vs. 58%), and the myocardial blush grade 3 was more frequent in the DSI group (P=.005). After repeat coronary angiography in the DSI group, stenting was not performed in 56%, and oral anticoagulation was more frequent in the follow-up (P=.031). Major cardiac adverse events were similar between groups. There was a tendency to better left ventricular function in the DSI group (P=.056).
ConclusionsDeferred stenting may be an efficient option in STEMI patients with a residual large thrombus burden reclassified after achieving a stable TIMI 2-3 flow.
La intervención coronaria percutánea (ICP) primaria oportuna con dilatación con balón e implante de stent mejora el pronóstico y es el tratamiento actual estándar para pacientes con IAM CEST1,2. La carga de trombo de la lesión culpable durante la angioplastia primaria puede ser tratada solo con ICP convencional y no suele ser lo suficientemente larga para requerir una estrategia de tromboaspiración de rutina3. Sin embargo, no existen datos del manejo en el contexto de alta carga de trombo residual reclasificado persistente, tras el cruce de la guía o la trombectomía.
Un trombo intracoronario largo es asociado a peor pronóstico pues incrementa el riesgo de embolización distal, no reflujo, cierre abrupto, trombosis de stent, nueva revascularización, infarto de miocardio y muerte4-7. La terapia antitrombótica y antiplaquetaria puede reducir la carga de trombo, y las medidas de trombectomía y los dispositivos de protección distal han sido propuestos para prevenir complicaciones causadas por el trombo, pero su uso rutinario ha fallado en mostrar algún efecto beneficio8,9. Además, una carga de trombo grande puede limitar la aposición de strut y el vasoespasmo inicial después de la reperfusión puede llevar a subestimación del tamaño de la arteria, siendo esto un factor de riesgo importante de trombosis o reestenosis del stent y la subsecuente necesidad de revascularización del vaso diana10-12.
El fenómeno de no reflujo es definido como una reducción aguda en el flujo sanguíneo miocárdico a pesar de una arteria coronaria epicárdica patente13. La fisiopatología del no reflujo envuelve la obstrucción microvascular secundaria a embolización distal, espasmo microvascular y trombosis. Es asociado con características del paciente, como edad avanzada, presentación retrasada, oclusión completa del vaso culpable y severa carga de trombo13-17. La estrategia de diferir la implantación del stent, después de que un flujo sanguíneo estable ha sido asegurado en la arteria relacionada al infarto, puede preservar el flujo coronario y reducir el riesgo de embolización, permitir tiempo para la reducción de la carga de trombo y el restablecimiento de la función microvascular, disminuir la probabilidad de no reflujo, incrementar el miocardio salvado y potencialmente mejorar los resultados clínicos18.
El estudio DANAMI 3 DEFER comparó el implante diferido del stent vs. el implante inmediato estándar, encontrando que diferir el stent 48 h no redujo el riesgo de muerte, falla cardiaca o reinfarto. Por otro lado, se encontró una pequeña diferencia en la función ventricular izquierda a favor del implante diferido del stent19. Cabe resaltar que no tuvieron en cuenta la reclasificación del grado de trombo TIMI después de cruzar la guía o inflar un balón, por lo que no podemos excluir un beneficio de esta estrategia en pacientes con alta carga de trombo residual persistente después de haber realizado la reperfusión inicial.
Un estudio reciente de tomografía de coherencia óptica en pacientes con IAM CEST que recibieron trombectomía por aspiración ha mostrado que aquellos con la mayor carga de trombo residual tuvieron peor disfunción microvascular y mayor daño miocárdico comparado con aquellos con pequeña carga de trombo residual20.
Ante este contexto, nuestro objetivo fue investigar si en pacientes con IAM CEST que presentan una alta carga de trombo residual reclasificado tras conseguir la reperfusión inicial del vaso culpable una estrategia alternativa de diferir el implante del stent se asocia a mejores resultados angiográficos y clínicos comparada con una estrategia estándar de stent inmediato.
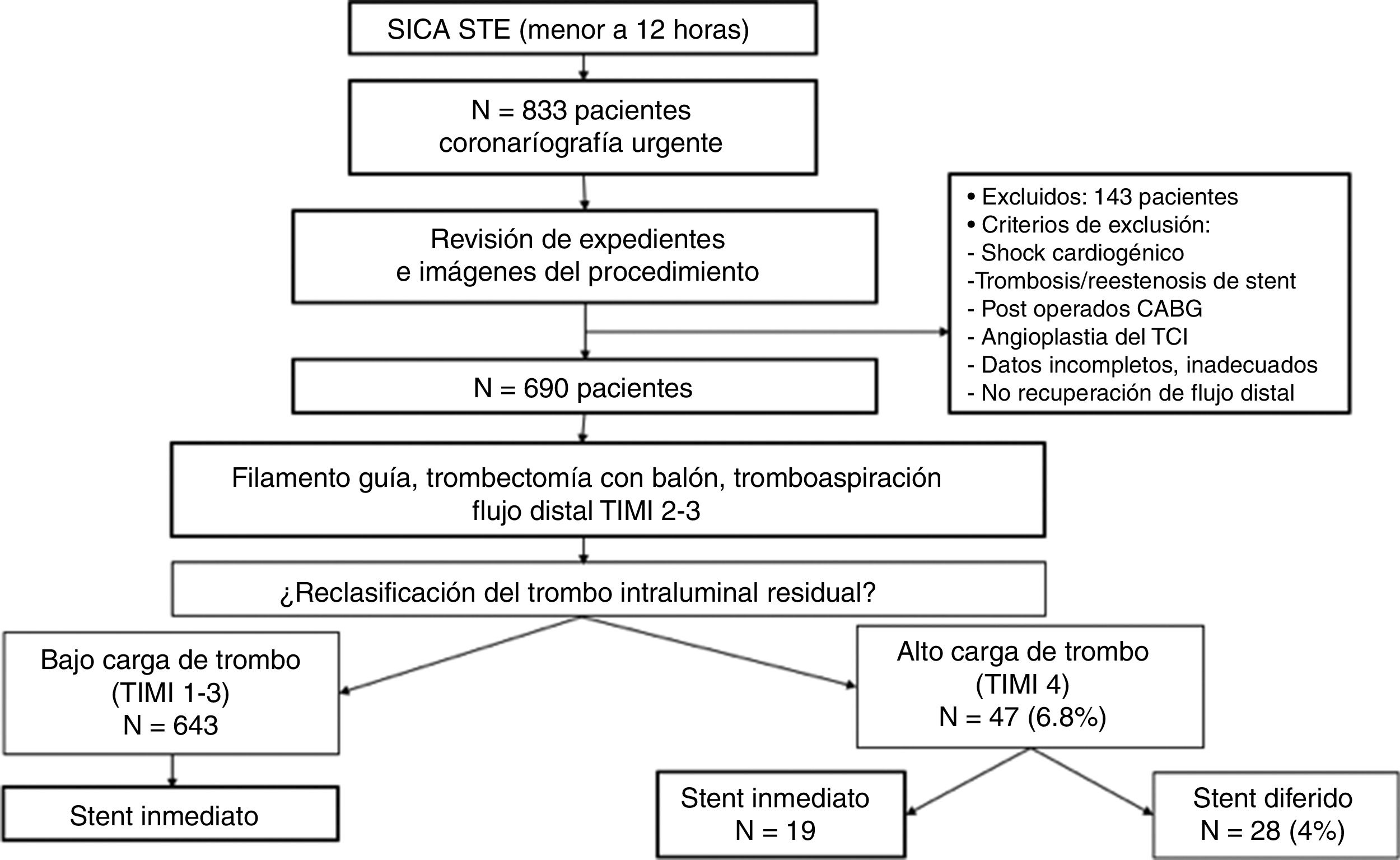
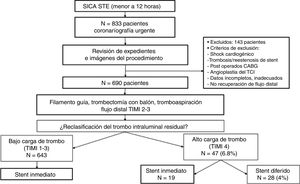
Material y métodosDiseño de estudio y criterios de elegibilidadEstudio descriptivo, retrospectivo, comparativo y longitudinal. Se incluyó a todos los pacientes que ingresaron con diagnóstico de IAM CEST a nuestro centro, dentro de las primeras 12 h del inicio del dolor, y que fueron llevados a sala de hemodinámica con la intención de realizar angioplastia primaria, entre enero del 2011 y junio del 2016. Las coronariografías antes y después de la ICP fueron revisadas, siendo seleccionados aquellos pacientes que tras la reperfusión coronaria inicial (flujo TIMI 2-3) con el cruce de la guía, predilatación con uno o más balones y/o la tromboaspiración presentaron una alta carga de trombo residual reclasificado (trombo TIMI 4), el cual fue finalmente manejado con estrategia de stent diferido vs. inmediato, a decisión del operador. Los criterios de exclusión fueron: 1) shock cardiogénico; 2) trombosis/reestenosis de stent; 3) cirugía de revascularización previa; 4) angioplastia del tronco coronario izquierdo; 5) ausencia de un flujo coronario estable, y 6) datos o imágenes incompletas.
Todos los pacientes fueron pretratados con doble antiagregación. La ICP con stent inmediato fue realizada de acuerdo con la práctica estándar. El uso de trombectomía, sistema de aspiración o tratamiento farmacológico periprocedimiento fue a consideración de los operadores.
En el caso de la estrategia de stent diferido, los pacientes fueron nuevamente cateterizados días posteriores a la reperfusión coronaria inicial, con un intervalo al segundo procedimiento a criterio del médico tratante. Todos los pacientes fueron trasladados a la unidad de cuidados coronarios. Tras la ICP, se aplicaron óptimas medidas de prevención secundaria. Se compararon los resultados entre ambos grupos.
Análisis angiográficoEl trombo intracoronario fue angiográficamente identificado y evaluado, según la coronariografía inicial en 5 grados según la escala TIMI21. El trombo residual final fue reclasificado en 2 categorías, pequeña carga de trombo para trombos grado < 4 y alta carga de trombo para trombos de grado 4. La longitud y el área del trombo residual intraluminal reclasificado fueron delineadas como un defecto de llenado de contraste usando un software QCA. El grado de trombo al inicio del segundo procedimiento fue comparado con el final del primer procedimiento.
SeguimientoLa información respecto a las características clínicas basales, los detalles del procedimiento, los eventos intrahospitalarios y en el seguimiento, fue obtenida del expediente médico electrónico. Un ecocardiograma transtorácico estándar fue realizado en el seguimiento como parte del manejo de estos pacientes. La fracción de eyección ventricular izquierda estimada por el método biplano de Simpson fue recogida del reporte correspondiente.
DefinicionesEl grado de flujo epicárdico TIMI y la perfusión microvascular TMP fueron evaluados según lo reportado previamente22,23. El no reflujo fue definido como un TIMI < 3 o un flujo TIMI 3 con un TMP < 2, en ausencia de disección, oclusión del sitio de tratamiento o embolización distal. La embolización distal fue definida como la migración del defecto de llenado distalmente ocluyendo la arteria relacionada con el infarto o una de sus ramas, o un nuevo corte abrupto del vaso/rama distal. La resolución del segmento ST se definió como una resolución > 50% evaluada 60 min después de la reperfusión inicial.
Las complicaciones clínicas durante el seguimiento fueron revisadas incluyendo: angina recurrente, revascularización urgente durante el intervalo al segundo procedimiento, muerte, infarto de miocardio recurrente, revascularización de la lesión (TLR)/vaso objetivo (TVR), sangrado, enfermedad cerebral vascular, nefropatía inducida por contraste y trombosis/reestenosis de stent de acuerdo con las definiciones previamente establecidas. Los eventos cardiovasculares adversos mayores (MACE) fueron definidos como el compuesto de muerte, revascularización (TVR/TLR), readmisión por falla cardiaca o infarto de miocardio recurrente.
Análisis estadísticoLas medias (± desviación estándar) fueron usadas para resumir datos continuos de distribución normal. Las medianas (rangos intercuartiles) fueron usadas para describir datos continuos asimétricos. El número y el porcentaje fueron usados para resumir datos categóricos. Todos los test tuvieron 2 colas y un valor de p < 0.05 fue considerado significativo. Las variables categóricas fueron comparadas usando el test de la chi al cuadrado o el test exacto de Fisher cuando el valor esperado en cualquiera de las celdas fue menor de 5. Antes del análisis estadístico, la normalidad y la homogeneidad de las variancias fueron testeadas usando el test de Kolgomorov-Smirnov. Las variables continuas fueron comparadas usando el test t o U de Mann-Whitney, según fue apropiado. Las odds radio y un intervalo de confianza del 95% fueron evaluados usando regresión logística para evaluar los resultados de los efectos de tratamiento. Las tasas de eventos acumulados fueron estimadas usando el método de Kaplan-Meier y las diferencias entre los grupos fueron evaluadas usando el test de significación log-rank. Variables asociadas con la tasa de eventos intrahospitalarios en el análisis bivariado de un nivel de p ≤ 0.1 fueron incluidas en un análisis multivariable de regresión logística para los desenlaces intrahospitalarios. Todos los análisis estadísticos fueron ejecutados en el programa SPSS versión 17.
ResultadosSe estudió a 690 pacientes con IAM CEST, que fueron llevados a sala de hemodinámica con la intención de realizar una angioplastia primaria y tras el cruce de la guía, predilatación con balón y/o tromboaspiración, que presentaron un flujo distal TIMI 2-3. Se realizó la reclasificación angiográfica del trombo residual intraluminal, presentando solo 47 pacientes (6.8% del total) una alta carga de trombo residual (fig. 1).
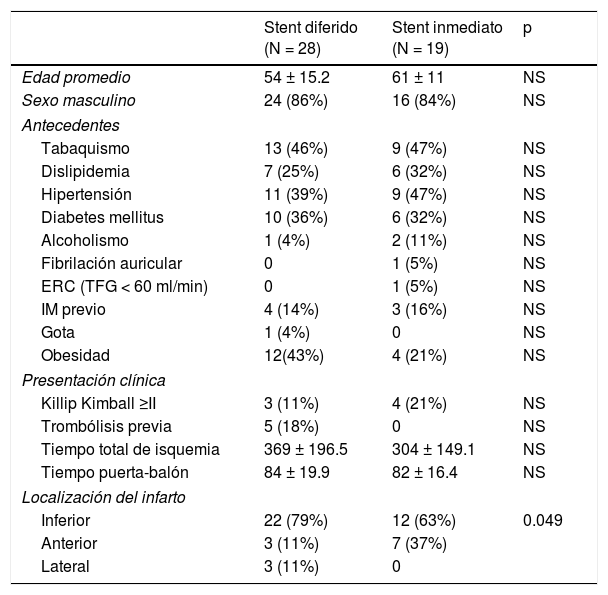
Dentro de las características basales, no se encontraron diferencias significativas según la edad, el sexo, los antecedentes médicos y la presentación clínica; 5 pacientes (18%) del grupo de stent diferido fueron cateterizados tras una trombólisis previa fallida. La mayoría de los pacientes en ambos grupos presentaron una localización inferior del infarto, siendo la arteria coronaria derecha la arteria más frecuentemente responsable del infarto. La presencia de ectasia coronaria fue significativamente más frecuente el grupo de stent diferido (p = 0.005) (tabla 1).
Características basales de los pacientes
| Stent diferido (N = 28) | Stent inmediato (N = 19) | p | |
|---|---|---|---|
| Edad promedio | 54 ± 15.2 | 61 ± 11 | NS |
| Sexo masculino | 24 (86%) | 16 (84%) | NS |
| Antecedentes | |||
| Tabaquismo | 13 (46%) | 9 (47%) | NS |
| Dislipidemia | 7 (25%) | 6 (32%) | NS |
| Hipertensión | 11 (39%) | 9 (47%) | NS |
| Diabetes mellitus | 10 (36%) | 6 (32%) | NS |
| Alcoholismo | 1 (4%) | 2 (11%) | NS |
| Fibrilación auricular | 0 | 1 (5%) | NS |
| ERC (TFG < 60 ml/min) | 0 | 1 (5%) | NS |
| IM previo | 4 (14%) | 3 (16%) | NS |
| Gota | 1 (4%) | 0 | NS |
| Obesidad | 12(43%) | 4 (21%) | NS |
| Presentación clínica | |||
| Killip Kimball ≥II | 3 (11%) | 4 (21%) | NS |
| Trombólisis previa | 5 (18%) | 0 | NS |
| Tiempo total de isquemia | 369 ± 196.5 | 304 ± 149.1 | NS |
| Tiempo puerta-balón | 84 ± 19.9 | 82 ± 16.4 | NS |
| Localización del infarto | |||
| Inferior | 22 (79%) | 12 (63%) | 0.049 |
| Anterior | 3 (11%) | 7 (37%) | |
| Lateral | 3 (11%) | 0 | |
ERC: enfermedad renal crónica; IM: infarto de miocardio; NS: no significativo, p > 0.05; TFG: tasa de filtración glomerular.
Los valores mostrados son n (%) y media ± desviación estándar.
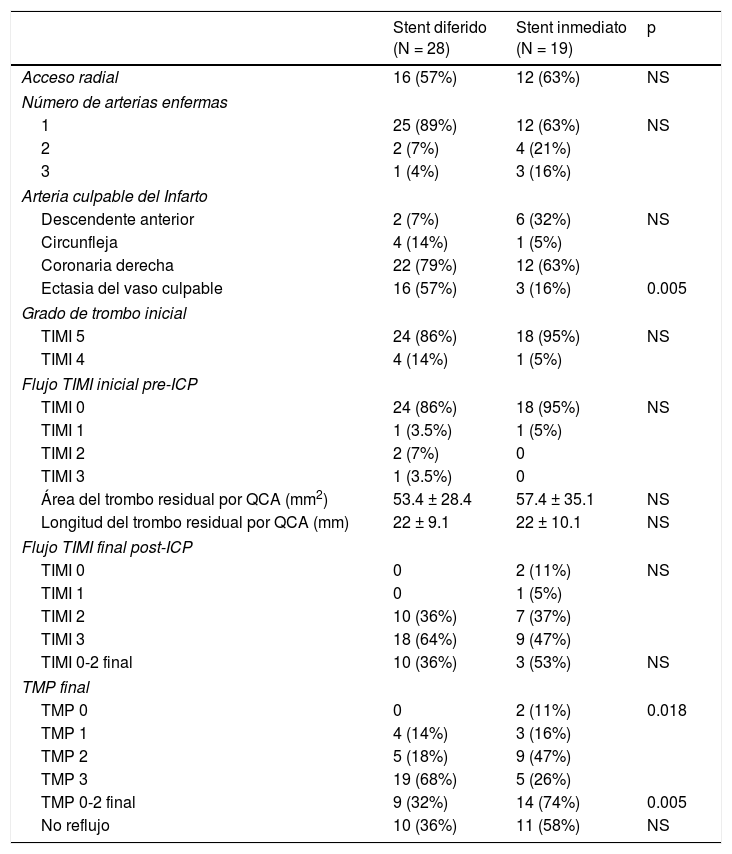
No se encontraron diferencias estadísticamente significativas en las tasas de no reflujo entre ambos grupos (36% vs. 58%), pero hubo una mayor proporción de pacientes en el grupo de stent diferido que concluyeron con un flujo TIMI 3 (64% vs. 47%) y un TMP 3 (68% vs. 26%), siendo en este último caso estadísticamente significativo (p = 0.018) (tabla 2).
Resultados angiográficos de los grupos
| Stent diferido (N = 28) | Stent inmediato (N = 19) | p | |
|---|---|---|---|
| Acceso radial | 16 (57%) | 12 (63%) | NS |
| Número de arterias enfermas | |||
| 1 | 25 (89%) | 12 (63%) | NS |
| 2 | 2 (7%) | 4 (21%) | |
| 3 | 1 (4%) | 3 (16%) | |
| Arteria culpable del Infarto | |||
| Descendente anterior | 2 (7%) | 6 (32%) | NS |
| Circunfleja | 4 (14%) | 1 (5%) | |
| Coronaria derecha | 22 (79%) | 12 (63%) | |
| Ectasia del vaso culpable | 16 (57%) | 3 (16%) | 0.005 |
| Grado de trombo inicial | |||
| TIMI 5 | 24 (86%) | 18 (95%) | NS |
| TIMI 4 | 4 (14%) | 1 (5%) | |
| Flujo TIMI inicial pre-ICP | |||
| TIMI 0 | 24 (86%) | 18 (95%) | NS |
| TIMI 1 | 1 (3.5%) | 1 (5%) | |
| TIMI 2 | 2 (7%) | 0 | |
| TIMI 3 | 1 (3.5%) | 0 | |
| Área del trombo residual por QCA (mm2) | 53.4 ± 28.4 | 57.4 ± 35.1 | NS |
| Longitud del trombo residual por QCA (mm) | 22 ± 9.1 | 22 ± 10.1 | NS |
| Flujo TIMI final post-ICP | |||
| TIMI 0 | 0 | 2 (11%) | NS |
| TIMI 1 | 0 | 1 (5%) | |
| TIMI 2 | 10 (36%) | 7 (37%) | |
| TIMI 3 | 18 (64%) | 9 (47%) | |
| TIMI 0-2 final | 10 (36%) | 3 (53%) | NS |
| TMP final | |||
| TMP 0 | 0 | 2 (11%) | 0.018 |
| TMP 1 | 4 (14%) | 3 (16%) | |
| TMP 2 | 5 (18%) | 9 (47%) | |
| TMP 3 | 19 (68%) | 5 (26%) | |
| TMP 0-2 final | 9 (32%) | 14 (74%) | 0.005 |
| No reflujo | 10 (36%) | 11 (58%) | NS |
No reflujo: TIMI < 3 o TIMI 3 con TMP < 2; NS: No significativo, p > 0.05; QCA: análisis coronario cuantitativo.
Los valores mostrados son n (%) y media ± desviación estándar. Los resultados angiográficos incluyen el primer y el segundo procedimiento en el caso del grupo de stent diferido.
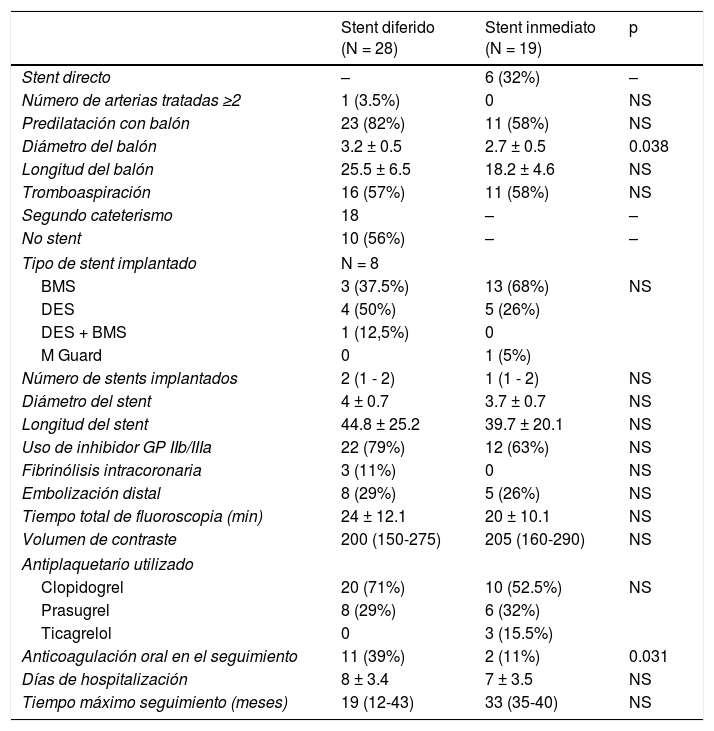
Se trató solo la arteria responsable del infarto en la casi la totalidad de los pacientes (98%), hubo mayor proporción de uso de predilatación con balón y el diámetro promedio del balón utilizado fue significativamente mayor en el grupo de stent diferido (3.2 vs. 2.7mm, p = 0.038) (tabla 3).
Datos del procedimiento y del seguimiento
| Stent diferido (N = 28) | Stent inmediato (N = 19) | p | |
|---|---|---|---|
| Stent directo | – | 6 (32%) | – |
| Número de arterias tratadas ≥2 | 1 (3.5%) | 0 | NS |
| Predilatación con balón | 23 (82%) | 11 (58%) | NS |
| Diámetro del balón | 3.2 ± 0.5 | 2.7 ± 0.5 | 0.038 |
| Longitud del balón | 25.5 ± 6.5 | 18.2 ± 4.6 | NS |
| Tromboaspiración | 16 (57%) | 11 (58%) | NS |
| Segundo cateterismo | 18 | – | – |
| No stent | 10 (56%) | – | – |
| Tipo de stent implantado | N = 8 | ||
| BMS | 3 (37.5%) | 13 (68%) | NS |
| DES | 4 (50%) | 5 (26%) | |
| DES + BMS | 1 (12,5%) | 0 | |
| M Guard | 0 | 1 (5%) | |
| Número de stents implantados | 2 (1 - 2) | 1 (1 - 2) | NS |
| Diámetro del stent | 4 ± 0.7 | 3.7 ± 0.7 | NS |
| Longitud del stent | 44.8 ± 25.2 | 39.7 ± 20.1 | NS |
| Uso de inhibidor GP IIb/IIIa | 22 (79%) | 12 (63%) | NS |
| Fibrinólisis intracoronaria | 3 (11%) | 0 | NS |
| Embolización distal | 8 (29%) | 5 (26%) | NS |
| Tiempo total de fluoroscopia (min) | 24 ± 12.1 | 20 ± 10.1 | NS |
| Volumen de contraste | 200 (150-275) | 205 (160-290) | NS |
| Antiplaquetario utilizado | |||
| Clopidogrel | 20 (71%) | 10 (52.5%) | NS |
| Prasugrel | 8 (29%) | 6 (32%) | |
| Ticagrelol | 0 | 3 (15.5%) | |
| Anticoagulación oral en el seguimiento | 11 (39%) | 2 (11%) | 0.031 |
| Días de hospitalización | 8 ± 3.4 | 7 ± 3.5 | NS |
| Tiempo máximo seguimiento (meses) | 19 (12-43) | 33 (35-40) | NS |
BMS: stent metálico desnudo; DES: stent liberador de fármaco; GP: glucoproteína; NS: no significativo, p > 0.05.
Los valores mostrados son n (%), media ± desviación estándar y mediana (rangos intercuartiles).
En el grupo de stent diferido se realizó un nuevo cateterismo a 18 pacientes. La nueva angiografía y el implante de stent diferido tuvieron una mediana de 3 días. No se registraron recurrencia de síntomas, elevación del ST o reinfarto antes de lo programado en este grupo. Tras el tratamiento anticoagulante intenso, el grado de trombo residual TIMI disminuyó en un 78% de casos. En este grupo un 56% de los pacientes quedaron libres de stent y se observó en promedio un mayor diámetro y longitud del stent implantado durante el segundo procedimiento, aunque esto no fue estadísticamente significativo.
La anticoagulación por vía oral durante el seguimiento fue más frecuentemente indicada en el grupo de stent diferido (p = 0.031). Los pacientes con ectasia coronaria tuvieron cerca del doble de posibilidad de recibir anticoagulación por vía oral en comparación con aquellos sin ectasia (odds ratio: 1.6, intervalo de confianza del 95%, 1.04-2.6, p = 0.013), además de los 3 pacientes que recibieron como parte del abordaje una trombólisis intracoronaria, todos presentaron ectasia coronaria (p = 0.03).
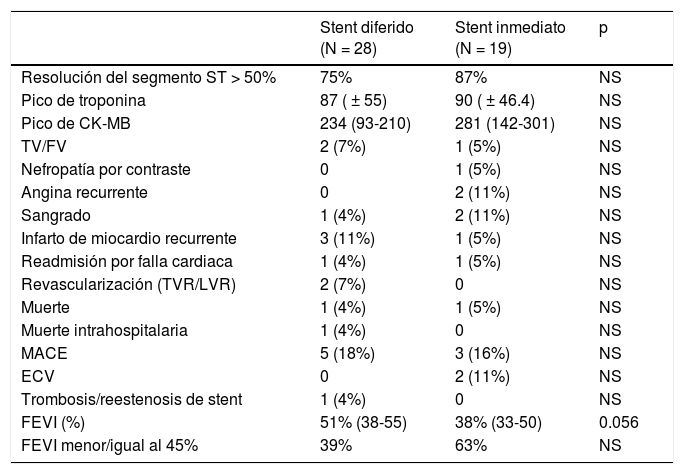
Dentro de los resultados clínicos no se presentaron diferencias significativas respecto a las tasas de resolución del segmento ST, pico de troponina, pico de creatincinasa MB, trombosis/reestenosis de stent, o los eventos intrahospitalarios, pero hubo una tendencia a una mejor fracción de eyección ventricular izquierda durante el seguimiento en el grupo de stent diferido (p = 0.056) (tabla 4).
Resultados clínicos de los grupos
| Stent diferido (N = 28) | Stent inmediato (N = 19) | p | |
|---|---|---|---|
| Resolución del segmento ST > 50% | 75% | 87% | NS |
| Pico de troponina | 87 ( ± 55) | 90 ( ± 46.4) | NS |
| Pico de CK-MB | 234 (93-210) | 281 (142-301) | NS |
| TV/FV | 2 (7%) | 1 (5%) | NS |
| Nefropatía por contraste | 0 | 1 (5%) | NS |
| Angina recurrente | 0 | 2 (11%) | NS |
| Sangrado | 1 (4%) | 2 (11%) | NS |
| Infarto de miocardio recurrente | 3 (11%) | 1 (5%) | NS |
| Readmisión por falla cardiaca | 1 (4%) | 1 (5%) | NS |
| Revascularización (TVR/LVR) | 2 (7%) | 0 | NS |
| Muerte | 1 (4%) | 1 (5%) | NS |
| Muerte intrahospitalaria | 1 (4%) | 0 | NS |
| MACE | 5 (18%) | 3 (16%) | NS |
| ECV | 0 | 2 (11%) | NS |
| Trombosis/reestenosis de stent | 1 (4%) | 0 | NS |
| FEVI (%) | 51% (38-55) | 38% (33-50) | 0.056 |
| FEVI menor/igual al 45% | 39% | 63% | NS |
CK-MB: creatincinasa MB; ECV: enfermedad cerebrovascular; FEVI: fracción de eyección del ventrículo izquierdo, resolución del segmento ST mayor del 50% a los 60 min; FV: fibrilación ventricular; MACE: eventos cardiacos adversos mayores, muerte o infarto de miocardio recurrente o readmisión por falla cardiaca, o revascularización; TLR: revascularización de lesión objetivo; TV: taquicardia ventricular; TVR: revascularización del vaso objetivo.
Los valores mostrados son n (%), media ± desviación estándar y mediana (rangos intercuartiles).
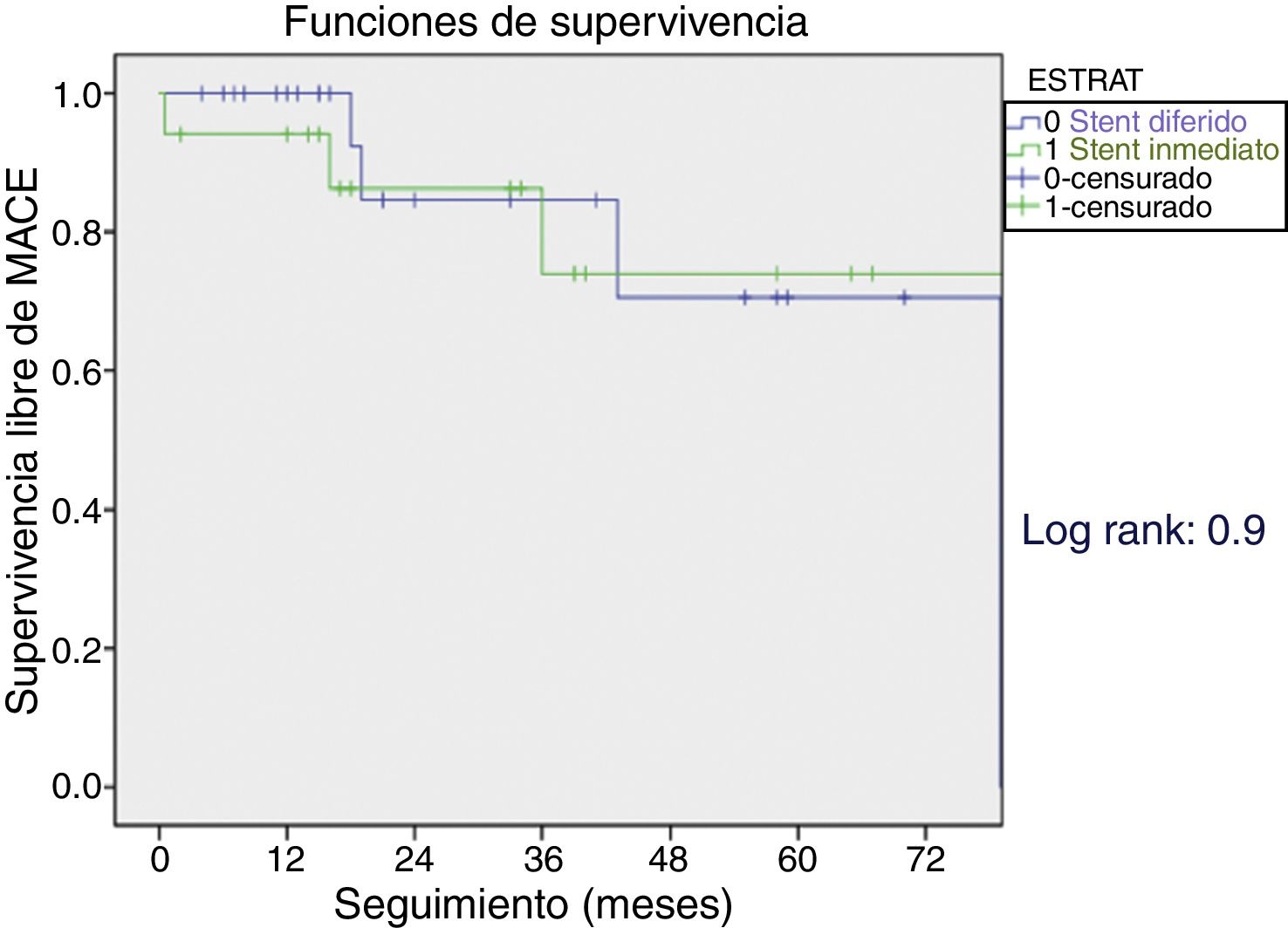
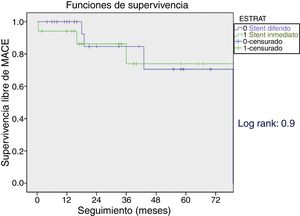
No se presentaron diferencias en las tasas de muerte entre ambos grupos y se encontró una tasa de supervivencia similar en el seguimiento (fig. 2).
DiscusiónEl principal hallazgo de nuestro estudio fue describir por primera vez los resultados en presencia de alta carga de trombo residual (TIMI 4) reclasificado, donde observamos que diferir el implante del stent es una estrategia prometedora en el intento de prevenir el no reflujo y mejorar los resultados clínicos.
Nosotros identificamos que este subgrupo de pacientes con alta carga de trombo residual reclasificado, tras cruzar la lesión con la guía, realizar dilataciones con balones y/o tromboaspiración, es una muy pequeña proporción del total de pacientes que son llevados a angioplastia primaria, por tanto, es comprensible que diferir el stent no haya tenido resultados diferentes de la ICP convencional en los ensayos clínicos que valoraron su uso de rutina, ya que la carga de trombo residual generalmente es baja y, por tanto, podría manejarse de forma convencional sin mayor riesgo.
Diferir el stent presentó mejores resultados angiográficos tanto en el TIMI como en el TMP final y en este último caso fue estadísticamente significativo. En este sentido, se ha descrito que a pesar la restauración exitosa del flujo epicárdico, obtener una perfusión miocárdica anormal ha sido asociado con un incremento del tamaño del infarto y mayor mortalidad24,25.
El tratamiento anticoagulante intenso durante el intervalo entre el primer y el segundo procedimiento disminuyó la carga de trombo y, por consiguiente, disminuyó el sustrato de embolización distal y trombosis microvascular, lo cual puede explicar la menor incidencia de no reflujo. Así pues, encontramos una tendencia a una mejor función ventricular izquierda en el grupo diferido, en relación probable con una mayor cantidad de miocardio salvado, lo cual es clínicamente relevante.
En nuestra experiencia, la estrategia de stent diferido puede hacerse con seguridad y el implante de stent podría evitarse en algunos pacientes, principalmente en aquellos con ectasia coronaria y mayor volumen de trombo, donde la desproporción del diámetro de referencia de la arteria responsable del infarto con relación con el diámetro del stent es una limitación importante, y en donde continuar con anticoagulación por vía oral a largo plazo podría ser una estrategia adecuada.
Durante el segundo procedimiento se usaron stents de diámetro y longitud mayores, lo cual podría indicar que en este momento los diámetros de referencia podrían ser mejor valorados, al evitar la vasoconstricción que acompaña el procedimiento y la reperfusión inicial.
Creemos que diferir el stent en este contexto, guiados por angiografía, podría ser conveniente para dejar la lesión «enfriarse», implantando el stent posteriormente en un contexto más estable, pero esta decisión exige estimar el riesgo de reoclusión temprana, el riesgo hemorrágico, los costos y la factibilidad de un segundo procedimiento.
Nuestro estudio refuerzan los hallazgos de Tang et al.26, quienes encontraron que ante una alta carga de trombo residual (TIMI ≥2) después de la tromboaspiración el TIMI corregido por cuadros y el rubor miocárdico grado 3 fue más frecuente en el stent diferido, hubo una menor incidencia de no reflujo y un significativo mayor índice de motilidad ventricular. Así mismo, se refuerzan los hallazgos de Ahn et al.27, quienes refirieron que la carga de trombo residual angiográfica se relaciona con mayor ocurrencia de no reflujo, y los hallazgos de Higuma et al.20, donde los pacientes con mayor carga de trombo residual tuvieron peores resultados a nivel microvascular y miocárdico.
Limitaciones del estudioEstudio unicéntrico, retrospectivo. Nuestros índices de no reflujo fueron mayores a los previamente reportados. No se realizó angiografía control en el grupo de stent inmediato. El tiempo del intervalo entre el primer y segundo procedimiento fue variable y a criterio del médico tratante. Aunque no hubo un esquema por igual de anticoagulación a todos los pacientes, consideramos que el uso de tirofibán intracoronario, seguido de infusión continua asociada a heparina no fraccionada al menos por 72 h, podría ser el esquema más recomendado. Un seguimiento a más largo plazo podría valorar mejor el riesgo de implantar un stent ante una alta carga de trombo residual, el cual podría corresponderse con una mayor incidencia de aposición incompleta y, por tanto, mayores tasas de trombosis de stent. La utilización de dispositivos de protección distal no fue posible debido al mayor costo. Debido a que solo fueron seleccionados pacientes con alta carga de trombo residual reclasificado, el número de pacientes fue relativamente pequeño.
ConclusionesEl stent diferido puede ser una opción eficiente en pacientes con IAM CEST seleccionados, con alta carga de trombo residual reclasificado tras conseguir un flujo TIMI 2-3 estable durante la intervención inicial. Se requieren estudios clínicos aleatorizados a futuro en este contexto específico.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.