Introducción
A pesar de los avances en el manejo de factores de riesgo, la disponibilidad de terapias convencionales que incluyen tratamientos invasivos para la enfermedad coronaria, la enfermedad arterial periférica y una mejora en el pronóstico de la insuficiencia cardiaca (IC) las enfermedades cardiovasculares continúan siendo la principal causa de muerte en el mundo occidental.1 La IC representa un gran desafío debido a que su mortalidad e incidencia continúan incrementándose; esto refleja en gran medida la ausencia de terapias enfocadas en los fundamentos moleculares de la patología, ya que a pesar de que la terapéutica ha mejorado en las últimas dos décadas, los tratamientos existentes no son ideales, debido a que no son suficientes para apoyar al miocardio e incrementar la función cardiaca global. Es por ello que se requiere de nuevas aproximaciones terapéuticas que estén dirigidas a los defectos moleculares de la disfunción ventricular.
La terapia génica (TG) puede ser definida como una transferencia de ácidos nucleicos a células somáticas de un individuo resultando en un efecto terapéutico.2 Entre las ventajas de la terapia génica sobre las modalidades de tratamiento actuales se encuentran: el tratamiento selectivo de los tejidos afectados, la posibilidad de emplear localmente proteínas endógenas en casos en los que su aplicación sistémica incurriría en efectos secundarios graves, y la posibilidad de efectos terapéuticos a largo plazo tras una sola aplicación.3
En la última década se ha identificado un gran número de mecanismos moleculares que constituyen la base molecular de la insuficiencia cardiaca.4 De igual manera la posibilidad de realizar transferencia de material genómico in vivo, ha hecho posible explorar esta metodología como una opción para corregir los defectos presentes en la IC, bajo la premisa de ser una terapéutica capaz de corregir los defectos fundamentales en la IC.
Entre los defectos moleculares observados durante la IC, y que han sido explorados como blancos terapéuticos, se encuentran las alteraciones en el manejo de Ca2+, durante el proceso del acoplamiento excitación-contracción,5-16 alteraciones en los receptores beta-adrenérgicos y en su acoplamiento a proteínas G,17-21 alteraciones de la señalización celular, incluyendo a la familia de la proteína cinasa C (PKC),22 y a la producción de segundos mensajeros por la enzima adenilato ciclasa.23 La apoptosis de miocitos cardiacos también ha sido señalada y estudiada.24,25 Por último, el uso de factores angiogénicos, también se ha analizado como una opción en pacientes con IC secundaria a cardiopatía isquémica.3
A pesar de que el tratamiento por transferencia de material genético aún presenta múltiples dificultades, en la actualidad ya se han realizado pequeños ensayos clínicos, aplicando factores angiogénicos en cardiopatía isquémica.26-28 Con relación a otros mecanismos moleculares de la IC, varios de ellos se encuentran en fases muy cercanas a ensayos clínicos. El potencial que tiene esta nueva opción terapéutica, aunado a lo novedoso de su mecanismo de acción, hace imperativo que se conozcan sus ventajas y desventajas para poder aprovechar esta opción terapéutica emergente. El objetivo de esta revisión es examinar el estado actual de la investigación sobre el uso de la terapia génica para la insuficiencia cardiaca, incluyendo a los vectores y métodos de aplicación y los blancos terapéuticos explorados en la actualidad.
Vectores y vías de administración
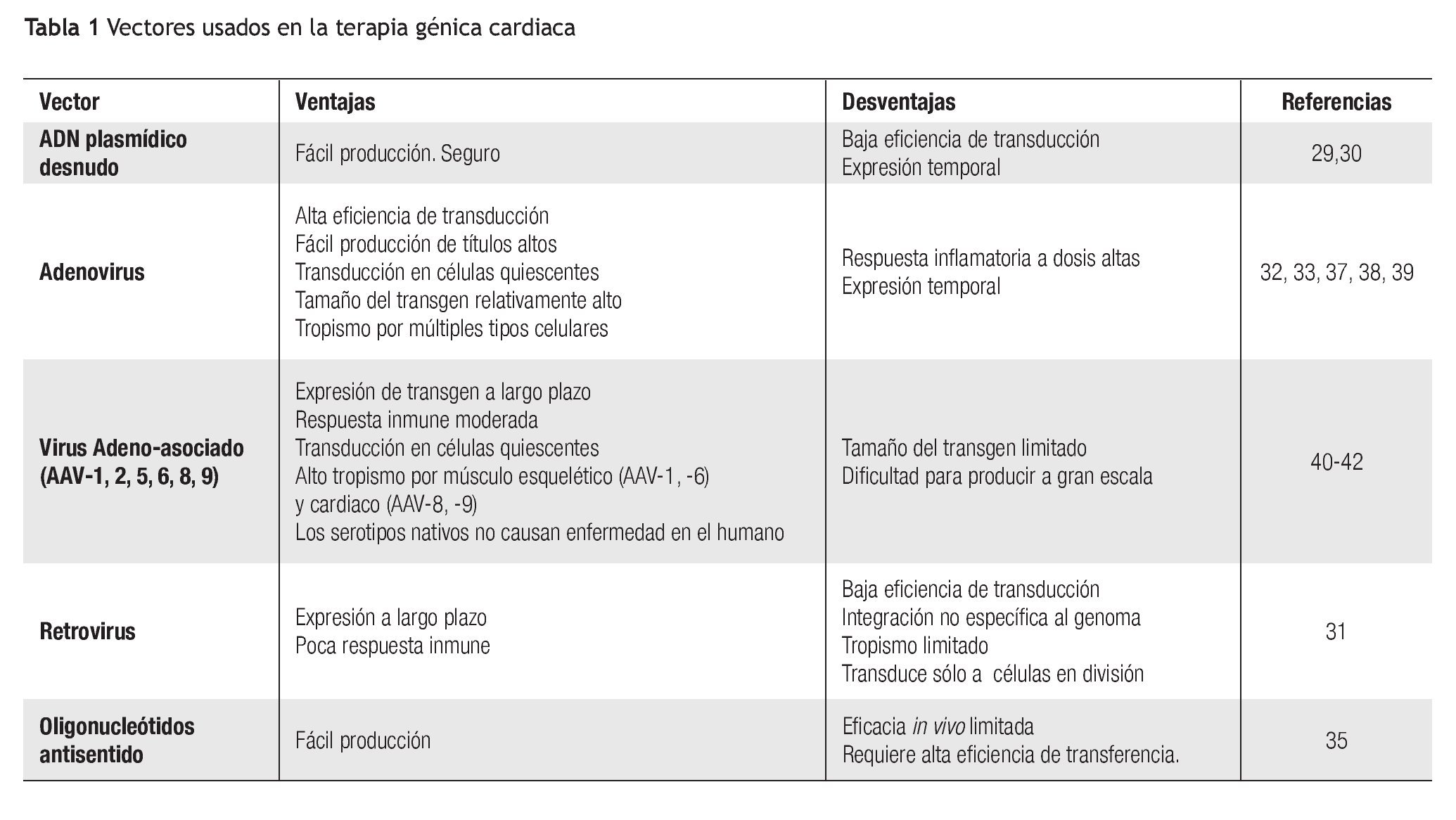
Los ensayos iniciales para transferir material genético al corazón empleaban fundamentalmente ADN plasmídico, por su fácil producción y seguridad. A pesar de que los primeros estudios mostraban resultados positivos29,30 en ensayos aleatorizados de mayor tamaño, donde se transfirieron genes codificantes para el factor de crecimiento vascular endotelial (VEGF, por sus siglas en inglés) y otros factores angiogénicos, mostraron que no era una técnica útil debido su muy baja eficiencia.27 El uso de liposomas y de polímeros catiónicos, útiles en transferencia de material genético en cultivos celulares, no incrementa la eficiencia de la transferencia.31,32 Uno de los mayores problemas con el uso de ADN plasmídico es la falta de respuesta ante el incremento de la dosis.33 El uso de este vector se considera relativamente seguro, pero se ha demostrado en modelos animales que puede producir fiebre, inflamación e infartos en el tejido muscular esquelético y en el miocardio.26 Debido a estos factores, los vectores virales son una mejor opción para la terapia génica cardiaca (Tabla 1).
Entre los vectores virales, inicialmente se emplearon los retrovirus, debido a la poca respuesta inmune que generan y a la posibilidad de una expresión sostenida a largo plazo (años); sin embargo, los retrovirus tienen como desventajas una baja eficiencia de infección, un tropismo cardiaco limitado -ya que infecta principalmente células en división-, además de que se han mencionado preocupaciones en su seguridad, a causa del potencial oncogénico.31 Por ello, es un vector en el que el interés ha disminuido. Recientemente se han empleado lentivirus, principalmente para transferir material genético a células de la pared vascular, debido a que han demostrado una alta eficiencia en el músculo liso y provocan una respuesta inmune mínima; sin embargo, el tropismo por el miocardio es limitado y su producción en grandes cantidades es difícil, por lo que actualmente se requiere de una ingeniería de este vector para mejorar su utilidad, facilitando su producción a gran escala.34 Los oligonucleótidos antisentido, o señuelo, fueron mencionados como opciones hace más de 10 años, pero su mínima eficacia in vivo, los descarta de alguna aplicación clínica.35 Los sendaivirus y herpesvirus han sido mencionados como posibles vectores, pero a la fecha no existen datos suficientes sobre su utilidad.38
Actualmente los adenovirus (Ad), y los virus adenoasociados (AAV), son los vectores más estudiados en la TG cardiovascular, ya que ambos han demostrado una gran eficacia en el tejido cardiaco, la pared vascular y el hígado.32 Los Ad de primera generación tienen una expresión inicial muy alta, alcanzando su efecto máximo en los primeros días tras la transferencia de material, pero disminuyen su expresión a las dos semanas aproximadamente.33,37,38 Por lo tanto, parecen tener utilidad cuando se requiere una expresión alta por poco tiempo como en la angiogénesis terapéutica para las heridas. La administración repetida de Ad para TG no es útil en mamíferos grandes, debido a que evoca una respuesta inmune importante. Los Ad en dosis pequeñas producen una respuesta inflamatoria mínima en el miocardio. Los Ad de segunda y tercera generación causan una menor respuesta inmune y parecen tener una expresión más prolongada, pero su utilidad en TG en humanos aún es desconocida.38 La seguridad de los Ad ha indicado ser muy alta en ensayos clínicos; la fiebre es su complicación más importante.
Los AAV poseen un número de cualidades que los hace potencialmente útiles para TG cardiaca, debido a que tienen un tropismo natural hacia el músculo liso vascular, músculo esquelético y el miocardio.40 Son capaces de expresar genes en células quiescentes, y por un largo periodo de tiempo, a pesar de que la expresión máxima se alcanza en días.41 Como no producen enfermedades en el humano, la respuesta inflamatoria que generan es mínima; los AAV nativos son capaces de integrarse al genoma humano, pero los vectores AAV modificados no pueden, y mantienen su expresión a largo plazo por medio de asociaciones episómicas con el ADN genómico. La ventaja de esta forma de asociación es que se elimina el riesgo de inserciones mutagénicas y oncogénicas, que se encuentran con otros vectores de expresión a largo plazo, como los retrovirus.42
Vías de administración
La transferencia de material genético al corazón puede lograrse por tres vías: transferencia intravascular, transferencia ex vivo y por inyección intraórgano.
Transferencia intravascular
Para la transferencia intravascular se han desarrollado distintos sistemas por catéter para mejorar la penetración de vectores a través de la íntima. Sin embargo, la transferencia en lesiones con calcificaciones, depósitos de colesterol, infiltrados e inflamación continúa siendo un gran desafío.43 El uso de stents porosos, por los cuales puedan ser eluidos los vectores con genes terapéuticos, ha sido propuesto como una opción para mejorar la transferencia, pero no hay suficientes datos para determinar su utilidad hasta este momento.44,45 La vía de administración ideal para TG es un vector intravenoso, pero la cantidad requerida de virus para lograr una expresión adecuada en mamíferos grandes es probablemente muy alta como para considerarla segura.
Transferencia ex vivo
La administración ex vivo es una combinación de la terapia celular, incluyendo a las células madre y la terapia génica. Consiste en la administración del vector in vitro a células madre aisladas de la médula ósea, o cultivos de mioblastos esqueléticos. con el objeto de transferir posteriormente a las células con los transgenes al organismo del paciente.46-54 Esta forma de administración ha sido estudiada principalmente en la expresión de factores angiogénicos y citocinas.46,54,55 Entre las ventajas de esta forma de administración está la posibilidad de usar métodos más eficientes para la transferencia de material genético, como lípidos catiónicos o electroporación, que no son posibles de emplear in vivo, y que, además, la localización de las células modificadas en el corazón tengan una expresión localizada, continua y con niveles constantes, sin efectos sistémicos.48,51,52 Los cardiomiocitos son, por naturaleza, resistentes a la transferencia de material genético, y esta forma de administración evita esta complicación. La administración ex vivo, tiene el potencial de convertirse en una herramienta de gran utilidad, pero en la actualidad depende de la investigación en células madre y su diferenciación al fenotipo cardiaco, para poder ser explorada ampliamente y conocer sus alcances y limitaciones. Uno de los mayores problemas con esta vía de administración es la localización de las células al ser transferidas al receptor. La inyección intramuscular de células transducidas ex vivo para expresar el gen de interés ha sido mencionada, pero la poca distribución de las células transferidas ha dificultado su uso.56,57
Transferencia intraórgano
La administración por inyección intramiocárdica se considera actualmente la forma más eficiente para lograr la expresión deseada en el tejido cardiaco, pero se ha mencionado que la administración de un volumen alto para lograr una expresión se puede asociar con lesión local y alteraciones en la estructura de la pared.27,33,58 Distintos estudios han demostrado que la ruta intraarterial es poco efectiva a menos que se incremente la permeabilidad del endotelio, o se emplee un gradiente de alta presión; en estos casos un problema a considerar es la biodistribución aumentada y expresión ectópica del gen trasferido.32,38,56 Las formas en las que se ha encontrado mayor efectividad para la transferencia consisten en perfusiones del miocardio, por métodos quirúrgicos. En modelos animales la técnica más empleada, consiste en ligar la aorta por 30 segundos, acompañada de una canulación de las arterias coronarias, perfundiendo de manera simultánea con una solución que contiene el vector de TG (generalmente Ad o AAV), y posteriormente se retira el pinzamiento aórtico; este método ha demostrado ser eficiente para lograr un buen grado de infección con el vector y en consecuencia de transferencia del gen de interés.59,60 En humanos se han explorado variaciones de esta misma técnica con resultados promisorios. Un sistema recientemente descrito para la administración intraórgano, y que resulta de gran interés, es el sistema "V-focus", el cual consiste en el establecimiento de una circulación coronaria en paralelo, por medio de la cateterización del seno coronario, que se conecta a un sistema de bombeo extracorpóreo con oxigenador, y que se adiciona con una infusión de la solución con vectores virales, para ser administrada al corazón por medio de un catéter en la arteria coronaria izquierda.61 Este sistema ha sido probado en modelos animales con resultados satisfactorios, y tiene la ventaja de evitar los procedimientos quirúrgicos para administrar el vector, obteniendo resultados equiparables o superiores a los obtenidos con técnicas quirúrgicas.
Una opción para evitar la expresión ectópica del gen transferido es ponerlo bajo el control de un promotor cardiaco específico, como el del gen de calsecuestrina cardiaca humana (hCasq2).62 Actualmente, en nuestro laboratorio estamos desarrollando vectores adenovirales que contienen el promotor del gen hCasq2 y dirigen la expresión de la bomba de calcio SERCA2a de forma específica para los miocitos cardiacos (datos no publicados).
Blancos terapéuticos
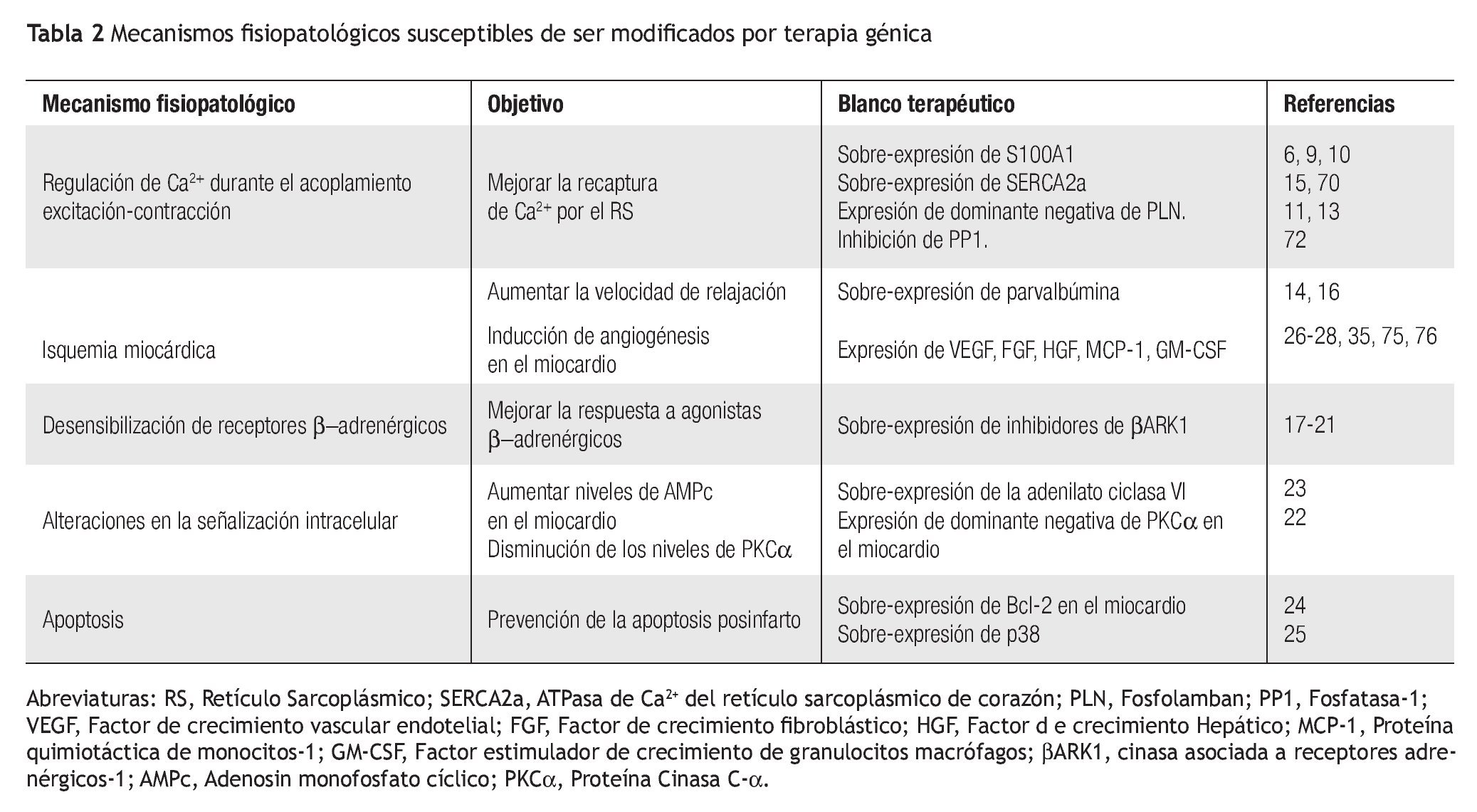
Uno de los mayores atractivos de la TG como opción terapéutica lo constituye la posibilidad de corregir los defectos celulares básicos que se encuentran en la IC. En los últimos años el conocimiento de las bases de la IC ha avanzado de forma importante, por lo que hoy se conocen de forma detallada múltiples alteraciones presentes durante la IC (Tabla 2). Aunque no se cuenta con un modelo capaz de integrar las múltiples alteraciones descritas en la IC,63 debido a las múltiples etiologías, los datos existentes permiten identificar blancos para TG.
Alteraciones en el manejo de calcio
Sin duda, el área de mayor interés en los mecanismos moleculares de la IC son las alteraciones en la regulación de las concentraciones de Ca2+ durante el proceso del acoplamiento excitación-contracción, las cuales han demostrado tener un papel crítico en la disminución de la capacidad contráctil del miocardio. Entre las alteraciones involucradas se encuentran cambios en los niveles de expresión de proteínas reguladoras y que actúan como sensores de las concentraciones de Ca2+ intracelular.5
Entre las alteraciones descritas se incluye una disminución de los niveles de la ATPasa de Ca2+ del retículo sarcoplásmico (SERCA2a), con una baja consecuente de la recaptura de Ca2+ al retículo sarcoplásmico (RS) durante la diástole, derivando en una menor cantidad del ion disponible para ser liberado en la siguiente contracción.5 La disminución de los niveles funcionales de fosfolamban (PLN) fosforilado, un regulador de la actividad de la bomba de calcio SERCA2a, provoca que la actividad de ésta se encuentre disminuida durante la IC; esta disminución no se debe a una menor expresión de la proteína, sino a alteraciones en los reguladores de su fosforilación; en estos cambios se incluyen un aumento en los niveles de la familia de la proteína cinasa C, la cual fosforila al inhibidor de la fosfatasa-1 (PP1), activándola, lo que provoca una defosforilación de fosfolamban.12 El canal de liberación de Ca2+ (receptor de rianodina, RyR), ha sido reportado en un estado inestable, debido a la disociación de la proteína calstabina, lo que provoca que la probabilidad de apertura del canal esté incrementada y se presenten liberaciones espontáneas de Ca2+ durante la diástole (fuga diastólica) que se asocian con arritmias ventriculares y de mayor relevancia con una disminución de la reserva de Ca2+ disponible para la contracción.4,63,64
Los trabajos existentes se han enfocado en la corrección de estos defectos; los blancos más mencionados incluyen a la proteína reguladora S100A1, al aumento de la expresión de SERCA2a o bloqueo de la expresión de su regulador PLN y a la proteína reguladora parvalbúmina, para hacer más eficiente la relajación cardiaca. A continuación se detalla cada una de estas estrategias.
S100A1
Esta proteína une Ca2+, el cual tiene un dominio de tipo "EF-hand". Es miembro de la familia de proteínas S100. Los miembros de esta familia están involucrados en varias funciones, a saber: la transducción de señales, el control del ciclo celular, interacciones con el citoesqueleto y diferenciación celular. La S100A1 es relevante para la función del músculo estriado, se expresa de forma abundante en el tejido muscular, particularmente en el músculo cardiaco, en donde colocaliza con el RS y los filamentos contráctiles. La expresión de S100A1 se ve afectada negativamente durante la IC secundaria a miocardiopatías.7-9
Se ha demostrado que la S100A1 tiene un papel positivo sobre el inotropismo y el lusitropismo. Sus efectos inotrópicos son debidos a la interacción con el RS y sus componentes, especialmente SERCA2a, incrementando su actividad, aumentando la recaptura de Ca2+ durante la relajación del miocardio, incrementando la cantidad de Ca2+ disponible para liberar en la contracción, la cual está directamente relacionada con la fuerza de contracción. La S100A1 también interactúa con el RyR, estabilizándolo y disminuyendo la fuga diastólica.6,65 Estos datos indican que la S100A1 está involucrada en dos de los procesos moleculares de mayor importancia para la IC, a lo que se agrega el hecho de que su expresión disminuye en esta enfermedad; por ello, es un objetivo de gran valor para explorar.
Ensayos in vitro han demostrado que la sobre-expresión de S100A1 mejora la función contráctil de los cardiomiocitos por medio de los dos mecanismos antes referidos.6,10 En modelos animales de IC se ha demostrado que la sobre-expresión de S100A1 es suficiente para preservar la función miocárdica después de un infarto agudo, y para prevenir la aparición de IC. Ensayos más recientes, que han empleado vectores de adeno-asociados, han seguido estos modelos por periodos prolongados (20 semanas), donde se ha observado que la sobre-expresión de S100A1 mejora la función miocárdica de forma sostenida, y en un efecto independiente y sinergístico al del tratamiento con b-bloqueadores9, llegando a restituir la sensibilidad del miocardio a agonistas b-adrenérgicos, que habitualmente se encuentra muy disminuida. En estos modelos, la sobreexpresión es capaz de revertir el fenotipo de IC expresado por el miocardio, regresando después de dos meses al patrón de expresión normal del músculo cardiaco adulto, de forma similar a lo observado en pacientes con IC en espera de trasplante cardiaco, con dispositivo de asistencia ventricular izquierda, los cuales pueden llegar a ser destetados del dispositivo después de un periodo prolongado, con una mejoría significativa de la función cardiaca.66-68 Los datos disponibles, indican que la S100A1 es un importante blanco terapéutico que se encuentra cerca de llegar a una fase de experimentación clínica.
La ATPasa de Ca2+ y Fosfolamban
La SERCA2a tiene un papel fundamental en la función miocárdica normal, durante la relajación muscular, recapturando la mayoría (60%) del Ca2+ liberado del RS para la contracción, y recargando el RS, manteniendo una cantidad suficiente de Ca2+ para lograr una contracción óptima. Debido a este mismo papel, se encuentra en un punto central de las bases moleculares de la IC, en donde su expresión se encuentra regulada de forma negativa, disminuyendo la capacidad de recargar el RS después de cada contracción, y provocando una contracción deficiente por falta de calcio.5 En los últimos años la expresión de SERCA2a se convirtió en uno de los blancos farmacológicos más explorados en investigación básica y, en menor medida, clínica, sin que se obtuvieran resultados positivos.69,70 El uso de TG para sobre-expresar a SERCA2a tiene la ventaja de eliminar los efectos secundarios asociados al uso de fármacos para incrementar su expresión.71
De la misma manera que la inducción de la expresión de SERCA2a ha sido extensamente explorada por medios farmacológicos, la sobre-expresión por transferencia de material genético ha sido también analizada in vitro e in vivo. La sobre-expresión de SERCA2a mejora la función contráctil y el consumo de energía en modelos animales con IC, mejorando el grosor de la pared anterior y reduciendo las arritmias ventriculares.15 Los ensayos de TG con la SERCA2a sólo han sido realizados con vectores adenovirales de primera generación, lo que no permite hacer un seguimiento a largo plazo para evaluar los efectos de la sobre-expresión; sin embargo, los datos obtenidos hasta la fecha, aunque son promisorios, requieren de profundizarse.
Estrechamente relacionado con la SERCA2a se encuentra PLN, un péptido de 52 aminoácidos, que tiene un papel como regulador de la función de SERCA2a, inhibiéndola en su estado nativo; se disocia de la bomba cuando es fosforilado por la proteína cinasa A (PKA), aumentando la velocidad de transporte de Ca2+ por la enzima. Durante la IC, la relación SERCA2a/PLN baja en gran medida por la disminución de SERCA2a, lo que provoca que disminuya su actividad y capacidad para recapturar el Ca2+, liberado durante la contracción.12
La estrategia de TG más empleada que involucra al PLN consiste en la transferencia de un péptido que codifica para una mutante pseudo-fosforilada de PLN, la cual imita los cambios conformacionales inducidos por la fosforilación y desplaza a la forma nativa de PLN, incrementando la actividad de SERCA2a.11 Los ensayos realizados en modelos animales han empleado vectores de AAV y seguido la evolución hasta por 6 meses posterior a la transferencia de genes. En los animales con IC tratados con TG con la mutante de PLN se observa una mejoría de la función cardiaca, deteniendo la progresión de la IC y acercando a niveles normales, corroborado por los valores hemodinámicas; de igual manera esta estrategia previene la remodelación de la pared cardiaca e incluso revierte los cambios observados en la IC, disminuyendo la fibrosis.13 Al igual que en el caso de la S100A1, el fenotipo fetal expresado durante la IC revierte al fenotipo adulto del corazón normal, mejorando su metabolismo.
Otra estrategia que involucra a PLN es la inhibición de la PP1, la enzima responsable de defosforilarlo, manteniendo a SERCA2a en un estado activado. Esta estrategia produjo una mejoría en el manejo de las concentraciones de Ca2+ intracelular y, consecuentemente, de la función cardiaca, así como disminución de la remodelación ventricular, disminuyendo significativamente la fibrosis.72
Los estudios mencionados indican que la TG dirigida hacia PLN o su regulación es un área que puede ser de importancia en un futuro, pero requiere de profundizarse con más estudios en modelos de IC, para alcanzar una fase de investigación clínica.
Parvalbúmina
La disfunción diastólica es un componente asociado a la IC, encontrado principalmente en pacientes mayores de 65 años, y actualmente no existen tratamientos específicos para esta disfunción. En miocitos cardiacos obtenidos de estos pacientes, se observa que el tiempo requerido para retirar el Ca2+ del citoplasma se encuentra aumentado; esto retarda la relajación del corazón y compromete el llenado de las cámaras cardiacas para el siguiente latido.14
La parvalbúmina es una proteína soluble intracelular de bajo peso molecular, con capacidad para unir Ca2+, que se expresa de manera importante en músculo estriado de contracción ultrarrápida, pero no se expresa nativamente en el corazón. Tiene como función principal acelerar la tasa de disminución del Ca2+ intracelular en una manera independiente de ATP.
Las intervenciones de TG que involucran a la parvalbúmina, hasta la fecha se han limitado a estudios in vitro y a modelos animales seguidos por plazos cortos de tiempo de hasta una semana; estos ensayos han demostrado que la expresión de parvalbúmina en el corazón se asocia con un incremento de la velocidad de relajación.14,16 Los datos pueden ser empleados como base para expresar parvalbúmina en el corazón, por medio de vectores con AAV, para hacer una evaluación a largo plazo. A pesar de que los efectos que se obtienen expresando parvalbúmina en el corazón son muy similares a los observados con la sobreexpresión de SERCA2a, los efectos obtenidos con parvalbúmina no requieren de ATP, evitando comprometer aún más las necesidades energéticas del corazón. Debido a esto, la parvalbúmina constituye un blanco terapéutico que debe de ser más explorado en el futuro.
Angiogénesis
La isquemia miocárdica se reporta como la principal causa de IC, debido a que el miocardio hibernante es un tejido con poca o nula función. A pesar de que la isquemia miocárdica puede ser tratada por angioplastia o cirugía de revascularización coronaria, la enfermedad coronaria difusa no es habitualmente manejable por medio de estas opciones. Lo anterior, deja un universo de pacientes sin una opción terapéutica para la base de su enfermedad. Es en estos pacientes en quienes se ha pensado al emplear estrategias de transferencia de material genético, para fomentar el desarrollo de nueva vascularización.3
Dentro de las estrategias para inducir angiogénesis se han empleado diferentes factores que incluyen al factor de crecimiento vascular endotelial (VEGF), las angiopoyetinas, el factor de crecimiento fibroblástico (FGF), el factor de crecimiento hepático (HGF), la proteína quimiotáctica de monocitos-1 (MCP-1) y el factor estimulador de colonias de granulocitos macrófagos (GM-CSF). La estrategia consiste en transferir el material genético que codifica para alguna de estas proteínas al tejido de interés, para favorecer el desarrollo de neovascularización en el tejido isquémico. En los modelos animales preclínicos esta metodología ha demostrado ser efectiva, en cuanto al crecimiento y generación de capilares, aunque la relevancia para el tejido muscular no se ha determinado.73,74 Se ha demostrado que con una expresión por más de cuatro semanas, los vasos formados experimentan una remodelación que les permite permanecer incluso cuando el estímulo ya no se encuentre.
En modelos animales con IC secundaria a isquemia, la administración de TG para angiogénesis mediada por VEGF se asoció con una mejoría de la perfusión miocárdica observada a las tres semanas, y también mejoró la función miocárdica global. La angiogénesis inducida por TG, es sin duda el área más explorada en la actualidad, respecto a la patología cardiovascular en humanos, con varios ensayos clínicos de fase I ya completados y 11 ensayos de fase II/III,26-28,34,75,76 con distintos objetivos, que incluyen la angiogénesis terapéutica para mejorar la perfusión miocárdica, la prevención de re-estenosis de stents, y la prevención de la falla de injertos venosos en revascularización; sin embargo, los resultados son difíciles de interpretar, debido a la gran variación entre los vectores empleados, las vías de administración y los blancos terapéuticos. Uno de los problemas más importantes a considerar es que la eficiencia de la transferencia de material genético es inversa al tamaño del huésped, en parte por la difusión limitada del vector en una mayor cantidad de tejido. Por ello, a pesar de que varios estudios sean promisorios en modelos animales, los resultados pueden ser difíciles de reproducir en humanos. Sin embargo, los resultados de los pocos ensayos clínicos realizados comprueban que la TG es una estrategia con viabilidad para tratar grupos de pacientes que no son susceptibles de ser tratados con opciones convencionales.
Sistema b-adrenérgico
Las alteraciones de los receptores b-adrenérgicos durante la IC han sido descritas extensamente, abarcando desde una disminución de la densidad de receptores en el miocardio, hasta una desensibilización a los b-agonistas. La desensibilización de los receptores explica en gran medida la naturaleza refractaria a los tratamientos dirigidos a las vías adrenérgicos. Los receptores b-adrenérgicos se encuentran acoplados a proteínas G, y éstas, reguladas por proteínas cinasas de receptores acoplados a proteínas G, conocidas en el caso de los receptores adrenérgicos como bARK1 (Beta Adrenergic Receptor Kinase) y ARK2; estas dos enzimas se encuentran aumentadas durante la IC, lo que contribuye de manera importante a la desensibilización de los receptores.20 En ratones transgénicos con sobre-expresión de los receptores b se desarrolla miocardiopatía, mientras que en animales que sobre-expresan receptores b2, la contractilidad se encuentra aumentada sin que se desarrolle ninguna enfermedad.
En modelos animales se ha demostrado que la sobreexpresión de receptores b2 dirigida al tejido cardiaco, se asocia con una contractilidad aumentada y una mayor respuesta a isoproterenol,17-19 En ratones en los que se sobre-expresa bARK1 se encuentra una contractilidad disminuida en respuesta a isoproterenol, mientras que ratones sobre-expresando un inhibidor de bARK1, llamado bARK1ct, tienen una función cardiaca incrementada.20 Estos datos sugieren que la manipulación de la función de bARK1 tiene un impacto sobre la función cardiaca, susceptible de manipularse por TG.
En modelos animales de IC, se ha demostrado que la transferencia de un vector adenoviral con bARK1ct en conejos con infarto agudo, previene las alteraciones en el sistema b-adrenérgico, mejora la función miocárdica y previene la aparición de IC.20 Otra estrategia empleada para modificar por TG componentes del sistema b-adrenérgico, incluye la sobre-expresión del recapturador-1 de norepinefrina en el corazón. Esta proteína se encuentra disminuida durante la IC, lo que provoca un aumento de los niveles extracelulares de catecolaminas, derivando en el estado hiperadrenérgico que tiene un papel central en la desensibilización de los receptores. En conejos con IC, en los que se generó una sobre-expresión del recapturador-1, la concentración de norepinefrina se mantuvo en niveles similares a los normales, lo que se asoció con una mejor función cardiaca, y se revirtió la hipertrofia cardiaca, recuperándose el fenotipo normal del corazón.21
Señalización intracelular
En la patogénesis de la IC, el estado hiperadrenérgico y las alteraciones en las concentraciones intracelulares de Ca2+, contribuyen a alterar la activación de distintas vías intracelulares, lo que las convierte en blancos potenciales para TG. Hasta la fecha se han explorado la adenilato ciclasa y la proteína cinasa C (PKC).
La adenilato ciclasa en una molécula central en los miocitos cardiacos, en particular la tipo VI (ACVI). En modelos animales con IC se ha demostrado que la sobre-expresión de la ACVI, mejora la función cardiaca e incrementa la sobrevida. En cerdos con IC establecida, además de mejorar los valores hemodinámicos, la función cardiaca y la respuesta al isoproterenol, la expresión de la ACVI previene la remodelación de la pared cardiaca y la aparición de fibrosis.23 Se cree que la función de la ACVI en el tratamiento de la IC no es sólo en relación con un aumento de los niveles de AMPc, ya que también modifica la expresión de otros genes, favoreciendo la expresión de genes útiles para la contracción miocárdica.
El otro blanco para TG que ha sido explorado es la familia de la PKC, la cual es un componente de varias vías de transducción asociadas a membrana. La isoforma PKCa es la más abundante en el corazón, en donde se ha reportado un papel muy importante en la regulación de la contractilidad cardiaca; la pérdida de la función contráctil en la IC va acompañada de un incremento en los niveles de PKCa en el corazón. Con base en esta función, se han realizado estudios en modelos animales transfiriendo una dominante negativa de PKCa por medio de un vector adenoviral, para determinar su viabilidad como opción terapéutica. En ratas con IC posinfarto, se encontró que la transferencia de una dominante negativa de PKCa mejora la contractilidad miocárdica y los valores hemodinámicos.22
Apoptosis
Se sabe que durante la dilatación de cavidades observada en la IC existe una remodelación de la pared miocárdica; se ha propuesto que uno de los mecanismos responsables de este proceso es la apoptosis de los miocitos cardiacos. A pesar de que no se conocen los mecanismos precisos por los que la apoptosis contribuye a la remodelación de la pared miocárdica, se han realizado estudios bloqueando por TG vías apoptóticas con resultados positivos.
El factor Bcl-2 es capaz de bloquear la apoptosis; ha sido administrado por medio de un vector adenoviral, después de un periodo de isquemia miocárdica en conejos, donde se encontró que es capaz de evitar el deterioro de la función cardiaca a corto y a largo plazo, además de prevenir la dilatación de cavidades y su remodelación.24 También se demostró que previene la apoptosis en los bordes del área lesionada, aunque no se ha determinado si la expresión de Bcl-2 es requerida en el momento inicial o se requiere de una expresión a largo plazo.
La proteína p38, es un miembro de las cinasas, de proteínas mitógeno-activadas (MPAK), un regulador fundamental del crecimiento, sobrevida y muerte celular. Se ha reportado que después de un infarto al miocardio la actividad de p38 disminuye, lo que contribuye al desarrollo de apoptosis en el corazón, aumentando el deterioro de la función y la remodelación de la pared. Cuando ratas posinfarto son tratadas con un vector adenoviral para sobreexpresar p38, se encuentra que previene el deterioro de la función miocárdica, tiene un efecto antiapoptótico, y evita la fibrosis y remodelación de la pared ventricular.25
Terapia para causas genéticas de insuficiencia cardiaca
Se han identificado múltiples causas de IC que se deben a mutaciones genéticas; sin embargo, se sabe que éstas constituyen un porcentaje mínimo de los casos de IC. Estas causas involucran a varios mecanismos patológicos, principalmente proteínas de la sarcómera y del citoesqueleto.77-83 En teoría estas causas de IC ofrecen un blanco inmediato para IC, debido a que al ser monogénicas tienen un mecanismo patológico más directo, y aislado de las redes de regulación involucradas en otros elementos ya mencionados. En esta línea de investigación, se ha demostrado que al sobre-expresar una proteína sarcomérica exógena, ésta se ensambla de forma ordenada y estequiométrica en el citoplasma. La idea en este tipo de terapia es desplazar a la proteína endógena que tiene el defecto, al cambiar la estequiometría en el interior de la célula. Este tipo de terapia no ha sido explorada experimental-mente, aunque es susceptible de serlo con modelos animales que reproducen a miocardiopatías hereditarias.
También se han identificado mutaciones de proteínas de mayor tamaño, como la distrofina en la distrofia muscular de Duchenne, en donde se han descrito varias mutaciones e incluso se ha encontrado que truncan a la proteína.84 En estos casos la posibilidad de ser tratados por TG presenta mayores dificultades técnicas, aunque se ha demostrado que la transferencia de un mini gen de distrofina puede mejorar la sintomatología.85,86
Conclusiones
A pesar de los avances terapéuticos, la insuficiencia cardiaca continúa siendo una de las principales causas de mortalidad; la TG se presenta como una opción promisoria, al tener la capacidad de corregir los defectos fundamentales observados en la insuficiencia cardiaca. En la actualidad es un área de investigación básica, preclínica y clínica de gran importancia, que puede dar resultados positivos en un futuro no distante. Uno de los mayores obstáculos que presenta la experimentación y aplicación clínica de ésta y otras opciones terapéuticas es la complejidad de los mecanismos de acción, por lo que se requiere que éstos, junto con las indicaciones, sean conocidos y entendidos para explotar al máximo las nuevas capacidades que esta opción terapéutica ofrece, por lo que es necesario seguir estrechamente los avances que se tengan en este campo en los próximos años.
Agradecimientos
Agradecemos los valiosos comentarios del Dr. David Jay (Instituto Nacional de Cardiología Ignacio Chávez, México, D.F.) y del Dr. Francisco Martínez Flores (Instituto Nacional de Rehabilitación, México, D.F.).
Este trabajo se realizó con el apoyo de una beca doctoral de CONACYT para José Luis Reyes, y del proyecto PAPIITUNAM IN215002.
*Autor para recibir correspondencia: Ángel Zarain-Herzberg.
Universidad Nacional Autónoma de México. Facultad de Medicina, Depto. de Bioquímica. Edificio D; 2ndo Piso. Circuito Exterior, Ciudad Universitaria, 04510 México, D.F. México.
Teléfono: (5255) 5623-2258; FAX: (5255) 5616-2419.
Correo electrónico: zarain@servidor.unam.mx
Recibido el 28 de de enero de 2008; aceptado el 19 de enero de 2009.