El objetivo de la presente investigación es identificar y sistematizar las afectaciones generadas por el SARS-CoV-2 en el nervio óptico y en la retina de pacientes jóvenes, adultos y adultos mayores que padecieron COVID-19 en el período del 2019 al 2022. Se realizó una revisión teórica documental (RTD) en el marco de una investigación para determinar el estado actual del conocimiento del tema objeto de estudio. La RTD contempla el análisis de publicaciones en las bases de datos científicas PubMed/Medline, Ebsco, Scielo y Google. Se encontraron un total de 167 artículos de los cuales se estudiaron a profundidad 56 artículos; se evidencia el impacto de la infección por COVID-19 en la retina y el nervio óptico de los pacientes contagiados, tanto durante la fase aguda como en la recuperación posterior. Entre los hallazgos reportados sobresalen: neuropatía óptica isquémica no arterítica anterior y posterior, neuritis óptica, oclusión vascular central o de rama, maculopatía medial aguda paracentral, neurorretinitis, así como también diagnósticos concomitantes como enfermedad posible de Vogt Koyanagi Harada, síndrome de múltiples puntos blancos evanescentes (MEWDS), retinopatía Purtscher-like, y otros.
The objective of this research is to identify and systematize the medical conditions generated by SARS-CoV-2 on the optic nerve and retina of young, adult, and elderly adults who suffered from COVID-19 in the period 2019-2022. A theoretical documentary review (TDR) was conducted within the framework of an investigation to determine the current state of knowledge of the subject under study. The TDR includes the analysis of publications in the scientific databases PubMed/Medline, Ebsco, Scielo and Google. A total of 167 articles were found, of which 56 were studied in depth, and these evidence the impact of COVID-19 infection on the retina and optic nerve of infected patients, both during the acute phase and in subsequent recovery. Among the reported findings, the following stand out: anterior and posterior non-arteritic ischemic optic neuropathy, optic neuritis, central or branch vascular occlusion, paracentral acute medial maculopathy, neuroretinitis, as well as concomitant diagnoses such as possible Vogt-Koyanagi-Harada disease, multiple evanescent white dot syndrome (MEWDS), Purtscher-like retinopathy, among others.
En diciembre del 2019 se produjo el brote del síndrome respiratorio agudo severo causado por el virus SARS-CoV-2 en la provincia de Wuhan China, que posteriormente fue declarado pandemia el 30 de enero del 2020 por el Dr. Tedros Adhanom Ghebreyesus, director de la Organización Mundial de la Salud (OMS), y se convirtió en un gran problema de salud pública global.
El SARS-CoV-2 es un β-coronavirus envuelto, con una secuencia genética muy semejante al SARS-CoV-1 (80%) y al coronavirus de murciélago RaTG13 (96,2%)1. Su revestimiento viral está recubierto por glicoproteína espiga (S), proteínas de la envoltura (E) y de la membrana (M). En la unión y el ingreso a la célula huésped interviene la proteína S. El primer paso en el proceso infeccioso es la unión del virus a una célula huésped a través de su receptor objetivo. La subunidad S1 de la proteína S contiene el dominio de unión al receptor que se une al dominio de peptidasa de la enzima conversora de angiotensina 2 (ACE 2). En el SARS-CoV-2, la subunidad S2 está muy conservada y se considera un posible objetivo antiviral. De acuerdo a la OMS, el COVID-19 es una enfermedad ocasionada por el coronavirus conocido como SARS-CoV-2, cuyo comportamiento incierto y evolución clínica tan diversa con un mecanismo de invasión aún poco conocida generó la imperiosa y urgente necesidad de realizar estudios clínicos multicéntricos y multidisciplinarios a nivel global con el fin de comprender y evaluar su origen, métodos de diagnóstico, evolución del cuadro, métodos de prevención, tratamiento y manejo de secuelas postinfección.
Hoy, se conoce que el SARS-CoV-2 penetra a las células huéspedes mediante el receptor de la ACE2, la cual se manifiesta en distintos tejidos, incluso en el endotelio vascular y la retina neurosensorial2,3. Si bien su sintomatología original se asocia al desarrollo de un síndrome respiratorio que incluye fiebre, tos, odinofagia, rinorrea, malestar general, entre otros, también se ha evidenciado y descrito un extenso y variado espectro de manifestaciones clínicas que afectan otras estructuras anatómicas, se han reportado estudios donde se evidencia un incremento de tromboembolias arteriales y venosos en individuos contagiados con COVID-19, que podrían asociarse a la invasión viral directa y a la inflamación secundaria generada en las células endoteliales vasculares4.
Tras el contagio con SARS-CoV-2, aproximadamente el 30% de los pacientes cursan también con afectación ocular como «conjuntivitis, hiperemia conjuntival, nodulaciones foliculares conjuntivales, ojo rojo o seco, quemosis, lagrimeo, dolor ocular, epifora, fotofobia, visión borrosa, queratoconjuntivitis, microhemorragias, resumiéndose en alteraciones que afectan tanto el segmento anterior como al segmento posterior»5, que han sido comprobados a través de la exploración por biomicroscopia y exámenes complementarios como la tomografía de coherencia óptica.
Se han reportado cambios isquémicos a nivel retiniano como, hemorragias en llama, manchas algodonosas y palidez sectorial, en pacientes postinfección por SARS-CoV-26. Recientemente se publicaron varios estudios sobre las manifestaciones microvasculares en la retina secundarios a la infección por SARS-CoV-2, donde se señaló que la densidad media de los vasos capilares maculares fue significativamente menor y con niveles bajos de densidad de perfusión peripapilar en pacientes con COVID-19 comparado con pacientes con controles normales de la misma edad, pero sin evidencia de contagio7,8. Por otra parte, la literatura científica ha divulgado la afectación del sistema nervioso central por infección del COVID-19 y el potencial neurotrópico del SARS-CoV-29 que genera los síntomas neurológicos y las complicaciones en COVID-19; sin embargo, son pocos y no concluyentes, y hasta la actualidad no se han realizado seguimientos a largo plazo, se ha informado que puede generar un edema del nervio óptico10 y es conocido que al dilatarse la vaina del nervio, desde la perspectiva neurológica, el COVID-19 tiene incidencia en las alteraciones de esta estructura11,12.
Frente a esta diversidad de hallazgos clínicos reportados ocasionados por este virus se justifica la necesidad e importancia de esta presente revisión bibliográfica, cuyo objetivo es el de recopilar y unificar los hallazgos de estudios y casos clínicos publicados en la literatura científica. Esta revisión busca alertar a los profesionales oftalmólogos sobre la necesidad de evaluar estas secuelas oftalmológicas postinfección por el virus SARS-CoV-2, lo cual pudiera contribuir a prevenir una posible progresión de enfermedades oftalmológicas preexistentes que afecten a la retina y al nervio óptico.
MétodosSe realizó una revisión teórica documental (RTD) en el marco de una investigación para determinar el estado actual del conocimiento del tema objeto de estudio. La RTD contempla el análisis de publicaciones sobre las alteraciones en el nervio óptico y retina en pacientes con COVID-19, publicadas en el periodo comprendido entre el 2019 y el 2022, en las bases de datos científicas PubMed/Medline, Ebsco, Scielo y Google Académico, considerando casos clínicos, artículos de revisión, ensayos clínicos y estudios de enfoques epidemiológicos que permitan establecer las diferentes afectaciones del nervio óptico y la retina en pacientes con la entidad clínica estudiada.
Los descriptores utilizados para la RTD son: SARS-CoV-2, COVID-19, retina y nervio óptico. Para el proceso de selección de la información se utilizaron los siguientes términos MESH y operadores booleanos: (COVID-19) AND (OPTIC NERVE) NOT (VACCINE) NOT (CHILDREN) (COVID-19) AND (RETINA) NOT (VACCINE) NOT (CHILDREN).
Los idiomas utilizados para la consulta en las bases de datos seleccionadas son el español e inglés.
Criterios de inclusiónSe seleccionó la información en referencia a los criterios mencionados a continuación:
- -
Artículos que contengan información sobre pacientes jóvenes, adultos y adultos mayores con diagnóstico confirmado de COVID-19 o post-COVID-19.
- -
Artículos que describan alteraciones en el nervio óptico y retina.
- -
Información descrita en la literatura médica entre 2019 y 2022 que incluya reportes de casos clínicos, artículos de revisión, serie de casos, estudios observacional, transversal, prospectivo, retrospectivo, de cohortes, casos y controles.
- -
Pacientes pediátricos o menores de 18 años.
- -
Pacientes con alteraciones en retina y nervio óptico secundarias a otras enfermedades no relacionadas a COVID-19.
- -
Resúmenes de congresos, cartas, publicaciones duplicadas, investigaciones no terminadas o en proceso.
- -
Pacientes con manifestaciones posvacuna contra COVID-19.
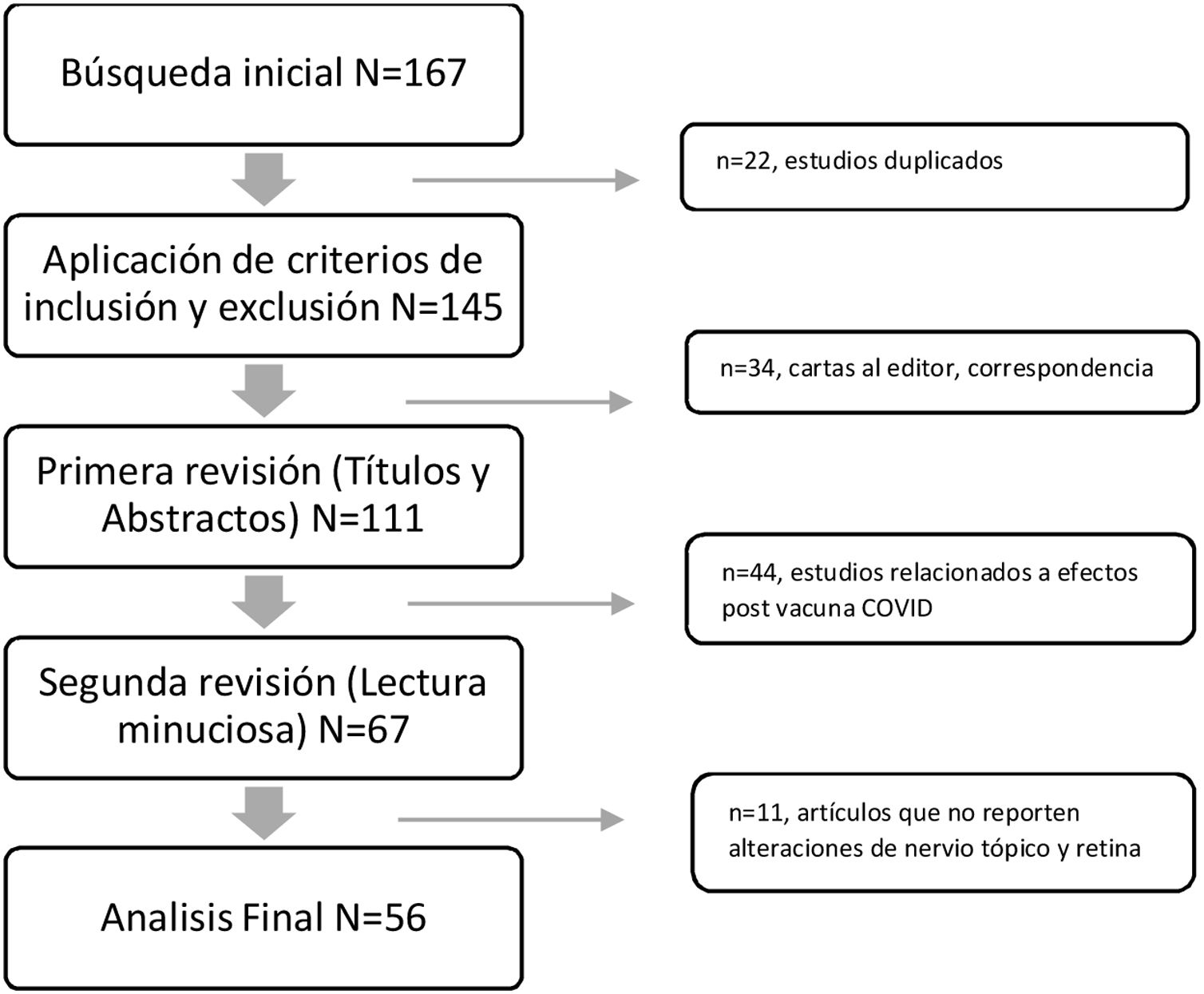
En las bases de datos seleccionadas para la consulta, fueron un total de 167 artículos publicados en el periodo objeto de estudio, de estos fueron excluidos 111 por no cumplir con los criterios de selección, de los cuales 56 artículos cumplieron criterios y fueron incluidos (fig. 1). Se elaboró una matriz de datos creada con los siguientes aspectos evaluando las siguientes variables: año, título del estudio, objetivo de la investigación y resultados, lo cual permite la presentación de los hallazgos más relevantes.
Consideraciones éticasLa presente investigación se trata de una RTD sobre publicaciones que cumplen los criterios éticos de la declaración de Helsinki en plataformas digitales circuladas en la red de consulta abierta y sin limitaciones.
ResultadosDe la información recopilada, se obtuvieron 56 artículos analizados en detalle en 2matrices que describen los hallazgos en retina y nervio óptico. La primera hace referencia a los 22 reportes de casos y la segunda detalla la información recopilada de los 34 artículos de revisión, serie de casos, estudios observacionales, transversales, prospectivos, retrospectivos, de cohortes, casos y controles.
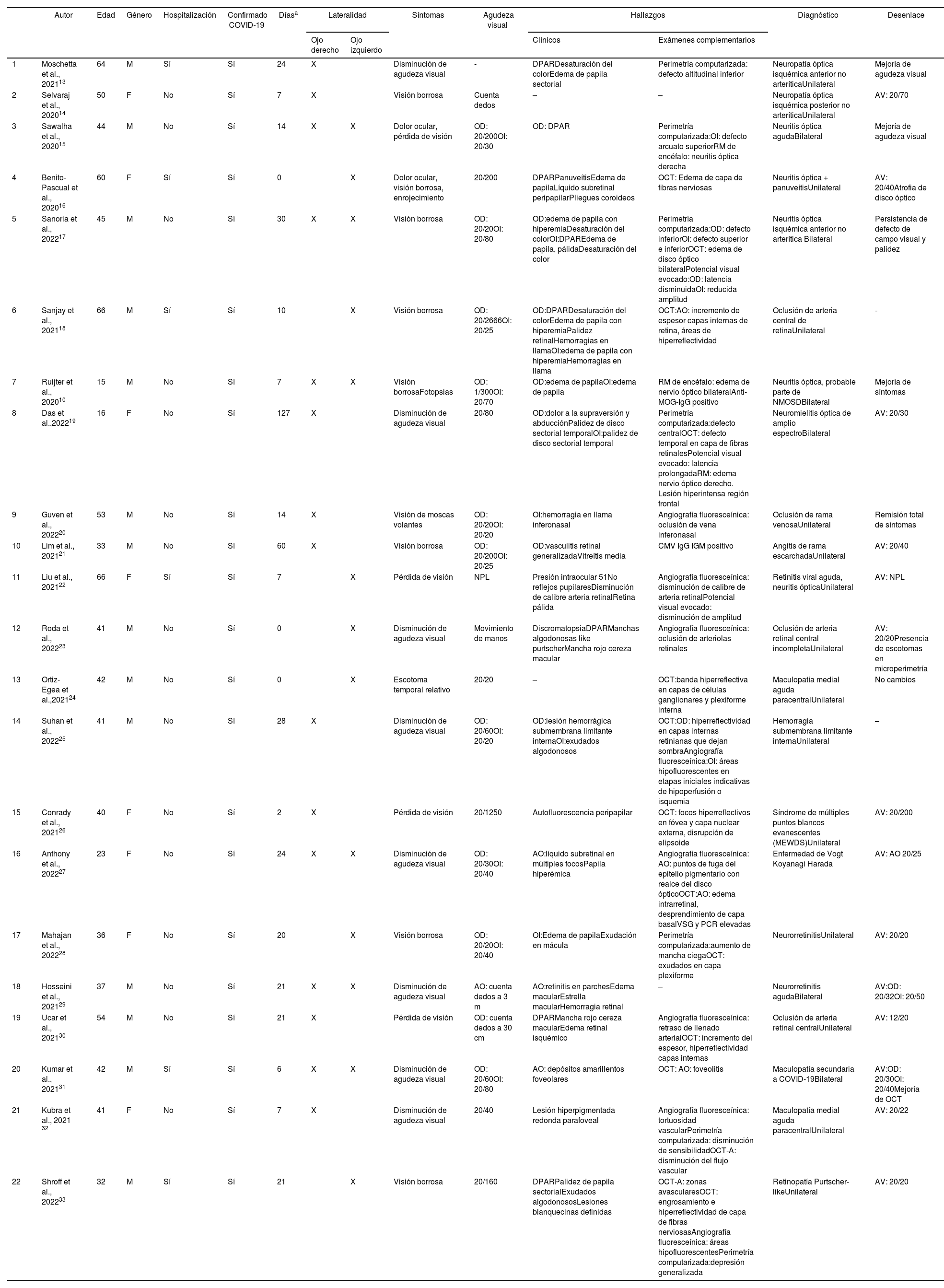
En la tabla 1, de los 22 reportes de casos con un total de 28 ojos afectados, la edad promedio fue de 42 años ± 14,32, con predominio de pacientes de género masculino 63,6% (n = 14). Del total de los casos, el 27,3% requirió hospitalización, se evidenció un promedio de 28,11 ± 6,39 días entre el inicio de los síntomas de COVID-19 hasta el inicio de la enfermedad oftalmológica. Con respecto a la lateralidad se determinó mayor incidencia de afectación en el ojo derecho con 9 casos, ojo izquierdo 7 casos y presentación bilateral 6 casos. Dentro de la sintomatología expresada por los pacientes se encontró disminución de agudeza visual y dolor ocular. La agudeza visual al momento de la evaluación inicial fue menor a 20/70, con 3 casos que presentaron visión de 20/40. Dentro de los hallazgos clínicos se encontró en orden de frecuencia: defecto pupilar aferente relativo, alteración de visión de colores, edema de papila sectorial o total, atrofia óptica, hemorragias en llama, vasculitis generalizada retiniana, disminución del calibre vascular retiniano, manchas algodonosas, líquido subretinal, retina pálida, mancha rojo cereza macular. En el campo visual se encontraron defectos campimétricos como defectos altitudinales, arcuatos, centrales, aumento de la mancha ciega, y disminución de la sensibilidad, sin una predilección de lateralidad del campo visual. En la tomografía de coherencia óptica, se evidenciaron edema de capa de fibras nerviosas, pérdida de capa de fibras nerviosas en área temporal, hiper reflectividad de las capas de la retina, presencia de exudados, disminución del flujo vascular y zonas avasculares. Con respecto a la angiografía fluoresceínica, se observó disminución de calibre vascular y tortuosidad, oclusiones vasculares, áreas de hipoperfusión o isquémicas, puntos de fuga en el epitelio pigmentario.
Características de los casos clínicos COVID-19 con alteraciones en nervio óptico y retina
| Autor | Edad | Género | Hospitalización | Confirmado COVID-19 | Díasa | Lateralidad | Síntomas | Agudeza visual | Hallazgos | Diagnóstico | Desenlace | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ojo derecho | Ojo izquierdo | Clínicos | Exámenes complementarios | |||||||||||
| 1 | Moschetta et al., 202113 | 64 | M | Sí | Sí | 24 | X | Disminución de agudeza visual | - | DPARDesaturación del colorEdema de papila sectorial | Perimetría computarizada: defecto altitudinal inferior | Neuropatía óptica isquémica anterior no arteríticaUnilateral | Mejoría de agudeza visual | |
| 2 | Selvaraj et al., 202014 | 50 | F | No | Sí | 7 | X | Visión borrosa | Cuenta dedos | – | – | Neuropatía óptica isquémica posterior no arteríticaUnilateral | AV: 20/70 | |
| 3 | Sawalha et al., 202015 | 44 | M | No | Sí | 14 | X | X | Dolor ocular, pérdida de visión | OD: 20/200OI: 20/30 | OD: DPAR | Perimetría computarizada:OI: defecto arcuato superiorRM de encéfalo: neuritis óptica derecha | Neuritis óptica agudaBilateral | Mejoría de agudeza visual |
| 4 | Benito-Pascual et al., 202016 | 60 | F | Sí | Sí | 0 | X | Dolor ocular, visión borrosa, enrojecimiento | 20/200 | DPARPanuveítisEdema de papilaLíquido subretinal peripapilarPliegues coroideos | OCT: Edema de capa de fibras nerviosas | Neuritis óptica + panuveítisUnilateral | AV: 20/40Atrofia de disco óptico | |
| 5 | Sanoria et al., 202217 | 45 | M | No | Sí | 30 | X | X | Visión borrosa | OD: 20/20OI: 20/80 | OD:edema de papila con hiperemiaDesaturación del colorOI:DPAREdema de papila, pálidaDesaturación del color | Perimetría computarizada:OD: defecto inferiorOI: defecto superior e inferiorOCT: edema de disco óptico bilateralPotencial visual evocado:OD: latencia disminuidaOI: reducida amplitud | Neuritis óptica isquémica anterior no arterítica Bilateral | Persistencia de defecto de campo visual y palidez |
| 6 | Sanjay et al., 202118 | 66 | M | Sí | Sí | 10 | X | Visión borrosa | OD: 20/2666OI: 20/25 | OD:DPARDesaturación del colorEdema de papila con hiperemiaPalidez retinalHemorragias en llamaOI:edema de papila con hiperemiaHemorragias en llama | OCT:AO: incremento de espesor capas internas de retina, áreas de hiperreflectividad | Oclusión de arteria central de retinaUnilateral | - | |
| 7 | Ruijter et al., 202010 | 15 | M | No | Sí | 7 | X | X | Visión borrosaFotopsias | OD: 1/300OI: 20/70 | OD:edema de papilaOI:edema de papila | RM de encéfalo: edema de nervio óptico bilateralAnti-MOG-IgG positivo | Neuritis óptica, probable parte de NMOSDBilateral | Mejoría de síntomas |
| 8 | Das et al.,202219 | 16 | F | No | Sí | 127 | X | Disminución de agudeza visual | 20/80 | OD:dolor a la supraversión y abducciónPalidez de disco sectorial temporalOI:palidez de disco sectorial temporal | Perimetría computarizada:defecto centralOCT: defecto temporal en capa de fibras retinalesPotencial visual evocado: latencia prolongadaRM: edema nervio óptico derecho. Lesión hiperintensa región frontal | Neuromielitis óptica de amplio espectroBilateral | AV: 20/30 | |
| 9 | Guven et al., 202220 | 53 | M | No | Sí | 14 | X | Visión de moscas volantes | OD: 20/20OI: 20/20 | OI:hemorragia en llama inferonasal | Angiografía fluoresceínica: oclusión de vena inferonasal | Oclusión de rama venosaUnilateral | Remisión total de síntomas | |
| 10 | Lim et al., 202121 | 33 | M | No | Sí | 60 | X | Visión borrosa | OD: 20/200OI: 20/25 | OD:vasculitis retinal generalizadaVitreítis media | CMV IgG IGM positivo | Angitis de rama escarchadaUnilateral | AV: 20/40 | |
| 11 | Liu et al., 202122 | 66 | F | Sí | Sí | 7 | X | Pérdida de visión | NPL | Presión intraocular 51No reflejos pupilaresDisminución de calibre arteria retinalRetina pálida | Angiografía fluoresceínica: disminución de calibre de arteria retinalPotencial visual evocado: disminución de amplitud | Retinitis viral aguda, neuritis ópticaUnilateral | AV: NPL | |
| 12 | Roda et al., 202223 | 41 | M | No | Sí | 0 | X | Disminución de agudeza visual | Movimiento de manos | DiscromatopsiaDPARManchas algodonosas like purtscherMancha rojo cereza macular | Angiografía fluoresceínica: oclusión de arteriolas retinales | Oclusión de arteria retinal central incompletaUnilateral | AV: 20/20Presencia de escotomas en microperimetría | |
| 13 | Ortiz-Egea et al.,202124 | 42 | M | No | Sí | 0 | X | Escotoma temporal relativo | 20/20 | – | OCT:banda hiperreflectiva en capas de células ganglionares y plexiforme interna | Maculopatía medial aguda paracentralUnilateral | No cambios | |
| 14 | Suhan et al., 202225 | 41 | M | No | Sí | 28 | X | Disminución de agudeza visual | OD: 20/60OI: 20/20 | OD:lesión hemorrágica submembrana limitante internaOI:exudados algodonosos | OCT:OD: hiperreflectividad en capas internas retinianas que dejan sombraAngiografía fluoresceínica:OI: áreas hipofluorescentes en etapas iniciales indicativas de hipoperfusión o isquemia | Hemorragia submembrana limitante internaUnilateral | – | |
| 15 | Conrady et al., 202126 | 40 | F | No | Sí | 2 | X | Pérdida de visión | 20/1250 | Autofluorescencia peripapilar | OCT: focos hiperreflectivos en fóvea y capa nuclear externa, disrupción de elipsoide | Síndrome de múltiples puntos blancos evanescentes (MEWDS)Unilateral | AV: 20/200 | |
| 16 | Anthony et al., 202227 | 23 | F | No | Sí | 24 | X | X | Disminución de agudeza visual | OD: 20/30OI: 20/40 | AO:líquido subretinal en múltiples focosPapila hiperémica | Angiografía fluoresceínica: AO: puntos de fuga del epitelio pigmentario con realce del disco ópticoOCT:AO: edema intrarretinal, desprendimiento de capa basalVSG y PCR elevadas | Enfermedad de Vogt Koyanagi Harada | AV: AO 20/25 |
| 17 | Mahajan et al., 202228 | 36 | F | No | Sí | 20 | X | Visión borrosa | OD: 20/20OI: 20/40 | OI:Edema de papilaExudación en mácula | Perimetría computarizada:aumento de mancha ciegaOCT: exudados en capa plexiforme | NeurorretinitisUnilateral | AV: 20/20 | |
| 18 | Hosseini et al., 202129 | 37 | M | No | Sí | 21 | X | X | Disminución de agudeza visual | AO: cuenta dedos a 3 m | AO:retinitis en parchesEdema macularEstrella macularHemorragia retinal | – | Neurorretinitis agudaBilateral | AV:OD: 20/32OI: 20/50 |
| 19 | Ucar et al., 202130 | 54 | M | No | Sí | 21 | X | Pérdida de visión | OD: cuenta dedos a 30 cm | DPARMancha rojo cereza macularEdema retinal isquémico | Angiografía fluoresceínica: retraso de llenado arterialOCT: incremento del espesor, hiperreflectividad capas internas | Oclusión de arteria retinal centralUnilateral | AV: 12/20 | |
| 20 | Kumar et al., 202131 | 42 | M | Sí | Sí | 6 | X | X | Disminución de agudeza visual | OD: 20/60OI: 20/80 | AO: depósitos amarillentos foveolares | OCT: AO: foveolitis | Maculopatía secundaria a COVID-19Bilateral | AV:OD: 20/30OI: 20/40Mejoría de OCT |
| 21 | Kubra et al., 2021 32 | 41 | F | No | Sí | 7 | X | Disminución de agudeza visual | 20/40 | Lesión hiperpigmentada redonda parafoveal | Angiografía fluoresceínica: tortuosidad vascularPerimetría computarizada: disminución de sensibilidadOCT-A: disminución del flujo vascular | Maculopatía medial aguda paracentralUnilateral | AV: 20/22 | |
| 22 | Shroff et al., 202233 | 32 | M | Sí | Sí | 21 | X | Visión borrosa | 20/160 | DPARPalidez de papila sectorialExudados algodonososLesiones blanquecinas definidas | OCT-A: zonas avascularesOCT: engrosamiento e hiperreflectividad de capa de fibras nerviosasAngiografía fluoresceínica: áreas hipofluorescentesPerimetría computarizada:depresión generalizada | Retinopatía Purtscher-likeUnilateral | AV: 20/20 | |
AO: ambos ojos; AV: agudeza visual; DPAR: defecto pupilar aferente relativo; NMOSD: Trastornos del espectro neuromielitis óptica; OD: ojo derecho; OCT: tomografía de coherencia óptica; OCT-A: tomografía de coherencia óptica angiográfica; OI: ojo izquierdo; PCR: proteína C reactiva; RM: resonancia magnética; VSG: velocidad de eritrosedimentación.
En el análisis realizado se reportaron un amplio espectro de diagnósticos: neuropatía óptica isquémica no arterítica anterior y posterior, neuritis óptica, oclusión vascular central o de rama, maculopatía medial aguda paracentral, neurorretinitis, así como también en menor frecuencia diagnósticos concomitantes como enfermedad posible de Vogt Koyanagi Harada, síndrome de múltiples puntos blancos evanescentes (MEWDS), Retinopatía Purtscher-like.
Con relación a la agudeza visual en los 22 casos reportados en esta matriz, la gran mayoría tuvo una mejoría en su agudeza visual comparada con la del momento del diagnóstico.
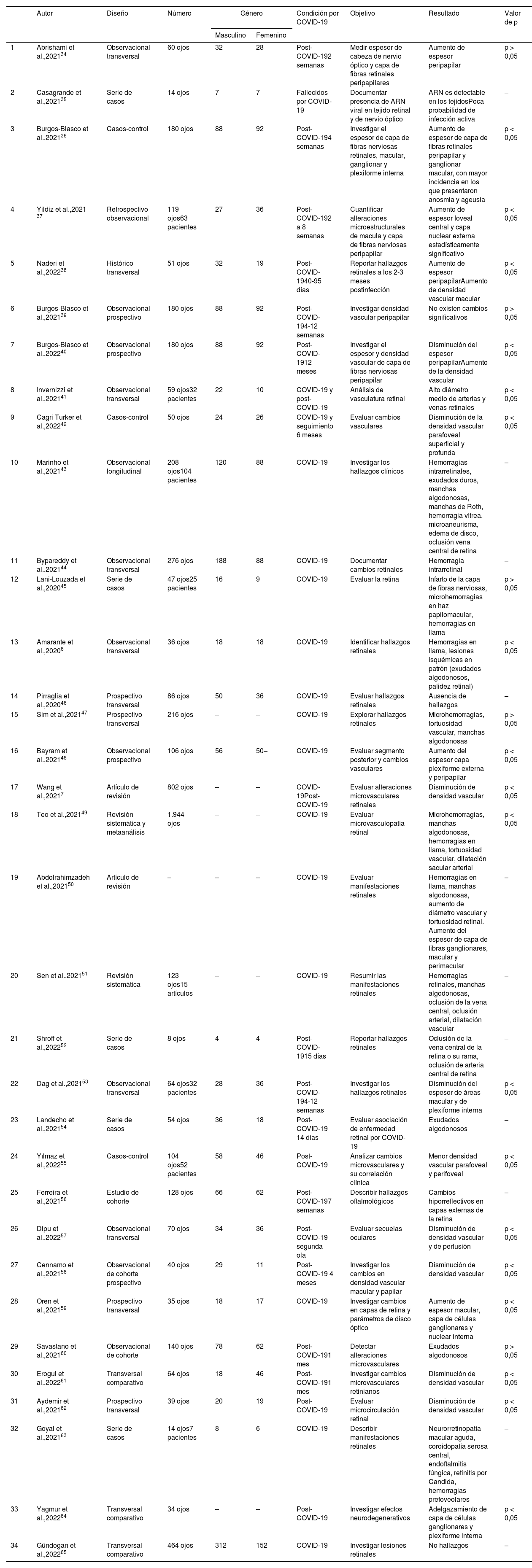
En la tabla 2, se revisaron 34 artículos que incluyen un total de 6.177 ojos analizados, de los cuales se resalta la información de los artículos que reportaron significación estadística (p < 0,05) durante el cuadro sintomático por COVID-19, en fondo de ojo reportaron hemorragias en llama y microhemorragias, lesiones isquémicas en patrón (exudados algodonosos, palidez retinal), tortuosidad vascular y dilatación sacular arterial. Adicionalmente se incorporan los estudios clínicos que realizaron exámenes complementarios de diagnóstico oftalmológico en los pacientes durante la etapa infecciosa activa y la fase de recuperación entre la segunda semana hasta los 12 meses posteriores al diagnóstico de COVID-19; en los cuales se reportó, en la mayoría de ellos, aumento del espesor de la capa plexiforme externa de la retina, área peripapilar, capa de células ganglionares maculares, y capa nuclear interna y externa de la retina, así como también aumento del espesor macular total; otros hallazgos reportados son un aumento del diámetro medio de arterias y venas retinales, y una disminución de la densidad vascular superficial y profunda. En 3 estudios, al contrario de los reportes antes mencionados, se observó una disminución del espesor peripapilar y macular, así como un aumento de la densidad vascular.
Características de los estudios incluidos
| Autor | Diseño | Número | Género | Condición por COVID-19 | Objetivo | Resultado | Valor de p | ||
|---|---|---|---|---|---|---|---|---|---|
| Masculino | Femenino | ||||||||
| 1 | Abrishami et al.,202134 | Observacional transversal | 60 ojos | 32 | 28 | Post-COVID-192 semanas | Medir espesor de cabeza de nervio óptico y capa de fibras retinales peripapilares | Aumento de espesor peripapilar | p > 0,05 |
| 2 | Casagrande et al.,202135 | Serie de casos | 14 ojos | 7 | 7 | Fallecidos por COVID-19 | Documentar presencia de ARN viral en tejido retinal y de nervio óptico | ARN es detectable en los tejidosPoca probabilidad de infección activa | – |
| 3 | Burgos-Blasco et al.,202136 | Casos-control | 180 ojos | 88 | 92 | Post-COVID-194 semanas | Investigar el espesor de capa de fibras nerviosas retinales, macular, ganglionar y plexiforme interna | Aumento de espesor de capa de fibras retinales peripapilar y ganglionar macular, con mayor incidencia en los que presentaron anosmia y ageusia | p < 0,05 |
| 4 | Yildiz et al.,2021 37 | Retrospectivo observacional | 119 ojos63 pacientes | 27 | 36 | Post-COVID-192 a 8 semanas | Cuantificar alteraciones microestructurales de macula y capa de fibras nerviosas peripapilar | Aumento de espesor foveal central y capa nuclear externa estadísticamente significativo | p < 0,05 |
| 5 | Naderi et al.,202238 | Histórico transversal | 51 ojos | 32 | 19 | Post-COVID-1940-95 días | Reportar hallazgos retinales a los 2-3 meses postinfección | Aumento de espesor peripapilarAumento de densidad vascular macular | p < 0,05 |
| 6 | Burgos-Blasco et al.,202139 | Observacional prospectivo | 180 ojos | 88 | 92 | Post-COVID-194-12 semanas | Investigar densidad vascular peripapilar | No existen cambios significativos | p > 0,05 |
| 7 | Burgos-Blasco et al.,202240 | Observacional prospectivo | 180 ojos | 88 | 92 | Post-COVID-1912 meses | Investigar el espesor y densidad vascular de capa de fibras nerviosas peripapilar | Disminución del espesor peripapilarAumento de la densidad vascular | p < 0,05 |
| 8 | Invernizzi et al.,202141 | Observacional transversal | 59 ojos32 pacientes | 22 | 10 | COVID-19 y post-COVID-19 | Análisis de vasculatura retinal | Alto diámetro medio de arterias y venas retinales | p < 0,05 |
| 9 | Cagri Turker et al.,202242 | Casos-control | 50 ojos | 24 | 26 | COVID-19 y seguimiento 6 meses | Evaluar cambios vasculares | Disminución de la densidad vascular parafoveal superficial y profunda | p < 0,05 |
| 10 | Marinho et al.,202143 | Observacional longitudinal | 208 ojos104 pacientes | 120 | 88 | COVID-19 | Investigar los hallazgos clínicos | Hemorragias intrarretinales, exudados duros, manchas algodonosas, manchas de Roth, hemorragia vítrea, microaneurisma, edema de disco, oclusión vena central de retina | – |
| 11 | Bypareddy et al.,202144 | Observacional transversal | 276 ojos | 188 | 88 | COVID-19 | Documentar cambios retinales | Hemorragia intrarretinal | – |
| 12 | Lani-Louzada et al.,202045 | Serie de casos | 47 ojos25 pacientes | 16 | 9 | COVID-19 | Evaluar la retina | Infarto de la capa de fibras nerviosas, microhemorragias en haz papilomacular, hemorragias en llama | p > 0,05 |
| 13 | Amarante et al.,20206 | Observacional transversal | 36 ojos | 18 | 18 | COVID-19 | Identificar hallazgos retinales | Hemorragias en llama, lesiones isquémicas en patrón (exudados algodonosos, palidez retinal) | p < 0,05 |
| 14 | Pirraglia et al.,202046 | Prospectivo transversal | 86 ojos | 50 | 36 | COVID-19 | Evaluar hallazgos retinales | Ausencia de hallazgos | – |
| 15 | Sim et al.,202147 | Prospectivo transversal | 216 ojos | – | – | COVID-19 | Explorar hallazgos retinales | Microhemorragias, tortuosidad vascular, manchas algodonosas | p > 0,05 |
| 16 | Bayram et al.,202148 | Observacional prospectivo | 106 ojos | 56 | 50– | COVID-19 | Evaluar segmento posterior y cambios vasculares | Aumento del espesor capa plexiforme externa y peripapilar | p < 0,05 |
| 17 | Wang et al.,20217 | Artículo de revisión | 802 ojos | – | – | COVID-19Post-COVID-19 | Evaluar alteraciones microvasculares retinales | Disminución de densidad vascular | p < 0,05 |
| 18 | Teo et al.,202149 | Revisión sistemática y metaanálisis | 1.944 ojos | – | – | COVID-19 | Evaluar microvasculopatía retinal | Microhemorragias, manchas algodonosas, hemorragias en llama, tortuosidad vascular, dilatación sacular arterial | p < 0,05 |
| 19 | Abdolrahimzadeh et al.,202150 | Artículo de revisión | – | – | – | COVID-19 | Evaluar manifestaciones retinales | Hemorragias en llama, manchas algodonosas, aumento de diámetro vascular y tortuosidad retinal. Aumento del espesor de capa de fibras ganglionares, macular y perimacular | – |
| 20 | Sen et al.,202151 | Revisión sistemática | 123 ojos15 artículos | – | – | COVID-19 | Resumir las manifestaciones retinales | Hemorragias retinales, manchas algodonosas, oclusión de la vena central, oclusión arterial, dilatación vascular | – |
| 21 | Shroff et al.,202252 | Serie de casos | 8 ojos | 4 | 4 | Post-COVID-1915 días | Reportar hallazgos retinales | Oclusión de la vena central de la retina o su rama, oclusión de arteria central de retina | – |
| 22 | Dag et al.,202153 | Observacional transversal | 64 ojos32 pacientes | 28 | 36 | Post-COVID-194-12 semanas | Investigar los hallazgos retinales | Disminución del espesor de áreas macular y de plexiforme interna | p < 0,05 |
| 23 | Landecho et al.,202154 | Serie de casos | 54 ojos | 36 | 18 | Post-COVID-19 14 días | Evaluar asociación de enfermedad retinal por COVID-19 | Exudados algodonosos | – |
| 24 | Yılmaz et al.,202255 | Casos-control | 104 ojos52 pacientes | 58 | 46 | Post-COVID-19 | Analizar cambios microvasculares y su correlación clínica | Menor densidad vascular parafoveal y perifoveal | p < 0,05 |
| 25 | Ferreira et al.,202156 | Estudio de cohorte | 128 ojos | 66 | 62 | Post-COVID-197 semanas | Describir hallazgos oftalmológicos | Cambios hiporreflectivos en capas externas de la retina | – |
| 26 | Dipu et al.,202257 | Observacional transversal | 70 ojos | 34 | 36 | Post-COVID-19 segunda ola | Evaluar secuelas oculares | Disminución de densidad vascular y de perfusión | p < 0,05 |
| 27 | Cennamo et al.,202158 | Observacional de cohorte prospectivo | 40 ojos | 29 | 11 | Post-COVID-19 4 meses | Investigar los cambios en densidad vascular macular y papilar | Disminución de densidad vascular | p < 0,05 |
| 28 | Oren et al.,202159 | Prospectivo transversal | 35 ojos | 18 | 17 | COVID-19 | Investigar cambios en capas de retina y parámetros de disco óptico | Aumento de espesor macular, capa de células ganglionares y nuclear interna | p < 0,05 |
| 29 | Savastano et al.,202160 | Observacional de cohorte | 140 ojos | 78 | 62 | Post-COVID-191 mes | Detectar alteraciones microvasculares | Exudados algodonosos | p > 0,05 |
| 30 | Erogul et al.,202261 | Transversal comparativo | 64 ojos | 18 | 46 | Post-COVID-191 mes | Investigar cambios microvasculares retinianos | Disminución de densidad vascular | p < 0,05 |
| 31 | Aydemir et al.,202162 | Prospectivo transversal | 39 ojos | 20 | 19 | Post-COVID-19 | Evaluar microcirculación retinal | Disminución de densidad vascular | p < 0,05 |
| 32 | Goyal et al.,202163 | Serie de casos | 14 ojos7 pacientes | 8 | 6 | COVID-19 | Describir manifestaciones retinales | Neurorretinopatía macular aguda, coroidopatía serosa central, endoftalmitis fúngica, retinitis por Candida, hemorragias prefoveolares | – |
| 33 | Yagmur et al.,202264 | Transversal comparativo | 34 ojos | – | – | Post-COVID-19 | Investigar efectos neurodegenerativos | Adelgazamiento de capa de células ganglionares y plexiforme interna | p < 0,05 |
| 34 | Gündogan et al.,202265 | Transversal comparativo | 464 ojos | 312 | 152 | COVID-19 | Investigar lesiones retinales | No hallazgos | – |
Fuente: base de datos de la investigación. Elaborado por el autor.
Con base en la información conocida sobre los mecanismos fisiopatológicos que utiliza el COVID-19 para producir alteraciones, se ha descrito la interacción directa entre el virus y el huésped, así como las teorías que sugieren una afectación indirecta, en la que el virus puede desencadenar un proceso autoinmune, vasculopatías o inflamación mediada por la respuesta viral, mecanismos que se presentan individualmente o en conjunto en el momento de la infección, confluyendo en las alteraciones estructurales detectadas en las estructuras del segmento posterior del globo ocular y en las estructuras vasculares48.
Una de las teorías describe el tropismo viral por los receptores de la enzima convertidora de angiotensina 2 presentes en las neuronas, endotelio vascular y coroides16, tejidos que se encuentran presentes en las estructuras oculares que, al ser infectados por el virus pueden desencadenar cuadros inflamatorios por su relación directa con el tejido neuronal, lo cual podría explicar los casos reportados de neuritis óptica; lo cual también se corrobora con el aumento de espesor en las capas de la retina que provocaría el daño transináptico, que al ceder el proceso inflamatorio podría resultar en una atrofia del tejido, lo cual se observó en los pacientes al año del padecimiento de la enfermedad, reportado en los estudios analizados en la presente revisión.
Con respecto a la teoría de vasculopatía, se encuentran inmersos un conjunto de efectos protrombóticos originados por la disfunción endotelial por afectación directa del tejido vascular que, asociada a un estado de hipercoagulabilidad, activación plaquetaria y estasis, resulta en una neuropatía óptica isquémica que consecuentemente se puede manifestar como una atrofia del nervio óptico. Es importante destacar que los eventos trombóticos por COVID-19 se evidenciaron en el 30% de los pacientes18, demarcando la ocurrencia del evento como una probabilidad de presentación debido a la alta incidencia de la enfermedad en la actualidad.
Otra teoría de la endoteliopatía establece un proceso de vasoconstricción induciendo vasoplejía con hipoperfusión transitoria13, la misma que se ha demostrado en la disminución de la densidad vascular y los hallazgos de hipoperfusión vascular. Es de amplio conocimiento que una hipoperfusión del nervio óptico y de la retina, desencadena una pérdida de las fibras nerviosas que, en enfermedades con una fisiopatología semejante se constituiría en un agravante de la enfermedad, como es el caso de las retinopatías o del glaucoma. De igual manera, al afectar los receptores presentes en la coroides que se conoce son el mecanismo de acción de algunos fármacos usados para el tratamiento del glaucoma, se debe considerar la posibilidad de una mala respuesta transitoria o definitiva a la medicación, conllevando a un daño del nervio óptico.
La infección por SARS-CoV-2 también es conocida por causar una tormenta de citocinas con la consecuente elevación de las citocinas proinflamatorias que provocan una respuesta inmunitaria exagerada dañando el tejido directamente o indirectamente al activar la cascada de coagulación provocando el estado de hipercoagulabilidad descrito anteriormente28. De esta manera, teniendo en cuenta el antecedente de la infección viral por COVID-19 entre 1-4 semanas previas31, puede iniciar con un cuadro de neurorretinitis y maculopatías secundarias al COVID-19.
Con toda esta información, es importante tener presente que la infección por COVID-19 podría contribuir a agravar enfermedades preexistentes en estas estructuras que ya mantenían un estado inflamatorio previo, como, por ejemplo, la retinopatía hipertensiva, retinopatía diabética, degeneración macular relacionada a la edad. De igual manera, la alteración del flujo vascular al nervio óptico genera la posibilidad de progresión del glaucoma, así como de otras afectaciones neurodegenerativas, y evaluar la microvasculatura como una alternativa no invasiva para pronóstico de las enfermedades de base. Aunque es importante igualmente mencionar que existen otros estudios que no reportan alteraciones en retina y nervio óptico secundarias a infección por COVID-19, por lo que son necesarios más estudios y evidencias que nos ayuden a soportar estos hallazgos.
Con el análisis de la evidencia existente hasta el momento de este análisis se podría recomendar que es importante en la evaluación del paciente conocer el tiempo transcurrido desde el diagnóstico de la infección por SARS-CoV-2 que oriente hacia presencia de signos inflamatorios o secuelas secundarias a la infección.
ConclusionesTras el análisis de la información científica obtenida, se destaca la importancia de realizar una anamnesis detallada previo a la evaluación de un paciente indagando sobre antecedentes de infección por COVID ya que este factor se podría considerar como una posible causa de la evolución o progresión de una enfermedad oftalmológica de base o una mala respuesta a un tratamiento administrado, así como también se debe analizar el tiempo transcurrido desde la infección para corroborar con los hallazgos oftalmológicos que se obtengan en el examen físico o exámenes complementarios. En consecuencia, la presente revisión permite establecer estrategias de prevención y manejo oportuno de las posibles alteraciones que puedan convertirse en secuelas, al optimizar su tratamiento mediante un control y seguimiento cercano del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.