Evaluar la presencia de anticuerpos IgA e IgG específicos del SARS-CoV-2 en lágrima de sujetos no vacunados y vacunados contra la COVID-19 con antecedentes de infección SARS-CoV-2. Correlacionar los resultados en lágrima con los de saliva y sangre, datos clínicos y regímenes de vacunación.
MétodosEstudio transversal que incluyó a sujetos con antecedentes de infección SARS-CoV-2, tanto no vacunados como vacunados contra la COVID-19. Se recogieron 3muestras: lágrima, saliva y sangre. Se analizaron IgA e IgG frente a S-1 SARS-CoV-2 con ELISA semicuantitativo.
ResultadosTreinta sujetos, con una edad media 36,4±10, varones 13/30 (43,3%) con historia de infección SARS-CoV-2 leve; 13/30 (43,3%) habían recibido un régimen de 2 dosis y 13/30 (43,3%) un régimen de 3 dosis de vacunación anti-COVID-19, 4/30 (13,3%) no estaban vacunados. Todos los sujetos con vacunación completa presentaron IgA detectable en los 3biofluidos. Entre los no vacunados, se detectó IgA en 3/4 sujetos en lágrima y saliva, mientras que no se detectó IgG. No se observaron diferencias entre la pauta de vacunación de 2 y 3 dosis según los títulos IgA-IgG.
ConclusionesAnticuerpos IgA e IgG del SARS-CoV-2 están presentes en lágrimas de pacientes con antecedentes de COVID-19 leve, lo que destaca el papel de la superficie ocular como primera línea de defensa frente a la infección. La mayoría de los sujetos no vacunados presentaron IgA a largo plazo en lágrima y saliva. La inmunización híbrida (infección natural más vacunación) parece potenciar las respuestas IgG mucosas y sistémicas. No se observaron diferencias entre la pauta de 2 y 3 dosis.
To evaluate the presence of SARS-CoV-2 specific IgA and IgG antibodies in tears of unvaccinated and anti-COVID-19 vaccinated subjects with previous history of SARS-CoV-2 infection. To compare results in tears with those in saliva and serum and correlate with clinical data and vaccination regimens.
MethodsCross-sectional study including subjects with a previous history of SARS-CoV-2 infection, both unvaccinated and vaccinated against COVID-19. Three samples were collected: tears, saliva and serum. IgA and IgG antibodies against S-1 protein of SARS-CoV-2 were analyzed with a semi-quantitative ELISA.
ResultsThirty subjects, mean age 36.4±10, males 13/30 (43.3%) with history of mild SARS-CoV-2 infection were included. 13/30 (43.3%) subjects had received a 2-dose regimen and 13/30 (43.3%) a 3-dose regimen of anti-COVID-19 vaccine, 4/30 (13.3%) subjects were unvaccinated. All the participants with full anti-COVID-19 vaccination (2-or 3-doses) presented detectable anti-S1 specific IgA in all 3biofluids, tears, saliva and serum. Among unvaccinated subjects, specific IgA was detected in 3/4 subjects in tears and saliva, whereas IgG was not detected. Considering IgA and IgG antibodies titers, no differences were observed between the 2- and 3-dose vaccination regimen.
ConclusionsSARS-CoV-2-specific IgA and IgG antibodies were detected in tears after mild COVID-19, highlighting the role of the ocular surface as a first line of defense against infection. Most naturally infected unvaccinated individuals exhibit long-term specific IgA in tears and saliva. Hybrid immunization (natural infection plus vaccination) appears to enhance mucosal and systemic IgG responses. However, no differences were observed between the 2- and 3-dose vaccination schedule.
Desde el estallido de la pandemia de la enfermedad por coronavirus de 2019 (COVID-19), más de 599 millones de personas han resultado infectadas, incluidas más de 6 millones de muertes registradas en todo el mundo, según la Organización Mundial de la Salud1. Además, se han administrado más de 12.000 millones de dosis de vacunas contra el COVID-19 en todo el mundo1. La mucosa de la superficie ocular está expuesta directa e indirectamente a muchos patógenos, entre ellos el coronavirus-2 del síndrome respiratorio agudo severo (SARS-CoV-2). En consecuencia, el ojo es un órgano susceptible de infección, en el que la mucosa ocular puede representar una primera línea de defensa contra el virus. El SARS-CoV-2 se ha detectado en lágrimas y secreciones conjuntivales de pacientes con COVID-19, lo que apunta al papel de la superficie ocular como posible vía de transmisión y, en consecuencia, a su posible implicación en la neutralización de la infección2,3.
La mayor parte de las investigaciones realizadas hasta la fecha se han centrado en la detección del SARS-CoV-2 en las secreciones oculares, más que en la respuesta inmunitaria local en la superficie ocular contra el propio virus. Dada la fase actual de la pandemia, la importante propagación de la infección por SARS-CoV-2 entre la población de todo el mundo y el progreso de la vacunación anti-COVID-19 han centrado nuestra atención en la inmunidad protectora frente a la reinfección por SARS-CoV-2 tras la infección o la vacunación.
En este estudio, hemos evaluado la presencia de 2clases de inmunoglobulinas específicas anti-SARS-CoV-2, IgA e IgG, en lágrimas de sujetos no vacunados y vacunados con anti-COVID-19, con antecedentes de infección por SARS-CoV-2. Además, se evaluaron los anticuerpos IgA e IgG específicos contra el SARS-CoV-2 en otros 2biofluidos, la saliva y el suero, y los resultados se correlacionaron con los datos clínicos y los regímenes de vacunación.
Sujetos y métodosSujetosEste estudio transversal fue aprobado por el Comité Ético de Investigación Clínica del hospital y se realizó de acuerdo con la Declaración de Helsinki. Se obtuvo el consentimiento informado por escrito de todos los sujetos.
Los criterios de inclusión fueron los siguientes: sujetos mayores de 18 años con antecedentes de infección por SARS-CoV-2 confirmada por reacción en cadena de la polimerasa con transcripción inversa en tiempo real (RT-PCR) a partir de frotis nasofaríngeos. Se excluyó a los sujetos con enfermedades oculares concomitantes, incluidas enfermedades de la superficie ocular, glaucoma o cualquier otra enfermedad ocular que requiriera tratamientos oculares tópicos. También se excluyó a los sujetos tratados mediante cirugía ocular en los 6 meses anteriores o que no hubieran dado su consentimiento para participar en el estudio. Se recogieron los datos demográficos, la historia clínica, los antecedentes de infección por SARS-CoV-2 y el régimen de vacunación contra COVID-19 de los sujetos.
MuestrasSe recogieron 3muestras de cada paciente: lágrimas, saliva y sangre (suero). Para la muestra de lágrimas se utilizaron tiras reactivas Schirmer estándar (SCHIRMER - PLUS®, DINA HITEX SPOL. S.R.O., Bučovice, República Checa). Las tiras de Schirmer se colocaron en el saco conjuntival inferior, entre los tercios medio y temporal del párpado inferior de ambos ojos, sin anestesia tópica. Las tiras se transfirieron a 600ml de una solución de NaCl al 0,9%, la solución se centrifugó a 1.000rpm en la centrifugadora Eppendorf™ 5430R (Thermo Fisher Scientific Inc., EE.UU.) a 4°C durante 5min y luego se recogió el sobrenadante. Las muestras de saliva se recogieron en un tubo estéril (tubo de propileno de 15 mL, Greiner Bio-One Monroe, EE.UU.), se centrifugaron a 300g a 4°C en la centrifugadora 5430R durante 10min y se diluyeron en NaCl al 0,9% (1:5, saliva:NaCl). En tercer lugar, se recogieron muestras de suero por venopunción empleando tubos secos con gelosa de 9ml (Vacuette® CAT de 9 mL, Greiner Bio-One Monroe, EE.UU.) y se centrifugaron a 3.500rpm a 4°C en la centrifugadora Kubota 5910 (Kubota Corporation, Tokio, Japón) para la recogida de suero. Las 3muestras se recogieron el mismo día y se almacenaron a –80°C hasta su análisis.
Detección de IgA e IgG anti-S1 específicas del SARS-CoV-2Se utilizó un kit ELISA semicuantitativo comercial específico para los anticuerpos IgA e IgG contra la proteína S1 del SARS-CoV-2 siguiendo las instrucciones del fabricante (Inmunoensayo SARS-CoV-2 IgA-IgG, Euroimmun, Lübeck, Alemania). Las muestras de suero se analizaron a una dilución de 1:101 en tampón de muestra presente en el kit, mientras que las muestras de lágrimas y saliva se analizaron añadiendo directamente 100μl de la solución a cada pocillo. Las muestras se analizaron e interpretaron según las instrucciones del fabricante (negativo: relación<0,8; límite: relación ≥ 0,8-<1,1; positivo: relación ≥ 1,1). Los resultados limítrofes se consideraron positivos para el análisis. El límite de detección para IgG fue de 8,5 RU/ml y para IgA de 6,9 RU/ml. Para concentraciones superiores al límite de detección del ELISA, se asumieron los valores anteriores a efectos de cálculo.
EstadísticasEl análisis estadístico se realizó con el programa SPSS para Windows (SPSS, Inc. Chicago, EE.UU., versión 25.0). Los valores se expresan como media±desviación estándar (DE) y frecuencia absoluta (n) y relativa (%) cuando corresponde. La normalidad se comprobó mediante la prueba de Kolmogorov-Smirnov, seguida de la prueba de Levene para evaluar la homogeneidad de las varianzas. Todos los datos cumplían una distribución normal. A los datos con homogeneidad de varianza se les aplicó un análisis de varianza (ANOVA) de clasificación simple. Para los datos sin homogeneidad de varianza, se realizó una prueba de Kruskal-Wallis. La significación estadística se fijó en p <0,05.
ResultadosEl estudio incluyó a un total de 30 sujetos con infección previa por SARS-CoV-2. Las características demográficas y clínicas de la infección por SARS-CoV-2 se resumen en la tabla 1. Todos los participantes eran sujetos sanos con antecedentes de COVID-19 leve según la clasificación de la OMS4.
Características demográficas y clínicas de la infección por SARS-CoV-2 en los sujetos del estudio
| N=30 | ||
|---|---|---|
| Sexo | ||
| Varones (n, %) | 13 | 43,3 |
| Mujeres (n, %) | 17 | 56,7 |
| Edad (media, DE) | 36,4 | 10,0 |
| Infección por SARS-CoV-2: gravedad clínica | ||
| Leve (n, %) | 30 | 100 |
| Moderada (n, %) | – | – |
| Grave (n, %) | – | – |
| Días desde la infección por SARS-CoV-2 hasta la recogida de muestras (media, DE) | ||
| Grupo vacunado con COVID-19 | 93,8 | 35,9 |
| Grupo no vacunado | 192,5 | 182,4 |
DE: desviación estándar; N: número de sujetos; %: porcentaje.
En el estudio participaron sujetos vacunados y no vacunados contra la infección por SARS-CoV-2: 4/30 sujetos (13,3%) no vacunados contra el SARS-CoV-2; 13/30 (43,3%) habían recibido 2 dosis de la vacuna anti-COVID-19 y 13/30 (43,3%) habían recibido 3 dosis. En cuanto al tipo de vacuna administrada, los participantes inscritos en el estudio recibieron un régimen de vacunación que incluía: 1) BNT162b2 COVID-19 mRNA Vaccine, Pfizer-BioNTech; 2) Spikevax (mRNA-1273), Moderna; 3) Vaxzevria (ChAdOx1-S), anteriormente COVID-19 Vaccine AstraZeneca, y 4) una combinación con cualquiera de las 3vacunas anteriores. Los participantes en el estudio habían recibido diferentes protocolos de inmunización, que aparecen resumidos en la tabla 2.
Esquemas de vacunación con COVID-19 de los sujetos del estudio
| Número de dosis de la vacuna COVID-19 | ||
|---|---|---|
| 0 (n, %) | 4 | 13,3 |
| 1 (n, %) | 0 | 0,0 |
| 2 (n, %) | 13 | 43,3 |
| 3 (n, %) | 13 | 43,3 |
| Media de dosis de vacuna COVID-19, DE | 2,2 | 1,0 |
| Tipo de vacuna de primera dosis | N | % |
| Spikevax® (Moderna) | 2 | 6,7 |
| Comirnaty® (Pfizer-BioNTech) | 22 | 73,3 |
| Vaxzevria® (AstraZeneca) | 2 | 6,7 |
| Calendario de vacunación COVID-19 | N | % |
| Moderna+Moderna | 1 | 3,3 |
| Pfizer+Pfizer | 9 | 30,0 |
| AstraZeneca+AstraZeneca | 2 | 6,7 |
| Moderna+Moderna+Pfizer | 1 | 3,3 |
| Pfizer+Pfizer+Moderna | 6 | 20,0 |
| Pfizer+Pfizer+Pfizer | 6 | 20,0 |
| Pfizer+Moderna | 1 | 3,3 |
| Días desde la primera vacuna hasta la recogida de muestras (media, DE) | 360,8 | 80,4 |
| Días transcurridos desde la última vacuna hasta la recogida de la muestra (media, DE) | 185,2 | 122,7 |
DE: desviación estándar; N: número de sujetos; %: porcentaje.
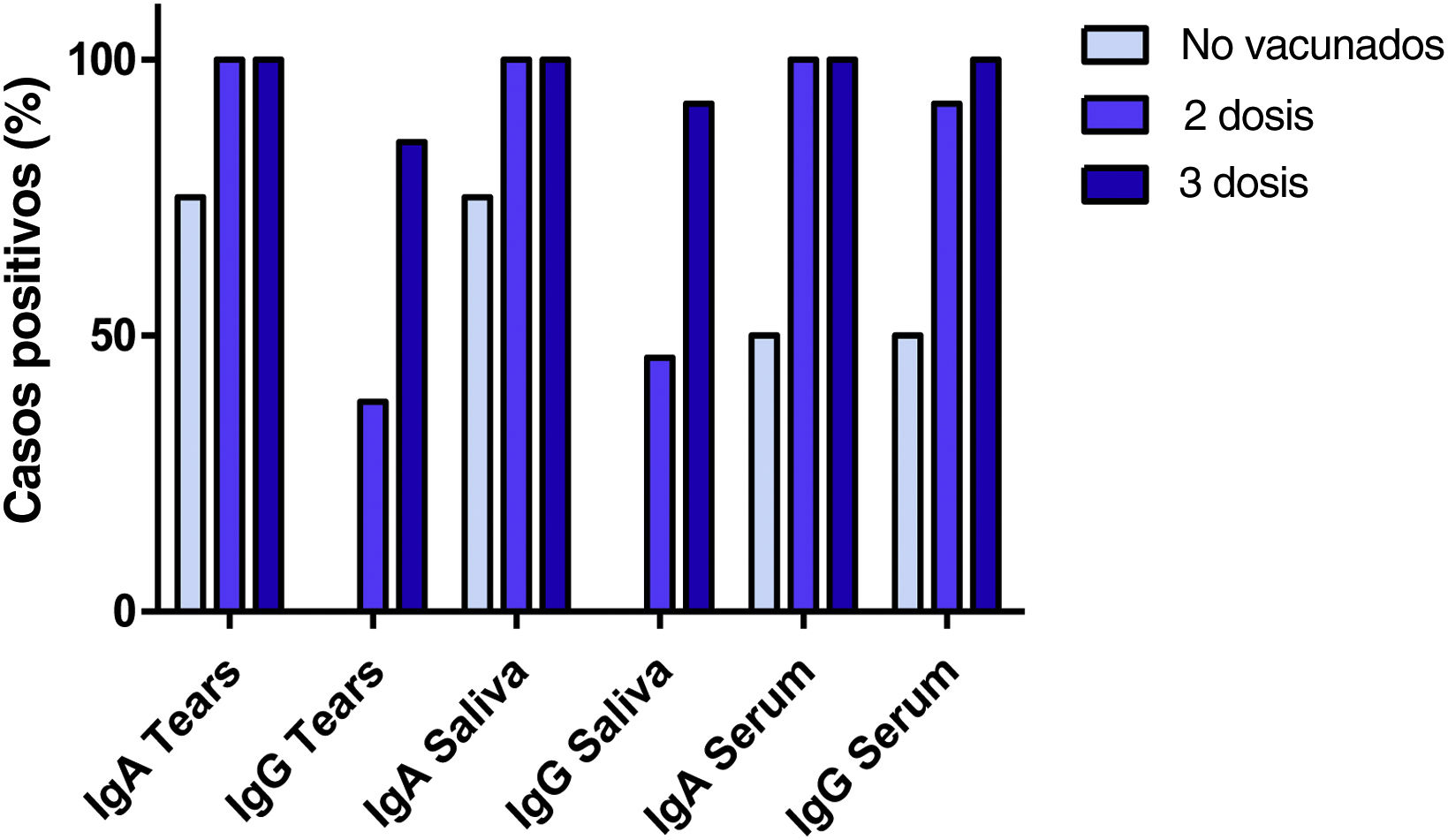
Todos los participantes con vacunación anti-COVID-19 completa (individuos con 2 y 3 dosis) presentaron niveles detectables de anticuerpos para IgA específica anti-S1 en dichos 3biofluidos. En el grupo de sujetos que habían recibido una pauta de 2 dosis, encontramos resultados positivos de IgG en el 38, el 46 y el 92% de los sujetos en las muestras de lágrimas, saliva y suero, respectivamente. En el grupo de sujetos que recibieron una pauta de 3 dosis, los resultados de IgG fueron positivos en el 85, el 92 y el 100% de los sujetos en las muestras de lágrimas, saliva y suero, respectivamente. Por otro lado, los 4individuos no vacunados presentaron resultados negativos para IgG en muestras de lágrimas y saliva. Curiosamente, se detectaron anticuerpos IgA anti-S1 en lágrimas y saliva de 3individuos no vacunados y 2de ellos presentaron resultados positivos de IgA e IgG anti-S1 en suero. Estos resultados se muestran en la figura 1. Considerando los anticuerpos específicos IgA e IgG anti-S1 en conjunto, se encontraron diferencias significativas entre los sujetos no vacunados y los que habían recibido 3 dosis (p=0,024). Sin embargo, no se encontraron diferencias entre el grupo de sujetos vacunados con 2 y 3 dosis contra el SARS-CoV-2 (p=0,151 y p=0,412, respectivamente).
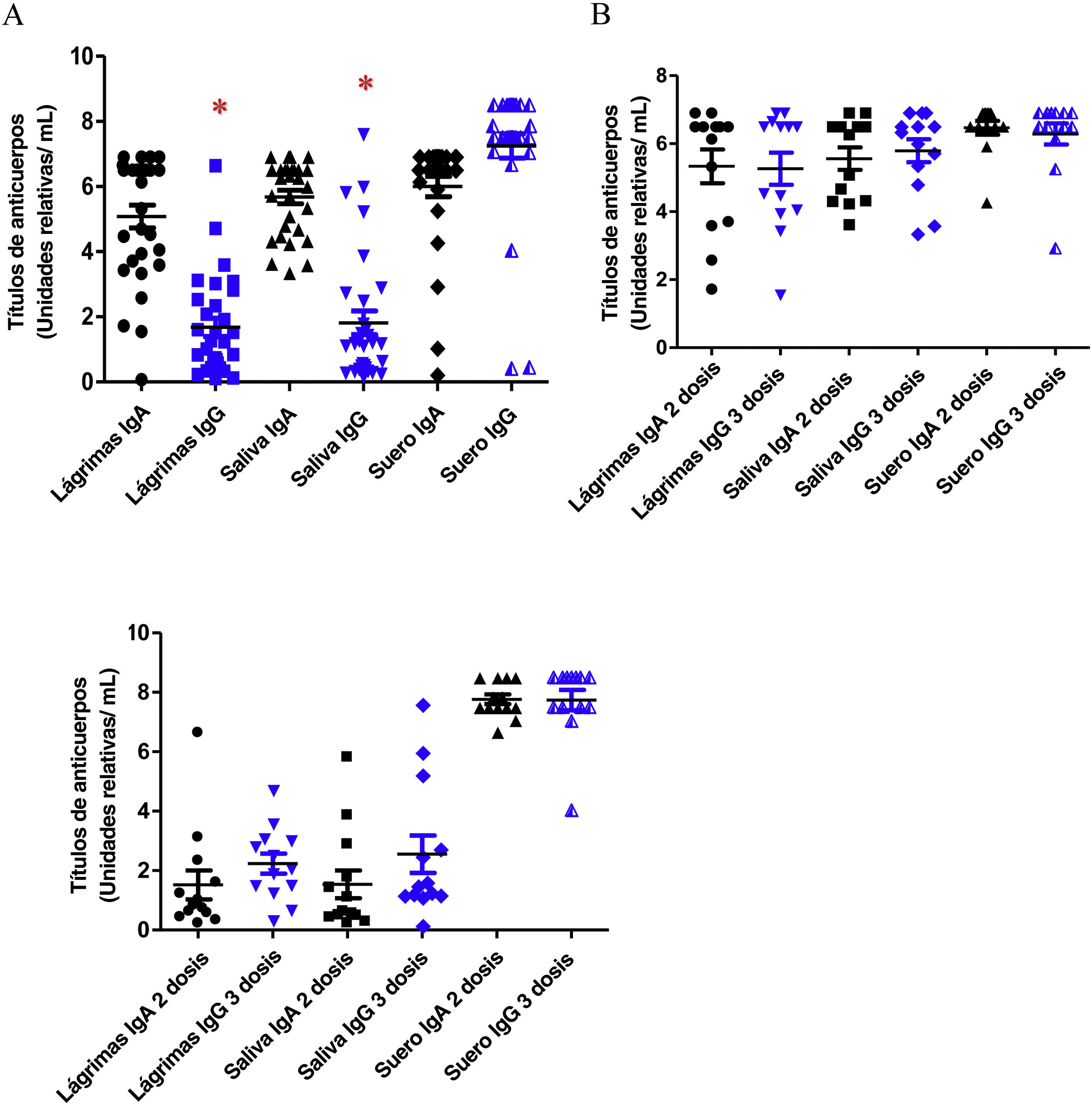
En cuanto a los títulos de anticuerpos, los valores más bajos se registraron en los títulos anti-S1 IgG de las muestras de lágrimas y saliva en ambos grupos: grupo vacunado con valores medios de 1,76±1,4 y 2,06±2,0 RU/ml, respectivamente, y grupo no vacunado con valores medios de 0,37±0,3 RU/ml y 0,32±0,04, respectivamente. Los títulos más altos de anticuerpos IgG específicos anti-S1 se encontraron en el suero también en ambos grupos (valores medios de 7,76±0,9 RU/ml en los sujetos vacunados y 4,08±3,9 RU/ml en los no vacunados). Se encontraron diferencias significativas entre los títulos de IgG en muestras de suero y mucosas (lágrimas p=0,001 y saliva p=0,008). Estos resultados se representan en la figura 2A.
Los títulos de anticuerpos IgA anti-S1 específicos en lágrimas, saliva y suero fueron de 5,25±1,7 RU/ml, 5,64±1,2 RU/ml y 6,37±0,9 RU/ml, respectivamente, en los individuos vacunados, y de 3,65±2,7 RU/ml, 5,73±0,9 RU/ml y 3,55±3,4 RU/ml, respectivamente, en los no vacunados. En el grupo de sujetos vacunados contra la infección por SARS-CoV-2, se compararon los títulos de IgA e IgG entre los sujetos vacunados con una pauta de 2 dosis y otra de 3 dosis. No se encontraron diferencias entre los títulos de IgA e IgG de los 2grupos en ninguna de las 3muestras (fig. 2B y C).
Además, se analizaron las diferencias en los títulos de anticuerpos en el grupo de sujetos vacunados en función del sexo. No se encontraron diferencias significativas entre los títulos medios de anticuerpos IgA e IgG en ninguna de las 3muestras entre mujeres y varones (p=0,774 para IgG y p=0,793 para IgA).
En cuanto a la correlación entre los títulos de anticuerpos IgA e IgG y la fecha de infección en todos los sujetos, y la fecha de vacunación en el grupo vacunado, no se encontró correlación en ninguna de las 3muestras analizadas.
DiscusiónLa imparable propagación de la infección por SARS-CoV-2 y el aumento de las tasas de vacunación nos han llevado a centrarnos en la inmunidad tras la COVID-19 y la vacunación, en particular en la inmunidad protectora local en la superficie ocular. Nuestro trabajo mostró resultados interesantes en relación con la detección de anticuerpos anti-SARS-CoV-2 (IgA e IgG) en 3biofluidos diferentes (lágrimas, saliva y suero) recogidos de sujetos no vacunados y vacunados contra COVID-19 previamente infectados. En nuestros sujetos vacunados, todos ellos con inmunización híbrida (infección natural más vacunación), se detectaron anticuerpos IgA anti-S1 específicos en las 3muestras, lo que podría indicar una mayor respuesta humoral específica en comparación con la inmunización natural. Además, como era de esperar, la prevalencia de sujetos con IgA e IgG detectables en las 3muestras fue mayor en los sujetos vacunados con un régimen de 3 dosis que en los vacunados con un régimen de 2 dosis, y esto a su vez fue mayor que en los sujetos no vacunados. En concreto, no se detectaron anticuerpos IgG contra el SARS-CoV-2 en las muestras de lágrimas y saliva de ninguno de los sujetos no vacunados, lo que podría indicar que la vacunación potencia la respuesta IgG en la mucosa. La inmunidad de las mucosas, tanto ocular como respiratoria, ha cobrado un gran interés por su papel como primera barrera defensiva frente a la infección por SARS-CoV-2. En la superficie ocular se han identificado varios receptores de entrada del SARS-CoV-2, como el receptor 2 de la enzima conversora de angiotensina y la serina proteasa transmembrana celular serina 25. En consecuencia, se ha sugerido que la superficie ocular puede representar una vía de entrada viral, ya que la superficie mucosa del ojo está directamente expuesta a los aerosoles infecciosos6,7. Se han detectado tasas variables y generalmente bajas de resultados positivos con RT-PCR de lágrimas e hisopos conjuntivales8-10. La inmunidad humoral frente al SARS-CoV-2 desempeña un papel esencial en la protección frente al COVID-1911. Las respuestas inmunitarias humorales suelen medirse en la sangre. Sin embargo, se sabe poco sobre la presencia de anticuerpos específicos contra el SARS-CoV-2 en la mucosa tras la infección y la vacunación frente al COVID-1912-14.
Los anticuerpos IgA en forma dimérica son los isotipos de anticuerpos más abundantes en la mucosa humana y desempeñan un papel fundamental en la interacción entre el sistema inmunitario y los patógenos ambientales para proporcionar protección a la mucosa, actuando a menudo como primera línea de defensa15. Sterlin et al. descubrieron que los anticuerpos IgA pueden dominar la respuesta temprana de anticuerpos específicos contra el SARS-CoV-2 en comparación con las concentraciones de IgG e IgM en suero y saliva16. Este mismo estudio descubrió que la IgA dimérica sérica era más potente que la IgG en la neutralización del SARS-CoV-2, lo que pone de relieve el papel potencial de la IgA durante la infección temprana por SARS-CoV-2 y proporciona una observación crítica dada la información emergente sobre los tipos de anticuerpos asociados con una protección óptima frente a la reinfección. Nuestro trabajo detectó la presencia de anticuerpos IgA específicos SARS-CoV-2 en los 3biofluidos ya mencionados de sujetos vacunados con COVID-19. Concretamente, en las muestras de lágrimas, observamos que todos los sujetos vacunados con COVID-19 presentaban anticuerpos IgA e IgG anti-S1. La mayoría de los sujetos no vacunados presentaron anticuerpos IgA anti-S1 en lágrimas y saliva después de 192,5 días tras la infección primaria, lo que pone de relieve la importancia de la infección natural en el bloqueo de la entrada del virus. Cabe destacar que el único sujeto de los 4 sujetos no vacunados que no presentaba anticuerpos IgA anti-S1 era un varón que se había infectado con SARS-CoV-2 464 días antes de la toma de muestras, lo que podría explicar el hecho de que no se detectara IgA. Además, los 4 individuos no vacunados presentaron resultados negativos para IgG en lágrimas. Estos resultados son congruentes con los de otros autores que observaron que la vacunación, a diferencia de la infección natural, inducía una respuesta dominada por IgG, con niveles reducidos de otros isotipos de Ab (IgM, IgA). Debido a la diferente función de estos isotipos en la mucosa (IgA) frente a la sistémica (IgG), estos hallazgos plantean la posibilidad de que, a pesar de las respuestas IgG aumentadas, la calidad de la protección frente a la reinfección conferida por las vacunas pueda diferir de la de la infección natural16,17. Otro hallazgo destacable de nuestro trabajo es el hecho de que no se encontraron diferencias en los títulos de anticuerpos IgA e IgG entre el grupo de sujetos vacunados con una pauta de 2 dosis y los vacunados con una pauta de 3 dosis. Estos resultados preliminares podrían cuestionar el valor de los refuerzos de la vacuna COVID-19, especialmente en sujetos jóvenes y sanos, como es el caso de nuestra muestra en términos de respuestas humorales. Estos resultados proporcionan una orientación cuantitativa para la vacunación de individuos no vacunados, pero previamente infectados, así como para la implementación de programas de vacunación de refuerzo. Dada la fuerte respuesta inmunitaria y la menor gravedad de la enfermedad mostrada en adultos jóvenes18,19 para determinar si, en el caso de individuos previamente infectados, cuándo y cuántas dosis de vacunas COVID-19 serían necesarias, se requerirá una vigilancia continua.
Por otra parte, aunque hay algunas pruebas de diferencias de sexo en la respuesta de anticuerpos, siendo más probable que las mujeres sean IgG positivas tras la vacunación que los hombres y que los anticuerpos neutralizantes decaigan más rápidamente en los hombres que en las mujeres tras la infección natural y tras la vacunación, en nuestro estudio no se observaron diferencias de sexo en los títulos de IgA e IgG en ninguna de las 3muestras20-22.
El presente estudio tiene algunas limitaciones: en primer lugar, incluyó principalmente a sujetos jóvenes y sanos con antecedentes de infección leve por SARS-CoV-2, lo que podría dar lugar a títulos de anticuerpos más elevados y duraderos que los encontrados en sujetos de más edad o con comorbilidades23,24. Diferentes estudios han mostrado una correlación entre los títulos de anticuerpos y la gravedad de la COVID-1925,26. Sin embargo, lamentablemente no pudimos relacionar los títulos de anticuerpos con la gravedad de la COVID-19, ya que todos los sujetos incluidos en el estudio presentaban una enfermedad leve. Por otro lado, el número de sujetos incluidos es limitado, especialmente el grupo de sujetos no vacunados, debido a la dificultad de reclutarlos en el ámbito hospitalario de la sanidad pública en España, donde el 92,7% de la población está totalmente vacunada27. Otra limitación es que el ensayo ELISA Euroimmun Anti-SARS-CoV-2 está destinado a la detección cualitativa de anticuerpos de clase IgG e IgA frente al SARS-CoV-2 en suero o plasma humano, pero no está validado para el análisis de saliva o lágrimas. No obstante, se ha utilizado en varios estudios13,28,29. Por último, las lágrimas han demostrado ser una muestra aceptable para la detección de anticuerpos contra el SARS-CoV-2 mediante ELISA estándar. Dado que, a diferencia del suero, tanto las lágrimas como la saliva pueden recogerse fácilmente y de forma no invasiva, estos biofluidos pueden ser una estrategia alternativa prometedora para la detección de anticuerpos anti-SARS-CoV-2 en programas de cribado de grandes poblaciones.
En conclusión, este estudio aporta datos valiosos sobre la presencia de anticuerpos IgA e IgG específicos del SARS-CoV-2 en las lágrimas tras la COVID-19 leve en adultos jóvenes, lo que pone de relieve el papel de la superficie ocular como primera línea de defensa contra la infección. Nuestros resultados preliminares revelan que la mayoría de los individuos no vacunados infectados de forma natural presentan anti-IgA específicos a largo plazo en lágrimas y saliva, mientras que los individuos híbridos desarrollaron anticuerpos IgA e IgG específicos.
La inmunización híbrida parece potenciar las respuestas IgG mucosas y sistémicas. Estos hallazgos subrayan la importancia de la vacunación con COVID-19 para potenciar la inmunidad humoral protectora, no solo en el suero, sino también en la mucosa, ya que esta constituye un importante portal de entrada para hacer frente a futuras reinfecciones.
DeclaracionesAprobación ética y consentimiento para participar: el estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Clínico San Carlos y se realizó de acuerdo con la Declaración de Helsinki. Número de referencia del Comité 22/309-E.
Se obtuvo el consentimiento informado por escrito de todos los sujetos.
Consentimiento para la publicación: todos los autores han aprobado este manuscrito y están de acuerdo con su envío a Archivos de la Sociedad Española de Oftalmología.
Declaraciones de interés: ninguna.
Contribuciones de los autoresTodos los autores aprobaron la versión final del manuscrito.
FinanciaciónEsta investigación no recibió ninguna subvención específica de organismos de financiación de los sectores público, comercial o sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a Ana María González-Nava y Helga Yolanda Tallón Avila que colaboraron en la recogida de determinados datos.