La retinopatía diabética (RD) tradicionalmente se ha considerado parte de un proceso vascular. Investigaciones recientes sugieren que la degeneración de la retina en la diabetes mellitus (DM) podría ser causada también por una neuropatía y que la neurodegeneración retiniana precedería a las alteraciones microvasculares. El presente artículo revisa la bibliografía existente sobre neurodegeneración en pacientes con DM tipo 2 (DM2) sin RD.
En los pacientes con DM2 no severa, temprana, con buen control metabólico y sin RD, las pruebas de función visual muestran anormalidades precoces que anteceden a la aparición de la RD clínica (la que diagnosticamos con una exploración oftalmológica convencional). Utilizando la tomografía de coherencia óptica (OCT) se observa que en estos pacientes existe una disminución en el espesor de distintas capas de la retina, tanto en el área macular como peripapilar. Recientes estudios sugieren que las complicaciones sistémicas (especialmente la isquemia) y una posible alteración microvascular contribuyen a la neurodegeneración retiniana, lo que abre la puerta a nuevos estudios que incluyan nuevas técnicas de evaluación de la microvascularización de las capas internas de la retina como la angio-OCT.
In diabetes mellitus (DM) patients retinal complications were typically considered part of a vascular process. Recent research suggests that retinal degeneration in DM might also be caused by a neuropathy that could precede microvascular alterations. The present work reviews the currently available bibliography about neurodegeneration in patients with type 2 DM (DM2) without diabetic retinopathy (DR).
In patients with non-severe, early DM2 without DR and good metabolic control visual function parameters show early abnormalities that precede clinical DR (in which we diagnose with a conventional ophthalmological examination). Using optical coherence tomography (OCT) technology, a reduction in macular and peripapillary thickness has been observed in different studies. Recent researches suggest that systemic complications (especially ischaemia) and a possible microvascular alteration eventually contributes to retinal neurodegeneration, which opens the door to new studies that include new techniques for evaluating the microvascularization of the retinal layers.
La diabetes mellitus (DM) engloba un conjunto de enfermedades metabólicas que se caracterizan por la hiperglucemia crónica secundaria a defectos en la secreción de la insulina o resistencia a su acción, desencadenándose un estado de hiperglucemia no controlada que con el tiempo puede producir daño en muchos órganos y sistemas1.
La Asociación Americana de Diabetes ha clasificado la DM en 4categorías fundamentales1:
- 1.
DM tipo 1 (DM1). Representa el 5-10% de casos de DM y se caracteriza por un déficit absoluto de insulina.
- 2.
DM tipo 2 (DM2). Engloba el 90% de casos de DM. El factor común predominante es la resistencia a la acción periférica de la insulina.
- 3.
DM gestacional. Este subtipo se diagnostica durante el segundo o tercer trimestre de la gestación, está favorecida por los cambios hormonales del embarazo y la susceptibilidad genética.
- 4.
Diabetes específicas de otros tipos. En este grupo se engloban subclases de DM como son la diabetes monogénica (llamada MODY, de las siglas en inglés Maturity Onset Diabetes of the Young), la diabetes causada por fármacos (inmunosupresores, glucocorticoides, etc.) y la diabetes causada por enfermedades del páncreas exocrino (como la fibrosis quística).
La prevalencia mundial de adultos con DM es del 8,8%, aproximadamente 425 millones, y se prevé que ascienda a unos 629 millones en 2045. El mayor aumento se producirá en regiones donde la economía está pasando de tener unos ingresos bajos a tener ingresos medios; se calcula que aproximadamente un tercio de los casos se deben al crecimiento y el envejecimiento de la población2. En países con ingresos altos podemos calcular la prevalencia de DM2 entre un 87 y un 91% y la de la DM1 entre un 2 y un 7% de la total. En Europa la prevalencia total de DM ajustada por edad y sexo es del 6,8%1.
Las complicaciones derivadas de la DM se encuentran entre las principales causas de muerte temprana. En 2012 la Organización Mundial de la Salud estimó que aproximadamente 1,5 millones de personas fallecieron por DM y 2,2 millones más a causa de sus complicaciones, principalmente cardiovasculares2.
El principal problema epidemiológico relacionado con la DM2 es que en algunos casos esta enfermedad puede permanecer asintomática durante meses o años, por lo que hasta el 50% de los adultos afectados de DM están aún sin diagnosticar2. Esto ha supuesto que se hayan establecido unos criterios rigurosos para el cribado y el diagnóstico. En el año 2006, la Asamblea General de las Naciones Unidas definió la diabetes como «enfermedad crónica, debilitante y costosa que tiene graves complicaciones, conlleva grandes riesgos para las familias, los estados miembros y el mundo entero»3.
Se trata, por tanto, de un problema de salud pública importante debido a su elevada y creciente prevalencia y morbimortalidad, derivadas del envejecimiento de la población (por un aumento en la esperanza de vida) y del estilo de vida de los países desarrollados (con unas dietas menos saludables y una disminución de la actividad física). Tanto la diabetes como sus complicaciones generan grandes pérdidas en forma de gastos médicos directos y de una pérdida de trabajo e ingresos1,2.
Etiopatogenia y factores de riesgo de la diabetes mellitusLa DM1 también conocida como insulinodependiente, es debida a una reacción autoinmune en la que el propio cuerpo ataca a las células beta encargadas de la producción de insulina en el páncreas, ocasionando un déficit absoluto de la hormona que requiere la administración exógena a diario para poder controlar los niveles de glucosa sanguíneos. Esta enfermedad no será el objeto del presente trabajo de revisión.
La DM2 (la más frecuente y objeto de esta revisión) es debida a una pérdida progresiva de la secreción de insulina por las células betapancreáticas, frecuentemente relacionada con la aparición de una resistencia insulínica que intenta ser compensada con una mayor producción de la hormona por el páncreas y conduce a un fallo progresivo en su secreción. La producción de insulina pancreática puede llegar a ser insuficiente para el control de la glucemia sanguínea, presentando niveles altos a pesar de estar asintomáticos. En estos casos, existe una clínica larvada que puede pasar desapercibida durante años y encontrarnos complicaciones en el momento del diagnóstico.
La DM2 tiene un origen multifactorial, destacando entre los posibles factores desencadenantes una importante carga genética, el sedentarismo y la obesidad. Esta categoría de DM se diagnosticaba frecuentemente a partir de los 30 años de edad, aunque el aumento de la obesidad infantil y juvenil está favoreciendo su aparición en edades cada vez más tempranas
Para el desarrollo de DM2 se han descrito los siguientes factores de riesgo clásicos4:
- –
Diagnóstico previo de prediabetes.
- –
Obesidad, condicionada por la dieta, la actividad física y otros factores, como la predisposición individual y genética.
- –
Antecedentes familiares de primer grado de DM2.
- –
Dislipidemia.
- –
Hipertensión arterial (HTA).
- –
Pertenecer a etnias de alto riesgo (afroamericanos, hispanoamericanos, nativos americanos, asiáticos americanos y nativos de las islas del Pacífico).
- –
Antecedentes personales de diabetes gestacional o parto con feto macrosómico (> 4 kg).
La presencia mantenida de niveles elevados de glucosa en sangre en la DM tiene como consecuencia el daño en los diferentes órganos y sistemas de las que derivan las siguientes complicaciones:
- 1.
Complicaciones microvasculares, debidas a la disfunción de los vasos de pequeño calibre causando retinopatía diabética (RD), nefropatía diabética y neuropatía diabética.
- 2.
Complicaciones macrovasculares, debidas a la disfunción de los vasos sanguíneos de gran calibre, responsables de la enfermedad cardiovascular, la enfermedad cerebrovascular y la arteriopatía periférica.
La neuropatía diabética se ha observado en hasta un 50% de los pacientes4 y es la complicación más frecuente derivada de la DM. De las diferentes formas de presentación, las más prevalentes son la polineuropatía simétrica distal, y la neuropatía autonómica.
Los mecanismos precisos que subyacen a esta complicación siguen sin estar claros. Se sabe que los niveles de glucemia en sangre desempeñan un papel fundamental5,6. Los diferentes estudios parecen estipular 2tipos de mecanismos de daño neural en la DM: los de tipo vascular y los de tipo metabólico5.
Se ha sugerido que los cambios de origen vascular serían responsables del inicio de la neuropatía, dado que cambios morfológicos de los vasa nervorum están presentes precozmente en el curso de la enfermedad. La hiperglucemia mantenida produce una cascada metabólica que hace que se acumulen productos de glicosilación avanzada lo que causa una disfunción endotelial que produce un descenso en el flujo sanguíneo conduciendo a la hipoxia de las células nerviosas. Otras alteraciones observadas han sido el engrosamiento de las paredes vasculares y la formación de neovasos, así como una regeneración aberrante de las fibras nerviosas, formando microfascículos que pueden comprimir la luz de los vasos5.
Tanto las alteraciones de tipo vascular-isquémico como las de tipo metabólico interaccionan de forma compleja y producen a largo plazo la disfunción de los mecanismos de reparación de las fibras nerviosas5.
La retinopatía diabéticaClasificación de la retinopatía diabéticaLa clasificación propuesta por el Early Treatment Diabetic Retinipathy Study (ETDRS) está considerada como referente a seguir en los ensayos clínicos. Sin embargo, no se utiliza habitualmente en la práctica clínica debido a su complejidad.
En un intento de conseguir un medio de comunicación para todos, un grupo de expertos (Global Diabetic Retinopathy Project Group [GDRPG]) propuso en el año 2002 una clasificación para la RD de más fácil manejo: la escala internacional de severidad de la retinopatía (tabla 1). Esta clasificación es la que se utiliza en la actualidad y está basada en los resultados del ETDRS y, por lo tanto, se apoya en la evidencia científica, no pretendiendo desplazar la clasificación original, sino proporcionar una base de manejo más sencilla y adecuada para la práctica clínica habitual7.
Clasificación clínica internacional de la RD
| Clasificación clínica internacional de la RD | |
|---|---|
| Sin RD aparente | Sin alteraciones diabéticas en fondo de ojo |
| Ausencia de microaneurismas | |
| RDNP leve | Solo microaneurismas |
| RDNP moderada | Microaneurismas asociados a: |
| Menos de 20 hemorragias intrarretinianas en cada uno de los 4 cuadrantes | |
| Exudados duros, exudados algodonosos o arrosariamiento venoso en un solo cuadrante | |
| RDNP severa | Microaneurismas junto a uno de los siguientes hallazgos: |
| Hemorragias intrarretinianas severas (> 20) en cada uno de los 4 cuadrantes | |
| Arrosariamiento venoso en ≥ 2 cuadrantes | |
| Anomalías microvasculares intrarretinianas en ≥ 1 cuadrante | |
| No signos de retinopatía diabética proliferante | |
| RDP | Neovasos o hemorragia prerretiniana o hemovítreo |
RD: retinopatía diabética; RDNP: retinopatía diabética no proliferativa; RDP: retinopatía diabética proliferativa.
En nuestro medio, la RD es la complicación microvascular más frecuente de la DM2 y la causa más frecuente de ceguera en la población con RD causó el 1,9% de las alteraciones visuales moderadas y graves en el mundo, y el 2,6% de los casos de ceguera8.
Aproximadamente, el 30% los pacientes con DM presenta algún grado de RD y hasta un 10% de estos presenta RD avanzada con serio compromiso de capacidad visual9.
La aparición y la progresión de la RD está condicionada por la duración de la DM y su control metabólico, que a su vez es el objetivo principal del tratamiento de la enfermedad. También se conoce el papel de otros factores de riesgo cardiovascular, como la HTA, la dislipidemia, la obesidad o la nefropatía diabética y la presencia de macroalbuminuria en fases avanzadas. Al igual que en la neuropatía diabética, la hiperglucemia y las alteraciones metabólicas que genera son las responsables de la aparición de lesiones microvasculares en la capa interna de la retina10.
Las primeras alteraciones estructurales que aparecen son el engrosamiento de la membrana basal de los vasos, la pérdida de pericitos y la rotura de las tight juntions (uniones fuertes) entre las células endoteliales. Esa disminución del número de pericitos facilita la formación de hemorragias focales y de microaneurismas. El engrosamiento de la membrana basal y el daño endotelial van a producir un aumento de la permeabilidad de membrana, lo que puede ocasionar la extravasación de líquido hacia el espacio intersticial y, secundariamente, un engrosamiento de la retina y la formación de exudados duros9.
Al avanzar estos daños en la retina, habrá una depleción de células endoteliales, favoreciendo la trombosis y la adhesión de leucocitos a la pared vascular dañada. Esto puede ocluir la luz del capilar, causando hipoxia en la retina adyacente. En esta fase, el examen oftalmoscópico permite ver exudados blandos o algodonosos, que son áreas de la retina infartadas, así como alteraciones en la microcirculación intrarretiniana (de sus siglas en inglés IRMA, Intraretinal Microvascular Abnormality). En las fases finales de RD los productos de degradación de la destrucción de la membrana basal celular, junto con agentes antiogénicos estimulados por la hipoxia, facilitarán la formación de neovasos. La neovascularización produce anclajes en el vítreo posterior fibrosis, lo que puede ocasionar un desprendimiento de retina traccional o puede producir hemorragias masivas en el interior del humor vítreo9.
El edema macular diabético es relativamente frecuente en la DM2 y se debe a una rotura de la barrera hematorretiniana con extravasación del contenido al intersticio, teniendo lugar un cúmulo de proteínas y aumento de la presión oncótica8.
Tradicionalmente se ha considerado la RD como una enfermedad de la microcirculación de la retina. Sin embargo, cada vez hay más estudios que sugieren que el proceso de neurodegeneración retiniana ocurre muy precozmente, simultáneamente o incluso antes de que comience el proceso vascular, como muestra el hecho de que se hayan detectado signos de neurodegeneración retiniana en ojos de donantes diabéticos que no presentaban alteraciones microvasculares11,12.
Neurodegeneracón retiniana en diabetes: ¿vasculopatía o neuropatía?La RD y las complicaciones retinianas en pacientes con DM tradicionalmente se han considerado parte de un proceso vascular. Sin embargo, investigaciones recientes sugieren que la degeneración de la retina en la DM podría ser causada no solo por una vasculopatía, sino también (y de manera importante) por una neuropatía13.
Se cree que la neurodegeneración retiniana puede preceder a las alteraciones microvasculares en su desarrollo o incluso fomentar su aparición14. Sin embargo, la posible correlación entre la neuropatía y la vasculopatía en este proceso es aún desconocida. Las alteraciones que observamos en el fondo de ojo de los pacientes con RD, microaneurismas y hemorragias en las primeras etapas, pueden ir precedidas de otras alteraciones vasculares no detectables en una exploración de fondo de ojo de rutina.
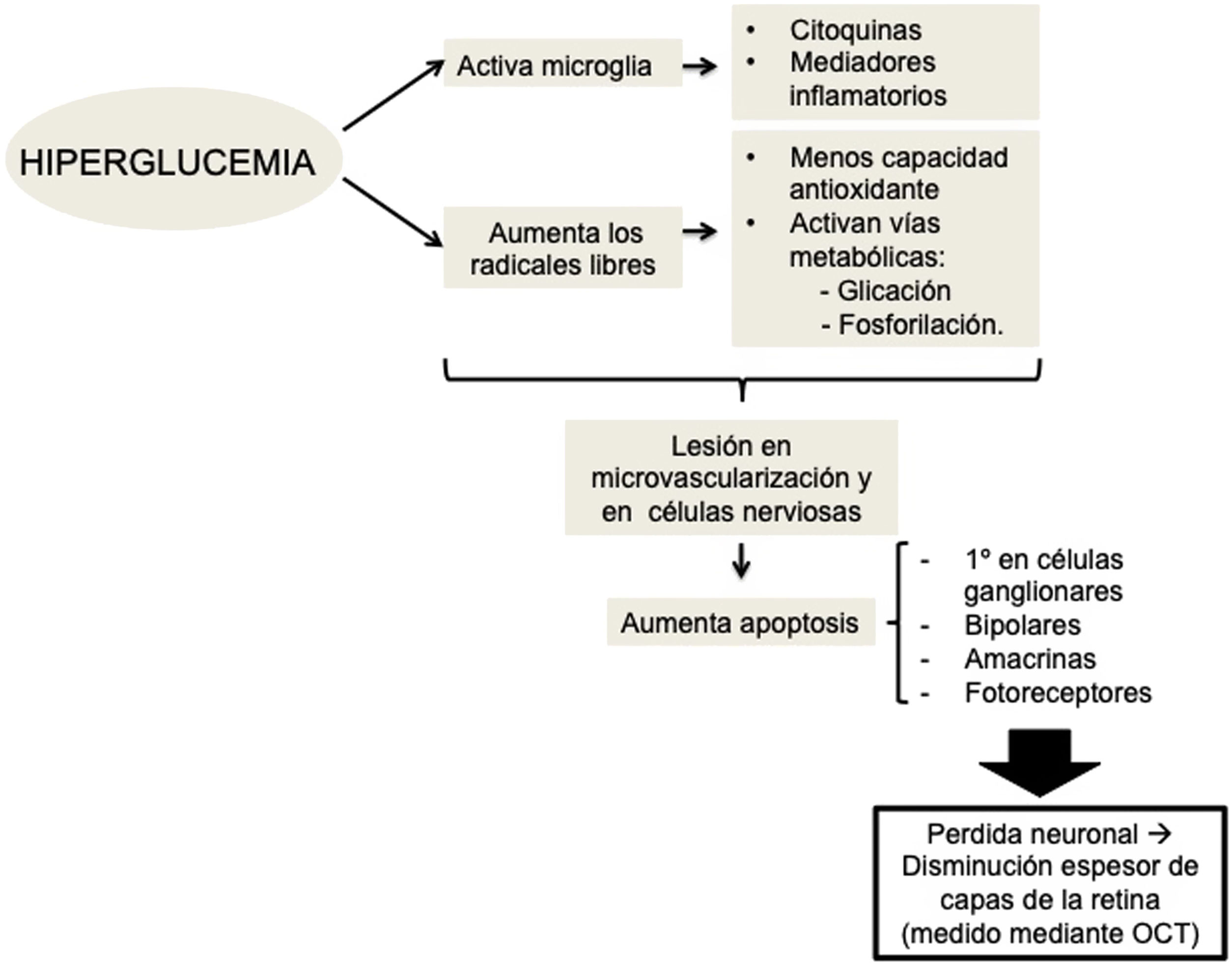
Por lo tanto, la RD preclínica (la que no detectamos con una exploración oftalmológica convencional) podría ser causada por cambios en el calibre de los vasos retinianos o en la regulación del flujo sanguíneo de la retina15,16. Sin embargo, también se han observado cambios que afectan a las neuronas de la retina, como el aumento de la apoptosis de las células ganglionares de la retina y la activación de la microglía sin signos de cambios vasculares11,17. La apoptosis neuronal se inicia en las células ganglionares de la capa interna de la retina, pero puede afectar también a otras células nerviosas retinianas, como son las células bipolares, amacrinas y los fotorreceptores18,19. Varios estudios han objetivado esta pérdida neuronal, la cual se manifiesta como disminución del espesor de algunas capas de la retina20,21. Se ha estipulado que alteraciones a nivel de mediadores moleculares que tienen lugar desde fases incipientes de la enfermedad sean las que produzcan un desequilibrio entre las señales proapoptóticas y de supervivencia celular17. Alteraciones en el glutamato extracelular22, el aumento del estrés oxidativo y productos derivados de la fotoxidación23 se han descrito como capaces de ocasionar lesiones a nivel de las células nerviosas de la retina y de los microvasos24,25.
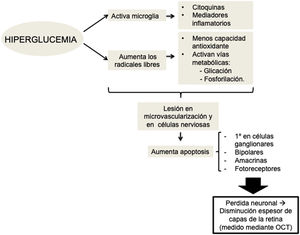
Existe evidencia de que la hiperglucemia conduce a una activación de la microglía. Las células gliales activadas producen gran cantidad de citocinas y mediadores inflamatorios, lo cual podría ser causa en la patogenia de la neurodegeneración retiniana al alterar la barrera hematorretiniana y disminuir el acoplamiento neurovascular, mecanismo por el que los vasos regulan su flujo en respuesta a una señal nerviosa26 (fig. 1).
Alteración funcional de la retina en diabetesLos estudios funcionales, como el electrorretinograma (ERG), la evaluación de la visión cromática o de la sensibilidad al contraste, muestran también anormalidades precoces a la RD, antes incluso de que esta sea diagnosticada.
El ERG es una herramienta fundamental en la evaluación de las alteraciones de la función retiniana y se han observado alteraciones características en el registro (menor amplitud en los voltajes y mayor latencia en la aparición de los potenciales oscilatorios), tanto en modelos animales como en humanos diabéticos, aun no existiendo ninguna alteración microvascular27,28. En un estudio reciente con más de 400 pacientes con DM2, el 58% de los pacientes mostraba alteraciones en el registro del ERG en ausencia de lesiones vasculares indicativas de RD13. Mediante el ERG multifocal, se ha observado incluso que los cambios electrofisiológicos en la retina de un modelo animal para DM2 preceden en el tiempo tanto a las lesiones vasculares retinianas, como a las alteraciones cognitivas típicas de esta enfermedad29,30. Todo esto sugiere la presencia de una neurodegeneración previa a las alteraciones vasculares retinianas (e incluso sistémicas).
Así mismo, otros estudios electrofisiológicos con potenciales evocados visuales han detectado cambios precoces en sus resultados en personas sin RD31,32. Lee et al. demostraron recientemente un aumento en la latencia de la onda P100 en pacientes diabéticos (tipo 1 y tipo 2) recién diagnosticados y con retinas aparentemente sanas31. Este aumento de latencia estaba incluso asociado en aquellos pacientes con DM2 a niveles anormalmente altos de hemoglobina glicosilada (HbA1c) (no así en los pacientes con DM1). Además, esta prueba electrofisiológica ha demostrado también cambios en la latencia en retinas de niños nacidos de madres con diabetes gestacional, especialmente aquellas con sobrepeso importante33.
Exámenes de otros parámetros de la función visual en personas con DM, como la sensibilidad al contraste34 y la visión cromática35, han demostrado anormalidades precoces que anteceden a la aparición de la RD clínica o establecida (la que detectamos en la exploración de FO).
Hay diversas rutas de conducción para diferentes frecuencias en el procesamiento de la información visual y no se sabe qué rutas son las más afectadas en DM36. Por lo tanto, la evaluación de la sensibilidad al contraste en diferentes frecuencias espaciales es de gran importancia en estos pacientes. Estudios previos apenas observaron pérdida de sensibilidad al contraste en los diabéticos tipo 2 sin RD36,37. Sin embargo, otros investigadores han encontrado cambios que afectan a la sensibilidad al contraste en todas las frecuencias en pacientes con DM2 y sin retinopatía34,38. Parece que, en presencia de una RD establecida, existe una disminución de la sensibilidad al contraste36, que puede ser independiente de la afectación de la agudeza visual34. Sin embargo, no existe todavía un acuerdo sobre si esta afectación de la sensibilidad al contraste comienza antes de que lo haga la RD. Se ha sugerido que la pérdida selectiva de sensibilidad de contraste para las frecuencias más altas es una señal de disfunción parvocelular (que son el 80% de las células ganglionares de la retina)39. Así mismo, hay estudios de correlación publicados36,38 que demuestran que los pacientes con más de 10 años de evolución de la enfermedad o que presentan peor control metabólico presentan una peor sensibilidad al contraste38.
Algunos estudios han sugerido la presencia de cambios en la visión del color en pacientes con DM y presencia de RD, especialmente en el eje azul-amarillo40. Esta alteración en la visión cromática también ha sido observada en pacientes diabéticos sin RD35,41 y parece estar asociada al riesgo de desarrollar diabetes, así como alteraciones vasculares retinianas secundarias a la hiperglucemia42. La visión cromática es dependiente sobre todo de los conos, por lo que estos hallazgos van en sintonía con estudios que muestran una disminución de la capa de fotorreceptores en la retina en ausencia de cambios microvasculares visibles43,44. Esto parece indicar que la discromatopsia sea una manifestación temprana de alteraciones neurológicas en estos pacientes.
La perimetría también ha sido estudiada en pacientes con DM. Se han observado defectos en el campo visual en pacientes con DM1 en estadios de enfermedad previos a la presencia de cambios típicos de la RD45,46. De manera similar, se ha sugerido que puede haber una afectación difusa del campo visual en pacientes con DM2, incluso sin RD, y que esta afectación aumenta significativamente con la cantidad y la gravedad de los cambios retinianos vasculares47. Sin embargo, otros autores no lograron detectar dichas alteraciones en la perimetría de pacientes con DM2 sin RD48,49, o bien, a pesar de detectarlas, estas no mostraban correlación con los cambios en la vasculopatía retiniana50. Un problema a destacar en estos estudios es que se utilizaron diferentes dispositivos de perimetría y las muestras de pacientes eran heterogéneas, mezclando en la mayoría de casos pacientes con y sin RD y ambos tipos de DM. Esto podría justificar que haya resultados tan dispares.
Por otro lado, otras variables pueden influir en los resultados finales, por ejemplo, diferencias en la edad, sexo, factores de riesgo cardiovascular (tabaquismo, hiperlipemia, obesidad, etc.) o longitud axial pueden alterar los resultados de la tomografía de coherencia óptica (OCT) como factores de confusión.
Los estudios de función visual en la DM todavía no han conseguido aclarar el origen vascular vs. neuropático de la RD. Sin embargo, todas estas alteraciones observadas en las pruebas de función visual, como el ERG13, la sensibilidad al contraste34, la visión cromática35 y los resultados del campo visual50,51, en pacientes con DM sin RD o solo cambios mínimos podrían sustentar la teoría de una neurodegeneración en fases incipientes de la enfermedad. Por otra parte, la neuropatía diabética se asocia con los mismos factores de riesgo que producen otras complicaciones macrovasculares y microvasculares en esta enfermedad, como dislipidemia, control metabólico deficiente y oligoalbuminuria. Estudios con modelos animales y biopsias en humanos han demostrado que en la neuropatía diabética hay una alteración en la microvascularización de los nervios, lo que lleva a la hipoxia endoneural52,53. Por lo tanto, podría sugerirse que, dado que comparten mecanismos patógenos, es posible que la presencia de complicaciones extraoculares de la diabetes, generadas por alteraciones vasculares, aparezcan simultáneamente con la presencia de cierta disfunción subclínica de la perfusión retiniana. Esta incipiente alteración vascular podría conducir a una hipoxia de las estructuras nerviosas de la retina, que se manifiesta como un deterioro de la sensibilidad al contraste, la visión cromática, la agudeza visual y la perimetría.
Alteración estructural de la retina en diabetesLos estudios estructurales actuales tienen como objetivo analizar si la DM2 produce una disminución en el espesor de la capa de fibras nerviosas de la retina (CFNR) y de la capa de células ganglionares (GCL) objetivable mediante técnicas de análisis de la imagen54. Esta evaluación se realizaba hasta hace unos años mediante la oftalmoscopia y las fotografías monocromáticas de la retina, las cuales sugerían la presencia de alteraciones estructurales precoces en la CFNR de pacientes diabéticos55. Sin embargo, estas técnicas de imagen no son cuantitativas y tienen una importante variabilidad dependiente del explorador, siendo además necesaria una pérdida superior al 50% de las células ganglionares para que puedan detectarse defectos en la CFNR, lo cual hace que sean poco efectivas en el diagnóstico precoz56.
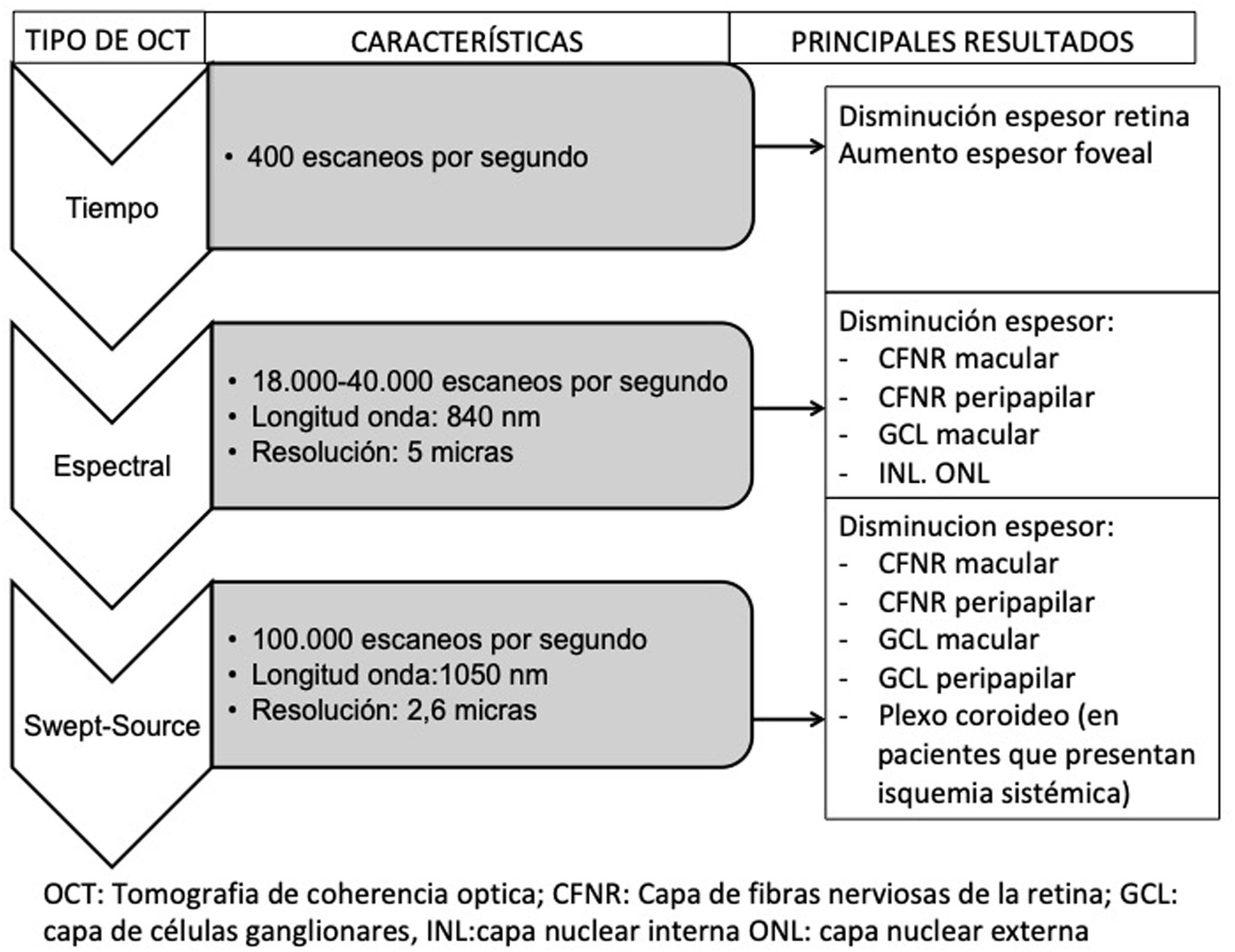
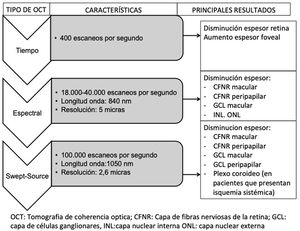
La OCT es capaz de obtener imágenes de la retina y del nervio óptico semejantes a un corte histológico de la retina, realizado in vivo y en tiempo real. Permite cuantificar de forma exacta los espesores de las diferentes capas de la retina, en la mácula y en el área peripapilar, de manera rápida e inocua para el paciente. Los sistemas de OCT han ido evolucionando desde que empezaron a usarse en 1991. Los más recientes dispositivos Swept Source OCT (SS-OCT o de barrido) utilizan fuentes de luz de mayor longitud de onda (1.050nm) alcanzando una velocidad de exploración de 100.000 A-scans por segundo y produciendo una mejor resolución axial y transversal. Realizan, por tanto, el análisis mediante una frecuencia de escaneo superior a sus antecesores de dominio tiempo o espectral. Esto permite evitar la gran reflectividad del epitelio pigmentario y la vascularización coroidea, permitiendo una mayor penetración de la luz a nivel tisular y un incremento aún mayor en la resolución y en la velocidad de exploración. Esta tecnología proporciona exámenes y análisis de mejor calidad de las capas más profundas (llegando a la coroides) en comparación con la tecnología de dominio espectral anterior57,58.
Son muchos y diversos los estudios publicados que analizan los cambios retinianos en pacientes con DM mediante OCT; sin embargo, ninguno parece aclarar qué aparece primero, si la neurodegeneración o la vasculopatía. Aquellos estudios que evalúan si las alteraciones que afectan a la CFNR y otras capas retinianas preceden a algún cambio vascular en pacientes con DM han obtenido resultados opuestos21,34,59, pero un reciente metaanálisis sugiere que este podría ser el caso60.
Los primeros estudios clínicos que utilizaron OCT de dominio tiempo apuntaron a un mayor espesor macular en sujetos con DM (con y sin RD) en comparación con los individuos sanos61. Investigaciones más recientes sugirieron una reducción significativa del área macular en pacientes con DM sin RD44,62,63.
Nuestro propio grupo realizó un análisis estructural de la retina (utilizando OCT Spectralis) en pacientes con DM sin signos fundoscópicos o de OCT de RD, demostrando una reducción importante del espesor macular en todos los sectores ETDRS64.
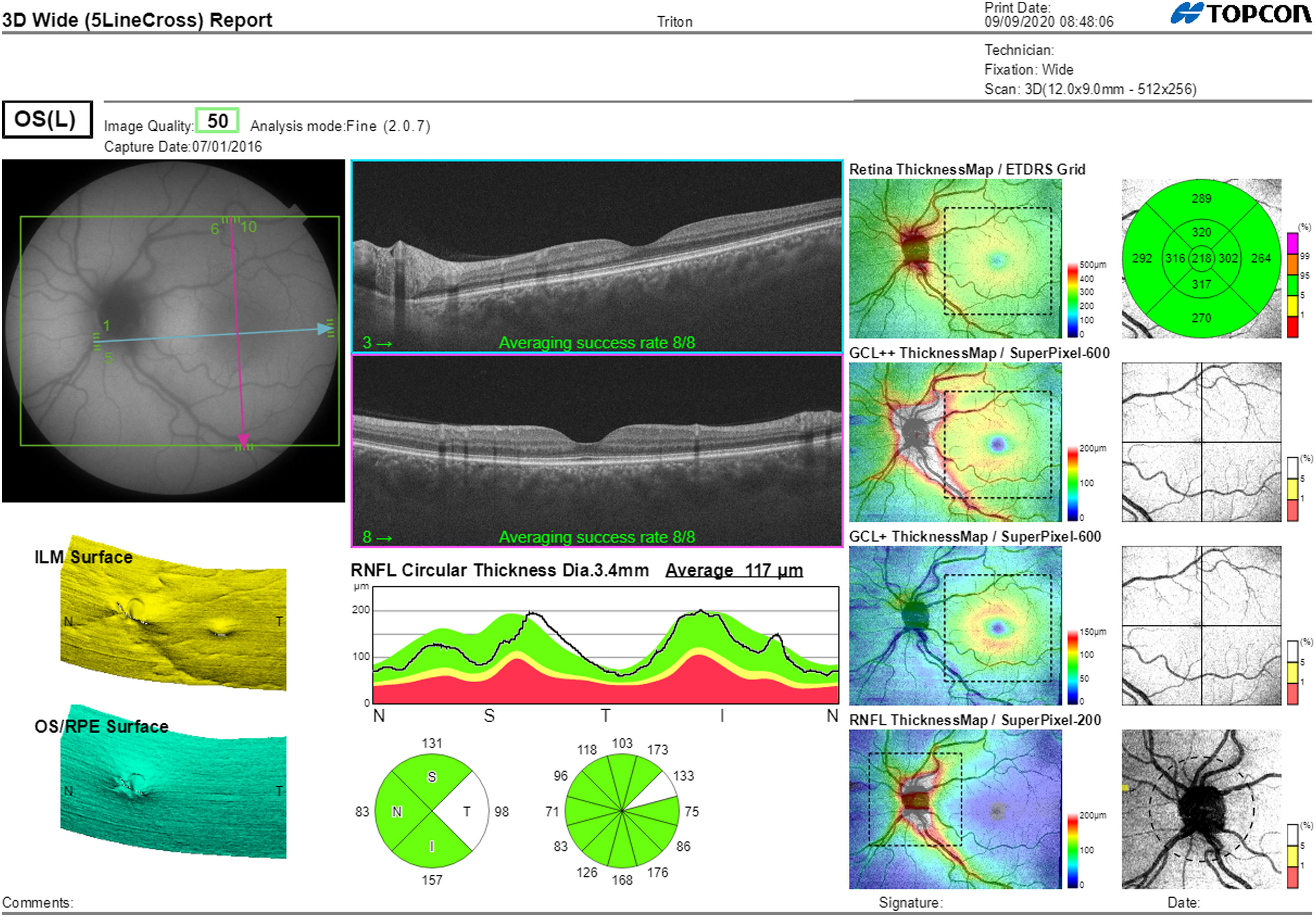
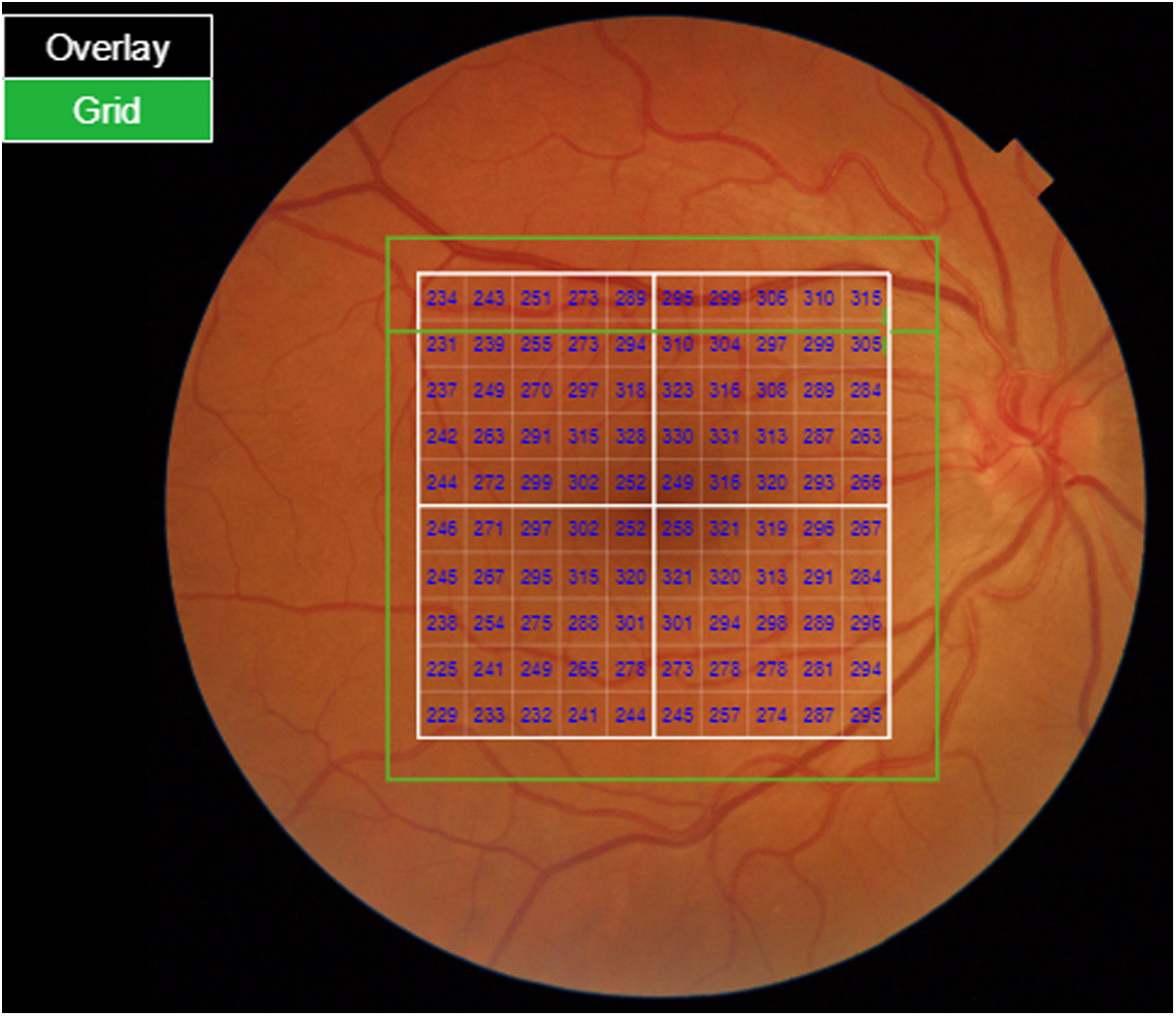
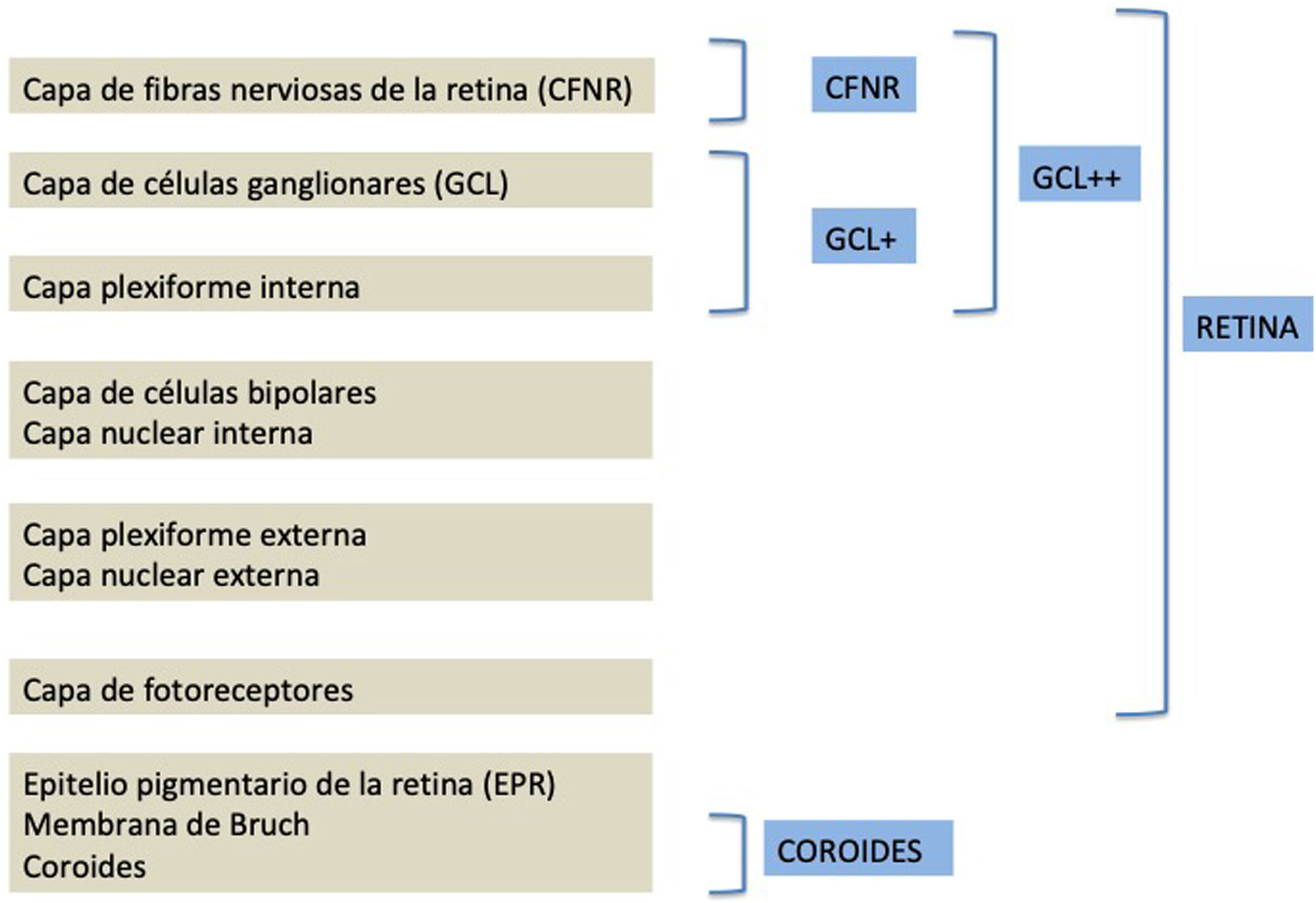
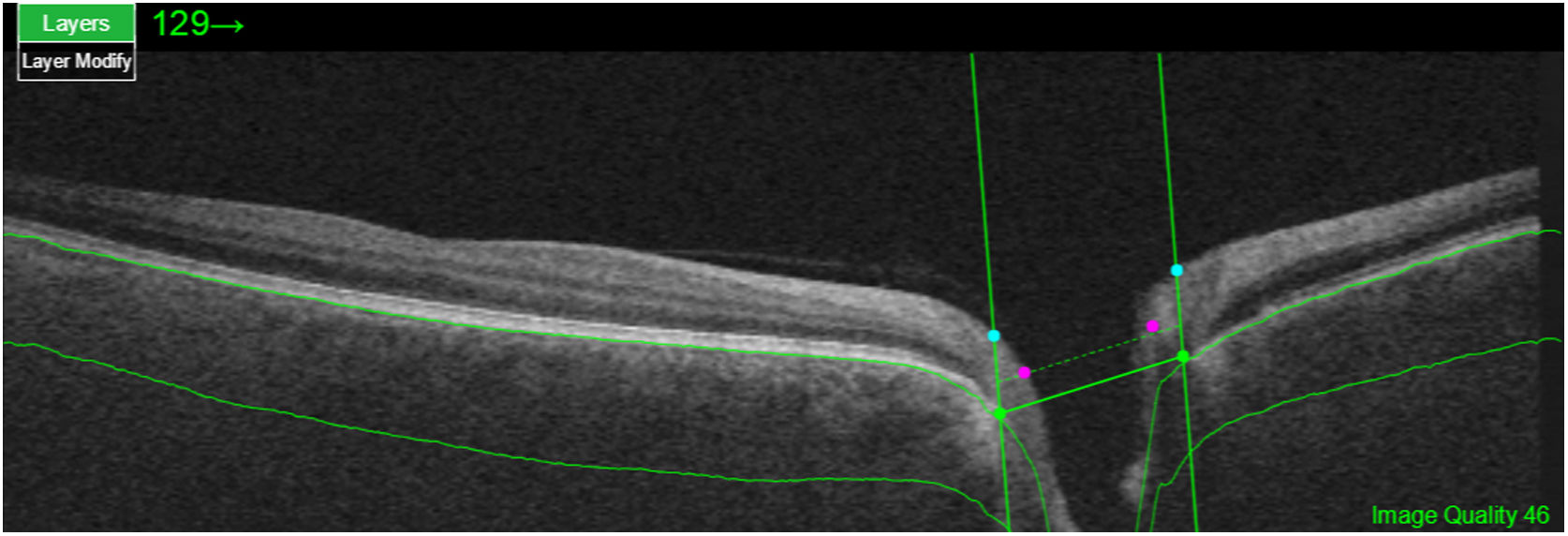
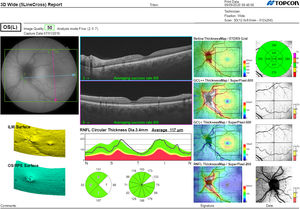
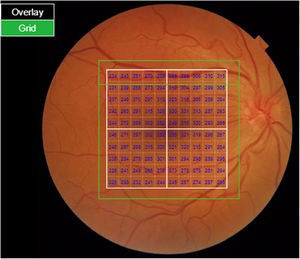
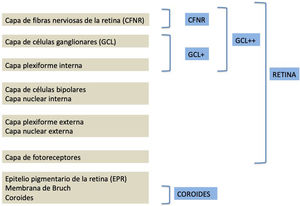
La segmentación de las diferentes capas maculares en pacientes con DM también ha demostrado resultados diferentes entre los estudios realizados: estudios recientes31,59,65,66 demostraron una reducción de la GCL del área macular en pacientes con DM (tipo 1 en los estudios de Scarinci et al. y Gundogan et al.) sin RD, pero algunos de ellos no pudieron encontrar diferencias en el espesor macular de la CFNR entre los grupos65,66. Otro estudio reciente encontró una reducción de la CFNR macular y de las células ganglionares en pacientes con DM tipo 2 sin RD, pero los cambios en el grosor de la CFNR no fueron significativos después de la corrección por edad para el grupo diabético67. Estos resultados sugieren que la neurodegeneración (es decir, la degeneración de las células ganglionares) está presente desde las primeras etapas de la DM, pero la pérdida axonal (la CFNR) en el área macular puede no ser detectable simultáneamente. En nuestro estudio con OCT Spectralis observamos una reducción en el grosor de GCL que afecta a todos los sectores (excepto a la fóvea) pero apenas observamos diferencias en el grosor macular de CFNR, lo que respalda los estudios mencionados anteriormente64. Más recientemente, nuestro grupo ha estudiado la retina de pacientes diabéticos utilizando la más novedosa tecnología SS-OCT con el dispositivo Triton (corporación Topcon, Tokio, Japón) que usa tecnología Deep Range Imaging (DRI)68. Incluimos en el estudio 60 pacientes con DM2 sin RD y 60 controles sanos. En los pacientes registramos la edad al momento diagnóstico, duración de la enfermedad, tratamientos prescritos y la presencia de complicaciones vasculares (macrovasculares: enfermedades cardiovasculares y cerebrovasculares, y microvasculares: neuropatía y nefropatía). Para realizar el análisis utilizamos el protocolo 3D Wide del dispositivo que incluye un amplio rango de exploración y que se enfoca tanto en la exploración macular (ETDRS) como en el área peripapilar (TSNIT: Temporal-Superior-Nasal-Inferior-Temporal) (fig. 2). Para realizar la segmentación macular utilizamos la aplicación Super Pixel Grid-600 del OCT Triton. Esta aplicación realiza mediciones del área macular subyacente a una cuadrícula compuesta de 100 celdas cada una de las cuales mide 600×600μm2 y proporciona un análisis automatizado de las diferentes capas de la retina en el área de la celda (fig. 3). Para el análisis, calculamos el valor medio para cada capa en 3zonas compuestas diferentes: total (T), que es la suma de todos los valores medios de las celdas dentro de la cuadrícula macular; superior (S), que es la suma de todos los valores medios de las celdas correspondientes a la mitad superior de la cuadrícula macular, y inferior (I), que es la suma de todos los valores medios correspondientes a la mitad inferior. Todos los sujetos de nuestro estudio fueron tratados mediante la evaluación para los protocolos ETDRS y TSNIT (este último incluye las siguientes capas: CFNR, la GCL+[que incluye mediciones entre la CFNR hasta los límites de la capa nuclear interna] y GCL++[entre la ILM y los límites de la capa nuclear interna] mediciones de espesor en los 4 cuadrantes básicos y los 6 sectores peripapilares), y análisis macular con la aplicación Super Pixel Grid-600 (que proporciona igualmente datos de las capas: retina completa, CFNR, GCL+, GCL++en las zonas T, S e I) (fig. 4). Obtuvimos también mediciones de espesor coroideo tanto para el área macular (ETDRS y análisis de rejilla) como el área peripapilar (fig. 5).
Las mediciones estructurales del área macular con el protocolo Wide (retina completa y espesor coroideo) mostraron un adelgazamiento retiniano significativo en pacientes con DM2 comparado con sujetos sanos en todas las áreas de ETDRS medidas, excepto en el exterior (sector T). El volumen macular total no mostró diferencias entre los grupos y el plexo coroideo no se redujo en pacientes en comparación con los controles. La segmentación del espesor macular utilizando la aplicación Super Pixel Grid-600 mostró una reducción significativa en pacientes con DM2 en todas las capas, lo que iría en concordancia con estudios previos68.
Resulta interesante mencionar que realizamos un análisis ANOVA post hoc para evaluar la influencia de la isquemia sistémica en estas mediciones y observamos que solo las diferencias en áreas externas del ETDRS y aquellas relacionadas con el GCL+(total y superior), el GCL++(total y superior) y CFNR (superior) se debieron únicamente a la DM2.
En general, la evaluación macular en pacientes con DM sin RD debe analizarse con precaución ya que el grosor macular (frecuentemente afectado por el edema macular que se produce en la RD) en pacientes con DM varía mucho con la evolución de la enfermedad y no tiene un comportamiento uniforme. El daño retiniano causado por la progresión de la enfermedad podría desencadenar una respuesta inmunitaria provocando una inflamación intra y extracelular, y cambios maculares secundarias a la presencia de edema. Además, las alteraciones vasculares pueden enmascarar otros procesos neurodegenerativos concomitantes que afectan a la misma zona de la retina69,70.
El área peripapilar contiene una mayor densidad de axones (CFNR) en comparación con el área macular y, por lo tanto, analizar las células ganglionares y el espesor de la CFNR en esta zona podría ser la mejor opción para detectar la neurodegeneración de manera temprana en estos pacientes siendo la ubicación óptima para evaluar la pérdida axonal causada por la enfermedad. Son muchos los estudios que han evaluado mediante OCT el espesor de la CFNR en el área peripapilar en pacientes con DM2 sin RD, encontrando así mismo un adelgazamiento significativo44,71. Varios autores han descrito una disminución en el espesor global de la CFNR en pacientes con DM2 sin RD59,62,72,73. Carpineto et al.73 demostraron daños adicionales en la CFNR, ya que observaron una reducción de la CFNR que afectaba a todos los cuadrantes peripapilares (superior, inferior, nasal y temporal). Sin embargo, esta reducción en el cuadrante inferior solo había sido publicada por Carpineto et al.73, Salvi et al.59 y recientemente por Mehboob et al.71 que son los que incluyeron es su estudio los tamaños muestrales más grandes.
Nuestro grupo analizó la CFNR peripapilar utilizando 2protocolos diferentes de OCT Spectralis: la aplicación de glaucoma (que es la que es más ampliamente utilizada en la clínica habitual): CFNR-G y la aplicación axonal (CFNR-N); este último protocolo fue diseñado específicamente para la evaluación de daños neurodegenerativos en el área peripapilar74,75. En nuestros pacientes, encontramos una reducción significativa del espesor de la CFNR en comparación con los controles no solo en el valor promedio, sino especialmente en los sectores ínfero-temporales. También encontramos reducción en el haz papilo-macular lo que sugiere una degeneración de la ruta axonal entre el disco óptico y las células ganglionares maculares64. Estos resultados también presentan correspondencia anatómica con la distribución de las células ganglionares maculares cuyos axones corresponden a la CFNR de los sectores temporal e inferior del disco óptico.
Esta afectación de los sectores temporales apenas había sido observada en estudios previos73 y los estudios más importantes sobre este tema no encontraron diferencias que afectasen al cuadrante temporal. Dado que el sector inferior es el que se ve afectado con mayor frecuencia por la hipoxia, es razonable encontrar una reducción significativa en este cuadrante. La reducción de las áreas temporales podría indicar además la presencia de neurodegeneración por diferentes causas distintas de la hipoxia, de manera similar a las observadas en las enfermedades neurodegenerativas76,77.
Al contrario que en el área macular, la GCL del área peripapilar apenas ha sido estudiada en sujetos con DM2 hasta la fecha. El análisis de la GCL a nivel de la papila aporta más información sobre la neurodegeneración en estos pacientes, dado que la CFNR se trata en su mayor parte de la prolongación axonal de las células ganglionares situadas a nivel macular, pero no aporta datos suficientes de los somas ganglionares del área peripapilar. En 2018, Şahin et al. encontraron alteraciones significativas en el cuadrante nasal de esta capa en un grupo de pacientes con prediabetes78. Nuestro grupo realizó el análisis peripapilar con el dispositivo OCT Triton y observamos una reducción significativa en el grupo de pacientes que afectaba al espesor de CFNR promedio, superior, inferior e ínfero-temporal. Sin embargo, solo el cuadrante inferior era independiente de la isquemia sistémica. También observamos una reducción significativa en la capa GCL++(apenas evaluado por investigaciones anteriores) que afectaba a diferentes sectores pero estos cambios también estaban influidos por la isquemia sistémica en estos pacientes68.
Como previamente ha sido expuesto, nuestro grupo evaluó si la isquemia sistémica tiene algún papel en la degeneración retiniana en estos pacientes. Los pacientes con complicaciones vasculares sistémicas crónicas presentaron una reducción adicional de la CFNR y de la capa GCL+en el cuadrante temporal, lo que sugiere que la isquemia sistémica contribuye a un mayor daño en la neurodegeneración retiniana. Asimismo, el espesor de GCL+se redujo en el grupo con mayor duración de la enfermedad, lo que indica la presencia de diferentes factores que contribuyen al daño neuronal. En nuestro estudio la isquemia sistémica se consideró un factor de confusión que afecta a las mediciones de la retina, lo que podría incluso explicar las diferencias entre los estudios publicados anteriormente. Observamos que las complicaciones isquémicas sistémicas en estos pacientes podrían explicar varias áreas que presentan adelgazamiento de la retina y, por tanto, podrían afectar a los resultados globales.
Estos resultados deben, sin embargo, ser analizados con cautela ya que en nuestro estudio no evaluamos la isquemia retiniana ni con angiografía fluoresceínica ni con angiografía-OCT (OCTA), es decir, no incluimos pruebas puramente vasculares para determinar la presencia o ausencia de alteraciones vasculares e isquemia retiniana no observables mediante fundoscopia u OCT/retinografía. A pesar de ello, resulta interesante resaltar que cuando se tiene en cuenta el factor isquemia sistémica, la cual puede reflejar una isquemia subyacente en la retina, se obtienen resultados diferentes68; esto sugiere una posible alteración microvascular en estos pacientes que eventualmente contribuye a la neurodegeneración retiniana y que abre la puerta a nuevos estudios que incluyan nuevas técnicas de evaluación de la microvascularización de las capas internas de la retina.
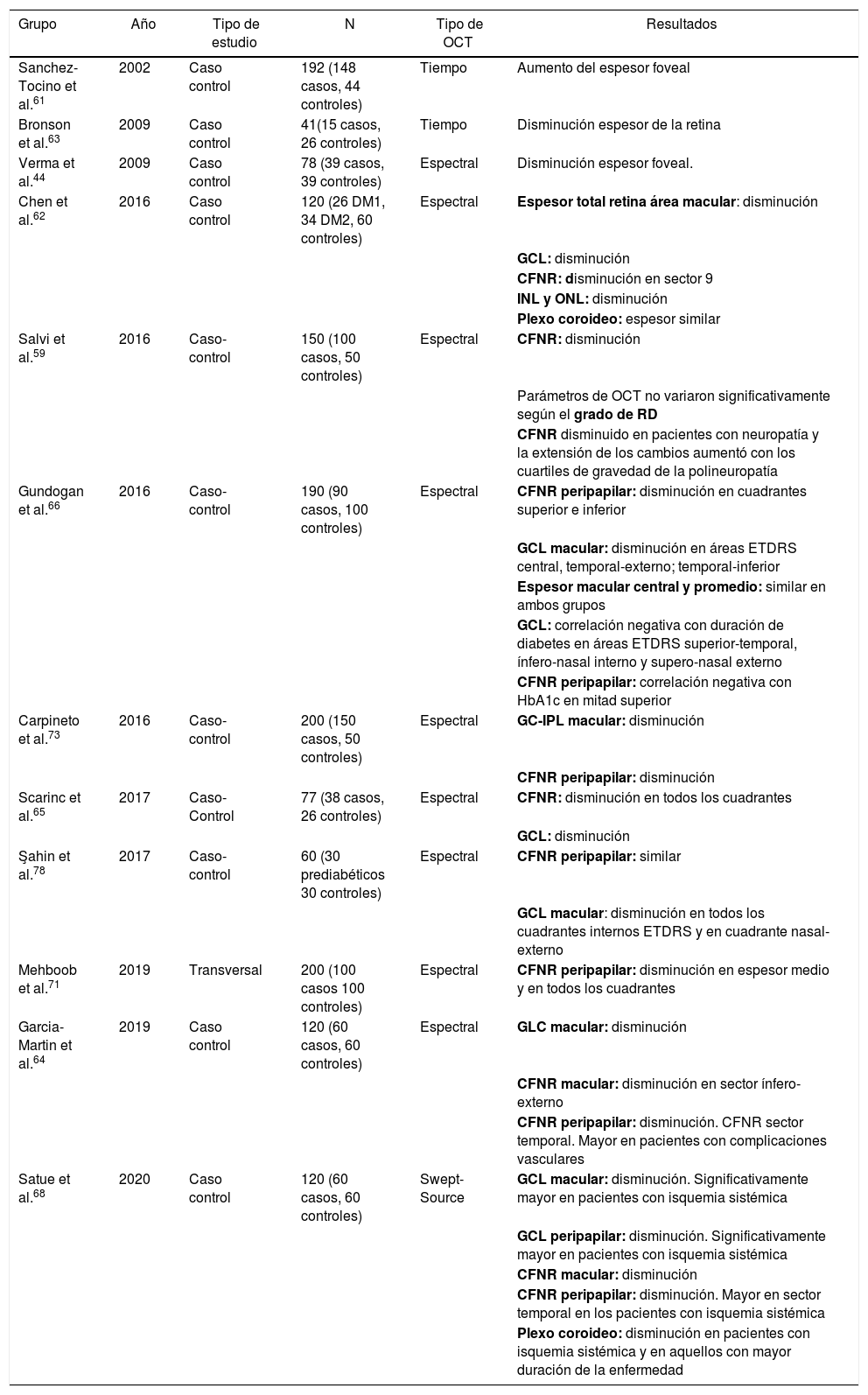
En la figura 6 y en la tabla 2 se exponen de manera resumida los principales estudios que han sido publicados hasta la fecha sobre estructura de la retina (estudiada mediante OCT) y neurodegeneración en pacientes con DM2.
Resumen esquemático de la evolución de los distintos dispositivos de tomografía de coherencia óptica (OCT), sus características y los principales resultados obtenidos en pacientes diabéticos tipo 2 sin retinopatía diabética.
CFNR: capa de fibras nerviosas de la retina; GCL: capa de células ganglionares; INL: capa nuclear interna; ONL: capa nuclear externa.
Resultados de los principales estudios publicados sobre estructura de la retina y neurodegeneración retiniana en pacientes con DM2
| Grupo | Año | Tipo de estudio | N | Tipo de OCT | Resultados |
|---|---|---|---|---|---|
| Sanchez-Tocino et al.61 | 2002 | Caso control | 192 (148 casos, 44 controles) | Tiempo | Aumento del espesor foveal |
| Bronson et al.63 | 2009 | Caso control | 41(15 casos, 26 controles) | Tiempo | Disminución espesor de la retina |
| Verma et al.44 | 2009 | Caso control | 78 (39 casos, 39 controles) | Espectral | Disminución espesor foveal. |
| Chen et al.62 | 2016 | Caso control | 120 (26 DM1, 34 DM2, 60 controles) | Espectral | Espesor total retina área macular: disminución |
| GCL: disminución | |||||
| CFNR: disminución en sector 9 | |||||
| INL y ONL: disminución | |||||
| Plexo coroideo: espesor similar | |||||
| Salvi et al.59 | 2016 | Caso-control | 150 (100 casos, 50 controles) | Espectral | CFNR: disminución |
| Parámetros de OCT no variaron significativamente según el grado de RD | |||||
| CFNR disminuido en pacientes con neuropatía y la extensión de los cambios aumentó con los cuartiles de gravedad de la polineuropatía | |||||
| Gundogan et al.66 | 2016 | Caso-control | 190 (90 casos, 100 controles) | Espectral | CFNR peripapilar: disminución en cuadrantes superior e inferior |
| GCL macular: disminución en áreas ETDRS central, temporal-externo; temporal-inferior | |||||
| Espesor macular central y promedio: similar en ambos grupos | |||||
| GCL: correlación negativa con duración de diabetes en áreas ETDRS superior-temporal, ínfero-nasal interno y supero-nasal externo | |||||
| CFNR peripapilar: correlación negativa con HbA1c en mitad superior | |||||
| Carpineto et al.73 | 2016 | Caso-control | 200 (150 casos, 50 controles) | Espectral | GC-IPL macular: disminución |
| CFNR peripapilar: disminución | |||||
| Scarinc et al.65 | 2017 | Caso-Control | 77 (38 casos, 26 controles) | Espectral | CFNR: disminución en todos los cuadrantes |
| GCL: disminución | |||||
| Şahin et al.78 | 2017 | Caso-control | 60 (30 prediabéticos 30 controles) | Espectral | CFNR peripapilar: similar |
| GCL macular: disminución en todos los cuadrantes internos ETDRS y en cuadrante nasal-externo | |||||
| Mehboob et al.71 | 2019 | Transversal | 200 (100 casos 100 controles) | Espectral | CFNR peripapilar: disminución en espesor medio y en todos los cuadrantes |
| Garcia-Martin et al.64 | 2019 | Caso control | 120 (60 casos, 60 controles) | Espectral | GLC macular: disminución |
| CFNR macular: disminución en sector ínfero-externo | |||||
| CFNR peripapilar: disminución. CFNR sector temporal. Mayor en pacientes con complicaciones vasculares | |||||
| Satue et al.68 | 2020 | Caso control | 120 (60 casos, 60 controles) | Swept-Source | GCL macular: disminución. Significativamente mayor en pacientes con isquemia sistémica |
| GCL peripapilar: disminución. Significativamente mayor en pacientes con isquemia sistémica | |||||
| CFNR macular: disminución | |||||
| CFNR peripapilar: disminución. Mayor en sector temporal en los pacientes con isquemia sistémica | |||||
| Plexo coroideo: disminución en pacientes con isquemia sistémica y en aquellos con mayor duración de la enfermedad |
CFNR: capa de fibras nerviosas de la retina; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; ETDRS: Early Treatment Diabetic Retinopathy Study; GCL: capa de células ganglionares; HbA1: hemoglobina glicada; INL: capa nuclear interna; IPL: plexiforme interna; OCT: tomografía de coherencia óptica; ONL: capa nuclear externa.
En negrita, capas y sectores de la retina en los que se han detectado cambios.
A pesar de que los estudios comentados sugieren la presencia de una degeneración neuronal clara, existe cierta discordancia en algunos aspectos referidos al espesor de la retina en pacientes con DM que no presentan RD. Varios estudios no han encontrado diferencias entre diabéticos sin lesiones de RD y la población sana en el espesor de la CFNR13,20 o encuentran diferencias únicamente en el subgrupo con DM263, pero no en el subgrupo con DM1. La llamativa disparidad en los resultados de estos estudios puede explicarse por la heterogeneidad del diseño de los mismos, los cuales incluyen a menudo a diabéticos tipo 1 y tipo 2, con y sin RD, y a los diferentes dispositivos de OCT empleados para el análisis estructural. Muchos de estos estudios se realizaron con dispositivos de OCT antiguos, con menor capacidad resolutiva que los actuales Swept Source u OCT de dominio espectral.
Uno de los estudios más grandes que se ha realizado sobre los cambios observados mediante OCT en pacientes con DM concluyó que el adelgazamiento de la retina en estos pacientes está causado tanto por alteraciones vasculares como por neurodegeneración y sugiere 2 fenotipos diferentes, uno vascular (en el que la neurodegeneración no está presente o tiene un papel mínimo) y el otro (hasta el 60% de los pacientes) más propenso a la neurodegeneración sin alteraciones vasculares13. Sin embargo, no estableció si las alteraciones microvasculares (subclínicas) desempeñaron un papel importante en la patogenia de los cambios retinianos en el fenotipo neurodegenerativo ni si los pacientes con cambios neurodegenerativos son más propensos a desarrollar enfermedad microvascular.
Los resultados de los recientes estudios llevados a cabo por nuestro grupo sugieren que, en pacientes con DM no severa, temprana y tipo 2 sin RD y buen control metabólico, está presente una neurodegeneración causada por DM que afecta especialmente a las neuronas en el área macular y a la CFNR en el cuadrante inferior del disco óptico. Además, sugieren que la isquemia sistémica podría ser un factor importante que contribuye a la neurodegeneración en la DM2. Nuestros resultados se suman a las evidencias previas de neurodegeneración observadas por otros grupos de trabajo, y proporcionan nuevos datos sobre el GCL peripapilar que apenas fueron evaluados por investigadores anteriores. OCT Triton proporciona imágenes de gran calidad y realiza una segmentación automatizada de la coroides, lo que facilita el estudio de esta capa vascular en pacientes con DM2. El futuro de los estudios sobre la neurodegeneración retiniana en estos pacientes se prevé que se centrará en la utilización de nuevas técnicas de imagen como la OCT-A para establecer el posible papel de las alteraciones vasculares subclínicas en la patogénesis de la neurodegeneración retiniana.
La detección de esta neurodegeneración en etapas tempranas de la DM2 podría tener implicaciones terapéuticas importantes ya que parece razonable pensar que estos pacientes se beneficiarían de estrategias terapéuticas basadas en la neuroprotección. Esto abre la posibilidad de desarrollar una terapia tópica o sistémica con fármacos neuroprotectores en las primeras etapas de la RD, donde las terapias de las que disponemos actualmente (como la fotocoagulación laser o las inyecciones intravítreas) no tienen ningún papel.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.