El síndrome de intestino irritable (sii) es un trastorno funcional crónico del tubo digestivo que cursa con molestia o dolor abdominal, diarrea o constipación, distensión abdominal y otros síntomas intestinales. Aunque no se conoce una causa única del sii, recientemente se ha enfatizado la participación de las bacterias en su fisiopatología, sobre todo por la presentación del sii después de infecciones gastrointestinales. La presencia de sobrecrecimiento bacteriano en el intestino delgado y modificaciones de la microbiota intestinal pueden provocar microinflamación intestinal, alteraciones de la motilidad intestinal, hipersensibilidad visceral y producción excesiva de gas, que serían los causantes de los síntomas. La respuesta clínica prolongada después del uso de antibióticos no absorbibles de amplio espectro, especialmente la rifaximina, apoya el concepto y ofrece un tratamiento adicional para muchos pacientes.
The Irritable Bowel Syndrome (ibs) is a chronic functional disorder of the digestive tract which courses with discomfort or abdominal pain, diarrhea or constipation, bloating and other intestinal symptoms. Although a unique cause of ibs is unknown, recently it has been emphasized the participation of the bacteria in its pathophysiology, especially by the presentation of the ibs after gastrointestinal infections. The presence of bacterial overgrowth in the small intestine and changes of the intestinal micro-biota may cause intestinal micro-inflammation, alterations of intestinal motility, visceral hypersensitivity and excessive production of gas, which would be the cause of the symptoms. A longer clinical response after the use of non absorbable antibiotics of wide spectrum, especially rifaximina, supports the concept and provides an additional treatment for many patients.
O Síndrome do intestino irritável (sii) é uma doença crônica funcional do trato digestivo que causa desconforto ou dor abdominal, diarréia ou prisão de ventre, distensão abdominal e outros sintomas intestinais. Embora não haja nenhuma causa conhecida único do sii, destacouse recentemente o envolvimento de uma bactéria na fisiopatologia, especialmente quando há apresentação da sii após infecções gastrointestinais. A presença de crescimento bacteriano no intestino delgado, e as modificações de flora microbiana intestinal pode causar microinflamação intestinal, alteração da motilidade intestinal, hipersensibilidade visceral e excesso de produção de gás, o que seria responsável pelos sintomas. A resposta clínica após utilização prolongada de antibióticos de largo espectro não-absorvível, particularmente rifaximina apoia o conceito e proporciona um tratamento adicional para muitos pacientes.
Con este título, la primera idea que viene a la mente es ¡qué absurdo! ¡Si el síndrome de intestino irritable no es una enfermedad infecciosa! Sin embargo, recientemente se han publicado diversos artículos científicos sólidos que apoyan la participación de las bacterias en la génesis de este síndrome y la utilización de antibióticos en su tratamiento; algunos de esos artículos pertenecen a investigadores mexicanos.1
El síndrome de intestino irritable (sii), llamado también por muchos años síndrome de colon irritable, es una de las alteraciones funcionales del tubo digestivo (tabla 1). Éstas son entidades clínicas con síntomas más o menos distintivos, pero sin sustratos anatómicos, bioquímicos o fisiopatológicos suficientemente sensibles y específicos que permitan por sí solos hacer el diagnóstico de certeza. Por lo tanto, el diagnóstico se sostiene con bases clínicas. El sii se manifiesta por dolor o malestar abdominal asociado con alteraciones en el hábito intestinal (diarrea o constipación o mixto) y otros síntomas como distensión abdominal, sensación de evacuación incompleta, urgencia de evacuar y pujo. Con objeto de unificar los criterios de diagnóstico del sii, en el Congreso Mundial de Gastroenterología que se llevó a cabo en Roma en 1989 se reunieron expertos en el tema y acordaron ciertos datos diagnósticos del sii llamados “criterios de Roma”; posteriormente se celebraron nuevas reuniones que actualizaron los primeros y dieron lugar a los criterios de Roma ii y a los últimos criterios de Roma iii (tabla 2). Estos criterios orientan el diagnóstico y permiten que los médicos, investigadores o clínicos hablen en todo el mundo de la misma entidad.2 Dependiendo de las características de las evacuaciones el sii puede clasificarse del siguiente modo: con predominio de diarrea (sii-d), con predominio de constipación (sii-c), con ambos en forma alterna o mixto (sii-a o sii-m) y no clasificable (sii-u). Se consideran síntomas de apoyo por su alta frecuencia, pero no forman parte de los criterios de Roma iii: sensación de distensión abdominal, sensación de evacuación incompleta, esfuerzo al defecar, urgencia para defecar y presencia de moco en las heces.
Trastornos funcionales del tubo digestivo
| A. | Trastornos funcionales esofágicos: pirosis funcional, dolor torácico funcional de supuesto origen esofágico, disfagia funcional, globus |
| B1. | Trastornos funcionales gastroduodenales: dispepsia funcional, síndrome de molestia postprandial, síndrome de dolor postprandial |
| B2. | Trastornos de eructos: aerofagia, eructos excesivos no especificados |
| B3. | Trastornos de náuseas y vómitos: náusea crónica idiopática, vómitos funcionales, síndrome de vómito cíclico |
| B4. | Síndrome de rumiación |
| C. | Trastornos funcionales intestinales |
| C1. | Síndrome de intestino irritable |
| C2. | Distensión abdominal funcional |
| C3. | Constipación funcional |
| C4. | Diarrea funcional |
| C5. | Trastornos intestinales funcionales no especificados |
| D. | Síndrome de dolor abdominal funcional |
| E. | Trastornos funcionales de la vesícula biliar y del esfínter de Oddi: vesicular, de Oddi biliar, de Oddi pancreático |
| F. | Trastornos funcionales ano-rectales: incontinencia fecal funcional, dolor ano-rectal funcional (proctalgia crónica, síndrome de elevador del ano, proctalgia fugax), trastornos funcionales de la defecación (defecación disinérgica, propulsión defecatoria inadecuada) |
| G. | Trastornos funcionales en la infancia (hasta lactantes) |
| H. | Trastornos funcionales en la niñez (desde preescolares) y adolescencia |
Criterios de Roma iii para el diagnóstico del sii
Dolor abdominal o molestia abdominal recurrente por al menos tres días al mes, en los últimos tres meses, asociado con dos o más de los siguientes:
|
| Los criterios deben cumplirse en los últimos tres meses, el inicio seis meses o más antes del diagnóstico |
| Molestia se refiere a sensación desagradable no descrita como dolor En investigación los síntomas deben estar presentes por lo menos dos días a la semana |
Síntomas de apoyo (no son requisitos ni criterios de Roma):
|
El sii es muy frecuente: en México afecta entre 16 y 35% de la población general3 y suele ser un problema crónico ya que 75% de los pacientes sigue teniendo síntomas de sii a los cinco años después del diagnóstico,4 el cual puede deteriorar la calidad de vida tanto como la depresión u otras enfermedades crónicas.
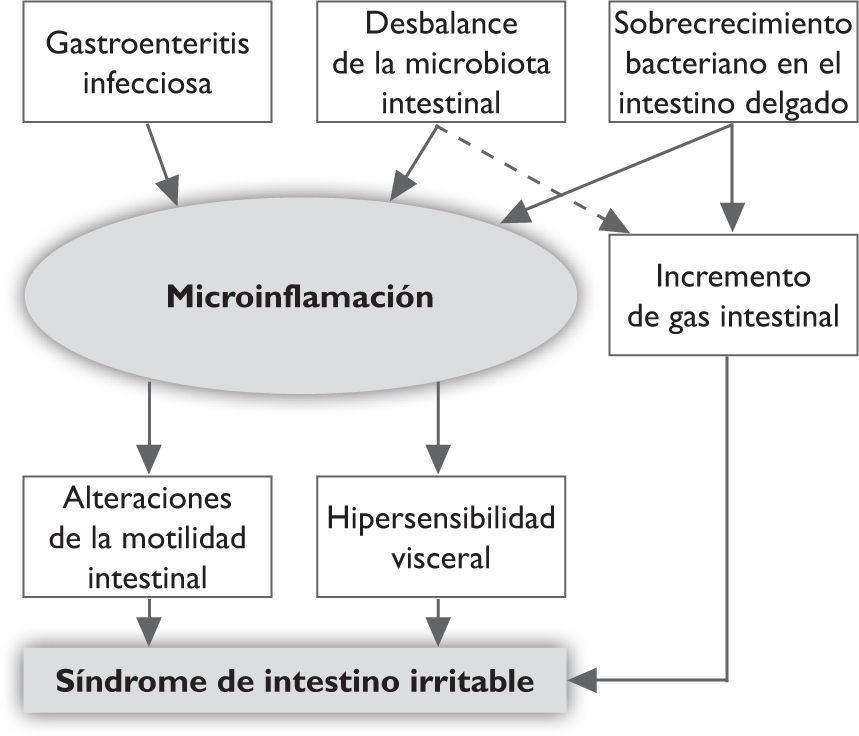
No se reconoce una causa única del sii, pero desde hace varias décadas se ha observado la participación de factores psicológicos como depresión, ansiedad y estrés; posteriormente se demostraron anormalidades en la motilidad intestinal, hipersensibilidad visceral dolorosa ante la distensión y en la última década se le ha dado más importancia a la participación de las bacterias en la producción de gas y en la microinflamación de la mucosa intestinal, en especial del colon.
¿Una infección puede causar el sii? El sii postinfecciosoDesde 1994 se ha publicado una serie de observaciones en la que cierta proporción de pacientes que había sufrido una gastroenteritis aguda infecciosa desarrolló siide novo. Una revisión sistemática de este tema, con metaanálisis, la realizaron Thabane y cols. en 2007.5 En 2010 se publicó información relevante en cuanto al seguimiento durante ocho años de pacientes con sii postinfeccioso: en Walkerton, Canadá, ocurrió una contaminación del agua potable (E. coli, Campylobacter jejuni y otras bacterias) que produjo diarrea aguda en 2 069 individuos, de los cuales 36.2% había desarrollado sii; luego de dos a tres años de observación, 28.3% tenía el síndrome de acuerdo con los criterios de Roma i (un grupo control sin el antecedente tenía 10.1%, p<0.0001); ocho años después del episodio agudo aún había sii en 15.4%, significativamente mayor que en la población control.6 También se ha informado que la diarrea por virus puede ser seguida por sii.7
Hasta aquí la evidencia epidemiológica parecía contundente, pero faltaba la demostración experimental. Recientemente un experimento en ratas demostró que la infección aguda por Campylobacter jejuni es capaz de provocar irregularidades en la frecuencia de las evacuaciones y en la consistencia de las heces tres meses después de curada la infección y que estas alteraciones pueden prevenirse con la administración oportuna de rifaximina.8
Entonces, ya que las infecciones gastrointestinales son muy comunes, especialmente en nuestro país, ¿existe la posibilidad de que todos los casos de sii se hayan desencadenado por una infección que no se hubiera reconocido? Aunque esta posibilidad no se puede excluir, la mayoría de los pacientes con sii no tiene antecedentes reconocibles de haber iniciado el síndrome después de una infección gastrointestinal. Además, la prevalencia del sii en países con menor frecuencia de gastroenteritis bacterianas no parece ser muy diferente de la observada en México.9 La interpretación es que una infección gastrointestinal aguda, sin importar el tipo de agente infeccioso, puede desencadenar alteraciones de la función intestinal, compatibles con el sii, sobre todo en personas con alguna predisposición.
Se han descrito dos tipos de alteraciones de las bacterias intestinales en el sii: sobrecrecimiento bacteriano del intestino delgado y composición anormal de la microbiota.
a) Sobrecrecimiento bacteriano en el siiEn condiciones normales la población bacteriana en el intestino delgado es relativamente escasa (~102/ml), en comparación con la que se encuentra en el íleon distal (~107/ml) y en el colon (~1011/ml). Cuando la concentración de bacterias en el yeyuno proximal aumenta, los carbohidratos que aún no se han digerido y absorbido son fermentados por bacterias que se encuentran en concentración anormalmente alta, produciendo gas (hidrógeno y metano principalmente). La cuantificación de bacterias en el líquido aspirado yeyunal y la medición del hidrógeno espirado después de la administración de lactulosa o de glucosa (prueba de aliento con lactulosa o glucosa) permiten hacer el diagnóstico de sobrecrecimiento bacteriano en el intestino delgado (o sibo=Small Intestinal Bacterial Overgrowth).10 La frecuencia de sibo en el sii es variable dependiendo del método utilizado, pero el hallazgo constante es una mayor prevalencia de sibo en el sii en comparación con los grupos control sin sii.
b) Alteración de la microbiota intestinalEl análisis de la microbiota intestinal, o de las heces, en múltiples investigaciones ha mostrado diferencias en comparación con los individuos sanos. Los resultados han sido distintos en cuanto a las zonas geográficas y a los métodos microbiológicos utilizados, pero las alteraciones más constantes son disminución de la proporción de bifidobacterias y bacteroidetes en general, con incremento relativo de lactobacilos y firmicutesen general.11,12
¿Cómo influyen las bacterias en la función intestinal? En el gasLas bacterias son la principal fuente de gas intestinal, y ya que la distensión y flatulencia son síntomas comunes del sii, la inferencia es que al menos la distensión se relaciona con alteraciones de la microbiota. Desde 1998 se demostró que en el sii existe una fermentación anormal con incremento en la producción de gas, específicamente hidrógeno.13 En efecto, con métodos radiográficos se pudo determinar que en los individuos con sii existe significativamente un mayor volumen de gas intestinal que en los controles.14
En la motilidadExisten diversas demostraciones de las alteraciones de la motilidad intestinal en el sii, sobre todo de la frecuencia y duración de las contracciones de la fase iii interdigestiva, aunque también de la fase ii y de la postprandial, en especial en relación con la presencia de sibo.15–17
La microinflamaciónSe ha publicado un sinnúmero de investigaciones que apoyan la presencia de modestos cambios inflamatorios en el sii, particularmente incremento de células cebadas activadas (mastocitos activados) en la cercanía de terminaciones nerviosas que explicarían la hipersensibilidad ya que correlacionan con la presencia de dolor abdominal.18 Recientemente Matricon y cols.,19 en una extensa revisión del tema, concluyeron que existe un incremento de mastocitos y de triptasa de mastocitos (signo de activación) en la mucosa del íleon, ciego y colon de los pacientes con sii en comparación con los controles, así como un aumento de linfocitos circulantes de origen intestinal (integrina β1+) y alteraciones en la secreción de citosinas. Asimismo, en el sii existe un incremento de la permeabilidad asociado con una disminución de proteínas de unión estrecha en la pared intestinal.
La interpretación de estos datos es que los trastornos en las bacterias intestinales, ya sea por bacterias patógenas como en el sii postinfeccioso, por incremento de bacterias normales en el intestino delgado (sibo) o por desproporción entre los distintos tipos de bacterias normales (microbiota), son capaces de elevar la producción de gas y alterar la motilidad intestinal y la sensibilidad al dolor llevando al sii; lo anterior estaría mediado por leves cambios inflamatorios en la pared intestinal, especialmente del colon20 (figura 1).
Fisiopatología propuesta del sii
Además de la evidencia experimental de la prevención de un modelo murino de sii, mencionado previamente, diversas investigaciones mostraron la eficacia de los antimicrobianos, específicamente la rifaximina, en la erradicación del sibo,21 así como en la mejoría de los síntomas relacionados con flatulencia y distensión abdominal con la administración de rifaximina durante 10 días.22 El tratamiento con otros antimicrobianos (clortetraciclina, neomicina, metronidazol) en pacientes con sibo ha presentado menores tasas de erradicación que con rifaximina.23–25
Existen diversos estudios doble ciegos, comparativos con placebo, que demuestran que un curso de tratamiento con rifaximina durante 10 a 14 días mejora los síntomas del sii y que la mejoría persiste durante tres meses de observación posteriores al tratamiento.26–28 No hay investigaciones semejantes con otros antimicrobianos.
¿Entonces los antibióticos no absorbibles curan el sii? Hasta el momento sólo puede asegurarse que el tratamiento antibiótico produce una mejoría prolongada de los síntomas, puede haber recaídas y requerirse un nuevo tratamiento antimicrobiano. ¿Y si hay una recaída se puede recibir nuevamente rifaximina? El único estudio que valora la eficacia del retratamiento analiza un grupo de pacientes con sii que requirió un nuevo tratamiento de uno a 42 meses después del previo, unos pocos fueron tratados nuevamente hasta cinco veces, pero la tasa de respuesta se mantuvo alta en cada ocasión,29 en concordancia con la ausencia de resistencia bacteriana de relevancia clínica, ya que las bacterias que desarrollan resistencia a este antibiótico desaparecen rápidamente del intestino, permitiendo el tratamiento cíclico sin pérdida de eficacia.30
Una revisión técnica de gastroenterólogos mexicanos del tratamiento farmacológico del sii en el año 2010 recomienda el uso de rifaximina, de antiespasmódicos y de antidepresivos tricíclicos para el control del dolor y en algunos casos de serotoninérgicos.31 Incluso antes del gran estudio target (n=1 260 pacientes) de Pimentel y cols.,27 las guías clínicas de la Asociación Mexicana de Gastroenterología y las del American College of Gastroenterology ya proponían a la rifaximina en el tratamiento del sii.32,33 Sin duda, éste es un recurso terapéutico importante en el sii.
ConclusionesLa participación de las bacterias en la fisiopatología del sii parece indudable y apoya la utilización de antimicrobianos en su tratamiento. Las evidencias actuales sugieren que un curso de tratamiento con el antibiótico no absorbible rifaximina, durante 10 a 14 días, es capaz de mejorar el cuadro clínico por tiempo prolongado y podría emplearse como medida terapéutica inicial en la mayoría de los casos.
Este artículo debe citarse: Frati-Munari AC. ¿Antimicrobianos para el síndrome de intestino irritable? Aten Fam. 2013;20(4):123–126.