La relación entre los anticonceptivos orales (ACO) y la enfermedad tromboembólica venosa (ETEV) es conocida desde la década de los sesenta1, y se ha demostrado en todos los estudios en que se ha investigado2,3
Introducción
La relación entre los anticonceptivos orales (ACO) y la enfermedad tromboembólica venosa (ETEV) es conocida desde la década de los sesenta1, y se ha demostrado en todos los estudios en que se ha investigado2,3. El esperado descenso del riesgo trombótico ocasionado por la reducción del contenido estrogénico (< 35 mg de etinilestradiol) en los modernos anticonceptivos se ha visto compensado por su asociación con los nuevos progestágenos de menor acción androgénica (los conocidos como gestágenos de tercera generación); por esta razón, el riesgo de ETEV no se ha reducido con estos nuevos ACO e incluso se ha visto aumentado4-6.
La relación entre los anticonceptivos orales (ACO) y la enfermedad tromboembólica venosa (ETEV) es conocida desde la década de los sesenta 1 , y se ha demostrado en todos los estudios en que se ha investigado 2,3 |
La patogenia de las complicaciones trombóticas producidas por estos agentes ACO no es del todo conocida; producen una activación tanto del sistema de la hemostasia como de la fibrinólisis, así como la inducción de un fenotipo resistencia a la proteína C activada similar al de los portadores heterocigotos de la mutación factor V Leiden (FVL) y al que se ha concedido de forma reciente importancia patogénica. Todos los cambios inducidos en las variables hemostáticas mencionadas son mayores con los ACO de tercera generación (en especial, aquellos que contienen desogestrel)7,8.
La patogenia de las complicaciones trombóticas producidas por estos agentes ACO no es del todo conocida; producen una activación tanto del sistema de la hemostasia como de la fibrinólisis, así como la inducción de un fenotipo resistencia a la proteína C activada similar al de los portadores heterocigotos de la mutación factor V Leiden (FVL) |
La incidencia basal de ETEV (que incluye la trombosis venosa profunda [TVP] y la tromboembolia pulmonar) en mujeres jóvenes que no consumen ACO oscila entre 0,4 y 0,8 por 10.000 mujeres y año4-6. En mujeres que consumen ACO con bajas dosis de estrógenos esta incidencia se eleva a 3 por 10.000 mujeres y año, lo que supone que se puede esperar entre 20 y 40 casos anuales de ETEV no mortal por cada 100.000 mujeres que siguen dicho tratamiento9. La mortalidad por ETEV en mujeres jóvenes en tratamiento anticonceptivo es de alrededor del 1%10.
Por tanto, comprobamos que el riesgo absoluto de ETEV en mujeres en tratamiento ACO es bajo, pero no debe ignorarse en determinados grupos de mujeres que, debido a sus características particulares, poseen una mayor predisposición trombótica. No se ha comprobado una influencia del uso creciente de los ACO de tercera generación sobre las tasas de mortalidad global de mujeres jóvenes, pero existen sendos estudios inquietantes realizados en los Países Bajos y el Reino Unido que sugieren que estos agentes podrían aumentar la mortalidad por ETEV en mujeres jóvenes, siendo este efecto más acusado entre los grupos de menor edad11,12; no obstante, estos hallazgos precisan aún confirmación.
Todos los cambios inducidos en las variables hemostáticas mencionadas son mayores con los ACO de tercera generación (en especial, aquellos que contienen desogestrel)7,8 |
El riesgo trombótico es mayor con los preparados que contienen gestágenos de tercera generación (en especial el desogestrel)4-6,13 y durante las etapas iniciales del tratamiento (entendidas como el primer año y, muy especialmente, los primeros 6 meses del mismo)2; igualmente, este riesgo es mayor en mujeres que consumen ACO por primera vez2,14, en aquellas con un índice de masa corporal elevado (> 25 kg/m2)2, antecedentes de hipertensión durante el embarazo2 o defectos trombofílicos. No parece, sin embargo, que la edad2, la obesidad15, la historia familiar previa de trombosis5 o la duración del tratamiento anticonceptivo16 supongan factores de riesgo trombótico asociados en estas mujeres. Es interesante destacar que dicho riesgo desaparece una vez que se interrumpe el tratamiento2.
El riesgo absoluto de ETEV en mujeres en tratamiento ACO es bajo, pero no debe ignorarse en determinados grupos de mujeres que, debido a sus características particulares, poseen una mayor predisposición trombótica. No se ha comprobado una influencia |
Riesgo trombótico asociado al uso de ACO en mujeres con trombofilia congénita
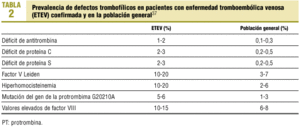
La interacción entre factores ambientales y defectos trombofílicos congénitos (tabla 1) constituye uno de los binomios clave en la patogenia de la ETEV; en la tabla 2 se recoge la prevalencia de estos defectos en población general y con ETEV. Los ACO constituyen un factor ambiental, cuya asociación con los defectos trombofílicos produce un incremento más pronunciado y característico del riesgo trombótico que ocasionan estos últimos; dicho riesgo es muy superior al inducido por cada uno de ambos factores por separado. Cada uno de los trastornos trombofílicos posee un perfil de riesgo trombótico diferente en su combinación con los ACO, lo que debe tenerse en cuenta, por una parte, cara a la indicación del tratamiento anticonceptivo y, por otra, al tipo de preparado. En términos generales debe contraindicarse el tratamiento ACO en toda mujer que tenga algún defecto trombofílico, aun en los casos en los que éste no ha producido aún manifestaciones trombóticas, si bien pueden admitirse algunas matizaciones en algún caso concreto, como se verá.
Las mujeres con trombofilia que comienzan un tratamiento ACO desarrollan complicaciones trombóticas con mayor frecuencia y de un modo más temprano que el resto; así, el riesgo relativo de ETEV en mujeres trombofílicas con respecto al descrito para mujeres en tratamientos prolongados con ACO de tercera generación se incrementa 19 veces durante los primeros 6 meses de tratamiento y 11 veces durante el primer año. Por tanto, en ausencia de clínica trombótica previa la ETEV temprano en el curso de un tratamiento ACO hace aconsejable descartar la presencia de un defecto trombofílico congénito17. Esto nos orienta sobre la importancia que el estudio de familiares asintomáticos (sobre todo si son mujeres jóvenes) de pacientes con ETEV y trastornos trombofílicos tiene en la evaluación de este tipo de riesgos.
Los ACO constituyen un factor ambiental, cuya asociación con los defectos trombofílicos produce un incremento más pronunciado y característico del riesgo trombótico que ocasionan estos últimos; dicho riesgo es muy superior al inducido por cada uno de ambos factores por separado |
La asociación entre ACO, trombofilia y trombosis venosa es también válida para la trombosis de los senos venosos cerebrales. La incidencia anual de este tipo de complicación en mujeres premenopáusicas es muy baja (4 * 106); la asociación del consumo de ACO con algún defecto trombofílico eleva este riesgo en alrededor de 30 veces con respecto a las mujeres sin trombofilia y que no consumen ACO18-20. Por razones desconocidas, este riesgo es máximo (alrededor de 150 veces) en las portadoras heterocigotas de la mutación G20210A del gen de la protrombina (PT20210)20; no obstante, el riesgo de trombosis a esa escala puede considerarse muy bajo, incluso en estos casos.
| En términos generales debe contraindicarse el tratamiento ACO en toda mujer que tenga algún defecto trombofílico |
Déficit de antitrombina
No existen series amplias de mujeres con este trastorno pero sí estudios limitados que demuestran con claridad que los ACO aumentan de forma notable el riesgo de ETEV en mujeres con este déficit (tabla 3)21.
Déficit de proteína C y S
La escasa frecuencia de estos déficit hace que se hayan estudiado grupos cortos de pacientes sin que, quizá por esa razón, se haya demostrado un claro aumento del riesgo trombótico en estas mujeres (en especial aquellas con déficit de proteína S)21 (tabla 3). No obstante, no puede excluirse un aumento del riesgo en estas mujeres, por lo que se recomienda evitar tratamientos con ACO en éstas.
La asociación entre ACO, trombofilia y trombosis venosa es también válida para la trombosis de los senos venosos cerebrales |
Resistencia a la proteína C activada (factor V Leiden)
La mutación heterocigota el FVL se detecta en alrededor de un 30% de mujeres con ETEV que ocurre en el curso de tratamientos con ACO. El riesgo basal estimado de ETEV en mujeres no portadoras que no toman ACO es de 0,8 por 10.000 mujeres y año; este riesgo aumenta hasta 3 por 10.000 mujeres y año en mujeres que toman ACO pero no expresan FVL heterocigoto (riesgo relativo [RR]: 3,7) y 5,7 por 10.000 mujeres y año en aquellas con FVL pero ausencia de ingesta de ACO (RR: 6,9). En aquellas mujeres con ambos factores de riesgo, la incidencia de ETEV se eleva a 28,5 por 10.000 mujeres y año (RR: 34,7) con respecto a las mujeres no consumidoras ni portadoras del FVL; si hablamos de ACO que contienen desogestrel, este RR llega hasta 505,9. Esto supone una mortalidad esperada en estos últimos dos grupos de mujeres de alrededor de 2,8 y 5 por 100.000 mujeres y año, respectivamente9.
Resistencia a la proteína C activada (factor V Leiden) La gran mayoría de autores recomiendan emplear otras alternativas anticonceptivas en mujeres portadoras heterocigotas |
La gran mayoría de autores recomiendan emplear otras alternativas anticonceptivas en mujeres portadoras heterocigotas, si bien algunos autores opinan que el riesgo trombótico es asumible siempre que no existan otros factores de riesgo para la trombosis y la paciente esté informada de forma adecuada y no desee utilizar otros métodos de control de la natalidad.
En el caso de las portadoras homocigotas del FVL, el RR de ETEV cuando se asocian a ACO es de aproximadamente 10022, por lo que la anticoncepción oral en este grupo de mujeres está totalmente contraindicada sin excepciones.
Mutación G20210A del gen de la protrombina Las portadoras heterocigotas de esta mutación que consumen ACO presentan un aumento moderado del riesgo trombótico (RR: 3,5) en relación con mujeres sanas que no toman ACO 23 |
Mutación G20210A del gen de la protrombina
Las portadoras heterocigotas de esta mutación que consumen ACO presentan un aumento moderado del riesgo trombótico (RR: 3,5) en relación con mujeres sanas que no toman ACO23. Además, la combinación de ambos factores produce de modo característico un aumento muy importante (del orden de 150 veces) del riesgo de trombosis venosa cerebral que, de forma sorprendente, no se ve modificado por su asociación con el FVL20. No existen datos con respecto a portadoras homocigotas y su relación con los ACO en cuanto al riesgo trombótico, pero es de esperar que el riesgo de esta combinación sea elevado.
| En general, los estudios de coste-beneficio de la realización sistemática de estudios de trombofilia previos a la anticoncepción oral no justifica esta práctica, si bien la mayor discusión al respecto se ha planteado a propósito del FVL |
Valores elevados de factor VIII
Se ha descrito un aumento del riesgo de ETEV en mujeres que consumen ACO con valores de factor VIII basales > 150 U/dl no debidas a causa reactiva; ambos factores poseen efectos aditivos, y se ha encontrado una odds ratio (OR) de 10,3 (intervalo de confianza [IC] del 95%: 3,7-28,9) en relación con mujeres que no toman ACO y presentan valores de factor VIII normales24.
Estudio de trombofilia previo al inicio de la anticoncepción oral
Las complicaciones trombóticas potencialmente graves que pueden producirse en mujeres consumidoras de ACO con defectos trombofílicos han hecho surgir el interés por la evaluación de la utilidad de la realización de pruebas de trombofilia congénita antes de la indicación de dicho tratamiento; dicho interés se ve acentuado por el coste personal y económico que la ETEV puede suponer en personas jóvenes y el riesgo de un síndrome posflebítico tras un episodio de TVP en las mismas (20-30% a los 5 años)25. La primera consecuencia de dichos estudios sería la contraindicación del tratamiento ACO entre un 3 y un 6% de mujeres, lo que podría ocasionar embarazos no deseados debido a la falta de empleo de otros métodos anticonceptivos peor aceptados26. En general, los estudios de coste-beneficio de la realización sistemática de estudios de trombofilia previos a la anticoncepción oral no justifica esta práctica, si bien la mayor discusión al respecto se ha planteado a propósito del FVL. Sin embargo, es de utilidad con este fin la historia trombótica personal y familiar (miembros de la familia que han sufrido episodios trombóticos recurrentes, a edades temprana o sin factores desencadenantes); el principal inconveniente de la historia familiar es su baja sensibilidad, sobre todo en el caso de familias cortas o defectos trombofílicos que inducen un riesgo trombótico moderado y pueden, por ello, pasar desapercibidos durante largos períodos de tiempo, como el FVL o la mutación PT20210 heterocigotas27,28.
| En el caso de los déficit de antitrombina, proteína C y proteína S, la baja prevalencia de los mismos en la población hacen que su determinación rutinaria con anterioridad a un tratamiento ACO no se justifique |
En el caso de los déficit de antitrombina, proteína C y proteína S, la baja prevalencia de los mismos en la población hacen que su determinación rutinaria con anterioridad a un tratamiento ACO no se justifique, así como tampoco el seguimiento de los valores de estas proteínas en el curso del mismo puesto que los cambios que pueden producirse en la concentración plasmática de estas variables hemostáticas ocurren, generalmente, dentro de los límites de la normalidad7.
El estudio de la mutación PT20210 tropieza con la dificultad de que, aun siendo ésta una anomalía cuya prevalencia en la población general se sitúa alrededor del 2%29, no existe una prueba coagulativa que facilite y reduzca el coste de su diagnóstico, siendo éste posible únicamente por técnicas de diagnóstico genético en la actualidad; además, el aumento del riesgo trombótico que induce en asociación al tratamiento ACO no pasa de ser moderado. No existen estudios que hayan analizado la determinación de los valores plasmáticos de factor VIII, por lo que ésta no está justificada en la actualidad.
| Por tanto, en el momento actual y en virtud de los datos existentes se considera razonable tanto la determinación rutinariade la RPCA previa a la anticoncepción oral como su estudio únicamente en aquellas mujeres con antecedentes personales o familiares de ETEV. |
En virtud de su prevalencia en la población general (alrededor de un 2% en España30), el efecto multiplicativo ya mencionado de su riesgo trombótico con los ACO, y la existencia de una prueba coagulativa (RPCA) de fácil realización y excelente correlación con el diagnóstico genético (sensibilidad y especificidad prácticamente del 100%31) se ha planteado la determinación sistemática de este parámetro. Las conclusiones de la mayoría de autores no justifican esta determinación de modo sistemático en virtud de su coste-beneficio10,28,32,33, pues se estima que habría que estudiar alrededor de 2 millones de mujeres para evitar una muerte por ETEV. En cambio, una minoría considera razonable la determinación sistemática de la RPCA y su confirmación por estudio genético de la mutación antes de iniciar un tratamiento ACO; para estos autores, el coste de esta determinación podría justificarse si se tiene en cuenta el número total de episodios de ETEV que podría evitarse y no sólo aquellos con un desenlace fatal34-36. Por tanto, en el momento actual y en virtud de los datos existentes se considera razonable tanto la determinación rutinaria de la RPCA previa a la anticoncepción oral como su estudio únicamente en aquellas mujeres con antecedentes personales o familiares de ETEV.
Correspondencia: Dr. Carlos Aguilar Franco. Servicio de Hematología y Hemoterapia. Hospital General del INSALUD. Paseo de Santa Bárbara, s/n. 42002 Soria. Correo electrónico: caraguilar@excite.com