Se presenta un caso de cetoacidosis diabética (CAD) grave, fracaso renal agudo y deshidratación en una paciente en tratamiento con canagliflozina. Mujer de 71 años con estenosis severa de válvula aórtica, hipertensión arterial, dislipemia y diabetes mellitus tipo 2 (DM2) en tratamiento con linagliptina/metformina 2,5/1.000mg/12h e insulina glargina 14UI/día, que consultó por hipoglucemias frecuentes, retirándose la insulina y añadiéndole canagliflozina 100mg/24h.
Al mes comenzó con decaimiento, náuseas, dolor abdominal y disminución de la ingesta y omisión de algunos fármacos objetivando glucemia capilar de 225mg/dl. Acudió a urgencias por empeoramiento en las últimas 24-48h sufriendo un síncope con traumatismo craneal. Cursó sin fiebre. Exploración: mal estado general, signos de deshidratación, tensión arterial: 80/50mmHg, frecuencia cardíaca: 110lpm, soplo mesosistólico grado 3/6 en foco aórtico. Analítica: acidosis metabólica con anión gap elevado, cetonuria, glucosuria, leucocitosis con neutrofilia, hiperglucemia, filtrado glomerular disminuido y PCR elevada. Disminución de insulinemia basal 1,9μUI/ml (2,5-25) y péptido C basal: 0,54ng/ml (1,1-4,4). Autoinmunidad normal (IA2, GAD, insulina e islotes pancreáticos). Mediante hidratación parenteral e infusión continua de insulina se normalizaron los parámetros alterados (tabla 1).
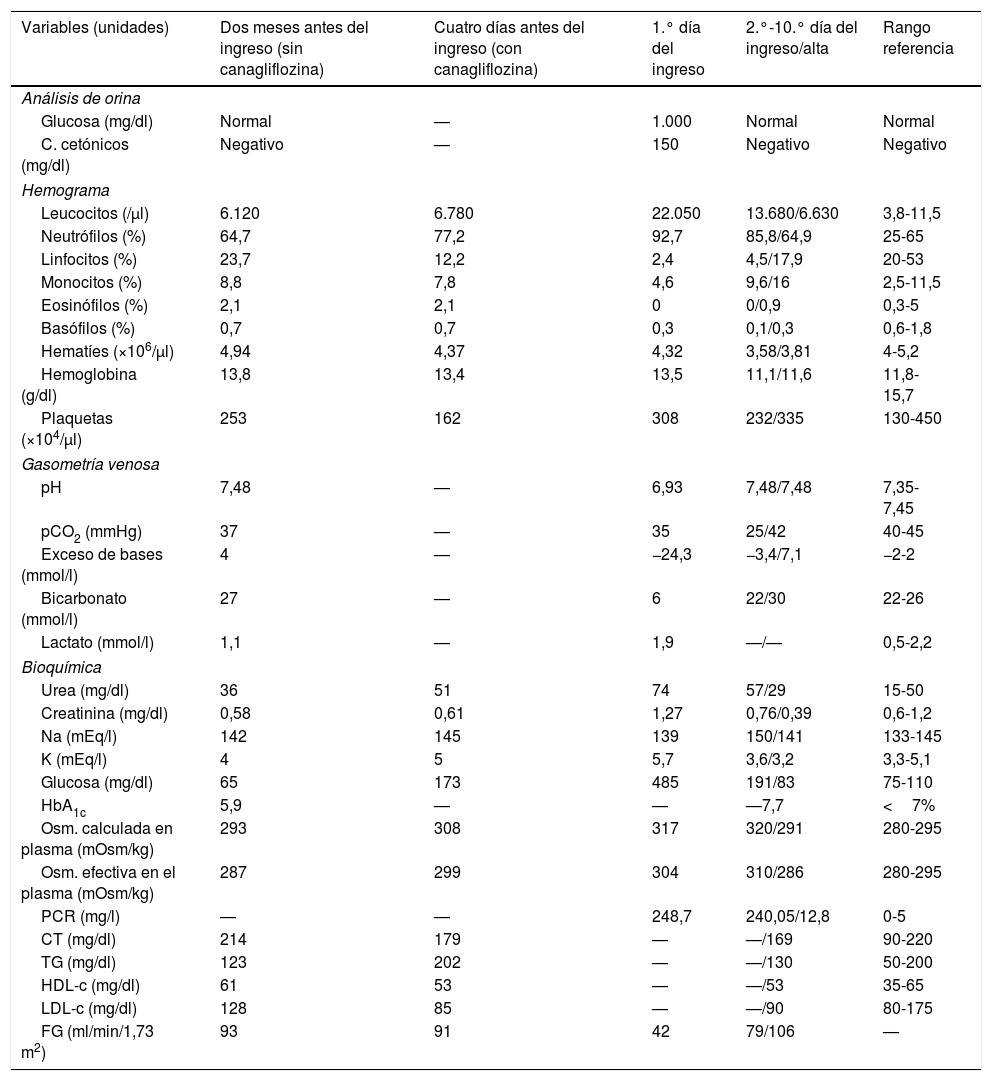
Datos de laboratorio de la paciente durante su evolución
| Variables (unidades) | Dos meses antes del ingreso (sin canagliflozina) | Cuatro días antes del ingreso (con canagliflozina) | 1.° día del ingreso | 2.°-10.° día del ingreso/alta | Rango referencia |
|---|---|---|---|---|---|
| Análisis de orina | |||||
| Glucosa (mg/dl) | Normal | — | 1.000 | Normal | Normal |
| C. cetónicos (mg/dl) | Negativo | — | 150 | Negativo | Negativo |
| Hemograma | |||||
| Leucocitos (/μl) | 6.120 | 6.780 | 22.050 | 13.680/6.630 | 3,8-11,5 |
| Neutrófilos (%) | 64,7 | 77,2 | 92,7 | 85,8/64,9 | 25-65 |
| Linfocitos (%) | 23,7 | 12,2 | 2,4 | 4,5/17,9 | 20-53 |
| Monocitos (%) | 8,8 | 7,8 | 4,6 | 9,6/16 | 2,5-11,5 |
| Eosinófilos (%) | 2,1 | 2,1 | 0 | 0/0,9 | 0,3-5 |
| Basófilos (%) | 0,7 | 0,7 | 0,3 | 0,1/0,3 | 0,6-1,8 |
| Hematíes (×106/μl) | 4,94 | 4,37 | 4,32 | 3,58/3,81 | 4-5,2 |
| Hemoglobina (g/dl) | 13,8 | 13,4 | 13,5 | 11,1/11,6 | 11,8-15,7 |
| Plaquetas (×104/μl) | 253 | 162 | 308 | 232/335 | 130-450 |
| Gasometría venosa | |||||
| pH | 7,48 | — | 6,93 | 7,48/7,48 | 7,35-7,45 |
| pCO2 (mmHg) | 37 | — | 35 | 25/42 | 40-45 |
| Exceso de bases (mmol/l) | 4 | — | −24,3 | −3,4/7,1 | −2-2 |
| Bicarbonato (mmol/l) | 27 | — | 6 | 22/30 | 22-26 |
| Lactato (mmol/l) | 1,1 | — | 1,9 | —/— | 0,5-2,2 |
| Bioquímica | |||||
| Urea (mg/dl) | 36 | 51 | 74 | 57/29 | 15-50 |
| Creatinina (mg/dl) | 0,58 | 0,61 | 1,27 | 0,76/0,39 | 0,6-1,2 |
| Na (mEq/l) | 142 | 145 | 139 | 150/141 | 133-145 |
| K (mEq/l) | 4 | 5 | 5,7 | 3,6/3,2 | 3,3-5,1 |
| Glucosa (mg/dl) | 65 | 173 | 485 | 191/83 | 75-110 |
| HbA1c | 5,9 | — | — | —7,7 | <7% |
| Osm. calculada en plasma (mOsm/kg) | 293 | 308 | 317 | 320/291 | 280-295 |
| Osm. efectiva en el plasma (mOsm/kg) | 287 | 299 | 304 | 310/286 | 280-295 |
| PCR (mg/l) | — | — | 248,7 | 240,05/12,8 | 0-5 |
| CT (mg/dl) | 214 | 179 | — | —/169 | 90-220 |
| TG (mg/dl) | 123 | 202 | — | —/130 | 50-200 |
| HDL-c (mg/dl) | 61 | 53 | — | —/53 | 35-65 |
| LDL-c (mg/dl) | 128 | 85 | — | —/90 | 80-175 |
| FG (ml/min/1,73 m2) | 93 | 91 | 42 | 79/106 | — |
C. cetónicos: cuerpos cetónicos; Ca correg: calcio corregido; CT: colesterol total; FG: filtrado glomerular; HbA1c: hemoglobina glicosilada; HDL-c: colesterol vehiculizado por las lipoproteínas de alta densidad; K: potasio; LDL-c: colesterol vehiculizada por las lipoproteínas de baja densidad; Na: sodio; Osm: osmolalidad; pCO2: presión parcial de dióxido de carbono; PCR: proteína C reactiva; TG: triglicéridos.
Ingresó por CAD y síncope secundario a estenosis aórtica sin sospechar hasta más adelante como causa la ingesta de canagliflozina. Al alta, se reintrodujo insulina glargina 12UI/24h y metformina 850mg/12h con retirada definitiva de canagliflozina. Asintomática en sucesivas revisiones.
Los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) tienen efectos beneficiosos debido a la glucosuria y natriuresis1. La CAD en pacientes con DM22 tratados con canagliflozina es un efecto adverso muy raro (<0,1%) y grave3, estimulan la secreción de glucagón a través de las células alfa pancreáticas y producen lipolisis aumentando las cetonas en sangre4. Tienen mayor riesgo de CAD los pacientes con baja reserva funcional de células β pancreáticas y/o alteración de la secreción de insulina.
La cetoacidosis diabética euglucémica (CDE) se caracteriza por hiperglucemia leve con niveles plasmáticos de glucosa <300mg/dl y de bicarbonato ≤10mEq/l5. Los desencadenantes suelen ser: enfermedad séptica grave, deshidratación, dieta baja en hidratos de carbono o consumo enólico. En este caso fueron favorecedores: deshidratación, anorexia, reducción de peso, suspensión de la insulina, escasa reserva pancreática y probable aumento de necesidades de insulina por estrés fisiológico (múltiples caídas). La toma de canagliflozina, el mantenimiento de fármacos deplectivos (diuréticos tiazídicos), antihipertensivos y metformina, que suprime la gluconeogénesis hepática, así como una menor oxidación de ácidos grasos6, pudieron originar la CAD, justificar la deshidratación y hemoconcentración con leucocitosis y el deterioro de la función renal.
La glucemia al azar de 485mg/dl se explica por la liberación de hormonas contrainsulares y la descarga adrenérgica (síncope, caída y traumatismo craneal). Se atribuyeron las caídas a síncope secundario a estenosis aórtica severa, y probablemente, fueron por deplección de volumen. El incremento de la osmolalidad plasmática previo al ingreso es significativo (tabla 1) pues debería hacer sospechar una CDE o una depleción de volumen con deshidratación. La determinación de la osmolaridad en sangre y en orina puede orientar hacia qué paciente tendría más riesgo de CAD antes de llegar a la cetonuria.
La CDE producida por iSGLT2, incluida canagliflozina, es predecible, detectable y prevenible al conocer su mecanismo fisiopatológico4, por lo que se debe valorar este efecto adverso ante un paciente en tratamiento con glucosúricos.
Se modificó el tratamiento por la gran variabilidad glucémica e hipoglucemias, a pesar del buen control metabólico (hemoglobina glicosilada del 5,9%). Se sustituyó la insulina por un tercer fármaco, canagliflozina 100mg/24h manteniendo linagliptina y metformina, creyendo que tenía una reserva pancreática normal dada la dosis baja de insulina que requería. Es importante determinar el péptido C antes de retirar la insulina, para valorar la reserva pancreática. La paciente tenía déficit de secreción de insulina, pero se comprobó después de la complicación. Si no se dispone del péptido C inicial, debe reducirse a la mitad la dosis de insulina, solicitar su determinación y realizar una nueva valoración del paciente en 2 meses, y no añadir un iSGLT2 sin conocer el valor del péptido C.
FinanciaciónLos autores declaran la no existencia de financiación externa del presente artículo.