La infección crónica por el virus de la hepatitis C (VHC) afecta un 3% de la población mundial (∼180 millones de personas) y es la principal causa de cirrosis (CH), hepatocarcinoma (CHC) y trasplante hepático en el mundo1. En España se estima que la tasa de infección activa VHC se sitúa entre el 1,2- 1,9% de la población2, siendo las transfusiones sanguíneas antes del año 1990 el principal mecanismo de transmisión. A pesar de que la historia natural de la infección crónica por VHC es lentamente progresiva, un 15-30% de los pacientes desarrollarán CH tras ∼20 años de infección3. Se estima, por tanto, que en los próximos años incrementará el número de pacientes con CH, CHC o con necesidad de trasplante hepático (TH), añadiendo una elevada carga económica para el Sistema Nacional de Salud4.
Escoger el mejor régimen terapéutico es de vital importancia para lograr la curación definida como respuesta viral sostenida (RVS) o negativización del ARN-VHC tras 12 semanas de la finalización del tratamiento1,5. La RVS no sólo logra la eliminación del virus sino que impacta en la historia natural de los pacientes con VHC reduciendo el riesgo de desarrollar CH y sus complicaciones así como mejorando la calidad de vida de los pacientes.
En los últimos años se han producido importantes cambios en el tratamiento de la hepatitis C crónica. Hasta el año 2011, el tratamiento de elección era la combinación de Interferón pegilado (peg-INF) y ribavirina (RBV) durante 24-48 semanas. Con esta combinación se lograban tasas de RVS del ∼50% en pacientes con genotipo 1. Sin embargo, debido a la alta tasa de efectos secundarios, la aplicabilidad de este tratamiento era baja y estaba contraindicado en muchos pacientes incluyendo aquellos con cirrosis avanzada6. El desarrollo de los antivirales de acción directa (AAD) ha supuesto un cambio en el paradigma de la infección VHC. En función de las enzimas del virus que inhiben los AAD se clasifican en tres grupos principales: los inhibidores de proteasa NS3/NS4A (IP), de polimerasa (NS5B) y de la enzima NS5A. Debido al mejor perfil de seguridad, la combinación de AAD en terapias libres de interferón ha permitido tratar a un mayor número de pacientes (incluyendo pacientes con cirrosis avanzada o de mayor edad) con altas tasas de eficacia pero también con un incremento en los costes del tratamiento antiviral.
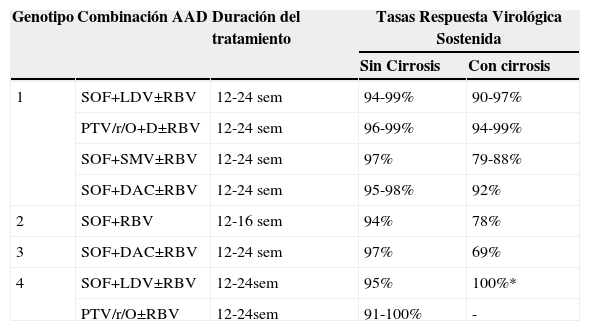
EFICACIALos IP de primera generación boceprevir o telaprevir en combinación con peg-INF y RBV lograron incrementar la tasa de RVS del 50 al 80% en pacientes genotipo 11,7,8. No obstante, este tratamiento supuso un aumento tanto de la frecuencia como de la severidad de los efectos adversos por lo que actualmente su uso no está recomendado9. Desde el año 2014 disponemos en España de nuevos AAD que pueden ser combinados entre sí. La selección del régimen terapéutico por parte del hepatólogo dependerá de varios factores entre los que se encuentran: el genotipo viral, la respuesta previa al tratamiento, la presencia de cirrosis o el grado de disfunción hepática, la función renal y la medicación concomitante. Estos fármacos nunca deben administrarse en monoterapia y la duración habitual del tratamiento es de 12-24 semanas. En la tabla 1 se resumen las principales combinaciones de AAD que se usarán durante el 2015-2016.
Principales combinaciones de AAD que se usarán durante 2015 y tasas de RVS en función de genotipo VHC y de la presencia de cirrosis o no (datos agrupados de varios estudios)
| Genotipo | Combinación AAD | Duración del tratamiento | Tasas Respuesta Virológica Sostenida | |
|---|---|---|---|---|
| Sin Cirrosis | Con cirrosis | |||
| 1 | SOF+LDV±RBV | 12-24 sem | 94-99% | 90-97% |
| PTV/r/O+D±RBV | 12-24 sem | 96-99% | 94-99% | |
| SOF+SMV±RBV | 12-24 sem | 97% | 79-88% | |
| SOF+DAC±RBV | 12-24 sem | 95-98% | 92% | |
| 2 | SOF+RBV | 12-16 sem | 94% | 78% |
| 3 | SOF+DAC±RBV | 12-24 sem | 97% | 69% |
| 4 | SOF+LDV±RBV | 12-24sem | 95% | 100%* |
| PTV/r/O±RBV | 12-24sem | 91-100% | - | |
Abreviaturas: AAD: agentes antivirales directos, SOF: sofosbuvir, LDV: ledipasvir; PTV: paritaprevir; r: ritonavir; O: ombitasvir; D: dasabuvir; SMV: simeprevir; DAC: daclatasvir; RBV: ribavirina. *n=10 pacientes
Es importante resaltar que en los pacientes con cirrosis, los regímenes que contienen peg-INF deben ser evitados debido a su pobre tolerancia, eficacia y riesgo de descompensación. Por el contrario, la mayoría de las combinaciones de AAD son bien toleradas tanto en CH compensada como descompensada (Child-Pugh B y C). Este grupo, sin embargo, presenta tasas de RVS más bajas que los pacientes sin fibrosis por lo que la adición de RBV o la extensión de la duración del tratamiento presentan ventajas desde un punto de vista de eficacia10. En el caso de pacientes coinfectados por VIH/VHC se recomiendan idénticos regímenes terapéuticos a pacientes monoinfectados, con la consideración especial del potencial riesgo de interacciones farmacológicas de los AAD con el tratamiento antirretroviral8. En el post-trasplante hepático por VHC, la infección del injerto es universal y hasta un 15% de los pacientes pueden desarrollar cirrosis en 5 años debido a un estado de inmunosupresión y progresión acelerada de la enfermedad11. En estos pacientes, varios estudios han demostrado altas tasas de eficacia y seguridad con las combinaciones de AAD sin peg-IFN10. También en esta población es relevante conocer y monitorizar de cerca las posibles interacciones farmacológicas con los fármacos inmunosupresores que pueden conllevar a la aparición de efectos secundarios o episodios de rechazo. Finalmente, en los últimos meses se han mostrado datos eficacia y seguridad en pacientes con insuficiencia renal avanzada o en hemodiálisis. Datos preliminares de combinaciones de AAD no sujetas a metabolismo renal han mostrado buena eficacia y seguridad en esta población11.
COSTEMientras que los casos nuevos de infección por VHC probablemente disminuirán debido al mayor control de los mecanismos de transmisión, se espera que el número de pacientes con fibrosis avanzada y con complicaciones de la cirrosis incremente en los próximos años4. Varios estudios de evaluación económica en salud han demostrado que la intervención temprana con regímenes de AAD en pacientes es costo-efectiva. No obstante, en el caso de pacientes con cirrosis se ha de tener en cuenta que la resolución de la infección no implica la curación de la enfermedad hepática por lo que, aunque en menor medida, estos pacientes continúan en riesgo de descompensación o hepatocarcinoma12 y deben seguir controles periódicos con el hepatólogo.
CONCLUSIÓNLa introducción de las combinaciones de AAD ha cambiado el escenario de la hepatitis C. La alta tasa de eficacia y el buen perfil de seguridad permiten tratar a un gran número de pacientes aunque con un mayor coste económico. No obstante, a medio-largo plazo se prevé una reducción de la morbimortalidad producida por la infección crónica por VHC, especialmente en aquellos pacientes con estadios de fibrosis leve-moderada, por lo que una estrategia de accesibilidad a estas terapias antivirales resultará claramente coste-efectiva.