Introducción
La compresión medular (CM) se define como la invasión del canal medular por un tumor localmente avanzado o por una metástasis que produce compresión o desplazamiento de la médula espinal1.
Es la segunda complicación neurológica más frecuente en los pacientes con enfermedad metastásica, después de las metástasis cerebrales.
Se presenta en un 5-10% de los pacientes oncológicos1-5. En el 10% de los casos constituye la presentación inicial de la enfermedad.
La CM se puede clasificar en dos grupos, externa e interna, según la localización del tumor. La CM externa es producida por metástasis epidurales (96-99%), en la cual la expansión de la masa tumoral en sentido posterior y los fragmentos óseos que entran dentro del canal por destrucción del hueso cortical producen compresión de la médula en su cara anterior (fig. 1). Otros tipos de CM externa menos frecuentes son las producidas por tumores paravertebrales que crecen en sentido anterolateral (fig. 2), tumores del arco posterior vertebral que crecen en sentido anterior (fig. 3) y tumores o metástasis leptomeníngeas que crecen envolviendo y comprimiendo las capas meníngeas y el espacio subaracnoideo.
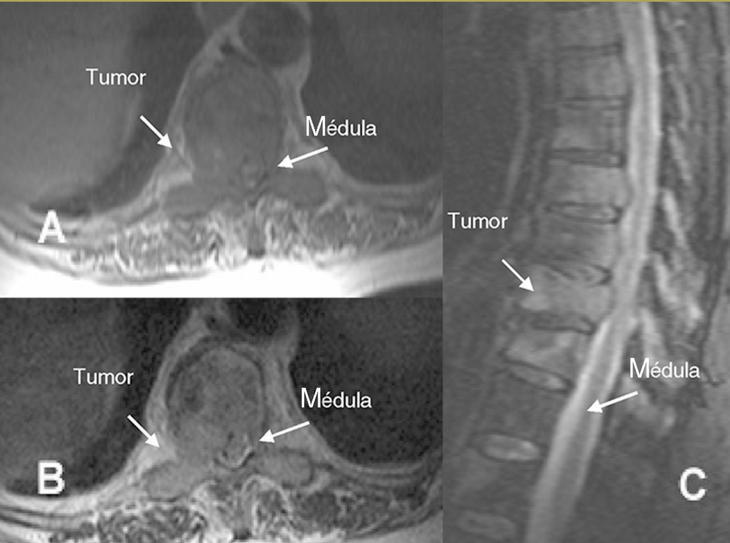
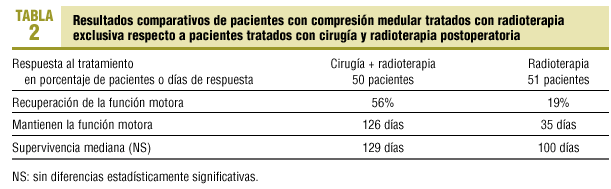
Figura 1. Resonancia magnética en un paciente con neoplasia de mama. A: imagen axial potenciada en T1, infiltración metastásica de la vértebra T10 con masa de partes blandas epidural que desplaza y comprime el cordón medular. B: imagen axial potenciada en T2, infiltración metastásica de la vértebra T10 con masa de partes blandas epidural que desplaza y comprime el cordón medular. C: imagen sagital potenciada en gradiente T2. Infiltración metastásica de las vértebras dorsales con protrusión del muro posterior en T8 y T10 con un componente de partes blandas epidural anterior que desplaza y comprime la superficie anterior de la médula.
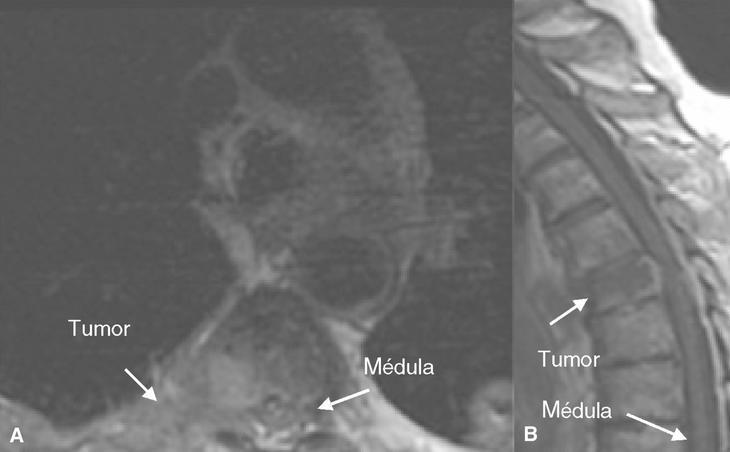
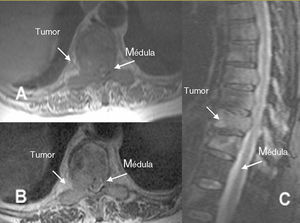
Figura 2. Resonancia magnética en paciente con neoplasia de pulmón de célula no pequeña. A: imagen axial potenciada en T1: afección metastásica de T4 con masa de partes blandas que se introduce a través del orificio de conjunción T4-T5 y se extiende al espacio epidural anterolateral derecho. La masa desplaza la médula hacia la izquierda y rectifica su contorno anterolateral. B: corte sagital: imagen potenciada en T1 que pone de relieve una infiltración metastásica de la vértebra T5 con masa de partes blandas que invade el espacio epidural anterior y rectifica el contorno medular.
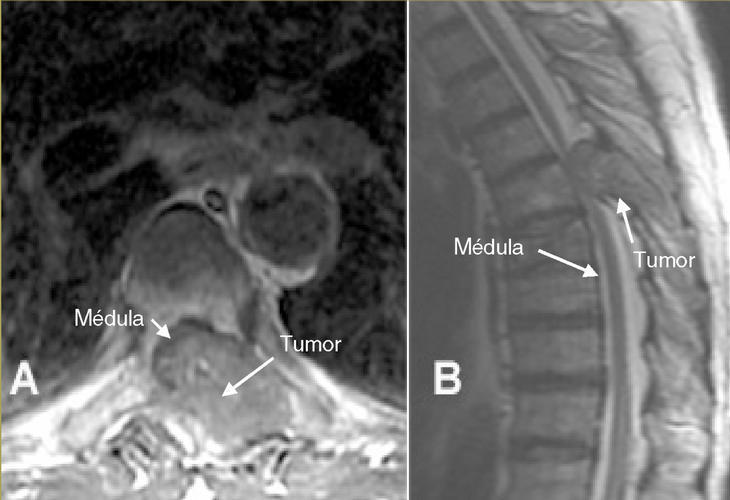
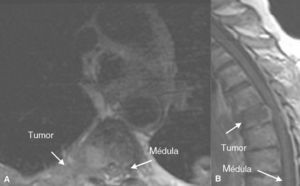
Figura 3. Resonancia magnética en un paciente con neoplasia renal de células claras. Infiltración metastásica en la vértebra T9 con masa de partes blandas epidural que invade y comprime el cordón medular en corte transversal (A) y corte sagital (B).
La CM interna está producida por metástasis intramedulares (1-4%)4.
Etiología
Los tumores primarios más frecuentes son de mama, pulmón y próstata4.
Fisiopatología
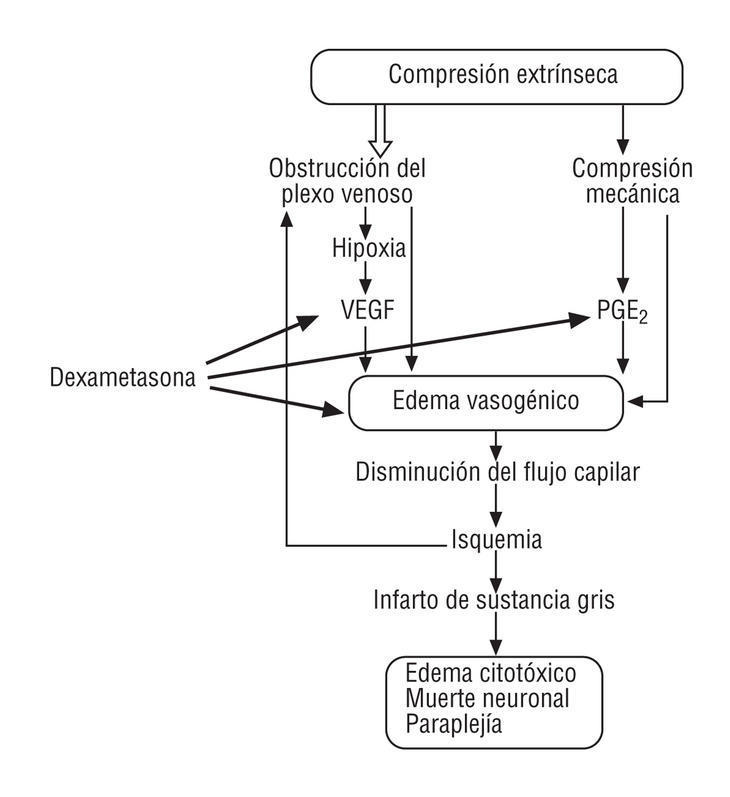
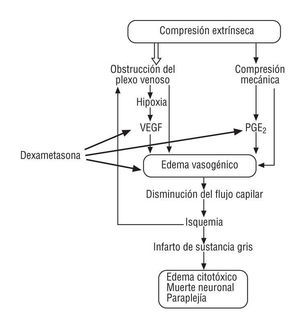
El principal mecanismo por el que se lesiona la médula espinal es la alteración vascular. Inicialmente se produce estenosis y obstrucción del flujo del plexo venoso epidural, que da lugar a un edema intersticial vasogénico de la sustancia blanca y, finalmente, a hipoxia, necrosis (gliosis) e infarto de la sustancia gris, con pérdida neurológica definitiva2.
Algunas sustancias influyen en la alteración vascular. El factor de crecimiento vascular endotelial (VEGF), cuya liberación es estimulada por la hipoxia y la estasis vascular, aumenta la permeabilidad vascular y produce un mayor edema vasogénico y, en consecuencia, más isquemia. Otras sustancias implicadas son las prostaglandinas (PGE2) que se liberan estimuladas por la compresión mecánica.
La dexametasona inhibe la expresión del gen que produce el VEGF, la PGE2 y disminuye el edema vasogénico (fig. 4).
Figura 4. Mecanismo de lesión de la médula espinal en las metástasis vertebrales. PGE2: prostaglandinas; VEGF: factor de crecimiento vascular endotelial.
Manifestaciones clínicas
El 70-96% de los pacientes con CM presentan dolor vertebral6, que suele preceder al diagnóstico en días o meses3. El dolor puede ser de tipo radicular, local o mixto. El dolor local es el más frecuente y se produce por destrucción y expansión de los elementos óseos vertebrales. En el 70% de los casos, la localización es dorsal, en el 20% lumbar y en el 10% cervical. En un 20-30% de los casos hay múltiples localizaciones no contiguas de CM.
La alteración de la función motora se presenta en el 60-90% de los casos. Aparece de forma progresiva por debajo de la zona medular afectada con pérdida de fuerza, ausencia de tono muscular e hiporreflexia (gradualmente se irá sustituyendo por paraplejía en flexión) y, por último, alteración de la función autonómica con incontinencia urinaria y fecal. La alteración en la función sensitiva en forma de pérdida de sensibilidad y parestesias es más tardía y ocurre en el 45-80% de los casos. Suele aparecer varios segmentos medulares por debajo del segmento afectado por la CM, por lo que no es un buen signo para identificar la localización de la CM7.
En algún caso, cuando la insuficiencia vascular progresa a isquemia franca, la focalidad neurológica aparece de forma aguda (shock medular,) con pérdida de la función motora y sensitiva de forma brusca por debajo de la zona medular afectada.
Diagnóstico
El diagnóstico de la CM se basa en una historia clínica y una exploración neurológica detalladas, con el apoyo del estudio radiológico5. En todo paciente oncológico con dolor en el raquis se deben evaluar minuciosamente sus características (local o radicular), la localización y la existencia de focalidad neurológica.
Exploraciones complementarias
La radiografía simple de columna será de utilidad para identificar la CM si va asociada a fractura vertebral o a masa de partes blandas paravertebral3.
La técnica de elección es la resonancia magnética (RM), que permite confirmar el diagnóstico, conocer la extensión de la enfermedad y planificar el posterior tratamiento quirúrgico o radioterapéutico3.
Diagnóstico diferencial
En la tabla 1 se incluyen otras causas de dolor vertebral con disfunción neurológica que nos permitirán efectuar un diagnóstico diferencial8.
Tratamiento
La radioterapia es el tratamiento de elección cuando hay evidencia de tumor primario conocido7. En caso contrario, es recomendable la descompresión quirúrgica, que permitirá al mismo tiempo la obtención del diagnóstico histológico.
Radioterapia
La radioterapia consigue un alivio del dolor en el 70% de los casos, mejoría de la función motora en el 45-60% de los casos, reversión de la situación de paraplejía en el 10-20% de los casos, citorreducción del tumor, control local de la enfermedad y prevención de los síntomas neurológicos progresivos.
Cirugía
La indicación quirúrgica está claramente establecida cuando hay inestabilidad vertebral9, retropulsión de fragmentos óseos cuando éstos son los causantes de la CM, irradiación previa sobre el lugar de la CM (con la máxima dosis permitida administrada), ausencia de respuesta a la radioterapia, o en ausencia de diagnóstico histológico en el contexto de deterioro neurológico rápido10.
La irradiación complementaria a la cirugía debe ser considerada en todos los casos.
Contraindicaciones
Hay ciertas circunstancias en las que la cirugía descompresiva no debe considerarse como tratamiento de elección: múltiples zonas de compresión medular, paraplejía establecida o mal estado general del paciente6,10.
Resultados
Únicamente hay un estudio prospectivo aleatorizado que compara los resultados de la cirugía y la radioterapia en la CM. En él no se encuentran diferencias estadísticamente significativas en cuanto al porcentaje de pacientes ambulatorios después del tratamiento, ni tampoco en la disminución del dolor. Se concluye que la laminectomía no contribuye a la eficacia de la radioterapia. No obstante, se trata de un estudio que incluye a un número de pacientes muy limitado (29 pacientes)11.
Recientemente, Patchell et al12 han realizado un estudio prospectivo aleatorizado que compara los resultados del tratamiento con irradiación exclusiva o cirugía seguida de irradiación postoperatoria. En los 2 grupos se ha administrado la misma pauta de dexametasona (100 mg y pauta descendente) y la misma dosis y fraccionamiento de radioterapia. La cirugía se ha realizado con intención de resecar la máxima cantidad tumoral, descomprimir la médula y estabilizar la columna vertebral. Los resultados demuestran que, aunque no hay diferencias estadísticamente significativas en cuanto a supervivencia, los pacientes tratados con cirugía descompresiva y radioterapia postoperatoria mantienen la capacidad de deambulación en un mayor porcentaje de los casos y durante más tiempo que los pacientes tratados con radioterapia sola. Así pues, la cirugía permite obtener una mayor calidad de vida en estos pacientes (tabla 2).
Corticoterapia
Todos los pacientes con confirmación radiológica de CM deben iniciar tratamiento con dexametasona7. No hay consenso en la dosis inicial a administrar, ya que dosis altas (100 mg-40 mg/día) no han demostrado mayor eficacia que dosis más bajas (32-16 mg/día) en cuanto a la disminución del dolor y al porcentaje de pacientes ambulatorios postratamiento7. Las dosis que se suelen utilizar son de 100 mg en infusión continua durante 30 minutos, seguidas de 16 mg/6 h durante 2 días y, posteriormente, pauta descendente de 4 mg cada 2 días.
En los pacientes sin disfunción neurológica (sólo dolor), con invasión del canal medular inferior al 50% y con afección de un máximo de 2 zonas vertebrales, no sería necesario iniciar tratamiento con dexametasona, ya que se observan excelentes resultados con radioterapia exclusiva13.
Quimioterapia
La quimioterapia como primera opción terapéutica sólo está indicada en tumores altamente quimiosensibles (linfomas, mieloma, tumores germinales, mama, próstata, carcinoma microcítico de pulmón), en pacientes no tributarios de radioterapia o cirugía, o en combinación con radioterapia en el linfoma no hodgkiniano, puesto que ha demostrado prolongar la supervivencia.
Factores pronósticos
El grado de disfunción neurológica previa al tratamiento es el mayor predictor de respuesta terapéutica1-3. El 85% de los pacientes que conservan la función neurológica en el momento del diagnóstico la mantendrá posteriormente al tratamiento con radioterapia, mientras que sólo la mantendrá el 45-50% de los pacientes con paraparesia y el 0-15% de los pacientes con paraplejía6,7. Otro predictor importante es la velocidad de instauración del déficit neurológico2. La rápida progresión de la clínica indica el grado de severidad del daño medular y la menor posibilidad de que el déficit sea reversible. Por último, el intervalo entre el diagnóstico de la neoplasia y el desarrollo de la CM predice el grado de disfunción motora1. Intervalos cortos implican mayor severidad de disfunción neurológica y esto, a su vez, depende de la histología2,6. Las neoplasias pulmonares suelen tener intervalos cortos (hasta 3 meses) y, por tanto, peor pronóstico que una neoplasia de mama, que puede llegar a presentar un intervalo largo (hasta 24 años) y, en consecuencia, mejor pronóstico.
La supervivencia mediana de estos pacientes depende de varios factores. El factor que más influye es la respuesta al tratamiento. Los pacientes ambulatorios postratamiento tendrán una supervivencia mayor (8 meses) que los que posteriormente al tratamiento quedan con una paraplejía instaurada (2 meses)1,7,14. Otro factor importante es la histología del tumor primario. Histologías favorables (mama, linfoma, próstata) pueden tener una supervivencia de hasta 10 meses, mientras que histologías desfavorables presentan una supervivencia de 3 meses1,4,7.
Conclusiones
El éxito en el tratamiento de la CM se basa en el diagnóstico temprano3. Ante un paciente oncológico que presenta dolor en el raquis de nueva aparición o progresivo, con o sin disfunción neurológica, se puede evitar la paraplejía si el diagnóstico y el tratamiento se inician con rapidez2,3,7. En estos casos, el tratamiento es efectivo en el 90% de los casos. La RM es la exploración radiológica de elección. Es muy importante tener presente que se trata de una urgencia oncológica que requiere tratamiento urgente, es decir, en menos de 24 horas desde la instauración de los síntomas2. La demora en el tratamiento puede ocasionar consecuencias motoras irreversibles, con pérdida de la calidad de vida y menor supervivencia1.
Los corticoides deberían administrarse en pacientes sintomáticos con confirmación diagnóstica. La radioterapia es el tratamiento de elección en todos los pacientes sin déficit o con mínimo déficit neurológico. La cirugía debe indicarse en pacientes con expectativa de vida superior a 2 meses, cuando no haya diagnóstico histológico de neoplasia o haya inestabilidad vertebral, CM por fragmentos óseos, historia de radiación previa en la misma localización o progresión neurológica durante el tratamiento de radioterapia.
Estudios publicados recientemente pueden conllevar un cambio en el abordaje terapéutico de la CM a corto plazo. La cirugía probablemente pasará a ser el tratamiento de elección en todos los pacientes sin contraindicación quirúrgica ya que, aunque no suponga un aumento en cuanto a supervivencia, sí que permite obtener una mayor calidad de vida12.
La supervivencia dependerá del déficit neurológico previo al tratamiento, del intervalo entre el diagnóstico de neoplasia y la CM y del tipo histológico. Pero, sin duda, el factor más importante será la respuesta al tratamiento, y ésta dependerá fundamentalmente de la rapidez en la instauración del diagnóstico y del tratamiento.