Describir las reacciones adversas más frecuentes producidas por la vacunación contra el virus del papiloma humano (VPH).
DiseñoEstudio descriptivo transversal mediante encuesta telefónica.
EmplazamientoSistema Sanitario Público de Andalucía.
ParticipantesMujeres vacunadas frente al VPH en Andalucía, seleccionadas por muestreo aleatorio simple con representatividad provincial.
MedicionesSe realizaron 3.135 llamadas telefónicas por el servicio público “Salud Responde” dependiente de teleoperadores con supervisión de personal sanitario.
Resultados principalesDe las 2.880 llamadas que cumplían criterio de inclusión, se consiguió encuestar a 1.207 personas (41,9% de respuesta). De las 2.124 encuestas realizadas tuvieron algún tipo de reacción adversa (fiebre, inflamación, dolor o enrojecimiento) en 467 dosis (22%): el 6,6% fue fiebre, el 49,5% inflamación, el 72,4% dolor, y el 6% enrojecimiento.
ConclusionesSe puede decir que es una vacuna segura, lo que concuerda con lo recogido en su ficha técnica y en la literatura.
To describe the most frequent adverse reactions produced by the human papillomavirus (HPV) vaccine.
DesignCross-sectional descriptive study using a telephone survey.
SettingA province in the Andalusian Public Health System.
ParticipantsFemales vaccinated against HPV in Andalusia, selected by simple random sampling representative of the province.
Main measurementsA total of 3,135 telephone calls were made by the public service “Health Answers” using telephone operators supervised by health personnel.
ResultsOf the 2,880 calls that fulfilled the inclusion criteria, 1,207 people (41.9% response) took part in the survey. Of the 2,124 surveys made there was some type of adverse reaction (fever, inflammation, pain or rash) in 467 doses (22%): 6.6% was fever, 49.5% inflammation, 72.4% pain, and 6% a rash.
ConclusionsIt can be said that HPV vaccine is safe, which is in agreement with that published in the summary of the product characteristics and in the literature.
La vacuna contra el virus del papiloma humano (VPH) es la primera vacuna explícitamente diseñada para prevenir el cáncer inducido por un virus1. Hay muchos genotipos asociados a la oncogénesis2, dos de ellos (16 y 18) producen entre el 60 y 80% de casos. Sin embargo, no todos los cánceres cervicales son causados por estos genotipos vacunales. En Andalucía la vacuna que administra el sistema sanitario público contiene solamente los genotipos 16 y 18, existiendo además la vacuna tetravalente que contiene los mismos genotipos más el 6 y el 11, que se asocian en un 90% a la aparición de verrugas genitales o condilomas.
En un informe emitido por el Sistema de Vigilancia y Control Postcomercialización3 de las vacunas frente al VPH sobre las notificaciones de sospecha de reacciones adversas (SRA), se señala que, desde la comercialización de la vacuna hasta fines de marzo de 2009, se registraron 237 notificaciones de SRA en España, de las que 17 fueron convulsiones o términos asociados (15 de la vacuna tetravalente y 2 de la vacuna bivalente), de las cuales 16 fueron graves. Un total de 50 notificaciones de SRA tenían algún tipo de efecto sobre el sistema nervioso central. En Europa se han notificado 62 casos de convulsiones o términos asociados (51 para la tetravalente y 11 para la bivalente). Por otro lado, los datos preliminares aportados por la compañía muestran 663 notificaciones de SRA que describen crisis convulsivas.
Por otro lado, los datos publicados por el Judicial Watch4 indican que, desde que se empezó a administrar la vacuna tetravalente en niñas de Estados Unidos, ha habido 3 muertes y 1.637 reacciones adversas notificadas hasta el 15 de mayo de 2007. Los datos provienen del VAERS (Vaccine Adverse Event Reporting System) de la FDA (Food and Drugs Administration), y hasta el 30 de junio de 2007 las reacciones adversas a la vacuna fueron 2.531, incluyendo 9 muertes, tras 7 millones de dosis distribuidas. El sistema sanitario de Canadá recibió 82 notificaciones de reacciones adversas tras 162.000 dosis distribuidas hasta el 17 de agosto de 2007, de los que 5 casos fueron hospitalizados, incluyendo dos que acabaron en apendicitis, uno que se asoció a infección viral y otro a encefalopatía, que están siendo investigados.
Entre el 8 de junio de 2006 y el 30 de abril de 2008, los casos notificados5 por Merck & Co al VAERS fueron 7.802 para la vacuna tetravalente. Quince de ellos fueron muertes, de los cuales 5 no pudieron confirmarse por no estar identificados los pacientes, y en los otros 10 fue imposible establecer una relación causal entre las muertes y la vacunación. También se recibieron 31 notificaciones de síndrome de Guillen-Barré (SGB), de las cuales no todas estaban relacionadas con la vacunación.
Sobre la experiencia pos-comercialización, la bibliografía recoge notificaciones de efectos adversos no descritos en la ficha técnica: accidente cerebrovascular, trombosis venosa profunda, embolismo pulmonar6, linfadenopatía7, anafilaxia8,9 (2,6/100.000 casos, confirmada la asociación con la vacuna tetravalente, frente a la producida por otras vacunas como la de meningococo C conjugada que produce 0,1/100.000 casos), pancreatitis10, reacciones de hipersensibilidad11 (confirmada la asociación con la vacuna tetravalente con una frecuencia de al menos 1/100.000 casos, y que fue mejor tolerado en las dosis siguientes) y SGB12,13.
El objetivo de este trabajo es describir las reacciones adversas más frecuentes producidas por la vacunación en Andalucía con la vacuna bivalente.
Material y métodoSe trata de un estudio descriptivo transversal mediante encuesta telefónica (anexo disponible en la versión electrónica) de la población seleccionada a través de listados nominativos de mujeres vacunadas frente al VPH por el Sistema Sanitario Público de Andalucía, mediante muestreo aleatorio simple con representatividad provincial y reemplazo de aquellas que no respondieron. El criterio de inclusión en calendario vacunal fue por fecha de nacimiento (niñas que cumplen los 14 años en el año natural).
El universo son 29.580 mujeres que habían recibido la vacuna de VPH en Andalucía, y el tamaño de muestra se calculó para una precisión del 3%, un nivel de confianza del 99% y una estimación de la proporción esperada del 20%.
Las encuestas fueron atendidas por el servicio público “Salud Responde” dependiente de teleoperadores con supervisión de personal sanitario. Se dividieron en 3 sesiones o grupos según el inicio y fin de las mismas: Grupo 1, del 29/10/2008 al 06/11/2008; Grupo 2, del 01/12/2008 al 31/12/2008; y Grupo 3, del 05/02/2009 al 03/03/2009.
Los datos se presentan como frecuencias absolutas y porcentajes. Para la comparación de proporciones se utilizó el test de la Ji cuadrado.
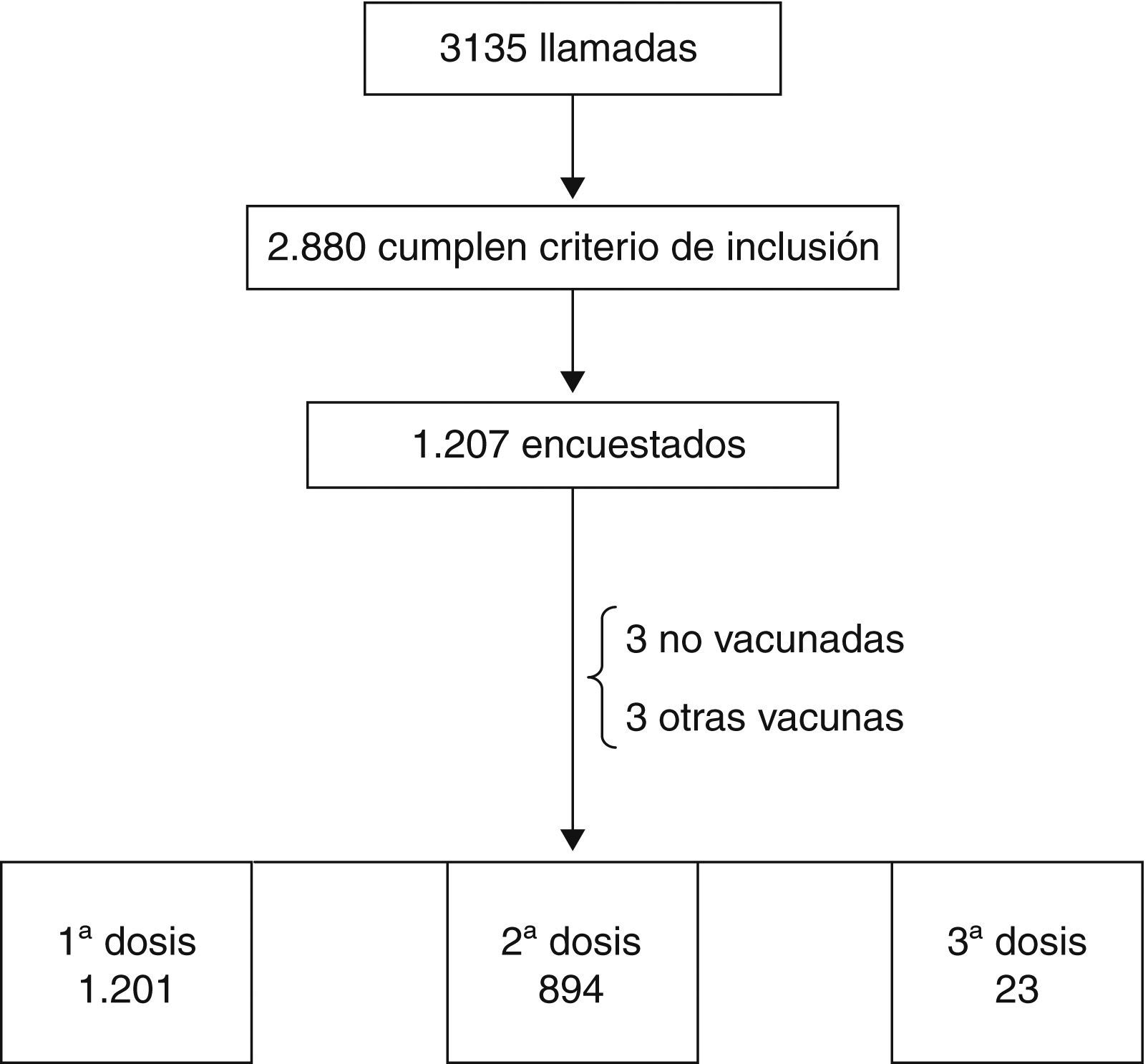
ResultadosSe realizaron 3.135 llamadas telefónicas, de las cuales 2.880 cumplían el criterio de inclusión. Se consiguió encuestar a 1.207 personas (respuesta del 41,9%).
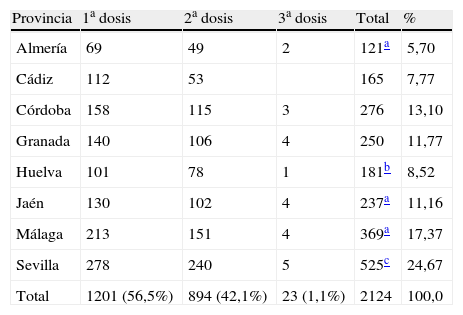
De las 2.124 encuestas realizadas, 1.201 se referían a la primera dosis, 894 a la segunda, 23 a la tercera, 3 no se habían vacunado aún y en 3 se había administrado otra vacuna (tabla 1).
Número de encuestas realizadas por provincia y dosis
| Provincia | 1a dosis | 2a dosis | 3a dosis | Total | % |
| Almería | 69 | 49 | 2 | 121a | 5,70 |
| Cádiz | 112 | 53 | 165 | 7,77 | |
| Córdoba | 158 | 115 | 3 | 276 | 13,10 |
| Granada | 140 | 106 | 4 | 250 | 11,77 |
| Huelva | 101 | 78 | 1 | 181b | 8,52 |
| Jaén | 130 | 102 | 4 | 237a | 11,16 |
| Málaga | 213 | 151 | 4 | 369a | 17,37 |
| Sevilla | 278 | 240 | 5 | 525c | 24,67 |
| Total | 1201 (56,5%) | 894 (42,1%) | 23 (1,1%) | 2124 | 100,0 |
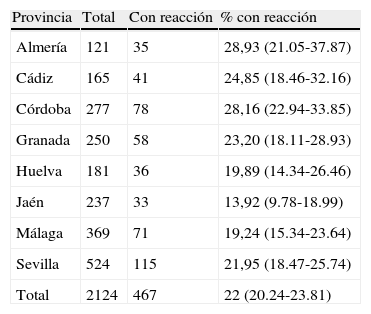
De las 2.124 encuestas realizadas se afirma que tuvieron algún tipo de reacción adversa en 467 dosis (22%) (tabla 2): en el 6,6% de los casos fue fiebre (en el 58,1% de los casos se dio con la primera dosis, y sólo 3 presentaron fiebre elevada), en el 49,5% fue inflamación (en el 58,4% se dio en la primera dosis, y sólo en 13 casos fue elevada), en el 72,4% fue dolor (en el 57,7% se dio en la primera dosis, y sólo en 33 fue elevado), y el 6% fue enrojecimiento (en el 46,4% se dio en la primera dosis, y sólo en 2 casos fue intenso). En cuanto a aquellos que dicen haber tenido otro tipo de síntoma, el 1,3% presentó inflamación y “bultos en la espalda”, malestar general y alteración en la menstruación, y en un 0,8% otros efectos (angustia, cansancio, mareo, hipotensión, pérdida de visión, miedo, nauseas, prurito).
Reacciones adversas por provincia
| Provincia | Total | Con reacción | % con reacción |
| Almería | 121 | 35 | 28,93 (21.05-37.87) |
| Cádiz | 165 | 41 | 24,85 (18.46-32.16) |
| Córdoba | 277 | 78 | 28,16 (22.94-33.85) |
| Granada | 250 | 58 | 23,20 (18.11-28.93) |
| Huelva | 181 | 36 | 19,89 (14.34-26.46) |
| Jaén | 237 | 33 | 13,92 (9.78-18.99) |
| Málaga | 369 | 71 | 19,24 (15.34-23.64) |
| Sevilla | 524 | 115 | 21,95 (18.47-25.74) |
| Total | 2124 | 467 | 22 (20.24-23.81) |
Los resultados del estudio concuerdan con lo descrito en la literatura científica. Ensayos clínicos sobre eficacia y seguridad de la vacuna14–17 muestran efectos adversos relacionados con el lugar de inyección (eritema, dolor, hinchazón) y efectos adversos sistémicos (cefaleas, fiebre, dolor de la faringe), aunque no muestran diferencias significativas en el número de reacciones adversas graves entre los vacunados y el grupo placebo. El Centro Andaluz de Farmacovigilancia18 informa de que, a fecha 27 de abril del presente año, se han recibido 51 notificaciones de sospecha de reacciones asociadas a la vacuna, de las que el 29,8% fueron trastornos del sistema nervioso y el 21% trastornos generales y alteraciones en el lugar de inyección. Nuestro trabajo muestra que la fiebre, la inflamación y el dolor se dan ligeramente más en la primera dosis que en la segunda, mientras que el enrojecimiento ocurre más en la segunda dosis.
En la literatura científica, entre los problemas neurológicos asociados, destaca por su mayor frecuencia el síncope19-22. Sin evidencia de etiología orgánica, estos casos podrían ser el resultado de una respuesta psicogénica en masa22,23. Algunos autores24,25 argumentan que puede ser producido por el propio procedimiento médico (inyección). De hecho, está documentado que el síncope ocurre tras vacunaciones, especialmente en adolescentes, y que pueden originar hospitalizaciones. Los síntomas generalmente incluyen dolor de cabeza, mareos, debilidad y pérdida de conciencia26.
Como limitaciones de nuestro trabajo, el porcentaje de respuesta del 41,9% se puede considerar moderado para esta forma de administrar un cuestionario. Comparada con la entrevista personal, la telefónica permite administrar un cuestionario a muchas personas de una amplia área geográfica en poco tiempo. Tiene un coste y una tasa de respuestas intermedia entre el envío postal y la entrevista personal. Lo ideal hubiera sido realizar una entrevista personal pero, por el coste y la extensión geográfica, se eligió la telefónica.
Por provincias, el porcentaje de reacciones adversas varía entre el 13 y el 28%, con diferencias estadísticamente significativas, lo que podría reflejar una diferencia importante del método de inyección y la detección de la reacción. Además, la representatividad de las provincias no es exacta, ya que el número de encuestas no es proporcional al número de habitantes dado que se ha pretendido una representación según el número de puntos de vacunación por provincia, a fin de evitar posibles sesgos, ya que al administrar en un mismo punto de vacunación muchas dosis se pueden producir problemas por la propia administración o por la conservación.
Por último, cabe destacar la necesidad de hacer otros estudios con más peso en la tercera dosis, ya que en este, no se ha podido valorar.
Como conclusión, podemos afirmar que aproximadamente una cuarta parte de los encuestados refieren reacciones adversas, siendo el dolor y la inflamación las más frecuentes, aunque ninguna puede ser considerada grave. A tenor de los resultados, se puede decir que la vacuna es segura, lo que concuerda con lo recogido en la ficha técnica y en la literatura científica.
- •
La vacuna contra el virus del papiloma humano (VPH) es la primera vacuna diseñada para prevenir el cáncer inducido por un virus.
- •
Las notificaciones de convulsiones o términos asociados en España y Europa provocaron gran alarma social.
- •
Los datos preliminares aportados por la compañía muestran 663 notificaciones de sospecha de reacciones adversas que describen crisis convulsivas.
- •
Las principales reacciones adversas descritas son fiebre, inflamación, dolor o enrojecimiento y se dieron en un 22% de encuestas.
- •
Se puede decir que es una vacuna segura, lo que concuerda con lo recogido en ficha técnica y en la literatura.
Los autores declaran no tener ningún conflicto de intereses.