evaluar el rendimiento de la visualización directa por endoscopia en la identificación de lesiones gástricas premalignas, utilizando como prueba de referencia el examen histopatológico de muestras obtenidas por biopsia.
Emplazamientoliga de Lucha Contra el Cáncer, de Bucaramanga, Colombia.
Diseñoestudio de evaluación de tecnologías diagnósticas con muestreo transversal.
Mediciones principalesse calculó la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo, el likelihood ratio positivo, el likelihood ratio negativo, el índice kappa y la prevalencia.
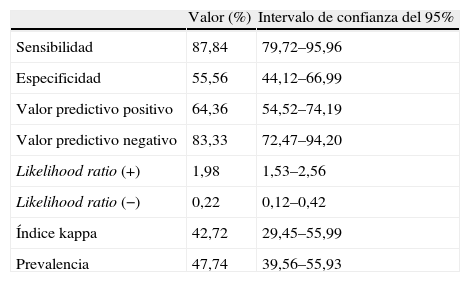
Resultadosse estudió a 155 pacientes con una media de edad de 45,43±14,15 años y una relación varón:mujer aproximada de 2:1. La visualización por endoscopia tuvo una sensibilidad del 87,84%, una especificidad del 55,56%, un valor predictivo positivo del 64,36%, un valor predictivo negativo del 83,33%, un likelihood ratio positivo de 1,98, un likelihood ratio negativo de 0,22 y un índice kappa de 0,4272, en la identificación de lesiones preneoplásicas del estómago en una población con una prevalencia de la enfermedad del 47,74%.
Conclusionesla visualización mediante endoscopia de la mucosa gastrointestinal permite una rápida y moderada identificación de lesiones preneoplásicas tempranas, lo que da la posibilidad de su diagnóstico histopatológico precoz.
To evaluate the performance of endoscopic visualization in the identification of premalignant gastric lesions, with histopathological examination of biopsy samples as a reference test, in Bucaramanga, Colombia.
LocationLeague for the Fight Against Cancer, Bucaramanga, Colombia.
DesignDiagnostic technology evaluation with cross-sectional sampling.
MeasurementsWe calculate the sensitivity, specificity, positive predictive value, negative predictive value, likelihood ratio (+), likelihood ratio (−), kappa index and the prevalence rate kappa.
ResultsA total of 155 patients were studied, with a mean age of 45.43 (14.15) years and an approximate male:female ratio of 2:1. The endoscopic visualization had a sensitivity of 87.84%, a specificity of 55.56%, a positive predictive value of 64.36%, a negative predictive value of 83.33%, a likelihood ratio+of 1.98, a likelihood ratio−de 0.22 and a kappa index of 0.4272, in the identification of preneoplastic lesions of the stomach in a population with a disease prevalence of 47.74%.
ConclusionsThe endoscopic visualization of the gastrointestinal mucosa, allows a moderate and fast identification of early preneoplastic lesions, providing an opportunity of its early histopathological diagnosis.
Las enfermedades crónicas del sistema gastrointestinal superior, entre las que se encuentran la gastritis, la úlcera péptica, el reflujo gastroesofágico y el cáncer gástrico, son una de las mayores causas de morbilidad y mortalidad en el mundo1–3. La última de ellas, el cáncer gástrico, es una de las neoplasias más prevalentes2,3, que representa el 9,9% de todos los tipos de cáncer y es la segunda causa de muerte en el mundo, con 650.000 muertes al año, luego del cáncer de pulmón4. Además, es la principal causa de muerte por enfermedades neoplásicas en muchos países3–5, entre ellos Colombia, donde afecta a 36/100.000 personas-año y causa 27,6 muertes/100.000 personas-año6,7. La razón de su elevada mortalidad se debe a su difícil diagnóstico temprano, ya que en la mayoría de los casos sólo se identifica en estadios avanzados3,8, esto a pesar de que la historia natural del cáncer gástrico ha sido ampliamente estudiada y se han determinado numerosas lesiones preneoplásicas, que preceden a la enfermedad durante muchos años, entre las que se incluyen gastritis crónica, metaplasia intestinal y displasia9,10. Para identificar este espectro de lesiones se han estudiado numerosos métodos de detección11,12, entre ellos, el más habitual es la evaluación endoscópica e histopatológica de la mucosa gástrica10–12. Sin embargo, este método, aunque eficiente en algunos países como Japón13–15, ha sido poco costo-efectivo en otros16, lo cual se puede deber al escaso acceso abierto de la población a este examen, aun en países desarrollados17, y que llega a cifras preocupantes en países en vía de desarrollo con altas tasas de mortalidad, como Colombia7,18, al igual que en otros países con alta prevalencia de la enfermedad y sistemas de salud poco acuciosos19. Por todo lo anterior se ha propuesto realizar el cribado sólo mediante visualización endoscópica para la detección de lesiones preneoplásicas y neoplásicas del estómago. La evaluación endoscópica de las anormalidades gastrointestinales comúnmente depende del reconocimiento de lesiones visibles8. Esta evaluación permite reconocer muchas lesiones con las ventajas económicas que supone, especialmente en la detección de estadios tempranos20. En Colombia, esta metodología no se ha evaluado. Por tanto, se traza como objetivo evaluar el rendimiento de la visualización directa por endoscopia en la identificación de lesiones gástricas premalignas, utilizando como prueba de referencia el examen histopatológico de muestras obtenidas por biopsia, en Bucaramanga, Colombia.
Material y métodosPoblación y muestraEste estudio se realizó con los pacientes estudiados en el programa de detección precoz para cáncer gástrico en la Liga Santandereana de Lucha Contra el Cáncer, única institución que posee este tipo de programas para esta enfermedad en Bucaramanga (Colombia), entre los años 2004 y 2005. Los pacientes fueron atendidos por la unidad de gastroenterología para estudio de lesiones neoplásicas y preneoplásicas del estómago, todos los pacientes presentaron algún síntoma gastrointestinal y/o factor de riesgo para desarrollar lesiones neoplásicas gástricas. A estos pacientes se les realizó una entrevista clínica y una endoscopia gastrointestinal superior por médicos gastroenterólogos con entrenamiento en endoscopia gastrointestinal, quienes estaban enmascarados con respecto a los datos clínicos de los sujetos a estudio. Las lesiones encontradas en la endoscopia se clasificaron según la American Society for Gastrointestinal Endoscopy (ASGE)21,22. Luego, se tomaron biopsias de cada paciente y el material quirúrgico se envió para valoración histopatológica, que fue realizada, mediante la coloración de hematoxilina-eosina, por médicos patólogos con entrenamiento en patología gastrointestinal, enmascarados con respecto a los datos clínicos y el estudio endoscópico; los resultados fueron clasificados según la Organización Mundial de la Salud (OMS)23. Para realizar la validación se consideró si los pacientes presentaban o no lesión premaligna, dentro de las lesiones premalignas se agruparon: gastritis crónica, atrofia, metaplasia intestinal y displasia. En este estudio se incluyó a los pacientes que participaron en el programa de detección precoz de cáncer gástrico desde enero de 2004 a diciembre de 2005 y se excluyó a los pacientes sin seguimiento en la institución.
Aspectos éticosLa investigación se realizó de acuerdo con la legislación nacional (Constitución Política Nacional de 1991 y resolución 008430 de 1993) e internacional (Declaración de Helsinki). Fue aprobada por las directivas de los servicios donde fue realizada, y catalogada como una investigación sin riesgo. Como examen de referencia se tomó el examen histopatológico de biopsia.
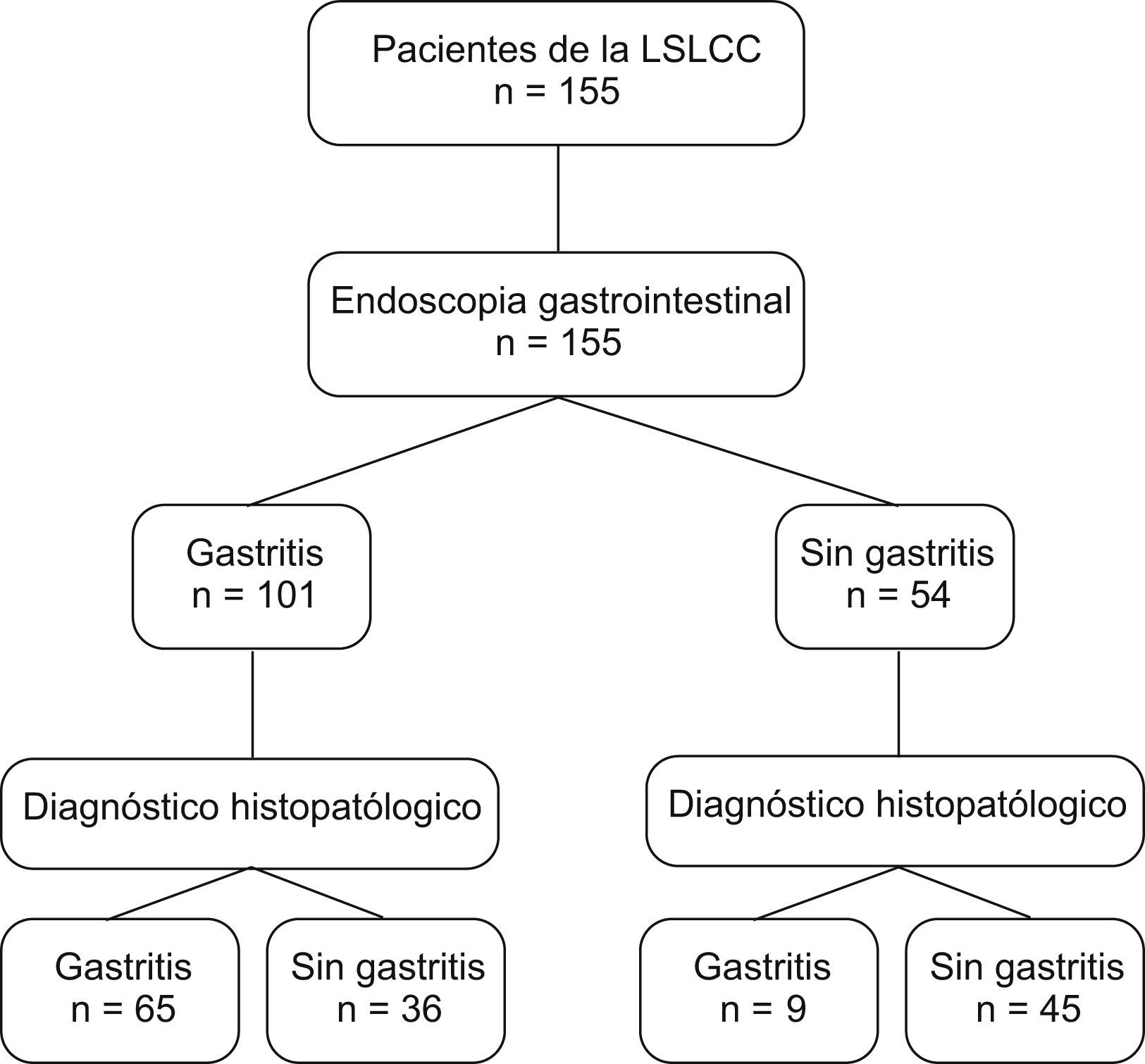
AnálisisSe estimó un tamaño de muestra mínimo de 130 pacientes según el método de Kraemer24. Se calculó, por medio de un muestreo transversal24, la sensibilidad, la especificidad, el valor predictivo positivo (VPP) y el negativo (VPN), el likelihood ratio (LR) (+), el likelihood ratio (−) y el índice kappa. Se calcularon además los intervalos de confianza (IC) del 95% para sensibilidad, especificidad, VPP, VPN, LR (+), LR (−), índice kappa y prevalencia. Para el manejo estadístico de los datos se utilizaron los programas EpiInfo versión abril 2004 (CDC, Estados Unidos), y Stata versión 10.0 (esquema 1).
Esquema del estudioPoblación a estudio.
LSLCC: Liga Santandereana de Lucha Contra el Cáncer.
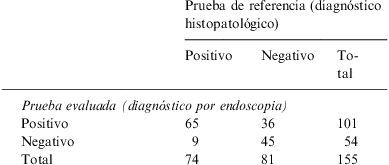
ResultadosSe estudió a 155 pacientes, con una relación varón:mujer aproximada de 2:1; 103 (66,5%) varones y 52 (33,5%) mujeres, la edad de los pacientes estaba entre los 15 y los 93 años, con una media±desviación estándar de 45,43±14,15 años y una mediana de 43 años. Los resultados obtenidos con la endoscopia y el examen histopatológico de la biopsia se muestran en la tabla 1. El rendimiento de la endoscopia gástrica en la identificación de gastritis se presenta en la tabla 2.
Tabla de contingencia 2×2 del muestreo
| Prueba de referencia (diagnóstico histopatológico) | |||
| Positivo | Negativo | Total | |
| Prueba evaluada (diagnóstico por endoscopia) | |||
| Positivo | 65 | 36 | 101 |
| Negativo | 9 | 45 | 54 |
| Total | 74 | 81 | 155 |
Valores de rendimiento de la endoscopia para el diagnóstico de gastritis
| Valor (%) | Intervalo de confianza del 95% | |
| Sensibilidad | 87,84 | 79,72–95,96 |
| Especificidad | 55,56 | 44,12–66,99 |
| Valor predictivo positivo | 64,36 | 54,52–74,19 |
| Valor predictivo negativo | 83,33 | 72,47–94,20 |
| Likelihood ratio (+) | 1,98 | 1,53–2,56 |
| Likelihood ratio (−) | 0,22 | 0,12–0,42 |
| Índice kappa | 42,72 | 29,45–55,99 |
| Prevalencia | 47,74 | 39,56–55,93 |
En Colombia, el cáncer gástrico es la principal causa de mortalidad por enfermedad neoplásica6,7, y las lesiones preneoplásicas en esta localización son muy comunes7. Sumado a esto en Colombia no hay una política oficial para la detección y el manejo de estas enfermedades y los programas de detección temprana en nuestro país se realizan sólo gracias a la labor de entidades no gubernamentales como la Liga de Lucha contra el Cáncer25. Este panorama es grave, ya que está en relación con el continuo aumento que han mostrado las cifras de mortalidad por estas enfermedades26.
El cribado realizado actualmente en muchos países consiste en la evaluación endoscópica e histopatológica del sistema gastrointestinal para la detección de enfermedades neoplásicas y preneoplásicas10–19, a pesar de los intentos de establecer este sistema como método universal de detección de cáncer gástrico, ha mostrado una baja costo-efectividad, además tiene poca cobertura, lo cual puede ser debido al alto costo que implica realizar un examen histopatológico completo que incluya tinciones histoquímicas para Helicobacter pylori a la totalidad de los pacientes evaluados11–13,27,28. Para disminuir estos costos, es aceptado actualmente que el cribado se realice sólo a los pacientes sintomáticos o con factores de riesgo para enfermedad gastrointestinal superior10–19,25–29. A pesar de esto no se ha logrado una cobertura aceptable10–19. Por esta razón se ha propuesto realizar evaluación endoscópica sólo a los pacientes con factores de riesgo para neoplasias gastrointestinales, para la evaluación de su enfermedad, y si presentan alguna alteración, que se realice biopsia8, y no realizar examen histopatológico a los pacientes sin lesiones aparentes; ya que la detección endoscópica de las anormalidades gastrointestinales depende del reconocimiento de lesiones mucosas visibles11 y ésta tiene múltiples ventajas clínicas y económicas, especialmente en la detección de lesiones tempranas19.
En este estudio se encontró un valor predictivo negativo y de sensibilidad moderados, lo cual se traduce en que este examen pueda ser útil en el cribado de lesiones preneoplásicas, al mismo tiempo la especificidad y el valor predictivo positivo fueron aceptables, que se puede interpretar que es útil en el cribado inicial de pacientes con síntomas gastrointestinales o con factores de riesgo para desarrollar lesiones neoplásicas. Los valores de LR (+) y LR (−) indican un cambio en la probabilidad de que el paciente tenga una lesión preneoplásica o no, según fuere positivo o negativo el resultado. Si utilizamos el nomograma de Fagan29 para este caso en particular, tenemos que el valor de LR (+) indica que, cuando la prueba es positiva, hay una probabilidad cercana al 63% de que el paciente tenga en realidad una lesión preneoplásica. De igual forma el LR (−) indica baja probabilidad, luego del examen con resultado negativo, de estar ante un paciente con el diagnóstico evaluado, en nuestro estudio esta cifra fue del 10%. Otros estudios similares han encontrado adecuados valores de rendimiento para la evaluación endoscópica de la mucosa en la identificación de lesiones preneoplásicas y neoplásicas con sensibilidades y especificidades similares8,17,19; sin embargo, también hay muchos estudios que informan una alta y significativa proporción de falsos positivos y negativos si se realiza el diagnóstico sólo con la endoscopia convencional11,12,14. Por esto se debe hacer énfasis en que la evaluación por endoscopia sólo tiene utilidad en el cribado inicial y que el diagnóstico final se logra únicamente con la evaluación histopatológica completa de la biopsia que incluya tinciones histoquímicas especiales, como Giemsa, Diff Quik o Steiner, que permiten determinar la naturaleza de la lesión, estudiar las lesiones preneoplásicas y establecer la presencia de infección por H. pylori; solamente con esta metodología se pueden tomar decisiones clínicas adecuadas17,27,28, hecho avalado por este estudio, ya que el valor de especificidad, si se utiliza sólo la endoscopia, se encuentra tan sólo entre el 44,12 y el 66,99%; además, la concordancia entre los dos métodos de examen es escaso con un índice kappa del 42,72%. Por lo cual se propone realizar la biopsia en todo caso con una lesión en el estómago y dejar a criterio del clínico su realización cuando se encuentre un estómago sano en la visualización endoscópica. Además, aunque se han estudiado otros métodos de detección temprana de cáncer gástrico, como las concentraciones séricas de pepsinógeno y gastrina, además de la espectroscopia infrarroja30,31, no se ha evaluado su costo-efectividad en poblaciones de países en vías de desarrollo, y no se pueden realizar apreciaciones sobre su uso.
En conclusión, la visualización mediante endoscopia de la mucosa gastrointestinal permite una rápida y moderada identificación de lesiones preneoplásicas tempranas, lo que da la posibilidad de un diagnóstico histopatológico precoz.
- •
Las enfermedades crónicas del sistema gastrointestinal superior son una de las mayores causas de morbilidad y mortalidad en el mundo, y el cáncer gástrico es la principal causa de muerte en Colombia.
- •
La elevada mortalidad del cáncer gástrico se debe a su difícil diagnóstico temprano, para lograr esta meta se ha utilizado la evaluación endoscópica e histopatológica de la mucosa gástrica.
- •
La endoscopia-biopsia ha mostrado una eficiencia variable con altos costos, por lo tanto se ha recomendado realizar sólo el reconocimiento endoscópico para obtener ventajes económicas.
- •
La endoscopia puede interpretarse como un examen útil en el cribado inicial de pacientes con síntomas gastrointestinales o con factores de riesgo para desarrollar lesiones neoplásicas.
- •
Hay muchos falsos positivos y negativos si se realiza el diagnóstico sólo con la endoscopia convencional. Por esto es aconsejable hacer una biopsia ante resultados positivos.