El cáncer es una de las principales causas de morbilidad y mortalidad. El consumo de tabaco, la dieta poco saludable, la inactividad física son algunos de los factores de riesgo que forman parte del estilo de vida y que han provocado un aumento del cáncer. En este artículo se actualizan las evidencias y recomendaciones de las estrategias de prevención para cada uno de los cánceres con mayor incidencia, con base en la disminución de los factores de riesgo (prevención primaria) y en el diagnóstico precoz del cáncer, a través del cribado y la detección temprana de los signos y síntomas, en población de riesgo medio y de riesgo elevado.
Cancer is a major cause of morbidity and mortality. Tobacco use, unhealthy diet, and physical inactivity are some of the lifestyle risk factors that have led to an increase in cancer. This article updates the evidence, and includes recommendations for prevention strategies for each of the cancers with the highest incidence. These are based on the reduction of risk factors (primary prevention) and early diagnosis of cancer through screening and early detection of signs and symptoms, in medium-risk and high-risk populations.
En este artículo, el grupo de Prevención del Cáncer del Programa de Actividades Preventivas y de Promoción de la Salud (PAPPS) de la Sociedad Española de Medicina Familiar y Comunitaria (semFYC) actualiza las evidencias y recomendaciones sobre prevención y detección precoz del cáncer en población de riesgo medio y riesgo elevado1. Para clasificar la calidad de la evidencia y la fuerza de las recomendaciones, hemos utilizado el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation)2,3. La evaluación de la calidad de la evidencia nos permite conocer el grado de confianza que tenemos en los resultados de la literatura2,3. En otras palabras, hasta qué punto confiamos o no en los resultados obtenidos en los estudios localizados. Las recomendaciones pueden ser clasificadas según su dirección y su fuerza2,3. Según GRADE, su dirección puede ser a favor o en contra de la intervención evaluada y, según su fuerza, se les divide en fuertes o débiles (también denominadas condicionales). GRADE tiene en cuenta criterios para determinar la dirección y la fuerza de las recomendaciones: a) el balance entre los beneficios y riesgos e inconvenientes; b) la confianza en la magnitud de las estimaciones del efecto de la intervención en los desenlaces importantes (calidad global de la evidencia); c) los valores y preferencias de los pacientes, y d) el uso de recursos y costes2,3.
La magnitud del cáncerLos registros de cáncer poblacionales realizan una labor continua y sistemática de recopilación, análisis e interpretación de datos clínicos y anatomopatológicos de las personas con cáncer en una población de un área geográfica definida (país, región, etc.). Son de utilidad para la vigilancia y el control del cáncer en la población. Los registros de mortalidad reflejan las defunciones recogidas en los sistemas nacionales de registro civil, con las causas básicas de muerte que proceden de los certificados médicos de defunción. A nivel mundial, los datos y estadísticas sobre el cáncer quedan recogidos y se pueden consultar a través de:
- •
GLOBOCAN (Global Cancer Observatory), la cual es una base de datos online de la International Agency for Research on Cancer (IARC), que forma parte de la Organización Mundial de la Salud (OMS). La información del GLOBOCAN 2018 se ha incorporado al proyecto Cancer Today4.
- •
CONCORD, programa para la vigilancia mundial de la supervivencia de cáncer liderado por la London School of Hygiene & Tropical Medicine5. Cuenta con el respaldo de 40 agencias nacionales e internacionales, entre ellas la WHO EURO, la Organización para la Cooperación y el Desarrollo Económico (OCDE) y el Banco Mundial. En 2018 se han publicado los resultados del estudio CONCORD-36.
- •
A escala nacional se dispone de los datos de incidencia elaborados por la Red Española de Registros de Cáncer (REDECAN)7 (https://www.redecan.es) y las de las estadísticas de mortalidad del Instituto Nacional de Estadística (INE) (http://ariadna.cne.isciii.es).
En España, el cáncer es la segunda causa de muerte por detrás de las enfermedades cardiovasculares y representa el 26,4% del total de defunciones8. Diferenciado por sexos, el cáncer es la primera causa de muerte en hombres (tasa bruta 297,8 fallecidos por cada 100.000) y en mujeres ocupa el segundo lugar (186,7 por cada 100.000).
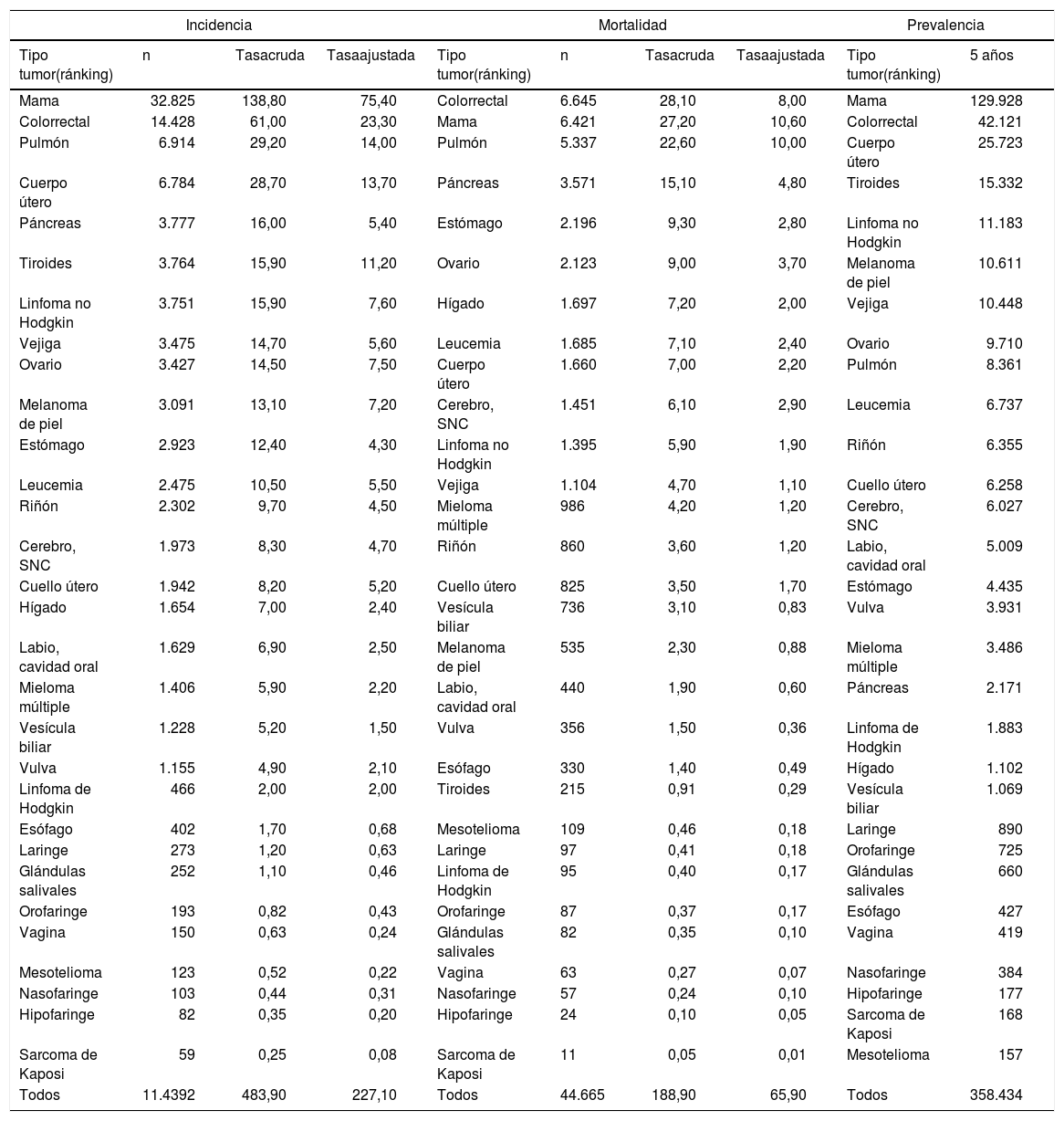
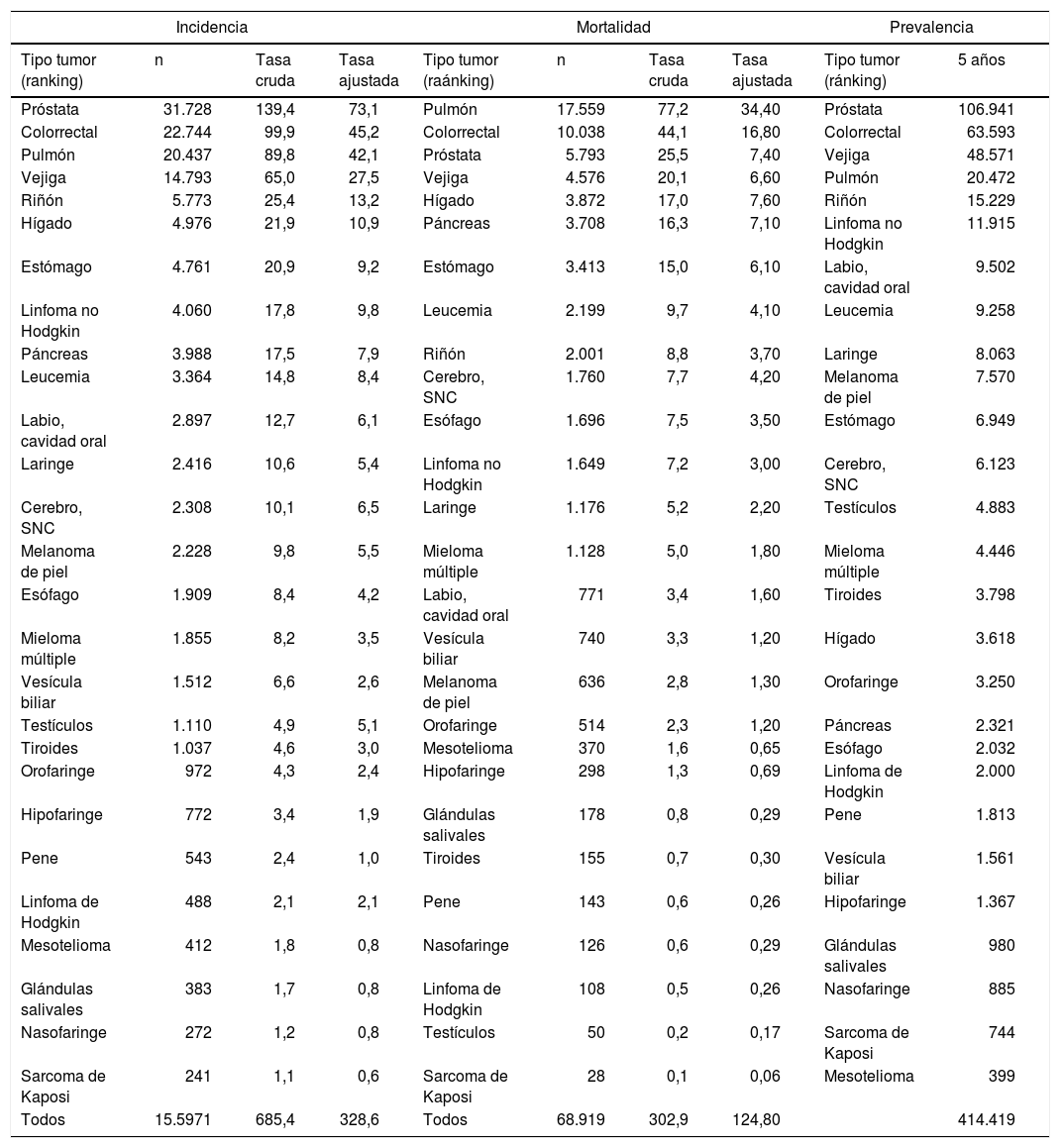
En España, en el año 2018, se estimaron un total de 270.363 nuevos casos de cáncer invasivo (tasa estandarizada por población mundial de 272,3 casos por cada 100.000), 155.971 en hombres (tasa estandarizada por población mundial de 328,6 casos por cada 100.000) y 114.392 en mujeres (tasa estandarizada por población mundial de 227,1 casos por cada 100.000)9. Estas tasas, comparadas con las de los países occidentales, se sitúan en una posición intermedia-baja. Los cinco cánceres más comunes en las mujeres son: mama, CCR, pulmón, endometrio y páncreas (tabla 1a); y en hombres son: próstata, colorrectal (CCR), pulmón, vejiga urinaria y riñón (tabla 1b). El envejecimiento de la población y el no seguir determinados estilos de vida saludables son factores que explican el aumento en el número de casos de cáncer.
Estimaciones de incidencia, mortalidad y prevalencia a cinco años. España 2018. Hombres
| Incidencia | Mortalidad | Prevalencia | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Tipo tumor (ranking) | n | Tasa cruda | Tasa ajustada | Tipo tumor (raánking) | n | Tasa cruda | Tasa ajustada | Tipo tumor (ránking) | 5 años |
| Próstata | 31.728 | 139,4 | 73,1 | Pulmón | 17.559 | 77,2 | 34,40 | Próstata | 106.941 |
| Colorrectal | 22.744 | 99,9 | 45,2 | Colorrectal | 10.038 | 44,1 | 16,80 | Colorrectal | 63.593 |
| Pulmón | 20.437 | 89,8 | 42,1 | Próstata | 5.793 | 25,5 | 7,40 | Vejiga | 48.571 |
| Vejiga | 14.793 | 65,0 | 27,5 | Vejiga | 4.576 | 20,1 | 6,60 | Pulmón | 20.472 |
| Riñón | 5.773 | 25,4 | 13,2 | Hígado | 3.872 | 17,0 | 7,60 | Riñón | 15.229 |
| Hígado | 4.976 | 21,9 | 10,9 | Páncreas | 3.708 | 16,3 | 7,10 | Linfoma no Hodgkin | 11.915 |
| Estómago | 4.761 | 20,9 | 9,2 | Estómago | 3.413 | 15,0 | 6,10 | Labio, cavidad oral | 9.502 |
| Linfoma no Hodgkin | 4.060 | 17,8 | 9,8 | Leucemia | 2.199 | 9,7 | 4,10 | Leucemia | 9.258 |
| Páncreas | 3.988 | 17,5 | 7,9 | Riñón | 2.001 | 8,8 | 3,70 | Laringe | 8.063 |
| Leucemia | 3.364 | 14,8 | 8,4 | Cerebro, SNC | 1.760 | 7,7 | 4,20 | Melanoma de piel | 7.570 |
| Labio, cavidad oral | 2.897 | 12,7 | 6,1 | Esófago | 1.696 | 7,5 | 3,50 | Estómago | 6.949 |
| Laringe | 2.416 | 10,6 | 5,4 | Linfoma no Hodgkin | 1.649 | 7,2 | 3,00 | Cerebro, SNC | 6.123 |
| Cerebro, SNC | 2.308 | 10,1 | 6,5 | Laringe | 1.176 | 5,2 | 2,20 | Testículos | 4.883 |
| Melanoma de piel | 2.228 | 9,8 | 5,5 | Mieloma múltiple | 1.128 | 5,0 | 1,80 | Mieloma múltiple | 4.446 |
| Esófago | 1.909 | 8,4 | 4,2 | Labio, cavidad oral | 771 | 3,4 | 1,60 | Tiroides | 3.798 |
| Mieloma múltiple | 1.855 | 8,2 | 3,5 | Vesícula biliar | 740 | 3,3 | 1,20 | Hígado | 3.618 |
| Vesícula biliar | 1.512 | 6,6 | 2,6 | Melanoma de piel | 636 | 2,8 | 1,30 | Orofaringe | 3.250 |
| Testículos | 1.110 | 4,9 | 5,1 | Orofaringe | 514 | 2,3 | 1,20 | Páncreas | 2.321 |
| Tiroides | 1.037 | 4,6 | 3,0 | Mesotelioma | 370 | 1,6 | 0,65 | Esófago | 2.032 |
| Orofaringe | 972 | 4,3 | 2,4 | Hipofaringe | 298 | 1,3 | 0,69 | Linfoma de Hodgkin | 2.000 |
| Hipofaringe | 772 | 3,4 | 1,9 | Glándulas salivales | 178 | 0,8 | 0,29 | Pene | 1.813 |
| Pene | 543 | 2,4 | 1,0 | Tiroides | 155 | 0,7 | 0,30 | Vesícula biliar | 1.561 |
| Linfoma de Hodgkin | 488 | 2,1 | 2,1 | Pene | 143 | 0,6 | 0,26 | Hipofaringe | 1.367 |
| Mesotelioma | 412 | 1,8 | 0,8 | Nasofaringe | 126 | 0,6 | 0,29 | Glándulas salivales | 980 |
| Glándulas salivales | 383 | 1,7 | 0,8 | Linfoma de Hodgkin | 108 | 0,5 | 0,26 | Nasofaringe | 885 |
| Nasofaringe | 272 | 1,2 | 0,8 | Testículos | 50 | 0,2 | 0,17 | Sarcoma de Kaposi | 744 |
| Sarcoma de Kaposi | 241 | 1,1 | 0,6 | Sarcoma de Kaposi | 28 | 0,1 | 0,06 | Mesotelioma | 399 |
| Todos | 15.5971 | 685,4 | 328,6 | Todos | 68.919 | 302,9 | 124,80 | 414.419 | |
SNC: sistema nervioso central.
Fuente: Global Cancer Observatory (GCO), 20184.
Estimaciones de incidencia, mortalidad y prevalencia a cinco años. España 2018. Mujeres
| Incidencia | Mortalidad | Prevalencia | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Tipo tumor(ránking) | n | Tasacruda | Tasaajustada | Tipo tumor(ránking) | n | Tasacruda | Tasaajustada | Tipo tumor(ránking) | 5 años |
| Mama | 32.825 | 138,80 | 75,40 | Colorrectal | 6.645 | 28,10 | 8,00 | Mama | 129.928 |
| Colorrectal | 14.428 | 61,00 | 23,30 | Mama | 6.421 | 27,20 | 10,60 | Colorrectal | 42.121 |
| Pulmón | 6.914 | 29,20 | 14,00 | Pulmón | 5.337 | 22,60 | 10,00 | Cuerpo útero | 25.723 |
| Cuerpo útero | 6.784 | 28,70 | 13,70 | Páncreas | 3.571 | 15,10 | 4,80 | Tiroides | 15.332 |
| Páncreas | 3.777 | 16,00 | 5,40 | Estómago | 2.196 | 9,30 | 2,80 | Linfoma no Hodgkin | 11.183 |
| Tiroides | 3.764 | 15,90 | 11,20 | Ovario | 2.123 | 9,00 | 3,70 | Melanoma de piel | 10.611 |
| Linfoma no Hodgkin | 3.751 | 15,90 | 7,60 | Hígado | 1.697 | 7,20 | 2,00 | Vejiga | 10.448 |
| Vejiga | 3.475 | 14,70 | 5,60 | Leucemia | 1.685 | 7,10 | 2,40 | Ovario | 9.710 |
| Ovario | 3.427 | 14,50 | 7,50 | Cuerpo útero | 1.660 | 7,00 | 2,20 | Pulmón | 8.361 |
| Melanoma de piel | 3.091 | 13,10 | 7,20 | Cerebro, SNC | 1.451 | 6,10 | 2,90 | Leucemia | 6.737 |
| Estómago | 2.923 | 12,40 | 4,30 | Linfoma no Hodgkin | 1.395 | 5,90 | 1,90 | Riñón | 6.355 |
| Leucemia | 2.475 | 10,50 | 5,50 | Vejiga | 1.104 | 4,70 | 1,10 | Cuello útero | 6.258 |
| Riñón | 2.302 | 9,70 | 4,50 | Mieloma múltiple | 986 | 4,20 | 1,20 | Cerebro, SNC | 6.027 |
| Cerebro, SNC | 1.973 | 8,30 | 4,70 | Riñón | 860 | 3,60 | 1,20 | Labio, cavidad oral | 5.009 |
| Cuello útero | 1.942 | 8,20 | 5,20 | Cuello útero | 825 | 3,50 | 1,70 | Estómago | 4.435 |
| Hígado | 1.654 | 7,00 | 2,40 | Vesícula biliar | 736 | 3,10 | 0,83 | Vulva | 3.931 |
| Labio, cavidad oral | 1.629 | 6,90 | 2,50 | Melanoma de piel | 535 | 2,30 | 0,88 | Mieloma múltiple | 3.486 |
| Mieloma múltiple | 1.406 | 5,90 | 2,20 | Labio, cavidad oral | 440 | 1,90 | 0,60 | Páncreas | 2.171 |
| Vesícula biliar | 1.228 | 5,20 | 1,50 | Vulva | 356 | 1,50 | 0,36 | Linfoma de Hodgkin | 1.883 |
| Vulva | 1.155 | 4,90 | 2,10 | Esófago | 330 | 1,40 | 0,49 | Hígado | 1.102 |
| Linfoma de Hodgkin | 466 | 2,00 | 2,00 | Tiroides | 215 | 0,91 | 0,29 | Vesícula biliar | 1.069 |
| Esófago | 402 | 1,70 | 0,68 | Mesotelioma | 109 | 0,46 | 0,18 | Laringe | 890 |
| Laringe | 273 | 1,20 | 0,63 | Laringe | 97 | 0,41 | 0,18 | Orofaringe | 725 |
| Glándulas salivales | 252 | 1,10 | 0,46 | Linfoma de Hodgkin | 95 | 0,40 | 0,17 | Glándulas salivales | 660 |
| Orofaringe | 193 | 0,82 | 0,43 | Orofaringe | 87 | 0,37 | 0,17 | Esófago | 427 |
| Vagina | 150 | 0,63 | 0,24 | Glándulas salivales | 82 | 0,35 | 0,10 | Vagina | 419 |
| Mesotelioma | 123 | 0,52 | 0,22 | Vagina | 63 | 0,27 | 0,07 | Nasofaringe | 384 |
| Nasofaringe | 103 | 0,44 | 0,31 | Nasofaringe | 57 | 0,24 | 0,10 | Hipofaringe | 177 |
| Hipofaringe | 82 | 0,35 | 0,20 | Hipofaringe | 24 | 0,10 | 0,05 | Sarcoma de Kaposi | 168 |
| Sarcoma de Kaposi | 59 | 0,25 | 0,08 | Sarcoma de Kaposi | 11 | 0,05 | 0,01 | Mesotelioma | 157 |
| Todos | 11.4392 | 483,90 | 227,10 | Todos | 44.665 | 188,90 | 65,90 | Todos | 358.434 |
SNC: sistema nervioso central.
Fuente: Global Cancer Observatory (GCO), 20184.
En el año 2018, ocurrieron un total de 113.584 defunciones por cáncer (tasa estandarizada por población mundial de 92,3 defunciones por cada 100.000): 68.919 en hombres (124,8 casos por cada 100.000) y 44.665 en mujeres (65,9 defunciones por cada 100.000)9. Los cinco cánceres con mayor mortalidad en las mujeres: CCR, mama, pulmón, páncreas y estómago (tabla 1a) y en hombres son: pulmón, CCR, próstata, vejiga e hígado (tabla 1b).
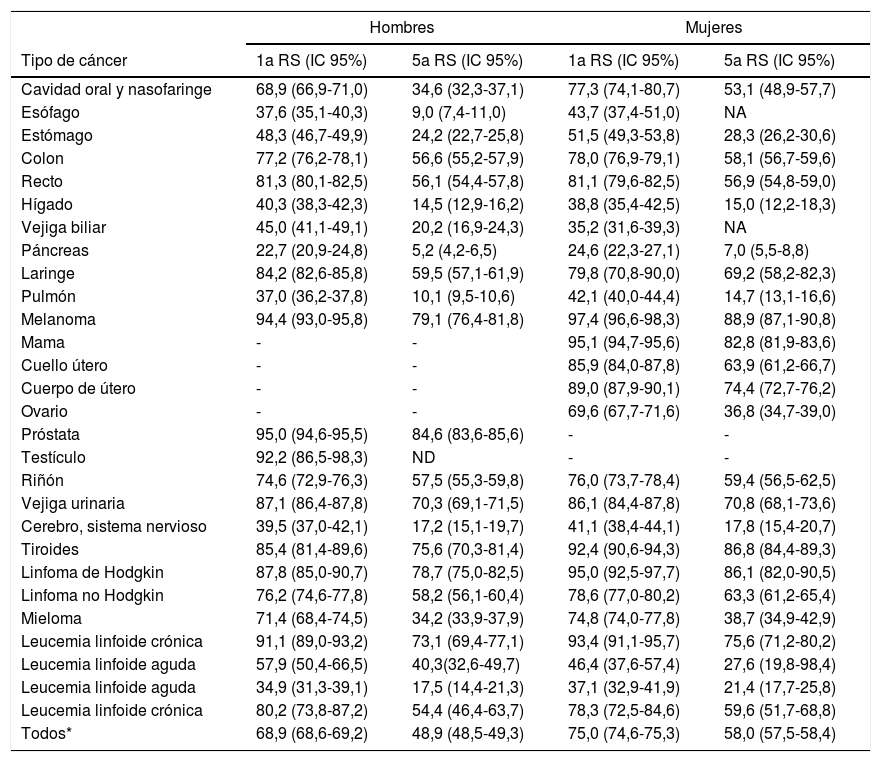
Las estimaciones de supervivencia relativa de cáncer en España según el estudio EUROCARE-5 (Survival of cancer patients in Europe), en los pacientes mayores de 15 años diagnosticados con cáncer en España en el periodo 2000-2007, se presentan en la tabla 2.
Supervivencia relativa a uno y cinco años, estandarizada por edad (intervalo de confianza del 95%), para pacientes > 15 años diagnosticados con cáncer. España en el periodo 2000-2007
| Hombres | Mujeres | |||
|---|---|---|---|---|
| Tipo de cáncer | 1a RS (IC 95%) | 5a RS (IC 95%) | 1a RS (IC 95%) | 5a RS (IC 95%) |
| Cavidad oral y nasofaringe | 68,9 (66,9-71,0) | 34,6 (32,3-37,1) | 77,3 (74,1-80,7) | 53,1 (48,9-57,7) |
| Esófago | 37,6 (35,1-40,3) | 9,0 (7,4-11,0) | 43,7 (37,4-51,0) | NA |
| Estómago | 48,3 (46,7-49,9) | 24,2 (22,7-25,8) | 51,5 (49,3-53,8) | 28,3 (26,2-30,6) |
| Colon | 77,2 (76,2-78,1) | 56,6 (55,2-57,9) | 78,0 (76,9-79,1) | 58,1 (56,7-59,6) |
| Recto | 81,3 (80,1-82,5) | 56,1 (54,4-57,8) | 81,1 (79,6-82,5) | 56,9 (54,8-59,0) |
| Hígado | 40,3 (38,3-42,3) | 14,5 (12,9-16,2) | 38,8 (35,4-42,5) | 15,0 (12,2-18,3) |
| Vejiga biliar | 45,0 (41,1-49,1) | 20,2 (16,9-24,3) | 35,2 (31,6-39,3) | NA |
| Páncreas | 22,7 (20,9-24,8) | 5,2 (4,2-6,5) | 24,6 (22,3-27,1) | 7,0 (5,5-8,8) |
| Laringe | 84,2 (82,6-85,8) | 59,5 (57,1-61,9) | 79,8 (70,8-90,0) | 69,2 (58,2-82,3) |
| Pulmón | 37,0 (36,2-37,8) | 10,1 (9,5-10,6) | 42,1 (40,0-44,4) | 14,7 (13,1-16,6) |
| Melanoma | 94,4 (93,0-95,8) | 79,1 (76,4-81,8) | 97,4 (96,6-98,3) | 88,9 (87,1-90,8) |
| Mama | - | - | 95,1 (94,7-95,6) | 82,8 (81,9-83,6) |
| Cuello útero | - | - | 85,9 (84,0-87,8) | 63,9 (61,2-66,7) |
| Cuerpo de útero | - | - | 89,0 (87,9-90,1) | 74,4 (72,7-76,2) |
| Ovario | - | - | 69,6 (67,7-71,6) | 36,8 (34,7-39,0) |
| Próstata | 95,0 (94,6-95,5) | 84,6 (83,6-85,6) | - | - |
| Testículo | 92,2 (86,5-98,3) | ND | - | - |
| Riñón | 74,6 (72,9-76,3) | 57,5 (55,3-59,8) | 76,0 (73,7-78,4) | 59,4 (56,5-62,5) |
| Vejiga urinaria | 87,1 (86,4-87,8) | 70,3 (69,1-71,5) | 86,1 (84,4-87,8) | 70,8 (68,1-73,6) |
| Cerebro, sistema nervioso | 39,5 (37,0-42,1) | 17,2 (15,1-19,7) | 41,1 (38,4-44,1) | 17,8 (15,4-20,7) |
| Tiroides | 85,4 (81,4-89,6) | 75,6 (70,3-81,4) | 92,4 (90,6-94,3) | 86,8 (84,4-89,3) |
| Linfoma de Hodgkin | 87,8 (85,0-90,7) | 78,7 (75,0-82,5) | 95,0 (92,5-97,7) | 86,1 (82,0-90,5) |
| Linfoma no Hodgkin | 76,2 (74,6-77,8) | 58,2 (56,1-60,4) | 78,6 (77,0-80,2) | 63,3 (61,2-65,4) |
| Mieloma | 71,4 (68,4-74,5) | 34,2 (33,9-37,9) | 74,8 (74,0-77,8) | 38,7 (34,9-42,9) |
| Leucemia linfoide crónica | 91,1 (89,0-93,2) | 73,1 (69,4-77,1) | 93,4 (91,1-95,7) | 75,6 (71,2-80,2) |
| Leucemia linfoide aguda | 57,9 (50,4-66,5) | 40,3(32,6-49,7) | 46,4 (37,6-57,4) | 27,6 (19,8-98,4) |
| Leucemia linfoide aguda | 34,9 (31,3-39,1) | 17,5 (14,4-21,3) | 37,1 (32,9-41,9) | 21,4 (17,7-25,8) |
| Leucemia linfoide crónica | 80,2 (73,8-87,2) | 54,4 (46,4-63,7) | 78,3 (72,5-84,6) | 59,6 (51,7-68,8) |
| Todos* | 68,9 (68,6-69,2) | 48,9 (48,5-49,3) | 75,0 (74,6-75,3) | 58,0 (57,5-58,4) |
El cáncer es fundamentalmente un problema de base genética. La etiología de la mayoría de los cánceres puede encuadrarse dentro de un modelo multifactorial y su aparición tiene un carácter esporádico11. En general, los cánceres esporádicos aparecen en edades avanzadas (a partir de los 50 años) y son consecuencia de mutaciones que afectan a las células somáticas adquiridas a lo largo de los años, ya sea por errores en la división de las células o por exposición a sustancias carcinógenas que dañan el ADN. Por otro lado, la epigenética juega un papel importante en el sistema de regulación que controla la expresión de los genes sin que se produzca afectación del ADN y está también implicada en la patogenia de algunos cánceres.
El cáncer hereditario (5-10% de los cánceres) ocurre en familias que tienen mutaciones que afectan a las células germinales (óvulos y espermatozoides)11. En la mayoría de los casos, las mutaciones se transmiten siguiendo un patrón autosómico dominante (un solo gen heredado de cualquiera de los padres es suficiente para causar la predisposición, cada hijo tiene un 50% de probabilidades de heredar la mutación). Cuando se hereda una mutación de la línea germinal, ésta va a estar presente en todas las células del cuerpo desde el nacimiento y durante toda la vida de la persona. Los portadores de mutaciones germinales tienen un riesgo elevado de desarrollar distintos tipos de cáncer a lo largo de la vida y la edad de presentación del cáncer es más precoz. Sin embargo, ser portador de una mutación genética no siempre implica que se desarrolle el cáncer y que se manifieste la enfermedad11. El conocimiento de la historia familiar permite identificar a aquellos individuos con un posible síndrome de predisposición hereditaria al cáncer (SPHC), en cuyo caso deben ser dirigidos a Unidades de Consejo Genético para, de ser preciso, realizar el test genético, asesorar y recomendar vigilancia específica a los portadores (cribados en población de alto riesgo)12. Los nuevos avances tecnológicos permiten, cada vez más, una mejor comprensión de la biología y la genética del cáncer hereditario y de los SPHC, así como la distribución de las mutaciones genéticas entre las diferentes poblaciones. Hasta la fecha se han descrito más de 200 SPHC11.
A nivel práctico, la estratificación del riesgo individual de cáncer se basa en la edad, los antecedentes personales (enfermedades predisponentes y factores de riesgo) y los antecedentes familiares12. Con esta información es posible clasificar el riesgo individual en tres categorías: riesgo bajo (< 50 años, sin antecedentes personales ni familiares de cáncer), riesgo medio (≥ 50 años, sin antecedentes personales ni familiares de cáncer) y riesgo elevado (cualquier edad, con antecedentes personales y/o familiares de cáncer). El valor predictivo positivo (VPP) de las pruebas de cribado varía en función de la categoría de riesgo.
Prevención primariaEl cáncer es una enfermedad multifactorial debida al efecto combinado de factores genéticos y factores externos (estilos de vida y ambientales). El tabaco es la principal causa de cáncer y de muerte por cáncer13,14. La dieta saludable, el consumo moderado de alcohol, el control de peso y la actividad física pueden prevenir un tercio de los cánceres más comunes15. En grupos de población específicos, la exposición a carcinógenos ocupacionales, la contaminación atmosférica, los agentes infecciosos, determinados aspectos de la vida sexual y reproductiva y el nivel socioeconómico son factores de riesgo destacables. Las desigualdades socioeconómicas condicionan los estilos de vida saludables y los patrones de comportamiento. En la tabla 3 se pueden consultar los factores de riesgo y factores de protección asociados de forma más significativa a los diferentes cánceres. En la tabla 4 se describen las recomendaciones generales del World Cancer Research Fund (WCRF) en relación a la dieta, alimentación, peso y ejercicio físico, para reducir el riesgo de cáncer y aumentar la supervivencia15. De igual modo, el Código Europeo Contra el Cáncer26 hace énfasis en las recomendaciones de prevención primaria del cáncer para la población europea (tabla 5).
Factores de riesgo y factores protectores para cáncer
| Tipo | Factores de riesgo | Factores protectores |
|---|---|---|
| Mama16 | - Edad, género femenino, raza blanca, talla alta- Obesidad en mujeres posmenopáusicas (estrógenos, hiperinsulinemia)- Estrógenos endógenos y factores reproductivos: menarquia temprana, menopausia tardía, nuliparidad, primer embarazo en edad avanzada, no lactancia materna- Uso de TH combinada en la menopausia a largo plazo- Lesiones proliferativas de mama, tejido mamario denso, mayor densidad de mama- Antecedentes personales de CDIS o cáncer invasivo, mayor riesgo de cáncer de mama contralateral- Antecedentes familiares cáncer mama de primer grado y factores hereditarios: la mutación BRCA1 confiere un riesgo del 55-70% y la BRCA2 del 45-70% (síndrome mama ovario hereditario). Otras mutaciones identificadas: p53, STK11, CDH1, PALB2, PTEN- Consumo de alcohol, tabaco, trabajar en turno de noche- Exposición a radiaciones ionizantes terapéuticas | - Actividad física vigorosa regular- Pérdida de grasa corporal- Lactancia materna- Dieta rica en frutas y verduras, pescado, productos lácteos y aceite de oliva- Quimioprevención: tamoxifeno, raloxifeno, inhibidores aromatasa |
| Cuello de útero17 | - Factores asociados a infección persistente VPH: inicio temprano relaciones sexuales, múltiples parejas sexuales, pareja sexual de alto riesgo, antecedentes de ETS (Chlamydia, herpes genital), antecedentes de neoplasia intraepitelial escamosa, vulvar o vagina o de cáncer, inmunosupresión (portadora de VIH, tratamiento inmunosupresor)- Nivel socioeconómico bajo, raza (mujeres negras no hispanas)- Anticonceptivos orales- Tabaco (carcinoma de células escamosas)- Historia familiar y diversos polimorfismos | - Cribado adecuado- Parejas sexuales son hombres circuncidados |
| Endometrio18 | - Exposición a largo plazo a estrógenos endógenos o exógenos (TH) sin una adecuada oposición de progestógenos- Tamoxifeno en mujeres postmenopáusicas (cáncer de mama)- Climaterio y síndrome de ovario poliquístico, nuliparidad, infertilidad- Obesidad (estrógenos, hiperinsulinemia)- Tumor de los cordones sexuales y del estroma del ovario e hiperplasia endometrial- Historia familiar de primer grado de cáncer de endometrio y factores hereditarios: mutaciones en los genes de reparación de bases desapareadas (Síndrome de Lynch). Otras mutaciones identificadas: PTEN y BRCA | - Anticonceptivos (estrógeno-progesterona, o progesterona sola)- Número de embarazos- Maternidad en edad avanzada- Lactancia materna- Actividad física, dieta |
| Ovario19 | - Edad, mujeres ≥ 50 años- Factores reproductivos y hormonales: menarquia temprana, menopausia tardía, nuliparidad- Endometriosis (carcinoma células claras, endometroide, seroso de bajo grado)- Tabaco (mucinoso)- Factores hereditarios: mutaciones BRCA1 y BRCA2 (síndrome de cáncer mama y ovario hereditario). Otras mutaciones (Síndrome de Lynch). | - Número de embarazos- Lactancia materna- Anticonceptivos- Histerectomía y ligadura de trompas |
| Colorrectal20 | - Edad, mujeres ≥ 50 años- Factores hereditarios: síndrome de Lynch, poliposis adenomatosa familiar. Otras mutaciones de elevada penetrancia: APC, MUTYH, BRCA1 y BRCA2, PALB2, CDKN2A y TP53- Historia personal / familiar de pólipos (adenomas, pólipos serrados) adenomatosos y CCR esporádico- Colitis ulcerosa, enfermedad de Crohn- Exposición a radiaciones ionizantes terapéuticas (cáncer de próstata)- Fibrosis quística- Raza (afroamericanos)- Acromegalia- Obesidad, diabetes e hiperinsulinemia, sedentarismo- Dieta (carne procesada y roja)- Tabaco y alcohol- Terapia de privación de andrógenos a largo plazo | - Actividad física- Dieta rica en vegetales crucíferos, fruta, cereales integrales, calcio y productos lácteos, folatos- Quimioprevención: ácido acetilsalicílico y otros antiinflamatorios no esteroideos |
| Próstata21 | - La edad es el factor de riesgo más importante, sobretodo a partir de los 50 años- Origen étnico: ascendencia africana y ocurre en edades más tempranas- Factores genéticos, especialmente mutaciones de la línea germinal en los genes de reparación del ADN (BRCA2 - síndrome de cáncer mama ovario hereditario) y pueden estar asociados con enfermedad más agresiva- Antecedentes de cáncer de próstata y otros cánceres en familiares de primer grado- Dieta (carne roja, productos lácteos)- Obesidad y sedentarismo | - Dieta rica en vegetales crucíferos (brócoli y coliflor), licopenos (tomate, sandía, albaricoque, arándanos, frutos rojos), fitoestrógenos, café. |
| Pulmón22 | - Tabaco- Exposición ambiental y/o laboral al humo del tabaco, asbesto, radón, metales (arsénico, cromo y níquel), radiación ionizante e hidrocarburos aromáticos policíclicos- Exposición a radiaciones ionizantes terapéuticas (linfoma Hodgkin, cáncer de mama)- Fibrosis pulmonar, sarcoidosis, esclerodermia, TBC, EPOC- Individuos con infección VIH- Antecedentes familiares | - Dieta rica en antioxidantes, vegetales crucíferos, fitoestrógenos- Actividad física |
| Melanoma23 | - Exposición solar intensa e intermitente, en áreas expuestas esporádicamente (espalda en hombres, piernas en mujeres) o crónicamente (cabeza y cuello); múltiples quemadura solares en la infancia- Psoraleno y fototerapia con UVA (PUVA)- Lámparas y las camas de bronceado- Piel y ojos claros, pelo rubio o pelirrojo- Número de nevus (> 25), nevus congénito, nevus displásicos o atípicos (> 1), síndrome del melanoma múltiple y melanoma atípico familiar (50-100 nevus atípicos)- Historia personal de melanoma y de cáncer de piel basocelular o escamoso- Historia familiar y factores hereditarios: mutación genes BRAF, NRAS, CDKN2A- Pacientes inmunosuprimidos: trasplantes de órganos, linfoma, VIH | - Protección solar: limitar la exposición y usar protector solar, sombreros y ropa de protección solar. |
| Tiroides24 | - Antecedentes de exposición a la radiación durante la infancia- Antecedentes de cáncer de tiroides en un familiar de primer grado, o antecedentes familiares de un síndrome de cáncer de tiroides (poliposis familiar, complejo de Carney, neoplasia endocrina múltiple tipo 2 (MEN2), síndrome de Werner o síndrome de Cowden | |
| Páncreas25 | - Edad, raza negra- Tabaco- Obesidad, IMC, talla alta- Infecciones: hepatitis B, Helicobacter pylori- Sedentarismo- Diabetes mellitus (no está claro si es causa o consecuencia)- Dieta rica en carne roja y procesada, alcohol, bebidas ricas en fructosa, ácidos grasos- Pancreatitis crónica no hereditaria- Historia familiar y factores hereditarios: síndrome hereditario de cáncer de seno y ovario (BRCA1 BRCA2), cáncer de mama hereditario (PALB2), síndrome del melanoma de nevo múltiple atípico familiar (CDKN2A) y síndrome de Lynch (MLH1). Pancreatitis crónica hereditaria | - Actividad física- Dieta rica en frutas, vegetales, granos integrales, leche y otras pautas de dieta saludable |
CCR: cáncer colorrectal; CDIS: carcinoma ductal in situ; EPOC: enfermedad pulmonar obstructiva crónica; ETS: enfermedades de transmisión sexual; TH: tratamiento hormonal; VIH: virus inmunodeficiencia humana; VPH: virus papiloma humano.
Recomendaciones para reducir el riesgo de cáncer y aumentar la supervivencia del cáncer, en relación a la dieta, la nutrición, la actividad física y el peso
| - Mantener el peso corporal dentro de los márgenes normales, con un índice de masa corporal con variación entre 21 y 23. Evitar el incremento de peso y el aumento de la circunferencia de la cintura durante la vida adulta |
| - Realizar actividad física de intensidad moderada, equivalente a una caminata enérgica durante al menos 30 minutos diarios |
| - Limitar el consumo de alimentos que aportan más energía (alimentos con alto contenido de grasas y/o azúcares añadidos y/o bajos en fibra). Evitar las bebidas azucaradas y consumir con moderación o evitar las «comidas rápidas». |
| - Consumir más frutas y verduras (cinco porciones al día), cereales integrales y/o legumbres en cada comida. Limitar los alimentos ricos en almidón refinados. |
| - Limitar la carne roja (de res, cerdo, cordero) y evitar el consumo de carne procesada (conservada mediante el ahumado, el curado o la salazón, o la adición de conservadores químicos) |
| - Lo mejor es no beber alcohol y en caso de beber, limitar el consumo |
| - Consumir menos de 6 g de sal por día |
| - No consumir suplementos dietéticos |
| - Lactancia materna exclusivamente hasta los seis meses y a partir de entonces continuar con la alimentación complementaria |
| - Todas las personas que sobreviven a un cáncer han de recibir atención nutricional y, a menos que se indique lo contrario, seguir las recomendaciones acerca de la dieta, peso saludable y actividad física |
Fuente: Adaptado de World Cancer Research Fund (WCRF)15.
Código Europeo contra el Cáncer. Doce formas de reducir el riesgo de cáncer
| 1. No fume. No consuma ningún tipo de tabaco |
| 2. Haga de su casa un hogar sin humo. Apoye las políticas antitabaco en su lugar de trabajo |
| 3. Mantenga un peso saludable |
| 4. Haga ejercicio a diario. Limite el tiempo que pasa sentado |
| 5. Coma saludablemente: |
| a. Consuma gran cantidad de cereales integrales, legumbres, frutas y verduras |
| b. Limite los alimentos hipercalóricos (ricos en azúcar o grasa) y evite las bebidas azucaradas |
| c. Evite la carne procesada, limite el consumo de carne roja y de alimentos con mucha sal |
| 6. Limite el consumo de alcohol, aunque lo mejor para la prevención del cáncer es evitar las bebidas alcohólicas |
| 7. Evite una exposición excesiva al sol, sobre todo en niños. Utilice protección solar. No use cabinas de rayos UVA |
| 8. En el trabajo, protéjase de las sustancias cancerígenas cumpliendo las instrucciones de la normativa de protección de la salud y seguridad laboral |
| 9. Averigüe si está expuesto a la radiación procedente de altos niveles naturales de radón en su domicilio y tome medidas para reducirlos |
| 10. Para las mujeres: |
| a. La lactancia materna reduce el riesgo de cáncer en la madre. Si puede, amamante a su bebé |
| b. La terapia hormonal sustitutiva (THS) aumenta el riesgo de determinados tipos de càncer. Limite el tratamiento con THS |
| 11. Asegúrese de que sus hijos participan en programas de vacunación contra: |
| a. La hepatitis B (los recién nacidos) |
| b. El virus del papiloma humano (VPH) (las niñas) |
| 12. Participe en programas organizados de cribado del cáncer: |
| a. Colorrectal (hombres y mujeres) |
| b. De mama (mujeres) |
| c. Cervicouterino (mujeres) |
Fuente: Código Europeo contra el Cáncer26.
La atención primaria de salud es el marco idóneo para recomendar intervenciones de prevención primaria del cáncer, ya que brinda acceso y cobertura universal. Las intervenciones breves en la consulta para disminuir el consumo de riesgo de alcohol o el abandono del tabaco son efectivas para cambiar las conductas de salud de los pacientes y también pueden mejorar las conductas dietéticas a corto plazo, aunque la evidencia del cambio de comportamiento a largo plazo es limitada. Las intervenciones sobre el estilo de vida se pueden consultar en las recomendaciones del grupo de expertos del PAPPS sobre estilos de vida27.
Prevención secundariaEl objetivo del cribado es detectar el cáncer antes de que se manifieste clínicamente, con la finalidad de poder ofrecer un tratamiento precoz y aportar beneficios a las personas en términos de reducción de la mortalidad y aumento de la calidad de vida12. Sin embargo, el cribado no está exento de riesgos, principalmente falsos positivos y exposición a pruebas adicionales innecesarias, falsos negativos, sobrediagnóstico y sobretratamiento de lesiones indolentes.
El sobrediagnóstico se define como el diagnóstico de una condición/enfermedad que nunca causaría síntomas en la vida de la persona28,29. La enfermedad se detecta correctamente, pero el diagnóstico es irrelevante. El sobrediagnóstico del cáncer es consecuencia de la no progresión tumoral o bien, de la mortalidad competitiva debida a otras causas (el paciente morirá a consecuencia de otra enfermedad antes de que el cáncer cause síntomas)28,29. El sobrediagnóstico del cáncer convierte a personas asintomáticas, en principio sanas, en enfermas (etiquetadas de por vida) y conduce a tratamientos innecesarios (cirugía, quimioterapia, radioterapia, tratamientos sustitutivos) que, al no aportar ningún beneficio en términos de salud, sólo causan daño físico y psicosocial (efectos secundarios a corto, medio y largo plazo)28,29.
En diciembre de 2003 el Consejo Europeo aprobó la recomendación de cribado poblacional del cáncer de mama, CCR y cáncer de cuello de útero (CCU) para la población de riesgo medio de sus estados miembros30. Estos tres cribados son los recomendados en el Código Europeo contra el Cáncer (tabla 5)26, están contemplados en la Estrategia en Cáncer del Sistema Nacional de Salud (SNS)31 e incluidos en la cartera de servicios como prestación básica del SNS32. Los cribados oportunistas (case-finding) son los que se solicitan y/o son realizados en la consulta, a iniciativa del profesional o a petición del paciente, y están dirigidos a personas de riesgo medio y riesgo elevado12.
Cualquier estrategia y modalidad de cribado requiere informar a las personas sobre el balance entre beneficios y riesgos, tener en cuenta los valores y preferencias personales, garantizar la calidad de las pruebas de cribado y la accesibilidad a las pruebas de confirmación diagnóstica en un plazo de tiempo adecuado12. Asimismo, el coste de los cribados no debería ser una carga onerosa para el sistema de salud12.
Detección temprana de signos y síntomas de cáncerUn pequeño porcentaje de cánceres se diagnostican en su fase presintomática, pero la gran mayoría presentan síntomas en el momento del diagnóstico. A veces, son síntomas muy inespecíficos, otras son una manifestación de enfermedad avanzada. El interés por el diagnóstico precoz del cáncer sintomático ha llevado a desarrollar diversos modelos teóricos mediante la identificación de sucesos claves que enmarcan distintos periodos de tiempo, cuya duración depende de la combinación de factores sociodemográficos, culturales y clínicos del paciente, de la biología del tumor y, también, del acceso y las características del sistema sanitario. En la Declaración de Aarhus33 se consensuan las definiciones de los distintos intervalos de tiempo, desde la aparición del primer síntoma hasta el inicio del tratamiento.
En la duración del intervalo atribuible al paciente (intervalo paciente), es decir desde la aparición del primer síntoma hasta la primera consulta, influye el conocimiento previo de los síntomas de sospecha asociados al cáncer y, la manera en que los individuos perciben y evalúan sus síntomas (barreras cognitivas y culturales)33.
En los modelos como el nuestro donde la atención primaria constituye el primer nivel de la atención sanitaria, el intervalo atribuible a la atención primaria (desde la primera consulta hasta la derivación a la atención secundaria) puede, a veces, prolongarse en exceso. Según una encuesta realizada en el Reino Unido, el 80% de los pacientes diagnosticados de cáncer habían consultado previamente a sus médicos de atención primaria una o dos veces antes de ser derivados a la atención secundaria, y el 20% restante, necesitaban tres o más consultas34. Esto es debido a que los VPP de los síntomas iniciales del cáncer consultados en la atención primaria son bajos, dada la alta frecuencia de los síntomas consultados y la baja incidencia del cáncer en la población general atendida en las consultas de atención primaria. El principal reto para el médico de atención primaria consistiría en mantener un difícil equilibrio entre evitar intervenciones innecesarias o inapropiadas y no demorar las actuaciones necesarias ante síntomas de alarma35.
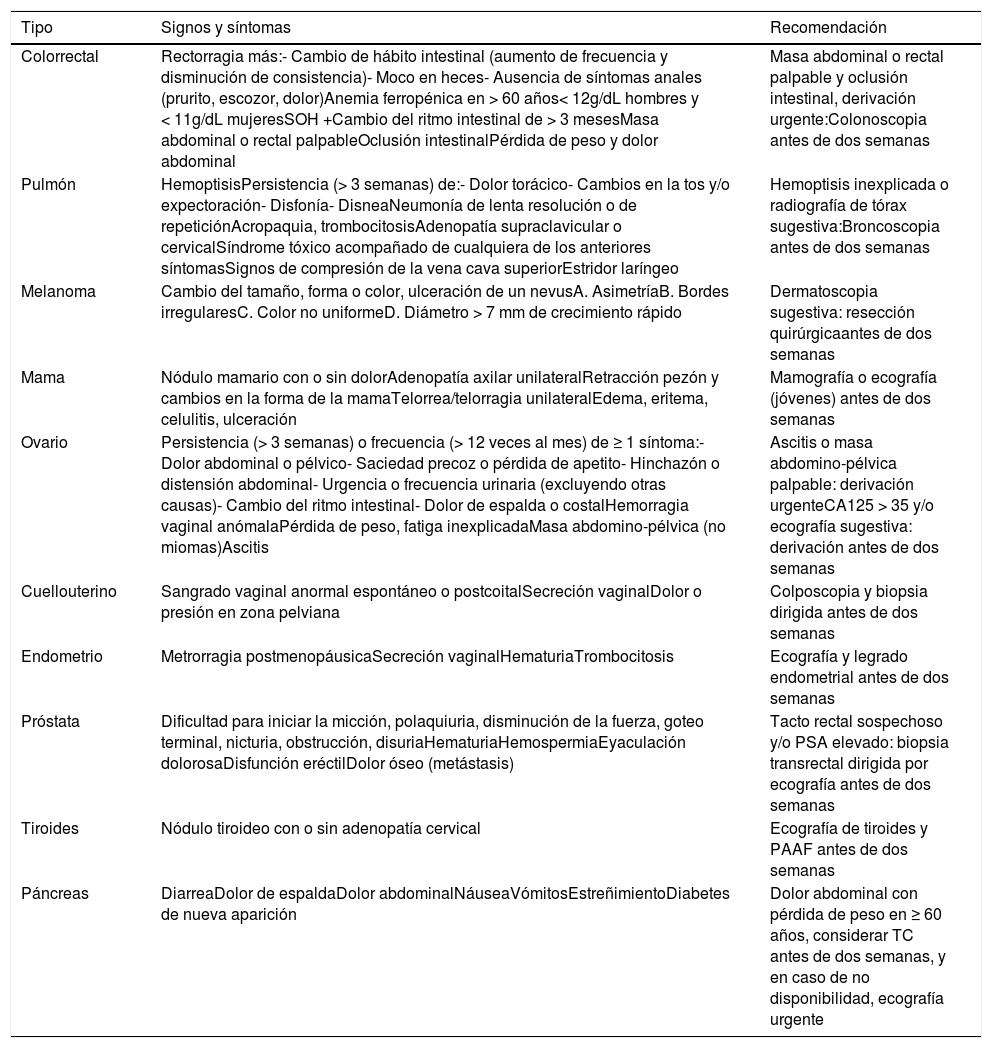
Para una correcta evaluación del paciente sintomático, debe considerarse el riesgo individual de cáncer (antecedentes personales y familiares de cáncer y presencia de enfermedades o factores de riesgo) y la persistencia o progresión de los síntomas, ya que en ambos casos aumenta el VPP. Un VPP ≥ 5% (1:20) se considera suficiente para iniciar el proceso diagnóstico36. En la tabla 6 y basado en las recomendaciones de National Institute for Health and Care Excellence (NICE) del Reino Unido, se describen los signos y síntomas con mayor VPP para los cánceres más comunes y las recomendaciones adecuadas en cada caso37.
Signos y síntomas con mayor valor predictivo positivo para distintos tipos de cáncer y recomendaciones
| Tipo | Signos y síntomas | Recomendación |
|---|---|---|
| Colorrectal | Rectorragia más:- Cambio de hábito intestinal (aumento de frecuencia y disminución de consistencia)- Moco en heces- Ausencia de síntomas anales (prurito, escozor, dolor)Anemia ferropénica en > 60 años< 12g/dL hombres y < 11g/dL mujeresSOH +Cambio del ritmo intestinal de > 3 mesesMasa abdominal o rectal palpableOclusión intestinalPérdida de peso y dolor abdominal | Masa abdominal o rectal palpable y oclusión intestinal, derivación urgente:Colonoscopia antes de dos semanas |
| Pulmón | HemoptisisPersistencia (> 3 semanas) de:- Dolor torácico- Cambios en la tos y/o expectoración- Disfonía- DisneaNeumonía de lenta resolución o de repeticiónAcropaquia, trombocitosisAdenopatía supraclavicular o cervicalSíndrome tóxico acompañado de cualquiera de los anteriores síntomasSignos de compresión de la vena cava superiorEstridor laríngeo | Hemoptisis inexplicada o radiografía de tórax sugestiva:Broncoscopia antes de dos semanas |
| Melanoma | Cambio del tamaño, forma o color, ulceración de un nevusA. AsimetríaB. Bordes irregularesC. Color no uniformeD. Diámetro > 7 mm de crecimiento rápido | Dermatoscopia sugestiva: resección quirúrgicaantes de dos semanas |
| Mama | Nódulo mamario con o sin dolorAdenopatía axilar unilateralRetracción pezón y cambios en la forma de la mamaTelorrea/telorragia unilateralEdema, eritema, celulitis, ulceración | Mamografía o ecografía (jóvenes) antes de dos semanas |
| Ovario | Persistencia (> 3 semanas) o frecuencia (> 12 veces al mes) de ≥ 1 síntoma:- Dolor abdominal o pélvico- Saciedad precoz o pérdida de apetito- Hinchazón o distensión abdominal- Urgencia o frecuencia urinaria (excluyendo otras causas)- Cambio del ritmo intestinal- Dolor de espalda o costalHemorragia vaginal anómalaPérdida de peso, fatiga inexplicadaMasa abdomino-pélvica (no miomas)Ascitis | Ascitis o masa abdomino-pélvica palpable: derivación urgenteCA125 > 35 y/o ecografía sugestiva: derivación antes de dos semanas |
| Cuellouterino | Sangrado vaginal anormal espontáneo o postcoitalSecreción vaginalDolor o presión en zona pelviana | Colposcopia y biopsia dirigida antes de dos semanas |
| Endometrio | Metrorragia postmenopáusicaSecreción vaginalHematuriaTrombocitosis | Ecografía y legrado endometrial antes de dos semanas |
| Próstata | Dificultad para iniciar la micción, polaquiuria, disminución de la fuerza, goteo terminal, nicturia, obstrucción, disuriaHematuriaHemospermiaEyaculación dolorosaDisfunción eréctilDolor óseo (metástasis) | Tacto rectal sospechoso y/o PSA elevado: biopsia transrectal dirigida por ecografía antes de dos semanas |
| Tiroides | Nódulo tiroideo con o sin adenopatía cervical | Ecografía de tiroides y PAAF antes de dos semanas |
| Páncreas | DiarreaDolor de espaldaDolor abdominalNáuseaVómitosEstreñimientoDiabetes de nueva aparición | Dolor abdominal con pérdida de peso en ≥ 60 años, considerar TC antes de dos semanas, y en caso de no disponibilidad, ecografía urgente |
PAAF: punción aspiración aguja fina; SOH: sangre oculta en heces; TC: tomografía computarizada.
Fuente: Adaptado de Suspected cancer: recognition and referral NICE guidelines37.
El intervalo atribuible al sistema sanitario es el tiempo que transcurre entre la solicitud de pruebas y/o derivaciones por sospecha de cáncer y el inicio del tratamiento. En gran parte, la duración de este intervalo está condicionado por las listas de espera y el posible acceso restringido a pruebas diagnósticas desde la atención primaria a la atención especializada.
Los circuitos de diagnóstico rápido (CDR) tienen como objetivo reducir el tiempo entre la sospecha fundamentada de cáncer, la confirmación diagnóstica y el inicio del tratamiento. Consisten en establecer vías de acceso específicas y preferentes, desde la atención primaria a la atención secundaria, para pacientes con síntomas de elevado VPP. En el Reino Unido, las clínicas de diagnóstico multidisciplinarias atienden a pacientes con síntomas inespecíficos pero sugestivos, con el objetivo explícito de detectar tumores malignos que se presentan con síntomas vagos y con VPP bajos38. Reducir la demora atribuible al sistema sanitario (intervalo sistema sanitario) puede contribuir a reducir la ansiedad que experimenta una persona en estas circunstancias, a un diagnóstico y tratamiento más tempranos y a la mejora de la calidad de todo el proceso asistencial.
Recomendaciones de prevención del cáncerA continuación se presentan las evidencias científicas y los elementos más significativos que se han tenido en cuenta para asignar la fuerza de la recomendación sobre las intervenciones de prevención de los cánceres con mayor impacto. En la tabla 7 se describen las variables de resultado identificadas de las intervenciones de cribado y la puntuación consensuada.
Puntuación de las variables de salud identificadas. Sistema GRADE2,3
| Pregunta PICO: Paciente (persona sana con riesgo medio de padecer un cáncer), Intervención (la prueba de cribado), Comparación (nada o la prueba de cribado a comparar), Outcomes (resultados en términos de beneficios y riesgos esperados) | |
| Variables de resultados en salud identificadas | Puntuación de importancia |
| Mortalidad específica (del propio cáncer cribado) | 9 |
| Mortalidad global (mortalidad por cualquier causa) | 9 |
| Tasas de detección de cáncer | 7 |
| Tasas de detección de lesiones premalignas | 7 |
| Sobrediagnóstico (casos que dejados a su evolución natural nunca se hubieran diagnosticado) | 9 |
| Sobretratamiento (casos que dejados a su evolución natural nunca se hubieran tratado) | 9 |
| Efectos adversos importantes de las pruebas (por ej., perforaciones en el caso de la colonoscopia) | 9 |
Puntuación 7-9: crítico para tomar la decisión; 4-6: importante pero no crítico para tomar la decisión; 1-3: no importante para tomar la decisión.
El cáncer de mama es el cáncer más frecuente en las mujeres en todo el mundo. En las tablas 1 y 2 se pueden consultar los datos de incidencia, mortalidad y supervivencia del cáncer de mama en España. En la tabla 3 se describen los factores de riesgo de cáncer de mama16.
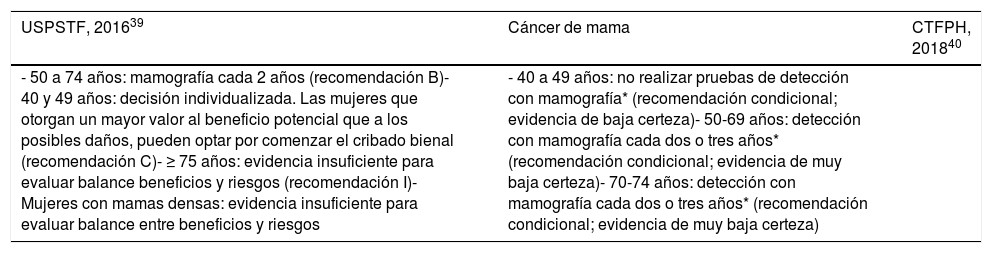
La historia natural del cáncer de mama favorece la detección precoz mediante la mamografía de cribado. La revisión de la evidencia científica se puede consultar en la actualización del PAPPS 20181. En general, existe acuerdo en que la mamografía de cribado en población de riesgo medio reduce la mortalidad por cáncer de mama pero no la mortalidad por todas las causas, y en que el cribado implica riesgo de sobrediagnóstico y de sobretratamiento39-41. Desde la década de los noventa, en todas las Comunidades Autónomas se implementaron programas poblacionales de cribado de cáncer de mama destinados a mujeres entre 50 y 69 años, mediante mamografía de cribado cada dos años31. Actualmente se están valorando otras pruebas de imagen (resonancia magnética, tomosíntesis, ecografía) para el cribado de cáncer de mama en mujeres de riesgo medio, pero la evidencia es escasa y los estudios presentan limitaciones en su diseño. La Canadian Task Force on Preventive Health(CTFPH) recomienda no utilizar imágenes de resonancia magnética, tomosíntesis o ecografía para detectar el cáncer de mama en mujeres de riesgo medio (recomendación fuerte; sin evidencia)40.
Las recomendaciones de cribado del cáncer de mama en población de riesgo medio de la U.S. Preventive Service Task Force(USPSTF)39 y de la CTFPH40 quedan recogidas en la tabla 8. Las actuales recomendaciones de cribado no discriminan entre aquellas mujeres con bajo riesgo de cáncer de mama y/o lesiones indolentes y aquellas mujeres con tumores más agresivos. Es necesario implementar programas de cribado adaptados al riesgo individual (edad, resultado mamografía previa, densidad de la mama) que sean más costo-efectivos y que se adapten a las necesidades de la población diana susceptible de cribado de cáncer de mama, es decir, programas que maximicen los beneficios de la mamografía. A la luz de las controversias en la evidencia de los beneficios y daños del cribado del cáncer de mama, así como de la variabilidad en las preferencias, las mujeres deben recibir apoyo para tomar una decisión informada que sea congruente con sus propios valores y preferencias38,40. Asimismo, la CTFPH recomienda no aconsejar a las mujeres que practiquen el autoexamen de mamas para detectar el cáncer de mama (recomendación débil; sin evidencia)40.
Recomendaciones de la U.S. Preventive Services Task Force (USPSTF) y Canadian Task Force on Preventive Health (CTFPH) para los cribados de cáncer
| USPSTF, 201639 | Cáncer de mama | CTFPH, 201840 |
|---|---|---|
| - 50 a 74 años: mamografía cada 2 años (recomendación B)- 40 y 49 años: decisión individualizada. Las mujeres que otorgan un mayor valor al beneficio potencial que a los posibles daños, pueden optar por comenzar el cribado bienal (recomendación C)- ≥ 75 años: evidencia insuficiente para evaluar balance beneficios y riesgos (recomendación I)- Mujeres con mamas densas: evidencia insuficiente para evaluar balance entre beneficios y riesgos | - 40 a 49 años: no realizar pruebas de detección con mamografía* (recomendación condicional; evidencia de baja certeza)- 50-69 años: detección con mamografía cada dos o tres años* (recomendación condicional; evidencia de muy baja certeza)- 70-74 años: detección con mamografía cada dos o tres años* (recomendación condicional; evidencia de muy baja certeza) |
| USPSTF, 201849 | Cáncer cuerpo del útero (CCU) | CTFPH, 201350 |
|---|---|---|
| - Detección del CCU cada 3 años con citología cervical sola en mujeres de 21 a 29 años. Para las mujeres de 30 a 65 años, detección cada 3 años con citología cervical sola, cada 5 años con VPH-AR solo, o cada 5 años con VPH-AR en combinación con citología (co-test) (recomendación A)- No realizar pruebas detección de CCU en mujeres > 65 años que se hayan sometido a pruebas de detección previas adecuadas y que de otro modo no tengan un alto riesgo de cáncer de cuello uterino (recomendación D)- En contra del cribado en mujeres > 21 años (recomendación D)- En contra del cribado en mujeres que se han sometido a una histerectomía con extirpación del cuello uterino y que no tienen antecedentes de lesión precancerosa de alto grado (CIN2 o CIN3) o CCU (recomendación D) | - < 20 años no se recomienda el cribado (recomendación fuerte, evidencia alta calidad)- 20 a 24 años no se recomienda el cribado (recomendación débil, evidencia moderada)- 25 a 29 años se recomienda el cribado cada 3 años (recomendación débil, evidencia moderada)- 30 a 69 años se recomienda el cribado cada 3 años (recomendación fuerte, evidencia alta)- 70 años correctamente cribadas y con resultados negativos (3 Papanicolaou en los últimos 10 años) se recomienda finalizar el cribado. Para el resto de las mujeres de 70 o más años se recomienda continuar con cribado hasta que se hayan obtenido 3 resultados negativos (recomendación débil, evidencia baja) |
| USPSTF, 201757 | Ovario |
|---|---|
| - En contra del cribado (recomendación D) | - No dispone de recomendaciones |
| USPSTF, 201771 | Colorrectal | CTFPH, 201672 |
|---|---|---|
| - 50 a 75 años: cribado del CCR anual si SOH, cada 10 años si colonoscopia y cada 5 para la sigmoidoscopia (recomendación A). Los riesgos y beneficios de las diferentes pruebas varían- 76 a 85 años: decisión individual, teniendo en cuenta la salud general del paciente y los resultados de los cribados previos (recomendación C) | - 50-59 años, se recomienda el cribado con SOH (SOHg o SOHi) cada 2 años o sigmoidoscopia flexible cada 10 años (recomendación débil, evidencia moderada)- 60-74 años, se recomienda el cribado con SOH (SOHg o SOHi) cada 2 años o sigmoidoscopia flexible cada 10 años (recomendación fuerte, evidencia moderada)- ≥ 75 años, no se recomienda el cribado de CCR (recomendación débil, evidencia baja)- Se recomienda no usar la colonoscopia como prueba de cribado de CCR (recomendación débil, evidencia baja) |
| USPSTF, 201980 | Páncreas | CTFPH |
|---|---|---|
| - En contra del cribado (recomendación D) | - No dispone de recomendaciones |
| - USPSTF, 201889 | Próstata | CTFPH, 201490 |
|---|---|---|
| - 50 a 69 años: recomienda que los médicos informen sobre los posibles beneficios y daños del cribado con PSA y que la decisión sea individualizada (recomendación C)- ≥ 70 años: en contra del cribado (recomendación D) | - < 55 años, no se recomienda cribado de cáncer de próstata con PSA (recomendación fuerte, evidencia baja)- 55-69 años, no se recomienda cribado de cáncer de próstata con PSA (recomendación débil, evidencia moderada)- ≥ 70 años, no se recomienda cribado de cáncer de próstata con PSA (recomendación fuerte, evidencia baja) |
| USPSTF, 201394 (proceso revisión) | Pulmón | CTFPH, 201695 |
|---|---|---|
| - Cribado anual con TCBD en las personas de 55 a 80 años que han fumado 30 paquetes-año, que son fumadores en la actualidad o han dejado de fumar en los últimos 15 años. Se excluye a las personas que no han fumado durante los últimos 15 años, o que desarrollan un problema de salud que limita sustancialmente la esperanza de vida o que no tienen la capacidad o la voluntad de someterse a un tratamiento quirúrgico de pulmón (recomendación B) | - 55-74 años, fumadores de 30 paquetes/año o que dejaron de fumar hace menos de 15 años, se recomienda el cribado anual con 3 TCBD consecutivos. Sólo debe realizarse en centros especializados en el diagnóstico y tratamiento de cáncer de pulmón en estadio precoz (recomendación débil a favor, evidencia baja). |
| USPSTF, 201897 | Piel | CTFPH |
|---|---|---|
| - Aconsejar a adultos jóvenes, adolescentes, niños y padres de niños pequeños sobre cómo minimizar la exposición a la radiación UV en personas de 6 meses a 24 años con tipos de piel clara para reducir el riesgo de cáncer de piel (recomendación B)- Los médicos deben ofrecer de forma selectiva asesoramiento a adultos > 24 años con tipos de piel clara sobre cómo minimizar su exposición a la radiación UV para reducir el riesgo de cáncer de piel (recomendación C)- La evidencia actual es insuficiente para evaluar el equilibrio entre los beneficios y los daños de aconsejar a los adultos sobre el autoexamen de la piel para prevenir el cáncer de piel (recomendación I). | - No dispone de recomendaciones |
| USPSTF, 2018100 | Tiroides | CTFPH |
|---|---|---|
| - En contra del cribado (recomendación D) | - No dispone de recomendaciones |
La CTFPH, sigue la metodología propuesta por GRADE2,3. La USPSTF clasifica sus recomendaciones según la magnitud de la evidencia científica y el grado de beneficio neto (beneficio-riesgo). Recomendación A: ofrecer la intervención (beneficio neto sustancial); recomendación B: ofrecer la intervención (beneficio neto moderado); recomendación C: ofrecer la intervención en pacientes seleccionados (el beneficio neto es muy pequeño); recomendación D: en contra de la intervención (beneficio neto negativo); recomendación I: evidencia insuficiente.
Tomado de https://uspreventiveservicestaskforce.org/uspstf/grade-definitions
La quimioprevención es una opción de prevención adicional en las mujeres con mayor riesgo (antecedentes familiares de primer grado, hiperplasia ductal o lobular atípica o carcinoma lobular in situ en una biopsia previa)42. Los moduladores selectivos del receptor de estrógenos (raloxifeno, tamoxifeno) y los inhibidores de la aromatasa (letrozol y anastrozol) se han asociado con una menor incidencia de cáncer de mama invasivo primario. Estos medicamentos también están asociados con efectos adversos (trombosis venosa, embolia pulmonar, eventos cardiovasculares, cáncer de endometrio, cataratas) y, por tanto, es muy importante la correcta selección de las candidatas a quimioprevención42. La USPSTF recomienda ofrecer tamoxifeno, raloxifeno o inhibidores de la aromatasa, a aquellas mujeres con riesgo elevado de cáncer de mama y bajo riesgo de efectos adversos a los medicamentos (recomendación B)42. El raloxifeno y los inhibidores de la aromatasa están indicados solo en mujeres posmenopáusicas, y el tamoxifeno en mujeres premenopáusicas.
Las mutaciones en los genes BRCA1 y BRCA2 aumentan el riesgo de cáncer de mama de 45% a 65% a los 70 años. El riesgo de cáncer de ovario, trompa de Falopio o peritoneal primario aumenta un 39% para las mutaciones BRCA1 y del 10% al 17% para las mutaciones BRCA243. En su actualización de 2019, la USPSTF recomienda que los médicos de atención primaria evalúen a las mujeres con antecedentes personales o familiares de cáncer de mama, ovario, trompas o peritoneal o con antecedentes familiares asociados con mutaciones genéticas BRCA1 y BRCA2, con una herramienta de evaluación de riesgos familiares adecuada. Las mujeres con riesgo elevado deben recibir consejo genético y, si esta indicado, realizar estudio genético (recomendación B)43. Las mujeres con mutaciones BRCA1 o BRCA2 deben recibir consejo sobre las diversas opciones preventivas (revisar las indicaciones de estudio genético y recomendaciones de prevención en los portadores de mutación BRCA en la actualización del PAPPS de 2018)1.
Recomendaciones para cáncer de mama, PAPPS 2020
- -
En las mujeres de 40 a 49 años con riesgo medio de cáncer de mama no se debería recomendar la mamografía de cribado (evidencia moderada, recomendación condicional en contra).
- -
En las mujeres de 50 a 69 años con riesgo medio de cáncer de mama se debería recomendar la mamografía de cribado cada dos años (evidencia moderada, recomendación condicional a favor).
- -
En las mujeres de 70 a 74 años con riesgo medio de cáncer de mama se debería recomendar la mamografía de cribado cada dos años (evidencia baja, recomendación condicional a favor).
- -
El médico de familia tiene que proporcionar información objetiva y contrastada que permita a cada mujer tomar su propia decisión, en el sentido de participar o no en los programas de cribado.
- -
El médico de familia tiene que identificar a las mujeres con riesgo elevado (antecedentes personales y/o con antecedentes familiares de cáncer hereditario asociado a mutaciones BRCA) y derivar a centros especializados y/o a la Unidad de Consejo Genético.
La incidencia y la mortalidad del cáncer de cuello del útero (CCU) en España es de las más bajas de Europa y del mundo, existiendo diferencias entre comunidades autónomas. En las tablas 1 y 2 se pueden consultar los datos de incidencia, mortalidad y supervivencia. En la tabla 3 se describen los factores de riesgo del CCU17.
El virus del papiloma humano (VPH) es una causa común de infección de transmisión sexual en hombres y mujeres. La infección por VPH es condición necesaria pero no suficiente para el desarrollo de lesiones precursoras y del CCU. La mayoría de las mujeres sexualmente activas están expuestas al VPH en algún momento de su vida, pero la infección suele ser transitoria y desaparece a los 12-24 meses; por tanto, es irrelevante desde el punto de vista oncogénico. La infección persistente por el virus VPH causa lesiones cervicales precancerosas de alto grado (por ej. neoplasia intraepitelial cervical [CIN] grados 2 y 3) que pueden progresar a CCU. Aproximadamente el 30% de las lesiones CIN3 progresan a cáncer invasivo. La persistencia de enfermedad es más común si intervienen otros cofactores (tabaco, multiparidad, uso prolongado de anticonceptivos orales, historia de infecciones de transmisión sexual, sobre todo el herpes virus tipo 2, o si existe inmunodepresión congénita o adquirida).
Las pacientes con inmunodepresión congénita o adquirida como consecuencia de tratamientos farmacológicos (que se han sometido a un trasplante de órganos, con enfermedades sistémicas, inflamatorias o autoinmunes que requieren inmunosupresión crónica) o las pacientes con infección por el virus de la inmunodeficiencia humana (VIH) son muy susceptibles a la infección persistente por VPH y tienen un alto riesgo de desarrollar lesiones precursoras o CCU44.
La vacunación frente a la infección por VPH es la forma más eficaz de prevenir el CCU. Las vacunas son profilácticas, es decir previenen la infección inicial por el VPH frente a los genotipos incluidos en ellas. Sin embargo, no tienen efecto terapéutico sobre la infección ya establecida previamente ni tampoco sobre las potenciales lesiones secundarias a la misma44. Actualmente, existen tres vacunas profilácticas frente al VPH registradas en España, autorizadas a través del procedimiento centralizado por la Agencia Europea de Medicamentos (EMA): la vacuna bivalente Cervarix® (vacuna VPH-2), la vacuna tetravalente Gardasil® (vacuna VPH-4) y la vacuna nonavalente Gardasil 9® (vacuna VPH-9). Las tres vacunas presentan un adecuado perfil de seguridad y un balance beneficio/riesgo favorable. La edad óptima para iniciar la vacunación es antes del inicio de relaciones sexuales de la mujer. La edad óptima de vacunación es a los 12 años. Cervarix®, en su ficha técnica, tiene autorizada la aplicación de dos dosis (0 y 6 meses) entre los nueve y los 14 años inclusive. Gardasil® también de dos dosis (0 y 6 meses), pero de nueve a 13 años inclusive y Gardasil 9® tiene autorizada la aplicación de dos dosis (0 y 6 meses) entre los nueve y los 14 años inclusive. Las mujeres de 13 a 26 años no vacunadas son un grupo de alta prioridad de vacunación y pueden beneficiarse de la misma sin necesidad de cribado citológico o viral previo. La vacunación frente al VPH también se debe contemplar en aquellas mujeres sometidas a tratamiento de lesiones cervicales ya que reduce el riesgo de segundas lesiones45.
Otras estrategias de prevención primaria son el consejo sobre tabaco, alcohol y protección en contactos sexuales46. El preservativo reduce el riesgo de contagio del VPH, aunque solo lo evita en un 60-70% de los casos, debido al contacto de zonas genitales no cubiertas o a su uso inadecuado. No obstante, el uso del preservativo evita embarazos y constituye una práctica sexual segura por su eficacia para prevenir otras enfermedades de transmisión sexual. Se recomienda consejo sobre el uso correcto del preservativo en los contactos sexuales46. Otro factor preventivo descrito es la circuncisión en hombres, ya que esta práctica reduce la prevalencia de infección, acorta el tiempo de aclaramiento viral y, paralelamente, puede disminuir el riesgo de contagio en la mujer46.
La larga fase preclínica de la infección por VPH desde la transformación del epitelio cervical hasta su invasión (10-15 años) permite la identificación y tratamiento de las lesiones. La revisión de la evidencia científica se puede consultar en la actualización del PAPPS de 20181. Las dos revisiones más completas son las realizadas por Cochrane47 y la USPSTF48. La prueba de cribado del VPH en primera ronda detecta tasas más elevadas de lesiones CIN3+ que la citología48. Los ECA no han mostrado que el co-test (citología + prueba VPH) incremente la detección de lesiones CIN3+48. La prueba del VPH y el co-test tienen mayores tasas de falsos positivos y colposcopia que la citología, lo que podría implicar sobretratamiento y posibles daños (hemorragia, dolor e infección al realizar la citología, partos prematuros, nacimientos con bajo peso, rotura prematura de membranas y mortalidad perinatal)48. No obstante, los diferentes ECA son heterogéneos en cuanto a los intervalos de detección, el número de rondas y protocolos1. Las recomendaciones de cribado del CCU en población de riesgo medio de la USPSTF49 y de la CTFPH50 quedan recogidas en la tabla 8.
Diversos estudios revelan diferencias en la participación de las mujeres en la detección del CCU. La auto-toma aumenta la cobertura del cribado de CCU. Una revisión sistemática (RS)51 y estudios posteriores52 confirman que la auto-toma tiene un rendimiento comparable en la detección de lesiones cervicales al de una muestra recogida por el médico en la consulta.
Actualmente, en España el cribado de CCU es de tipo oportunista. La mayoría de los programas y sociedades científicas recomiendan las pruebas del VPH en el cribado del CCU44,53. El 1 de julio de 2019 entró en vigor la orden de actualización de la cartera de servicios de la sanidad pública del Sistema Nacional de Salud (SNS) que obliga a las Comunidades Autónomas (CCAA) a implantar un cribado poblacional de CCU de manera progresiva y en el plazo máximo de cinco años54. Según esta orden, antes de 2024 las CCAA deberán invitar expresamente por carta a todas las mujeres de entre 25 y 65 años a realizarse el cribado. Concretamente, a las mujeres de 25 a 34 años se les realizará citología cada tres años, y a las mujeres de 35 a 65 años se les determinará el VPH-AR. Si este último resulta negativo, se repetirá a los cinco años, mientras que si es positivo, se realizará una citología.
Los profesionales de atención primaria tienen un papel fundamental para promocionar la participación en el cribado, especialmente en las mujeres con mayor riesgo y/o cribado inadecuado.
Recomendaciones para cáncer de cuello de útero, PAPPS 2020
- -
Los profesionales de atención primaria deben proporcionar consejo sobre protección en los contactos sexuales (evidencia moderada, recomendación fuerte a favor).
- -
En mujeres menores de 25 años no se recomienda el cribado (evidencia moderada, recomendación fuerte a favor).
- -
En mujeres asintomáticas de 25 a 35 años, se recomienda la citología de cribado cada tres años (evidencia alta, recomendación fuerte a favor).
- -
En mujeres asintomáticas de 35 a 65 años se recomienda la prueba de VPH cada cinco años (evidencia moderada, recomendación fuerte a favor) o la citología de cribado cada tres años (nivel de evidencia moderada, recomendación condicional a favor).
- -
El cribado se finalizará a los 65 años, siempre que exista un cribado previo adecuado y negativo (10 años) y no haya antecedentes de CIN o CCU (20 años) (nivel de evidencia moderada, recomendación fuerte a favor).
- -
No se realizará cribado en mujeres que no han tenido relaciones sexuales ni en mujeres que han tenido una histerectomía con extirpación del cuello de útero (nivel de evidencia moderada, recomendación fuerte a favor).
- -
Los profesionales de atención primaria tienen que realizar una búsqueda activa dirigida a aumentar la participación de la población diana, con especial énfasis en la población con mayor riesgo.
El cáncer de endometrio es el cáncer ginecológico más frecuente en los países desarrollados. En la tabla 1 se pueden consultar los datos de incidencia y mortalidad. En el 85% de los casos el cáncer de endometrio se diagnostica en estadio temprano, lo que repercute positivamente en las tasas de supervivencia (tabla 2). El principal factor de riesgo (tabla 3) es un exceso de estrógeno endógeno o exógeno sin la oposición adecuada de un progestágeno55. El síndrome de Lynch (cáncer de colon hereditario sin poliposis) predispone a un riesgo de cáncer de endometrio a lo largo de la vida del 27 al 71% en comparación con el 3% en población general55. El sangrado uterino anormal es el síntoma cardinal presente en el 75-90% de los casos de cáncer de endometrio55.
En mujeres asintomáticas, ninguna prueba de cribado (examen pélvico, citología, ecografía, biopsia) ha demostrado tener impacto sobre la reducción de mortalidad por cáncer de endometrio. La mejor estrategia de detección precoz es dar consejo a las mujeres postmenopáusicas, especialmente si tienen factores de riesgo, para que consulten ante cualquier sangrado uterino anormal55.
En las mujeres con síndrome de Lynch, aunque no se ha establecido claramente su utilidad, los expertos recomiendan exploración pélvica, ecografía transvaginal (ETV), marcador CA-125 y biopsia/aspirado endometrial, con periodicidad anual, desde los 30-35 años (o 5-10 años antes de la edad del familiar más joven diagnosticado de cáncer). También se propone histerectomía como medida reductora de riesgo55.
Recomendaciones para cáncer de endometrio, PAPPS 2020
- -
En las mujeres asintomáticas sin factores de riesgo de cáncer de endometrio conocidos no se debe recomendar cribado para este cáncer (evidencia moderada, recomendación fuerte en contra).
- -
Los profesionales de atención primaria tienen que aconsejar a las mujeres postmenopáusicas, especialmente a aquellas con riesgo elevado de cáncer de endometrio, para que consulten ante cualquier sangrado vaginal.
El cáncer de ovario pese a su baja incidencia es la segunda causa de muerte por cáncer ginecológico. En las tablas 1 y 2 pueden consultarse los datos de incidencia, mortalidad y supervivencia del cáncer de ovario en España. La supervivencia está relacionada con el tipo de tumor y el estadio en el momento del diagnóstico (más del 70% se diagnostican en estadios avanzados). La clasificación, según riesgo individual de cáncer de ovario, se basa fundamentalmente en la presencia de antecedentes personales y familiares de cáncer y en la identificación de las familias con predisposición hereditaria al cáncer de ovario (SCMOH y síndrome de Lynch) (tabla 3)56. La clasificación clínicopatológica y molecular del cáncer de ovario se puede consultar en la actualización del PAPPS de 20181. El carcinoma seroso de alto grado representa el 70-80% de los cánceres de ovario, que de acuerdo con las actuales teorías de la carcinogénesis incluyen los tumores invasivos originados en el ovario, trompas de Falopio y peritoneo.
La RS de la USPSTF sobre cribado de cáncer de ovario en mujeres asintomáticas postmenopáusicas de riesgo medio (sin síndrome de cáncer hereditario conocido), identifica tres ECA de buena calidad con seguimiento a largo plazo: UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS), y su piloto UK Pilot, y el Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Trial de Estados Unidos57. Ninguno de estos ECA muestra diferencias estadísticamente significativas en la reducción de la mortalidad por cáncer de ovario, trompas de Falopio y de peritoneo primario en las mujeres cribadas: PLCO (RR 1,18; IC 95% 0,82-1,71), UKCTOCS grupo ETV (HR 0,91; IC 95% 0,76-1,09) y brazo CA-125 (HR 0,89; IC del 95% 0,74-1,08)57. En los diferentes ECA se observa una distribución por estadios más favorable. Entre las mujeres con pruebas de cribado positivas, la cirugía es uno de los posibles daños a tener en cuenta. En el UKCTOCS, grupo ETV y el PLCO, las cirugías innecesarias fueron superiores al 3%; mientras que en el UKCTOCS, brazo CA-125 con algoritmo ROCA (Risk of Ovarian Cancer Algorithm), para seleccionar a las candidatas a la ETV (cribado multimodal), se redujeron al 1%. En estos ECA las tasas de falsos positivos oscilaron entre el 9,8 y el 44% y las complicaciones quirúrgicas graves en las mujeres que no tenían cáncer fueron superiores al 3% en el UKCTOCS y del 15% en el PLCO57. Se dispone de escasa evidencia sobre los daños psicológicos del cribado de cáncer de ovario57.
La USPSTF se posiciona en contra de realizar cribado del cáncer de ovario en mujeres sin síntomas y sin riesgo elevado de cáncer hereditario, ya que los daños superan los posibles beneficios57 (tabla 8). Las mujeres con una predisposición genética conocida para el cáncer de ovario (mutaciones BRCA1 o BRCA2 en el SCMOH, síndrome de Lynch) deben ser remitidas a las Unidades de Consejo Genético y recibir consejo sobre las diversas opciones preventivas (ver indicaciones de estudio genético y recomendaciones de prevención en los portadores de mutación BRCA en la actualización del PAPPS 2018)1.
En las mujeres sin predisposición hereditaria conocida, la detección del cáncer de ovario se basa en el diagnóstico temprano del cáncer sintomático, mediante el reconocimiento e identificación de los síntomas y signos iniciales de la enfermedad. Diferentes estudios han demostrado que el 85-90% de las mujeres diagnosticadas con cáncer de ovario presentan algún síntoma, predominantemente de tipo gastrointestinal y/o genitourinario varios meses antes del diagnóstico (tabla 4). A las mujeres, especialmente postmenopáusicas, con síntomas inespecíficos abdomino-pélvicos, persistentes o recurrentes y no justificados, se les debe realizar un examen pélvico, determinación de CA-125 y una ETV58.
Recomendaciones para cáncer de ovario, PAPPS 2020
- -
En las mujeres con riesgo medio de cáncer de ovario no se debe recomendar cribado para este cáncer (evidencia moderada, recomendación fuerte en contra).
- -
Las mujeres con una predisposición genética conocida para el cáncer de ovario se tienen que derivar a centros especializados y/o Unidades de Consejo Genético.
El cáncer colorrectal (CCR) tanto en hombres como en mujeres ocupa el segundo lugar en incidencia y actualmente es la primera causa de muerte en mujeres y la segunda en hombres (tabla 1). El riesgo de CCR aumenta a partir de los 50 años. Para el cáncer de colon, la edad promedio en el momento del diagnóstico es de 68 años en hombres y 72 años en mujeres. Para el cáncer de recto, la edad es 63 años para hombres y mujeres59. La supervivencia del CCR ha mejorado en los últimos años, favorecida por el cribado y las mejoras en el tratamiento y, se sitúa dentro de la media de los países europeos (tabla 2). Las tasas de incidencia y mortalidad por CCR en las dos últimas décadas han disminuido entre las personas mayores de 50 años, en gran parte atribuible a la detección precoz y al cribado. Sin embargo, entre adultos jóvenes esta tendencia va en sentido opuesto60,61.
Un análisis de los datos de incidencia y mortalidad por CCR entre 1990 y 2016, relacionados con la edad, obtenidos de los registros de cáncer nacionales y regionales de Europa, confirma este aumento de la incidencia del CCR en los adultos jóvenes de 20 a 49 años, siendo el aumento más rápido en los más jóvenes, y más prominente para el cáncer de colon que para el cáncer de recto62. Sin embargo, este aumento de la incidencia no guarda relación con el aumento de la mortalidad62. En el caso de España, solo estaban disponibles los datos de Catalunya y la tendencia de la incidencia en personas jóvenes no muestra un cambio significativo62. La causa de esta tendencia en la población joven es desconocida, aunque probablemente contribuyen la combinación de diversos factores, entre ellos el aumento de la prevalencia de la obesidad u otros factores relacionados con los estilos de vida (tabla 3). Una proporción importante de pacientes con CCR a una edad temprana tiene antecedentes familiares de CCR (25% frente a 17% en pacientes de edad avanzada) y un síndrome de cáncer hereditario confirmado o probable (7% frente a 1% en pacientes de edad avanzada)63.
El cribado del CCR tiene como objetivo detectar de forma precoz las lesiones precursoras y el cáncer en un estadio inicial. Su efectividad se ha demostrado en términos de reducción de la incidencia y mortalidad en los ECA con pruebas de sangre oculta en heces guayaco (SOHg) y sigmoidoscopia. No se dispone de ECA con sangre oculta en heces inmunológico (SOHi), pero se supone que es tan efectivo como la SOHg, ya que el SOHi es una prueba más específica y sensible. Tampoco se dispone de ECA con colonoscopia, pero se supone que es, al menos, tan efectiva como la sigmoidoscopia. La revisión de la evidencia científica se puede consultar en la actualización del PAPPS de 20181. Actualmente es un cribado ampliamente aceptado, pero las recomendaciones sobre el tipo de prueba, la edad de inicio del cribado y el intervalo entre pruebas de cribado, varían ampliamente.
En el contexto del proyecto BMJ Rapid Recommendations Project de UK (metodología GRADE), en colaboración con MAGIC Research and Innovation Programme (http://magicproject.org/), se ha actualizado la RS de Cochrane de 20131,64. Esta actualización incluye los resultados del seguimiento a 15 años de los tres ECA con una única sigmoidoscopia: UK Flexible Sigmoidoscopy Screening(UKFSST)65, Norwegian Colorrrectal Cancer Prevention(NORCCA)66 y Prostate Lung, Colorectal and Ovarian Cancer (PLCO)67, demostrando la importante protección que ofrece la sigmoidoscopia.
Los resultados de la RS (12 ECA)68 muestran que la sigmoidoscopia reduce la incidencia de CCR, incluso 15 años después una única prueba (RR 0,76; IC 95% 0,70-0,83). La sigmoidoscopia (RR 0,74; IC 95% 0,69-0,80), la SOHg anual (RR 0,69; IC 95% 0,56-0,86) y bienal, reducen la mortalidad por CCR. Es probable que la sigmoidoscopia sea más efectiva en hombres que en mujeres, tanto para reducir la incidencia como la mortalidad por CCR, pero ninguna de estas pruebas de cribado muestra reducción de la mortalidad por todas las causas. Estos resultados indican que una sola sigmoidoscopia mantiene el efecto hasta 15 años después del cribado68. La mayoría de las guías de práctica clínica (GPC) actuales recomiendan repetir la sigmoidoscopia a los 5-10 años después del examen inicial. Sin embargo, estos resultados permiten aplicar un intervalo de al menos 15 años de manera segura68.
La SOHg, anual o bienal, es importante en la evaluación de posibles daños ya que es probable que a mayor frecuencia de pruebas, los daños del cribado aumenten: evaluación de positivos en las pruebas de cribado y necesidad de vigilancia68. No se dispone de evidencias directas de la efectividad de la SOHi, ni de la colonoscopia a largo plazo, en términos de reducción de la incidencia y la mortalidad68.
A pesar de los beneficios del cribado de CCR, los programas de cribado son costosos y la colonoscopia, ya sea en el contexto de cribado o de vigilancia, es un procedimiento laborioso, invasivo y de accesibilidad limitada. Para dilucidar estos problemas, el grupo de trabajo del BMJ Rapid Recommedations y MAGIC Research and Innovation Programme realizaron un modelo de microsimulación (SCreening ANalysis-Colon - MISCAN-Colon)69. Los autores concluyen que durante un período de 15 años, todas las estrategias de cribado pueden reducir la mortalidad por CCR en un grado similar. La colonoscopia y la sigmoidoscopia también pueden reducir la incidencia de CCR, mientras que SOHi muestra una menor reducción de la incidencia. Los daños son poco frecuentes y de magnitud similar para todas las estrategias de cribado.
Los resultados de esta RS y del estudio de microsimulación se reflejan en su GPC70. Las recomendaciones van dirigidas a adultos de 50 a 79 años sin cribado previo, asintomáticos y con una esperanza de vida de al menos 15 años. Proponen estimar el riesgo de CCR con base en la edad, sexo, raza, índice de masa corporal (IMC), tabaquismo e historia familiar, con la QCancer®(15yr, colorectal) risk calculator (https://qcancer.org/15yr/colorectal/)70. Para las personas con un riesgo estimado de CCR a los 15 años por debajo del 3%, sugieren no realizar cribado (recomendación débil en contra)70. Para las personas con un riesgo estimado a 15 años por encima del 3%, sugieren el cribado con cualquiera de las opciones: SOHi anual, SOHi cada dos años, una única sigmoidoscopia o una única colonoscopia (recomendación débil a favor)70.
En la tabla 8 se describen las recomendaciones de la USPSTF71 y de la CTFPH72, ambas del 2016 y actualmente en fase de revisión. La U.S. Multi-Society Task Force (MSTF) on Colorectal Cancer que representa a la American College of Gastroenterology (AGA), la American Gastroenterological Association (ACG) y la American Society for Gastrointestinal Endoscopy (ASGE), al igual que American Cancer Society (ACS), han modificado la edad de inicio del cribado, pasándola de 50 a los 45 años73.
En nuestro medio, el cribado del CCR con SOH está incluido en la cartera de servicios del SNS. Todas las CCAA han ido implementando progresivamente el cribado poblacional del CCR mediante programas organizados con la prueba de SOHi con periodicidad bienal a la población diana de entre 50 y 69 años. Es preciso avanzar hacia una mayor cobertura de la población diana con participación superior al 60% para conseguir impacto poblacional sobre la mortalidad por CCR con un coste-efectividad favorable74, equilibrando el efecto del sobrediagnóstico que conlleva este cribado. El seguimiento adecuado de los resultados anormales de las pruebas de SOH es un componente clave de la calidad de los programas de cribado. En un estudio realizado en California (EEUU), entre todas las muertes por CCR, se estima que un 8,1% fueron atribuibles a la falta de seguimiento de una prueba de detección positiva75. Los recordatorios automatizados para pacientes y profesionales pueden ayudar a mejorar las tasas de colonoscopia de adultos asintomáticos con resultados positivos en la SOH76. La implicación de los profesionales de atención primaria en los programas de cribado de CCR poblacionales y en la vigilancia de los individuos de riesgo elevado es fundamental.
Las características que confieren un riesgo elevado de CCR son la historia personal o familiar de CCR o pólipos adenomatosos y serrados de riesgo (tamaño igual o superior a 10 mm, vellosos, displasia grave o múltiples [≥ 3]), así como los síndromes hereditarios (poliposis adenomatosa familiar, CCR hereditario no asociado a poliposis, CCR familiar), las enfermedades relacionadas con el CCR (enfermedad inflamatoria intestinal de larga evolución y/o afectación colorrectal extensa) o la exposición a radiación abdominal durante la infancia. La identificación, cribado y vigilancia de las personas con riesgo elevado debe considerarse prioritario en la prevención del CCR. Para los individuos con riesgo elevado, el cribado y/o la vigilancia generalmente requiere de recomendaciones específicas en cuanto a frecuencia y edad de inicio para realizar la colonoscopia u otras pruebas. La Guía de Práctica Clínica de semFYC y Asociación Española de Gastroenterología (AEG) propone las actuaciones de seguimiento específicas para cada situación de riesgo elevado77. En la tabla 9 se especifican las recomendaciones de vigilancia en los pacientes con pólipos78.
Recomendaciones para cáncer colorrectal, PAPPS 2020
- -
La SOH con la prueba inmunológica se debería recomendar como prueba de cribado del CCR a las personas de 50 a 74 años, con periodicidad anual o bienal (evidencia moderada, recomendación débil a favor).
- -
La sigmoidoscopia cada 15 años (o única a edad de máximo riesgo, entre 55 y 64 años) se podría recomendar como método de cribado a las personas de 50 a 74 años allí donde esté disponible (evidencia moderada, recomendación débil a favor).
- -
La colonoscopia cada 15 años (o única a edad de máximo riesgo, entre 55 y 64 años) se podría recomendar como prueba de cribado a las personas de 50 a 74 años (evidencia moderada, recomendación débil a favor).
- -
Los profesionales de atención primaria tienen que identificar a las personas con riesgo elevado de CCR (sospecha de CCR hereditario y familiar) y derivarlas a las unidades especializadas y/o Unidades de Consejo Genético.
- -
Los profesionales de atención primaria tienen que facilitar el cumplimiento de las recomendaciones de las colonoscopias de seguimiento de los pólipos.
Clasificación de los grupos de riesgo en pacientes con pólipos colorrectales que requieren y no requieren vigilancia78
| Pacientes que no requieren vigilancia endoscópica* | - 1 o 2 adenomas tubulares con displasia de alto grado y < 1 cm- Pólipo serrado sin displasia < 1 cm** |
| Pacientes que requieren vigilancia endoscópica (intervalo 3 años) | - 3 o más adenomas tubulares con displasia de bajo grado y < 1 cm- Al menos 1 adenoma velloso con displasia de alto grado o ≥ 1 cm- Al menos 1 pólipo serrado con displasia o ≥ 10 mm (adenoma serrado sésil con displasia o adenoma serrado tradicional) o tamaño ≥ 1 cm |
| Pacientes que requieren vigilancia endoscópica (intervalo 1 año) | - 5 o más adenomas o algún adenoma ≥ 2 cm |
El 95% de los cánceres de páncreas son adenocarcinomas y solo el 5% se desarrollan a partir de las células endocrinas, las productoras de insulina. Generalmente el adenocarcinoma de páncreas se diagnostica en etapas avanzadas (80-85% de los casos) y el tratamiento es complejo79. En las tablas 1 y 2 se pueden consultar los datos de incidencia, mortalidad y supervivencia. En los países occidentales y, posiblemente relacionado con los factores de riesgo, la incidencia va en aumento. Aproximadamente un 5-10% de los adenocarcinomas pancreáticos son familiares sin mutaciones genéticas claramente conocidas80. En diversos SPHC se ha observado una alta incidencia de cáncer de páncreas (tabla 3). La mayoría de los pacientes con cáncer de páncreas desarrollan una enfermedad metastásica o localmente avanzada durante una fase asintomática del tumor79. Los síntomas iniciales son inespecíficos (tabla 6).
La USPSTF recientemente ha actualizado su RS sobre cribado de cáncer de páncreas80. La RS incluye 13 estudios de cohorte prospectivos (con un total de 1.317 pacientes), realizados en personas mayoritariamente de elevado riesgo familiar o genético, no identificando ningún ECA. Ningún estudio aporta resultados sobre la morbilidad o mortalidad ni sobre la efectividad del tratamiento para el adenocarcinoma pancreático detectado por cribado. Los rendimientos oscilaron entre 0 y 75 casos por cada 1.000 personas en estudios que utilizaron ultrasonido endoscópico, resonancia magnética y/o detección con tomografía computarizada. En total, se identificaron 18 casos de adenocarcinoma pancreático en 1.156 adultos con riesgo familiar o hereditario y se detectaron 0 casos en 161 adultos sin riesgo. En ocho estudios (n = 675) que evaluaron los daños del cribado, no se informaron daños graves del cribado inicial. La evidencia de daños quirúrgicos fue limitada.
La USPSTF concluye que el cribado basado en pruebas de imagen en grupos con alto riesgo familiar puede detectar adenocarcinoma pancreático con evidencia limitada sobre los daños80. Se desconoce el efecto del cribado sobre la morbilidad y la mortalidad en personas con predisposición familiar y hereditaria, y no se dispone de datos en población de no riesgo. La evidencia sobre beneficios y daños de la intervención quirúrgica para el adenocarcinoma pancreático detectado por cribado es limitada.
La USPSTF recomienda no realizar cribado del cáncer de páncreas en adultos asintomáticos (tabla 8)80. Actualmente, ninguna organización recomienda la detección del cáncer de páncreas en la población general de adultos asintomáticos. El American College of Gastroenterology recomienda la vigilancia del cáncer de páncreas en ciertas personas de alto riesgo (p. ej., personas con síndromes genéticos conocidos asociados con el cáncer de páncreas y aquellos con un familiar de primer grado afectado de cáncer de páncreas) y sugiere se debería realizar en centros experimentados, idealmente bajo condiciones de investigación80.
Cáncer de próstataEl cáncer de próstata es el tumor más frecuente en hombres de los países occidentales. En las tablas 1 y 2 se pueden consultar los datos de incidencia, mortalidad y supervivencia del cáncer de próstata en España. En la tabla 3 se describen los factores de riesgo21. Los síntomas se presentan en las etapas avanzadas de la enfermedad81 (tabla 6).
La implementación y los cambios en las recomendaciones del cribado con antígeno prostático específico (PSA) han modulado la incidencia del cáncer de próstata y su tendencia en los diferentes países. Generalmente, el cribado detecta tumores de crecimiento lento que no causarán síntomas en la vida de la persona (sobrediagnóstico). Se considera normal un rango de PSA total, entre 0,1 y 4 ng/mL. Un PSA entre 4 y 10 ng/mL se puede encontrar en diversos procesos benignos: hiperplasia benigna de próstata, prostatitis aguda y crónica, retención urinaria, biopsia prostática, eyaculación y masaje prostático82. Por encima de los 10 ng/mL se debe sospechar un proceso maligno. Asimismo, valores por debajo de 4 ng/mL tampoco garantizan la ausencia de cáncer de próstata. Es decir, la determinación del PSA es una prueba sensible pero poco específica (alrededor del 33%), con muchos resultados falsos positivos y también falsos negativos. Por sí sola no permite distinguir entre cánceres indolentes y cánceres de crecimiento rápido, capaces de diseminarse y que pueden ser letales.
La actualización de las revisiones sistemáticas de la USPSTF83 y la del proyecto BMJ Rapid Recommendations Project de UK, en colaboración con MAGIC research and innovation programme (http://magicproject.org/)84, incluyen el ECA Cluster Randomised Trial of PSA Testing for Prostate Cancer85 realizado en Inglaterra y Gales. Cuando se tienen en cuenta los cinco ECA disponibles, no se observa reducción de la mortalidad total (RR 0,99; IC 95% 0,98-1,01), ni de la mortalidad específica del cáncer de próstata (RR 0,96; IC 95% 0,85-1,08). Sin embargo, cuando solo se tiene en cuenta el ECA europeo ERSPC, no hay reducción de la mortalidad total (RR 1,00; IC 95% 0,98-1,01), pero sí de la mortalidad específica del cáncer de próstata (RR 0,79; IC 95% 0,69-0,91)84. La reducción del riesgo absoluto se estima de 1,1 muertes por 10.000 persona-año (IC 95% 0,5-1,8). Los resultados del ECA europeo ERSPC también sugieren que el cribado reduce la incidencia de enfermedad metastásica83. Entre los daños del cribado hay que destacar los falsos positivos, las complicaciones de la biopsia (infección, sangrado o dificultades urinarias) y el no despreciable sobrediagnóstico y sobretratamiento de cánceres de próstata localizados. La incontinencia urinaria y la disfunción eréctil son efectos secundarios de la prostatectomía radical, y la disfunción eréctil se observa tras la radioterapia83.
En el tratamiento de los cánceres de próstata localizados en personas asintomáticas de edad avanzada se plantea la observación (no hacer nada) y el seguimiento activo (PSA y/o tacto rectal) como alternativa al sobretratamiento activo (cirugía o radioterapia) de muchos cánceres de próstata indolentes. En este sentido, el estudio Prostate Testing for Cancer and Treatment Trial PROTECT (de EE.UU., seguimiento a 10 años) compara la monitorización activa mediante PSA frente a la prostatectomía radical y la radioterapia de haz externo. Los resultados muestran que la mortalidad específica por cáncer de próstata fue baja, sin diferencias significativas entre los tratamientos86. Tampoco hubo diferencias en la mortalidad global. Sin embargo, la cirugía y la radioterapia se asociaron con una menor incidencia de progresión de la enfermedad y metástasis, comparado con la monitorización activa86. En el estudio Cancer Intervention vs. Observation Trial PIVOT (de Reino Unido, seguimiento a 19,5 años) se compara la observación frente a la prostatectomía y tampoco se observan diferencias significativas en la mortalidad, excepto en la mortalidad por todas las causas de los tumores de riesgo intermedio (RR 0,8; IC 95% 0,67-0,96). El 20,4% de los hombres asignados a la observación se sometió a un tratamiento definitivo, aunque en la mayoría de los casos fue por progresión local (la mitad de ellos, asintomática)87.
En el contexto de enfermedad más avanzada, el ECA Scandinavian Prostate Cancer Group Trial-4(SPCG-4) evaluó la prostatectomía radical versus la observación en pacientes. En estos casos, la prostatectomía radical sí se asoció con una reducción estadísticamente significativa de la mortalidad por cáncer de próstata (RR 0,56; IC 95% 0,41-0,77) y mortalidad por todas las causas (RR 0,7; IC 95% 0,59-0,86), en comparación con la espera vigilante88.
La USPSTF modifica sus anteriores recomendaciones en contra del cribado de 2002 y propone que para el grupo de 55 a 69 años la decisión sea individualizada, informando previamente sobre los posible beneficios y daños del cribado (recomendación C)89. En hombres de 70 años o más, se mantiene la recomendación en contra del cribado (recomendación D) (tabla 8)89. La USPSTF señala que se necesitan más estudios para recomendar el intervalo entre pruebas de cribado. Un cribado más frecuente potencialmente ofrece mayor reducción de la mortalidad por cáncer de próstata, pero también tasas más elevadas de sobrediagnóstico y otros daños. Asimismo, también se necesitan más estudios para comprender los posibles beneficios y daños de adelantar la edad de inicio del cribado en hombres con riesgo elevado89.
Los miembros del proyecto BMJ Rapid Recommendations consideraron que la mayoría de los hombres rechazarán el cribado porque el beneficio es pequeño e incierto y hay daños claros91. Sin embargo, es probable que haya una variación considerable en los valores y las preferencias. Los hombres con antecedentes familiares de cáncer de próstata, ascendencia africana o de un nivel socioeconómico más bajo, que tienen un mayor riesgo inicial de muerte por cáncer de próstata, pueden ser más propensos a elegir la prueba de PSA. La toma de decisiones compartida es necesaria para los hombres que consideran el cribado de cáncer de próstata.
Las diferentes recomendaciones coinciden al igual que la USPSTF y la NCCN en ofrecer un proceso de decisión compartida tras una información detallada e individualizada sobre las incertidumbres, daños y beneficios del cribado de cáncer de próstata91. Asimismo, recomiendan ofrecer determinación de PSA en edades más tempranas a los hombres con riesgo elevado de cáncer de próstata (antecedentes familiares, ascendencia afroamericana y portadores de mutaciones BRCA2). En los portadores de la mutación BRCA está indicada la vigilancia intensiva de cáncer de próstata y también de mama.
En resumen, las recomendaciones más actuales abogan por un cribado con PSA individualizado, tras una decisión compartida médico-paciente, teniendo en cuenta los grupos de alto riesgo (edad, afroamericanos, antecedentes familiares) valorando los posibles beneficios y daños del cribado89,91. El balance entre beneficios y riesgos es más favorable en los pacientes con cáncer de próstata de alto riesgo que se pueden beneficiar de un tratamiento activo (prostatectomía radical, radioterapia). Los profesionales de atención primaria deben favorecer que el paciente tome una decisión personal de acuerdo con sus preferencias.
Recomendaciones para cáncer próstata, PAPPS 2020
- -
En el grupo de población de menores de 55 años asintomáticos no se debe recomendar la determinación del PSA (evidencia baja, recomendación fuerte en contra).
- -
En el grupo de población entre 55 y 69 años asintomáticos se debería recomendar la determinación del PSA en función de un riesgo elevado (antecedentes familiares, afroamericanos) y las preferencias de la persona (evidencia moderada, recomendación débil a favor).
- -
En el grupo de población de 70 años o más asintomáticos no se debe recomendar la determinación del PSA (evidencia baja, recomendación fuerte en contra).
- -
No se ofrecerá la realización de PSA a población asintomática de forma activa. Si la persona lo solicita será necesario ofrecer información exhaustiva y detallada sobre el balance entre riesgos y beneficios.
El cáncer de pulmón es uno de los cánceres más comunes a nivel mundial. En España es la principal causa de muerte por cáncer entre los hombres y la tercera entre las mujeres. En las tablas 1 y 2 se pueden consultar los datos de incidencia, mortalidad y supervivencia del cáncer de pulmón en España.
El tabaco es el principal factor de riesgo de cáncer de pulmón, responsable del 90% de los casos22. Según la Encuesta Nacional de Salud de 2017, el porcentaje de fumadores es del 25,6% en hombres y del 18,8% en mujeres92. Comparado con las anteriores encuestas, la evolución de la tendencia indica un descenso muy lento, sobre todo de las mujeres fumadoras, aunque todavía una importante proporción de la población es fumadora92. El consejo claro y personalizado para dejar de fumar y evitar el inicio del hábito tabáquico entre los jóvenes es la estrategia más efectiva para reducir la incidencia y mortalidad por cáncer de pulmón1. La exposición al radón (emisiones de gas radiactivo en subsuelos ricos en uranio) y otros carcinógenos como el asbesto, incrementan el riesgo en fumadores, pero también son factores de riesgo en los no fumadores. En la tabla 3 se describen los diferentes factores de riesgo asociados al cáncer de pulmón22.
El ECA norteamericano NLST (National Lung Screening Trial) y el ECA holandés/belga NELSON (Nederlands-Leuvens Longkanker Screenings) han mostrado que el cribado de cáncer de pulmón con tomografía computarizada de baja dosis de radiación (TCBD) en pacientes fumadores importantes, permite un diagnóstico del cáncer de pulmón en estadios precoces y reduce de forma significativa la mortalidad (20-26% de reducción). Sin embargo, es un cribado controvertido por los daños que conlleva la exposición a la radiación y los procedimientos invasivos (biopsia pulmonar), en el caso de un resultado del TCBD positivo o sospechoso, así como de sobrediagnóstico y sobretratamiento. La revisión de la evidencia científica se puede consultar en la actualización del PAPPS de 20181. La RS más reciente publicada en 2018 por el American College of Chest Physician concluye que el cribado con TCBD para cáncer de pulmón muestra un balance beneficio-riesgo favorable, pero muy discreto, muy tenue, viéndose afectado por el riesgo basal del paciente, la calidad de las imágenes y su interpretación, y la efectividad de las intervenciones para dejar de fumar93. El riesgo basal en relación con la edad y el historial de tabaquismo, también la historia familiar de cáncer de pulmón y la enfermedad pulmonar obstructiva crónica, modulan el balance beneficio-riesgo de este cribado.
El American College of Chest Physicians y las diversas sociedades americanas, entre ellas la American Thoracic Society, la American Society of Clinical Oncology y el National Comprehensive Cancer Network abogan también por este cribado. La USPSTF94 y la CTFPH95 están actualizando sus respectivas RS y recomendaciones (tabla 8). Todas las instituciones señalan que el método más importante para reducir la mortalidad por cáncer de pulmón es dejar de fumar.
En Europa el cribado de cáncer de pulmón no está aprobado. A pesar de la reducción de la mortalidad, existe incertidumbre sobre los posibles efectos negativos del cribado y si es un cribado coste-efectivo. No obstante, el panel de expertos europeos sobre políticas de salud en Europa (ESMO Open-Cancer Horizons) considera que implementar el cribado de cáncer de pulmón debería ser una prioridad en Europa96. Señala las oportunidades de mejorar de este cribado a través de la planificación de «programas de investigación de implementación» y señala dos áreas que necesitan consideración específica: conocer el coste-efectividad (los datos del UKLS indican £ 12.000/año de vida ajustado por calidad) y si ofrecer el cribado cada dos años, a la vez que integrar programas para dejar de fumar, es apropiado96. Implementar el cribado de cáncer de pulmón en España requiere un análisis de la factibilidad y la accesibilidad a las pruebas y el coste-efectividad de este cribado.
Recomendaciones para cáncer de pulmón, PAPPS 2020
- -
Los profesionales de atención primaria deben realizar consejo claro y personalizado para dejar de fumar a todas las personas fumadoras (evidencia alta, recomendación fuerte a favor).
- -
La radiografía de tórax y/o la citología de esputo no se deben recomendar como pruebas de cribado del cáncer de pulmón (evidencia moderada, recomendación fuerte en contra).
- -
La TCBD no se debería recomendar como prueba de cribado del cáncer de pulmón (evidencia moderada, recomendación débil en contra).
El cáncer de piel engloba tres enfermedades neoplásicas que tienen diagnóstico, tratamiento y pronóstico muy diferente. El carcinoma de células basales es la forma más común, seguido del carcinoma de célula escamosas (espinocelular), ambos conocidos como cáncer de piel no melanoma y con pronóstico muy favorable. El melanoma, es menos frecuente, pero es el cáncer de piel más agresivo. En las tablas 1 y 2 se describen los datos de incidencia, mortalidad y supervivencia del melanoma de piel en España. Los factores de riesgo son genéticos, familiares y ambientales (tabla 3). La radiación solar (rayos ultravioleta-UV) es el factor etiopatogénico más importante. La mayoría de los melanomas se localizan en la piel y rara vez se desarrollan en mucosas (boca, iris, retina y órganos internos). En los hombres, las localizaciones más frecuentes son el tronco, incluidos hombros, cabeza y cuello, y en las mujeres, en los brazos y piernas. Los criterios ABCD (asimetría, bordes, color y diámetro) ayudan a identificar una lesión como sospechosa de malignidad (tabla 8).
Las medidas de prevención primaria incluyen intervenciones sobre consejo de protección solar. Estas medidas incluyen: el uso de protector solar de amplio espectro con un SPF de 30 o más; usar sombreros, gafas de sol o ropa protectora contra el sol; evitar la exposición al sol; buscar sombra durante las horas del mediodía; y evitar el uso de camas de bronceado en interiores. Desde el punto de vista de la salud pública, es especialmente importante proteger a los grupos de población más vulnerables. El Código Europeo contra el Cáncer recomienda evitar la exposición solar (tabla 5). También aconseja consultar cualquier lunar o úlcera de nueva aparición de la piel.
La USPSTF ha revisado la evidencia sobre los beneficios y daños del consejo para la prevención del cáncer de piel en niños y adultos de piel clara, sin antecedentes de cáncer de piel97 y ha actualizado sus recomendaciones de 201698 (tabla 8). La RS incluye 21 ECA (n = 20,561). Los estudios sobre los efectos del consejo son muy heterogéneos (diseño, población diana, intervención, medidas de resultado, etc.) por lo que no es posible agrupar los resultados. Los autores concluyen que el consejo promueve conductas de protección solar para niños y adultos de hasta 24 años, pero no hay evidencia consistente en cuanto a la reducción de la frecuencia de quemaduras solares en niños o adultos, tampoco sobre los resultados del cáncer de piel. La intervención puede aumentar el autoexamen de la piel en adultos, que puede generar un aumento de visitas médicas sin detectar nevos atípicos o cánceres de piel adicionales. Los daños potenciales del consejo son menores e incluyen reacciones adversas en la piel al protector solar, actividad física reducida por pasar menos tiempo en el exterior y deficiencia de vitamina D por la reducción de la exposición al sol.
Una reciente RS de Cochrane ha evaluado la efectividad del cribado del melanoma en población general de riesgo medio mediante el autoexamen visual de la piel y la inspección visual por un médico u otro profesional de la salud99. La RS incluyó un ECA (1.356 personas) sobre autoexamen de la piel realizado en EE. UU., con un seguimiento a los dos, seis y 12 meses y un ECA de cribado en la consulta realizado en Australia (63.035 adultos), que duró tres años y no tuvo seguimiento. Los autores concluyen que no existe evidencia para recomendar o rechazar el cribado de melanoma (autoexamen o examen médico) en población general adulta. Antes de proponer programas de cribado en población es necesario un ECA riguroso que evalúe la mortalidad global, el sobrediagnóstico, las cirugías innecesarias, las consecuencias psicosociales y el uso de recursos, para determinar el balance entre beneficio y daños del cribado del melanoma maligno.
La mayoría de las sociedades científicas avalan las recomendaciones de cribado mediante autoexamen de piel y evaluación por parte de un profesional por lo menos una vez al año, fundamentalmente a individuos con riesgo elevado: personas con antecedentes de melanoma maligno o con disposición genética para este cáncer (por ej., síndrome de lunar atípico familiar y síndrome del melanoma).
Los médicos de atención primaria juegan un papel importante en la prevención y detección precoz del cáncer de piel. Deben dar consejo sobre factores de riesgo modificables y estrategias para evitar el sol, particularmente en pacientes con antecedentes personales o familiares de cáncer de piel.
Recomendaciones para cáncer de piel, PAPPS 2020
- -
En población con riesgo medio de cáncer de piel no se debe recomendar cribado para este cáncer (evidencia baja, recomendación fuerte en contra).
- -
En individuos de riesgo elevado se debe recomendar el examen de la piel dirigido a la identificación de lesiones sugestivas de cáncer (evidencia moderada, recomendación fuerte a favor).
- -
En los niños, adolescentes y adultos de riesgo elevado se debe realizar consejo para evitar la exposición excesiva a la radiación solar y recomendar el uso de protectores solares (evidencia moderada, recomendación fuerte a favor).
- -
Las campañas de sensibilización sobre protección solar son importantes para concientizar a la población en general.
El cáncer de tiroides se clasifica en tres tipos histológicos: a) epiteliales: carcinomas papilares (80-90% de los casos) y foliculares (5-10%), b) células parafoliculares: carcinomas medulares (< 5%); y c) carcinomas anaplásicos, que son tumores indiferenciados (más raros y de peor pronóstico).
El mayor uso de la ecografía de tiroides conlleva la detección de cánceres papilares de pequeño tamaño. El carcinoma papilar de tiroides de pequeño tamaño (diámetro inferior a 3 mm), es un hallazgo común en las autopsias de personas que han muerto por otra causa24. En las tablas 1 y 2 se pueden consultar los datos de incidencia, mortalidad y supervivencia del cáncer de tiroides en España. En la tabla 3 se describen los factores de riesgo de cáncer de tiroides24.
La revisión de la evidencia científica se puede consultar en la actualización del PAPPS de 20181. Los estudios ecológicos y transversales sugieren que el cribado del cáncer de tiroides conduce a un aumento de la incidencia sin ningún cambio resultante en la mortalidad. La mejor evidencia ecológica sobre el sobrediagnóstico del cáncer de tiroides proviene de Corea del Sur, que ha tenido un programa organizado de detección de cáncer desde 1999. En 2011, la tasa de diagnóstico de cáncer de tiroides fue 15 veces mayor que la tasa de diagnóstico en 1993, mientras que la tasa de mortalidad por cáncer de tiroides se mantuvo estable.
La USPSTF concluye, con una certeza moderada, que el cribado del cáncer de tiroides en personas asintomáticas produce daños que superan los beneficios100 (tabla 8). La mayoría de los cánceres son tratados con la extirpación de la glándula tiroides. Los daños quirúrgicos permanentes más frecuentes de la tiroidectomía, con o sin disección de los ganglios linfáticos, incluyen hipoparatiroidismo no reversible (hipocalcemia) y la parálisis recurrente del nervio laríngeo (parálisis de las cuerdas vocales). Las personas que se han sometido a una tiroidectomía necesitarán tomar levotiroxina diariamente, de manera indefinida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
This article is part of a supplement entitled “PAPPS- Actualización 2020” which is sponsored by “Sociedad Española de Medicina de Familia y Comunitaria (SemFYC)”.