Introducción
La Sociedad Española de Medicina de Familia y Comunitaria (semFYC), la Sociedad Española de Ginecología y Obstetricia (SEGO) y la Asociación Española para el Estudio de la Menopausia (AEEM), con el apoyo metodológico del Centro Cochrane Iberoamericano (CCIb), han elaborado una guía de práctica clínica (GPC) sobre la menopausia y la posmenopausia1. La versión en formato electrónico de la guía completa puede consultarse en la web de semFYC (http://www.semfyc.es) y en las respectivas webs de las instituciones participantes. Asimismo, la GPC se presenta en 3 artículos, siendo éste el tercero de ellos.
En el primer artículo de esta serie se han revisado los beneficios del tratamiento hormonal (TH) para los síntomas vasomotores y vaginales, así como las posibles alternativas, farmacológicas y no farmacológicas, al TH2. A partir de las evidencias disponibles se puede concluir que el TH, sólo con estrógenos o combinado con progestágenos, es efectivo para el tratamiento de los síntomas vasomotores intensos y se debe recomendar en la mínima dosis eficaz y durante el mínimo tiempo posible. En el segundo artículo se ha abordado la evaluación del riesgo de fractura y el cribado de la osteoporosis en la mujer posmenopáusica3. Asimismo, en la GPC se han evaluado las intervenciones preventivas, de modificación de estilos de vida y farmacológicas, incluido el TH, dirigidas hacia la prevención de fracturas en mujeres posmenopáusicas sanas y/o con criterios densitométricos de osteoporosis (prevención primaria), y las intervenciones dirigidas a las mujeres con fracturas (prevención secundaria)1.
En este artículo se presenta la parte de la GPC que evalúa, a partir de una revisión exhaustiva de los estudios de TH en la prevención primaria y secundaria de las enfermedades crónicas, los riesgos y beneficios del TH a medio y largo plazo. Durante las últimas décadas se ha sugerido que el uso del TH podría ser beneficioso para la prevención de diversas afecciones en las mujeres posmenopáusicas, entre ellas la enfermedad cardiovascular y la osteoporosis. Actualmente, y a partir de los resultados de los ensayos clínicos aleatorizados (ECA) iniciados en la segunda mitad de la década de los noventa, se considera que el riesgo del TH a largo plazo es superior al beneficio esperado, lo que ha originado un cambio profundo en la práctica clínica de la menopausia.
Descripción de los estudios sobre el tratamiento hormonal en la prevención de enfermedades crónicas
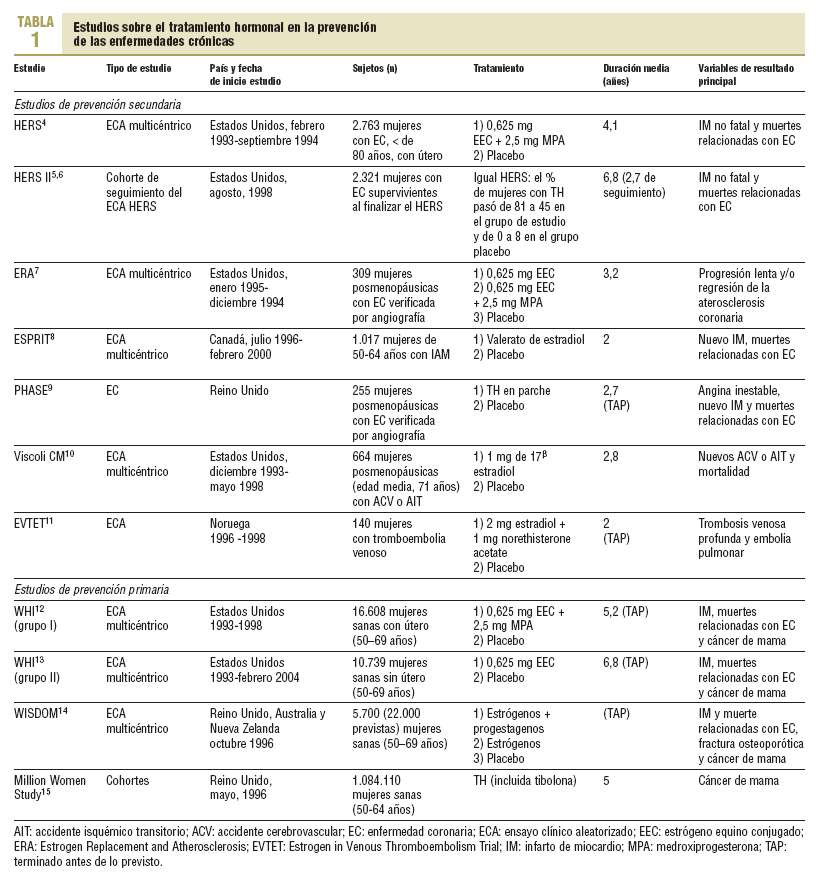
En la tabla 1 se describen los principales estudios sobre el TH en la prevención de algunas afecciones crónicas en las mujeres posmenopáusicas con enfermedad cardiovascular (prevención secundaria)4-11 y en mujeres sanas (prevención primaria)12-14. El estudio más importante de prevención secundaria es el Heart and Estrogen/Progestin Replacement Study (HERS)4, un ECA realizado en mujeres con enfermedad coronaria, y su cohorte de seguimiento HERS II5,6. Otros ECA de prevención secundaria presentan un tamaño muestral más pequeño. Los dos ECA de prevención primaria son el Women's Health Initiative (WHI)12,13, y el Women's International Study of Long Duration Oestrogen after Menopause (WISDOM)14. En ambos ECA se ha evaluado el tratamiento con estrógenos y progestágenos combinados en mujeres con útero (grupo I) y los estrógenos administrados de forma aislada en mujeres sin útero (grupo II), frente a placebo, finalizando ambos antes de lo previsto porque los riesgos superaban a los beneficios12-14. El Million Women Study es un estudio de cohortes en el que se describe la relación entre el uso de las distintas formas de TH, incluida la tibolona, y el riesgo de diversas afecciones, en especial el cáncer de mama15.
Riesgos del tratamiento hormonal a medio-largo plazo
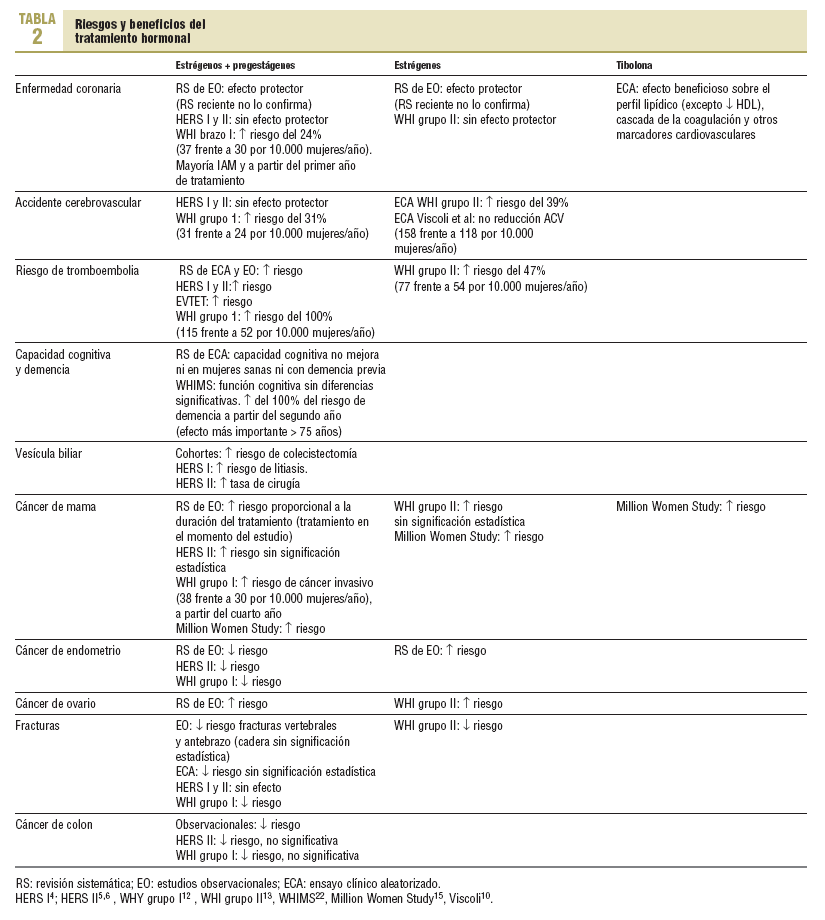
A continuación se presentan los principales riesgos del TH, incluida la tibolona. En la tabla 2 se describen los resultados más significativos:
Enfermedad coronaria (EC). Diversas revisiones sistemáticas (RS) de los estudios observacionales realizados a principios de los años noventa mostraron que el TH presentaba un efecto protector del riesgo global de incidencia y mortalidad por EC. Este efecto no pudo ser confirmado en el ECA HERS4, en su cohorte de seguimiento HERS II5, ni a través de otros ECA de prevención secundaria7-9. Este potencial beneficio tampoco se ha podido demostrar en ninguno de los grupos del ECA WHI donde, al contrario de lo esperado, el grupo I (TH combinado) ha mostrado un aumento del riesgo del 24% en el grupo de tratamiento12. Una RS posterior en la que se han evaluado de nuevo los estudios observacionales disponibles teniendo en cuenta en su análisis los diversos sesgos de selección, inclusión y análisis, no mostró, al contrario que las originales, ningún efecto protector del TH sobre la incidencia y la mortalidad por EC17.
Los estudios con tibolona presentan un efecto beneficioso sobre los marcadores de las enfermedad cardiovascular, pero los datos de eventos cardiovasculares son escasos18.
Enfermedad cerebrovascular (ECV). En las RS de estudios observacionales se han observado resultados contradictorios sobre el efecto del TH en la ECV19. El ECA HERS y su cohorte de seguimiento HERS II no han mostrado diferencias en la incidencia de accidentes cerebrovasculares (ACV) fatales y de accidentes isquémicos transitorios (AIT)4,5. Otro ECA de prevención secundaria con estrógenos administrados de forma aislada tampoco ha mostrado ningún beneficio sobre la ECV10. Por el contrario, los 2 grupos del ECA WHI han mostrado un incremento significativo del riesgo de ACV12,13.
Tromboembolia. Una RS sobre los efectos del TH en mujeres sanas ha mostrado un aumento del riesgo de tromboembolia (RR = 2,14; IC del 95%, 1,64-2,81)20. Este riesgo es mayor en los primeros 2 años de tratamiento y se correlaciona directamente con la dosis utilizada. Asimismo, el estudio HERS4,5 y otros ECA de prevención11 han mostrado un aumento del riesgo de tromboembolia en mujeres con enfermedad cardiovascular. Este aumento del riesgo tromboembólico también ha sido objetivado en los 2 grupos del estudio WHI12,13.
Capacidad cognitiva y demencia. Los resultados de las RS son contradictorios y se puede concluir que la evidencia del efecto del TH sobre la función cognitiva en la mujer posmenopáusica no es concluyente16,21. Los resultados del estudio WHIMS (Women's Health Initiative Memory Study), subestudio del WHI en mujeres > 65 años sin demencia, no han mostrado diferencias en la función cognitiva22 y, de hecho, el TH combinado duplicó el riesgo de presentar demencia (RR = 2,05; IC del 95%, 1,21-3,48)23. Este riesgo fue más acentuado en mujeres > 75 años y a partir del segundo año de tratamiento, y persistió durante todo el estudio23.
Alteraciones de la vesícula biliar. El ECA de prevención secundaria HERS mostró un aumento entre 1,5 y 2 veces en el riesgo de litiasis biliar4. La cohorte de seguimiento HERS II mostró un incremento de la tasa de cirugía de vesícula biliar (RR = 1,44; IC del 95%, 1,10-1,90)6.
Cáncer de mama. Las RS de estudios observacionales han mostrado un incremento del riesgo de cáncer de mama en las mujeres que utilizaban el tratamiento en el momento del estudio, el cual es proporcional a la duración del tratamiento16. No obstante, las mujeres que habían utilizado el TH en algún momento no mostraron un incremento del riesgo. La cohorte HERS II ha mostrado un aumento del riesgo sin alcanzar significación estadística (RR = 1,27; IC del 95%, 0,84-1,94)6. En el grupo I del WHI se ha observado un incremento del riesgo de cáncer de mama invasivo a partir del cuarto año en las mujeres del grupo de tratamiento, con una tendencia hacia el aumento ante un mayor tiempo de tratamiento12. Los cánceres de mama fueron diagnosticados en estadios más avanzados en el grupo de tratamiento, sin que se observaran diferencias significativas para los cánceres in situ. Este aumento del riesgo de cáncer de mama ocurre tanto con la administración de progestágenos secuencial como con su uso continuo. Contrariamente a lo esperado, en el grupo II del estudio WHI se ha observado una disminución no significativa del riesgo de cáncer de mama13.
En el estudio Million Women Study se ha obtenido un mayor riesgo de cáncer en las mujeres que recibían TH (RR = 1,66; IC del 95%, 1,58-1,75,), así como un aumento de la mortalidad por esta causa (RR = 1,22; IC del 95%, 1,0-1,48)15; la magnitud de la asociación fue mayor para el tratamiento combinado que para los diferentes tipos de estrógenos de forma aislada o la tibolona. Sin embargo, las mujeres que tenían antecedentes de haber utilizado el tratamiento en algún momento, pero no en el momento del estudio, no presentaron un aumento del riesgo. La tibolona también ha mostrado un incremento significativo de la incidencia de cáncer de mama (RR = 1,45; IC del 95%, 1,25-1,68); este riesgo es más elevado en relación con la duración del tratamiento15.
Cáncer de endometrio. La administración de estrógenos de forma aislada aumenta el riesgo de hiperplasia y cáncer de endometrio16. Este riesgo es 2,3 veces mayor (IC del 95%, 2,1-2,5) y se asocia directamente con la duración del tratamiento, permaneciendo elevado hasta 5 o más años tras su retirada. Los primeros estudios de cohortes ya mostraron que los progestágenos asociados con los estrógenos disminuían el riesgo de cáncer de endometrio (RR = 0,4; IC del 95%, 0,2-0,6)16. Este efecto protector de los progestágenos ha sido confirmado en la cohorte de seguimiento de los estudio HERS II4 y WHI (grupo I)13.
Cáncer de ovario. Diversas RS de estudios observacionales y posteriores estudios de cohortes con mujeres posmenopáusicas que recibieron el tratamiento durante más de 10 años han mostrado un aumento de la incidencia y la mortalidad por cáncer de ovario, con un gradiente de riesgo relacionado con la duración del tratamiento16. En el grupo II del WHI también se ha observado un incremento, aunque no significativo, del riesgo de cáncer de ovario (RR = 1,58; IC del 95%, 0,77-3,24)13.
Beneficios del tratamiento hormonal a medio y largo plazo
Osteoporosis y riesgo de fractura. Las diferentes RS muestran que el TH aumenta la densidad mineral ósea (DMO) y el porcentaje de recambio de ésta después de 1 año de tratamiento (el 5,4% en la columna lumbar, el 3,0% en el antebrazo y el 2,5% en el cuello femoral). Estos porcentajes se incrementaron a los 2 años de tratamiento16,25.
A partir de los principales estudios de cohortes de mujeres que utilizaron TH y que fueron seguidas durante períodos prolongados se objetiva una reducción significativa de las fracturas vertebrales y de antebrazo, y una disminución no significativa de las fracturas de cadera. Los primeros ECA disponibles habían mostrado una mayor reducción de fracturas vertebrales frente a las no vertebrales (RR = 0,87; IC del 95%, 0,71-1,08), aunque en ninguno de los casos era significativa25. Los resultados de los estudios HERS I y II no han mostrado una reducción del riesgo de fractura de cadera o de otras localizaciones en mujeres con antecedentes de enfermedad cardiovascular4,6. En el grupo I del WHI se han obtenido los datos más consistentes, con una reducción del riesgo para cualquier fractura (RR = 0,76; IC del 95%, 0,69-0,83) y para la fractura de cadera (RR = 0,67; IC del 95%, 0,47-0,96) en mujeres sanas con TH combinado12. En el grupo II del WHI se han obtenido resultados similares13.
En relación con el mantenimiento del efecto una vez retirado el tratamiento, las mujeres que habían suspendido el TH hacía más de 5 años presentaron valores de DMO similares a los de las mujeres que nunca habían sido tratadas26. Estos hallazgos son independientes de la edad, el índice de masa corporal, el estilo de vida o los años transcurridos tras la menopausia y el lugar de evaluación de la DMO.
Cáncer de colon. En 2 RS de estudios observacionales se ha observado una disminución del riesgo de cáncer de colon en las mujeres que utilizaron o estaban utilizando TH16. Tanto la cohorte de seguimiento del HERS II como el grupo I del WHI muestran un efecto protector6,13. No obstante, este efecto beneficioso sólo fue estadísticamente significativo en el grupo II del estudio WHI (RR = 0,56; IC del 95%, 0,38-0,81), aunque los cánceres diagnosticados en el grupo de tratamiento se encontraban en un estadio más avanzado13.
Conclusiones y aplicación práctica
Las evidencias disponibles a partir de los diferentes ECA y los distintos regímenes de TH no han permitido demostrar una protección cardiovascular en mujeres con enfermedad cardiovascular ni en mujeres sanas. La prevención cardiovascular requiere la intervención sobre los factores de riesgo y los hábitos de vida y, cuando esté indicado, el tratamientos para el control lipídico y las cifras de presión arterial.
El TH, a medio y largo plazo, aumenta el riesgo de tromboembolia venosa, accidentes cerebrovasculares, demencia, litiasis biliar y cirugía de vesícula biliar, cáncer de mama y cáncer de ovario. Los progestágenos asociados a la toma de estrógenos tienen un efecto protector sobre el cáncer de endometrio. A pesar de los resultados disponibles, el tratamiento sólo con estrógenos no ha mostrado incrementar el cáncer de mama. El TH protege frente al cáncer de colon.
El TH aumenta la DMO y disminuye el riesgo de fractura, tanto vertebrales como no vertebrales. No obstante, el balance riesgo-beneficio del TH a medio y largo plazo es desfavorable, por lo que éste no se puede considerar como tratamiento de primera línea en el manejo de la osteoporosis.
A partir de la información derivada de estos estudios, las diferentes agencias internacionales y la Agencia Española del Medicamento no recomiendan el TH en mujeres asintomáticas debido a este balance riesgo-beneficio desfavorable. Esta recomendación sobre el TH afecta a todas las especialidades farmacéuticas que contienen estrógenos con o sin progesterona y a la tibolona. Cuando se requiera un TH para el control de los síntomas vasomotores intensos, éste se debe recomendar, en la mínima dosis eficaz y durante el mínimo tiempo posible, con el objetivo de minimizar los riesgos.