Introducción
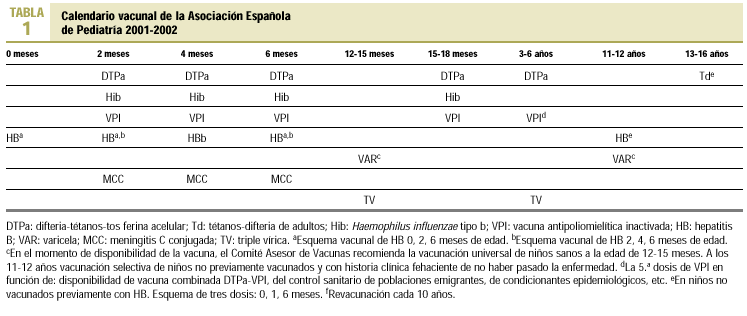
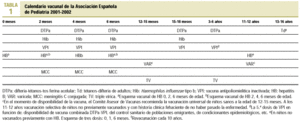
El calendario de vacunaciones sistemáticas varía según el país, institución o grupo de expertos que efectúa las recomendaciones. La Asociación Española de Pediatría (AEP) efectuó las suyas en los años 1995, 1999, 2000 y 2001. En 1995 se adelantó la primovacunación a los 2-4-6 meses y se introdujo la vacuna anti-Hib, la antihepatitis B en los lactantes y la segunda dosis de triple vírica, entonces a los 11-12 años. En 1999 se adelantó la segunda dosis de triple vírica a los 3-6 años y se dejó a criterio de las diferentes CCAA la pauta de vacunación antihepatitis B. También en 1999 se generalizó la vacunación sistemática anti-Hib a los 2-4-6-18 meses. A finales del 2000 se añadió al calendario la vacuna conjugada antimeningococo C a los 2-4-6 meses. En 2001 la AEP publicó un nuevo calendario con las recomendaciones para el bienio 2001-2002, en el que aparecen importantes novedades (tabla 1):
dTP acelular. En todas las dosis de DTP que se administren.
Polio inactivada inyectable. En todas las dosis de vacuna antipoliomielítica administradas.
Varicela. Vacunación sistemática cuando esta vacuna sea de libre disposición.
Durante los últimos años se han comercializado en España muchas nuevas vacunas (tabla 2). Están también a punto de comercializarse nuevas vacunas antigripales para administración nasal, se están ensayando vacunas antineumocócicas conjugadas 9, 11 y 13 valentes y se encuentran en avanzadas fases de investigación nuevas vacunas contra el rotavirus y contra el meningococo, incluyendo vacunas contra el serotipo B.
La disponibilidad de nuevas y mejores vacunas y la posibilidad de inmunizar frente a más enfermedades sin aumentar excesivamente el número de inyecciones a administrar aconseja reconsiderar las posibilidades de actualización del calendario vacunal. En futuros calendarios es de esperar (tabla 3):
La incorporación de nuevas vacunas mono o polivalentes.
La sustitución de alguna vacuna actual por otras más modernas, seguras e inmunógenas.
La modificación del número de dosis e intervalos con que se administran algunas de ellas.
La asociación de vacunas actuales y futuras en nuevas vacunas combinadas.
Vacunación sistemática contra la varicela
La varicela tiene un coste sanitario y social significativo. Su importancia clínica se debe a las complicaciones (sobreinfección bacteriana, neumonía y complicaciones neurológicas, sobre todo), mucho más frecuentes en adultos, inmunodeficientes y niños menores de 1 año. La mortalidad es también mayor en inmunodeficientes (15-20%), adultos (25/100.000) y niños menores de un año (6/100.000) que en niños de 1-15 años inmunocompetentes (1-3/100.000). En España se declaran unos 200.000 casos anuales (se supone que la incidencia puede ser el doble), que comportan alrededor de 1.000 hospitalizaciones y 5-6 defunciones. La mayoría de las hospitalizaciones y muertes por complicaciones de la varicela tienen lugar en niños sin factores de riesgo, pues la mayoría de los casos de varicela ocurren en este grupo etario. A los 14 años más del 90% de la población española es ya inmune y a los 35, el 99%. Queda, por tanto, un 5% de jóvenes de 15-35 años susceptibles a la varicela, que deberán tenerse en cuenta al decidir la estrategia de vacunación. Ya que suelen encontrarse en ese rango de edad, un similar porcentaje de las mujeres embarazadas son también susceptibles. La varicela en la embarazada comporta mayor riesgo de varicela grave y la posibilidad de ocasionar una varicela neonatal, si se contrae al final del embarazo, o un síndrome de varicela fetal, si se adquiere en los primeros meses de la gestación. La vacuna confiere protección excelente (> 95%) frente a la enfermedad grave, buena contra la enfermedad clínica con exantema (70-90%) y sólo modesta contra la infección. Más del 95% de niños sanos logran la seroconversión con una sola dosis. Los mayores de 13 años y adultos sanos seroconvierten tras 2 dosis en el 99% de casos (en la primera dosis existe un 20% de fallos). Estudios en EE.UU. y Japón comprueban una duración de la protección, hasta la fecha, de 11 y 20 años, respectivamente. La experiencia con otras vacunas de virus vivos sugiere que la inmunidad proporcionada por la vacuna será de larga duración, probablemente de por vida. Se dudaba acerca del efecto de la vacuna en la epidemiología de la varicela y la posibilidad de desplazar su máxima incidencia a edades adultas, cuando la varicela es más grave y sus complicaciones más frecuentes. Se calcula que alcanzando coberturas mayores del 90% mediante vacunación universal, una mayor proporción de casos ocurriría en edades más avanzadas, pero el número absoluto de varicelas disminuiría en los niños y en los adultos. Con coberturas bajas, un número excesivo de niños alcanzaría la edad adulta siendo aún susceptibles, y el número de varicelas en adultos aumentaría.
También parecen aclaradas las dudas existentes en cuanto a la varicela posvacunal (un 3-5% de niños vacunados presenta erupción vesiculosa localizada en el punto de inyección y otro 3-5% generalizada, maculopapulosa o similar a la varicela, usualmente leve), el herpes zoster (la incidencia y gravedad del zoster en vacunados es inferior que en los no vacunados) y la posible transmisión del virus vacunal, muy excepcional y que sólo se produce a partir de vacunados que tienen erupción. El virus parece seguir atenuado al transmitirse a partir de un vacunado y es sensible al aciclovir. No se recomienda, por todo ello, la administración de inmunoglobulina específica varicela-zoster a personas susceptibles de alto riesgo (inmunodeficiencia o inmunosupresión) expuestas a un caso de varicela vacunal.
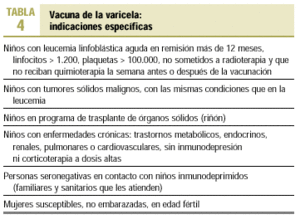
Los estudios de coste-beneficio, en nuestro país y en otros con características socioeconómicas similares, si se incluyen los costes médicos directos y los costes sociales indirectos, son favorables a la vacunación sistemática. En España de momento está catalogada como de «uso hospitalario» y sólo se encuentra indicada en pacientes de alto riesgo y sus contactos susceptibles (tabla 4). La estrategia de vacunación universal contra la varicela incluiría:
Vacunación sistemática con una sola dosis entre los 12 y los 15 meses, preferiblemente de forma simultánea con la triple vírica.
Vacunar a todos los niños susceptibles antes de cumplir los 13 años, preferiblemente en una visita rutinaria a los 11 y 12 años. En mayores de 13 años se deben administrar 2 dosis separadas al menos durante un mes.
Probablemente se decida administrar, al menos durante algunos años, una segunda dosis de vacuna en la preadolescencia, como se hizo en su momento con la triple vírica, para evitar que queden individuos susceptibles más allá de esta edad.
Vacunación (2 dosis) de los adultos susceptibles, siendo prioritaria la vacunación de los adultos que cuidan niños, los que tengan contacto estrecho con personas con alto riesgo de complicaciones graves, los que tengan riesgo elevado de adquirir la varicela y las mujeres en edad fértil, no embarazadas.
La AEP aconseja ya desde 1999 que se amplíe la indicación a todos los niños sanos y se incorpore al calendario de vacunaciones sistemáticas de todas las CCAA, en la misma visita en que se administra la triple vírica (12-15 meses). Es importante el inicio simultáneo y lograr rápidamente altas coberturas en todas las comunidades para evitar bolsas de individuos susceptibles dentro de una población en la que exista escasa transmisión infantil del virus de la varicela natural.
Sustitución de la vacuna antipoliomielítica oral por la inactivada intramuscular
En zonas libres de poliovirus salvaje la única causa de polio paralítica son los poliovirus de la vacuna oral. Su circulación representa un problema para la erradicación global de la polio, ya que una vez suspendida la vacunación podrían revertir al estado salvaje o adquirir neurovirulencia. Ello ha llevado a discutir el papel de las distintas vacunas antipoliomielíticas existentes y, a medio plazo, probablemente su retirada del calendario de vacunaciones sistemáticas.
En España no hay casos de polio desde 1989, la cobertura vacunal es mayor del 95% en el primer año de vida y sólo existe el riesgo de adquirirla en no vacunados que viajen a zonas endémicas y la posibilidad de algún caso importado. En 1999 se declaró el último caso de poliomielitis paralítica asociada a la vacuna antipoliomielítica oral.
La vacuna antipoliomielítica oral (VPO) (Sabin) sigue siendo la recomendada por la OMS para lograr la erradicación global de la poliomielitis, sobre todo donde aún se declaran casos por poliovirus natural, y es también la indicada para controlar brotes epidémicos de polio, incluso en países que usan sólo la inactivada, porque consigue mayor seroconversión que la vacuna inactivada tras una dosis única, proporciona inmunidad intestinal, reduciendo así la transmisión del virus, y se excreta en las heces, contribuyendo a la inmunidad colectiva. Este hecho, hasta ahora ventaja de la VPO, se ha convertido en argumento en contra de su uso en países donde no se detectan casos nuevos desde hace muchos años.
Su único efecto grave es el desarrollo de polio paralítica en el receptor de la vacuna o en sus contactos, especialmente si uno u otros son inmunodeficientes. El riesgo global de polio paralítica producida por la VPO es de 1/2.400.000 dosis administradas (en la primera dosis 1/750.000). En inmunodeficientes el riesgo es 3.000-7.000 veces mayor. Debido al riesgo de polio paralítica y a que el virus se excreta en las heces, la VPO está contraindicada en niños con inmunodeficiencia congénita o adquirida (VIH, inmunosupresión, neoplasia) o que conviven con inmunodeficientes, durante el embarazo y en la primovacunación de mayores de 18 años.
En la vacuna antipoliomielítica inyectable (VPI) (Salk) los 3 virus están inactivados. Sus desventajas en relación con la vacuna oral (coste y facilidad de administración) se verán minimizadas por el empleo de vacunas combinadas que la incluyan entre los antígenos que contienen. Los países desarrollados han empezado a sustituir la vacuna oral por la inactivada, administrándola junto a la DTP, como la VPO. La Academia Americana de Pediatría, a partir del 2000, recomienda emplear exclusivamente VPI. Los países escandinavos han utilizado desde siempre sólo la vacuna inactivada y en Francia se sustituyó a la VPO a partir de 1989. En Europa occidental solamente España, Portugal, Grecia y Reino Unido usan VPO.
La VPI se emplea actualmente en España sólo para vacunación de adultos, inmunodeficientes de cualquier edad y quienes conviven con estos últimos. La recomendación de la Asociación Española de Pediatría a partir del bienio 2001-2002 es emplear la inactivada en todas las dosis de vacuna antipoliomielítica que se administren. Uno de los obstáculos que se oponen a la utilización en nuestro país de las vacunas penta (DTPa + Hib + VPI) y hexavalentes (DTPa + Hib + VPI + hepatitis B) es el retraso en la sustitución de la vacuna antipoliomielítica oral por la inactivada, cuando la disponibilidad de estas vacunas debería, por el contrario, facilitar la sustitución de la VPO por la VPI. Por otra parte, no existen razones para seguir recomendando 5 dosis, ya que bastan 4 para garantizar una adecuada inmunización en los países desarrollados. La administración de una quinta dosis vendrá condicionada por cambios en la situación epidemiológica, un eventual descenso de las coberturas, la existencia de grupos de población susceptibles y la disponibilidad de preparados comerciales adecuados (no se dispone de vacunas tetravalentes DTPa-VPI sin Hib o hepatitis B).
Introducción de la vacuna antineumocócica conjugada
La única vacuna antineumocócica disponible hasta hace poco era la polisacárida 23-valente. Recientemente se ha comercializado en España la vacuna antineumocócica conjugada 7-valente (Prevenar®), con antígenos de 7 serotipos (4, 6B, 9V, 14, 18C, 19F, 23F) conjugados individualmente a una proteína transportadora (CRM197, mutante atóxica de la toxina diftérica). Las conclusiones del análisis coste-beneficio dependen sobre todo del precio de la vacuna, especialmente en niños mayores de 24 meses. Los grupos en los que se demuestra mayor rentabilidad de la vacuna conjugada son los niños menores de 24 meses y los niños menores de 5 años incluidos en los grupos de riesgo.
En EE.UU. la vacuna forma parte del calendario de vacunaciones sistemáticas. Las recomendaciones del ACIP y la AAP incluyen, en síntesis, la vacunación sistemática con vacuna conjugada 7-valente de todos los menores de 2 años y de los niños mayores de 2 años incluidos en los grupos de riesgo ya definidos para la anterior vacuna no conjugada. En otros niños menores de 5 años recomiendan considerar la administración de una dosis de vacuna conjugada, siendo prioritarios los de 24-35 meses, los que asisten a guarderías y los de ciertos grupos étnicos.
En España, la Dirección General de Farmacia y Productos Sanitarios, en resolución de 22-7-2001, indica que en el ámbito del Sistema Nacional de Salud su prescripción y uso se restringirá a determinados grupos de riesgo (tabla 5). En estas condiciones la vacuna es financiada por el Sistema Nacional de Salud, precisando para ello el visado de la inspección pertinente. La vacuna se encuentra ya, sin embargo, disponible en las farmacias para su administración a aquellos niños cuyos padres, siguiendo el consejo de su pediatra, deseen adquirirla.
Su inclusión en el calendario de vacunas sistemáticas de nuestro país dependerá de estudios epidemiológicos (impacto real de la enfermedad neumocócica en la población infantil española) y de coste-eficacia actualmente en marcha y del precio de la vacuna, que es actualmente su inconveniente más importante, ya que, por lo demás, se trata de una vacuna eficaz y segura.
Revacunación contra la tos ferina en adolescentes (vacuna dTpa)
En España la cobertura vacunal es del 94% (1997), pero aún se declaran 5.000-6.000 casos/año, seguramente menos de la incidencia real, evitables en parte mejorando la cobertura de la cuarta dosis a los 18 meses e incluyendo la vacuna antitos ferina a los 4-6 años, en forma de DTP acelular. Por otra parte, existe un declive de la inmunidad a partir de los 6-10 años de la última dosis, por lo que muchos adultos, que son además los que mantienen la circulación del agente infeccioso en la comunidad, no están ya adecuadamente protegidos.
La vacunación de los niños mayores de 7 años, adolescentes y adultos no se recomendaba mientras se empleaba la vacuna de células enteras por los efectos secundarios que presentaba en estas edades, que no compensaban los riesgos de la tos ferina pasada la primera infancia. La tos ferina es una causa frecuente (10-25%) y difícilmente identificable clínicamente, salvo en los casos graves, de tos persistente en adolescentes y adultos. Desde la disponibilidad de la vacuna acelular se plantea la posibilidad de inmunizar a los jóvenes y adultos sanos para disminuir la incidencia de la enfermedad en estas edades y su transmisión a lactantes y niños. Ya está comercializada en España la nueva vacuna dTpa:
d: toxoide diftérico tipo adulto (como en la Td).
T: toxoide tetánico.
Da: vacuna antipertussis acelular con baja carga antigénica, para adultos.
No se dispone de estudios sobre su eficacia en la prevención de la enfermedad, magnitud y duración de la protección conferida, y seguridad de dosis de recuerdo repetidas, pero en los estudios efectuados hasta ahora ha demostrado ser inmunogénica y segura.
Es de esperar que sustituya a la Td en la vacunación de los adolescentes de 14-16 años y probablemente también, en el futuro, en la revacunación sistemática de los adultos cada 10 años, como se hace actualmente con la Td. En principio, las prioridades y los grupos en que resulta más coste-efectiva son:
Adolescentes sanos.
Adultos que cuidan niños.
Trabajadores sanitarios.
Control de epidemias.
Por el momento se acepta sólo como dosis de recuerdo en individuos mayores de 12 años previamente inmunizados contra el tétanos, difteria y tos ferina, y no se recomiendan ulteriores dosis hasta que se disponga de más estudios de eficacia-seguridad.
Vacuna antigripal en niños
Los niños constituyen el reservorio de esta infección. En ellos tienen lugar las máximas tasas de ataque anual de la gripe, por lo que la infección gripal conlleva una importante morbilidad pediátrica. En lactantes, sobre todo menores de 6 meses, es causa frecuente de hospitalización. Los niños en edad escolar tienen gran importancia en la diseminación de la gripe en la comunidad. Las altas tasas anuales de infección y enfermedad comportan repercusiones sociales, económicas y sanitarias considerables.
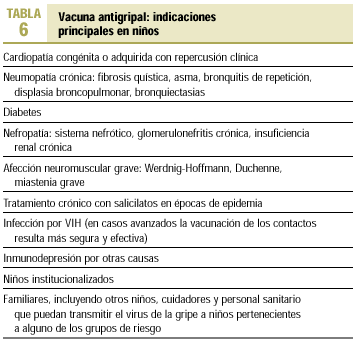
Las vacunas empleadas actualmente son vacunas inactivadas. Se encuentran indicadas en individuos con riesgo aumentado de complicaciones y personas que pueden transmitir la infección a los individuos de riesgo. Se administran anualmente, a partir de los 6 meses de edad, a los niños de los grupos de riesgo (tabla 6) y sus familiares. Los menores de 9 años necesitan 2 dosis separadas un mes si es una primovacunación.
Las últimas recomendaciones (2002) para la prevención y control de la gripe del ACIP (EE.UU.), además de recordar la necesidad de vacunar a los niños mayores de 6 meses incluidos en los grupos de riesgo, incluyen ya la de vacunar a los niños sanos de 6 a 23 meses, si es factible, y a los contactos domiciliarios de todos los niños menores de 2 años. Se espera que las recomendaciones definitivas acerca de su uso sistemático en niños menores de 2 años se puedan efectuar entre 2003 y 2005, una vez resueltos algunos problemas: informar y sensibilizar previamente a los padres y proveedores de servicios de salud acerca del impacto de la gripe y los potenciales beneficios y riesgos de la vacunación de los lactantes y niños pequeños, y diseñar la mejor estrategia para la vacunación anual de estos niños, teniendo en cuenta además que parte de ellos deberán recibir dos dosis en la misma estación gripal.
Pronto se dispondrá de vacunas de virus atenuados adaptadas al frío para administrar por vía nasal. Son virus vivos capaces de replicarse a las temperaturas habituales en las vías respiratorias altas, pero no a la temperatura corporal de 36-37 ºC, por lo que pueden originar síntomas mínimos locales y generar una respuesta inmunitaria protectora pero no causar la enfermedad gripal. Permitirá aumentar la cobertura vacunal en niños en los que estando indicada la vacunación antigripal no la reciben y obligará a plantearse la conveniencia de vacunar de forma sistemática a los niños pequeños, en especial a los de 6-36 meses que asisten a guardería, pudiendo así protegerles a ellos, limitar la extensión de las epidemias y reducir la transmisión del virus a los convivientes, ancianos y sujetos de los grupos de riesgo. Los resultados de estudios de coste-efectividad apoyan su uso sistemático.
Vacunas combinadas
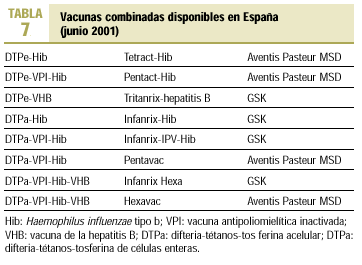
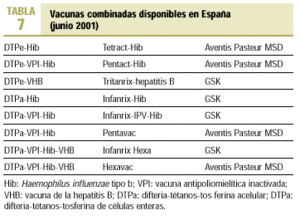
Tras la introducción en los calendarios vacunales de la vacuna anti-Hib y antihepatitis B y del cambio de la vacuna antipoliomielítica oral a la inyectable se ha hecho necesario desarrollar vacunas combinadas que permitan incorporar nuevas vacunas mono o polivalentes al calendario vacunal, minimizar el número de inyecciones y facilitar la armonización de los distintos calendarios. Las vacunas combinadas actuales se basan en distintas combinaciones de la vacuna DTP (acelular casi siempre) y otros antígenos: Hib, hepatitis B, polio inactivada (tabla 7).
Vacunas tetravalentes
DTPe + VHB (Tritanrix-hepatitis B).
DTPa + Hib (Infanrix-Hib). Es la base de las ulteriores vacunas penta y hexavalentes.
Vacunas pentavalentes
DTPa + VPI + Hib (Pentavac e Infanrix-IPV-Hib). Es una firme candidata a formar parte del calendario de vacunaciones sistemáticas.
Vacunas hexavalentes
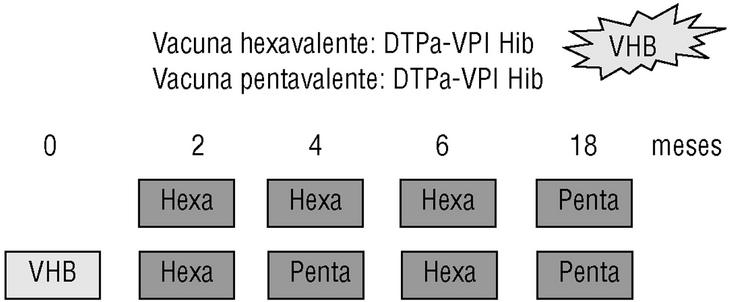
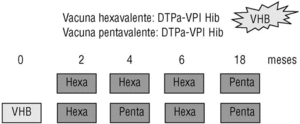
DTPa + VPI + Hib + VHB (Hexavac e Infanrix Hexa). Comercializadas en España en el 2001. Permitirán la aplicación de las recomendaciones actuales de la AEP, ya que posibilitan el empleo de vacuna de tos ferina acelular en todas las dosis de DTP, el uso de vacuna inactivada en todas las dosis de vacuna poliomielítica, la armonización de los calendarios vacunales existentes en distintas CCAA y las distintas pautas de vacunación contra la hepatitis B en recién nacidos y lactantes actualmente empleadas (fig. 1):
Figura 1. Pautas de vacunación antihepatitis B y vacunas penta y hexavalente.
Pauta 2-4-6 meses. Las 3 dosis que constituyen la primovacunación contra las 6 enfermedades pueden administrarse como vacuna hexavalente. A los 18 meses se utilizaría la pentavalente, sin antihepatitis B.
Pauta 0-2-6 meses. Se administra una dosis de vacuna antihepatitis B al nacimiento (junto a inmunoglobulina específica si está indicado) y posteriormente la vacuna hexavalente a los 2 y 6 meses y la pentavalente a los 4 meses. En ambos casos, a los 18 meses se utilizaría la pentavalente.
Correspondencia: Joan Pericas Bosch. CAP La Mina. Pediatría. C/ Mar, s/n. 08930 Sant Adrià de Besós (Barcelona). España. Correo electrónico: jopericasb@eresmas.net
Manuscrito recibido el 22 de julio de 2002.
Manuscrito aceptado para su publicación el 22 de julio de 2002.
Bibliografía general
American Academy of Pediatrics. Committee on Infectious Diseases. Policy Statement: Recommendations for the prevention of pneumococcal infections including the use of pneumococcal conjugated vaccine (Prevnar), pneumococcal polysaccharide vaccine and antibiotic prophylaxis (RE9960). Pediatrics 2000; 106:362-6.
American Academy of Pediatrics. Committee on Infectious Diseases. Prevention of poliomyelitis: recommendations for use of only inactivated poliovirus vaccine for routine immunization. Pediatrics 1999;104:1404-6.
American Academy of Pediatrics. Committee on Infectious Diseases. Recommended Childhood Immunization Schedule-United States, 2002. Pediatrics 2002;109:162.
American Academy of Pediatrics. Committee on Infectious Diseases. Varicella vaccine update. Pediatrics 2000;105:136-41.
Belshe RB, Mendelman PM, Treanor J, Kings, Gruber WL, Piedra P, et al. The efficacy of live attenuated, cold adapted, trivalent, intranasal influenza virus vaccine in children. N Engl J Med 1998;338:1405-12.
Black S, Shinefield H, Fireman B, Lewis E, Ray P, Hansen JR, et al. Eficacia, seguridad e inmunogenicidad de la vacuna conjugada antineumocócica heptavalente en niños. Pediatr Infect Dis J 2000;19:187-95.
Black S, Shinefield HR, Hansen J, Elvin L, Laufer L, Malinoski F. Postlicensure evaluation of the effectiveness of seven valent pneumococcal conjugate vaccine. Pediatr Infect Dis 2001;20:1105-7.
Campins M, Cheng HK, Forsyth K, Guiso N, Halperi S, Huang LM, et al. Recommendations are needed for adolescent and adult pertussis immunisation: rationale and strategies for consideration. Vaccine 2001;20:641-6.
Campins M, Moraga FA. La tos ferina en el adolescente y el adulto. Epidemiología e implicaciones para la vacunación. Med Clin (Barc) 2000;114:661-4.
CDC. General recommendations on immunization: recommendation of the Advisory Committee on Immunization Practices (ACIP) and the American Academy of Family Physicians (AAFP). MMWR 2002;51(RR-2):1-36.
CDC. Poliomyelitis Prevention in the United States. Updated recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2000;49(RR-05):1-22.
CDC. Preventing pneumococcal disease among infants and young children. Recommendations of the Advissory Committee on Immunization Practices (ACIP). MMWR 2000;49(RR-09):1-38.
CDC. Prevention of Varicella. Updated Recomendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 1999;48(RR-06):1-5.
Chartrand SA. Varicella Vaccine. Ped Clin North America 2000;373-94.
Comité Asesor de Vacunas de la Asociación Española de Pediatría. Manual de Vacunas en Pediatría. Edición 2001. Madrid, 2001.
Comité Asesor de Vacunas de la Asociación Española de Pediatría. Calendario Vacunal de la Asociación Española de Pediatría 2001-2002. An Esp Pediatr 2001;55:30-8.
Comité Asesor de Vacunas de la Asociación Española de Pediatría. La enfermedad neumocócica y su prevención. Vacuna neumocócica conjugada heptavalente. An Esp Pediatr 2002;56:79-90.
Díez J, Ridao M, Latour J, Ballester A, Morant A. A cost benefit analysis of routine varicella vaccination in Spain. Vaccine 1999; 17:1306-11.
Dirección General de Salud Pública. Consejería de Sanidad de la Comunidad de Madrid. Prevención de la enfermedad neumocócica. Disponible en: www.comadrid.es/sanidad/salud/preven/pdf/neumococo.PDF
García-Corbeira P, Dal-Ré R, Aguilar L, García de Lomas J. Seroepidemiology of Bordetella pertussis infections in the spanish population: a cross-sectional study. Vaccine 2000;18: 2173-6.
Giebink G. The prevention of pneumococcal disease in children. N Engl J Med 2001;16:1177-83.
Halperin S. Should all adolescents and adults be vaccinated against pertussis? Infect Med 2001;18:473-5.
Hernández A, Ruiz J, Arístegui J. Erradicación de la poliomielitis: papel de las vacunas en los próximos años en España. Acta Pediatr Esp 2002;60:2-13.
Lee CH, Lee L, Koizumi K. Polysaccharide vaccines for prevention of encapsulated bacterial infections: Part 1. Infect Med 2002; 19:127-33.
Lee CH, Lee L, Koizumi K. Polysaccharide vaccines for prevention of encapsulated bacterial infections: Part 2. Infect Med 2002;19:179-82.
Merino M. Calendarios de vacunación españoles. Web de la Asociación Española de Pediatría de Atención Primaria. Disponible en: www.aepap. org/calvaces.htm
National Advisory Committee on Immunization. Statement on adult/adolescent formulation of combined acellular pertussis, tetanus, and diphtheria vaccine. Canada Communicable Disease Report (CCDR) 2000;26(ACS-1):1-8.
National Advisory Committee on Immunization. Statement on recommended use of pneumococcal conjugate vaccine. Canada Communicable Disease Report (CCDR) 2002;28(ACS 2):
1-32.
Pericas J. Vacunas en la infancia y adolescencia: Web de la Asociación Española de Pediatría de Atención Primaria: Disponible en: www.aepap. org/previnfad/Vacunas.htm
Pericas J. Vacunas en la infancia y adolescencia: vacunas no sistemáticas. Web de la Asociación Española de Pediatría de Atención Primaria: Disponible en: www.aepap.org/previnfad/Vacunas2. htm
Plotkin SA. Developed countries should use inactivated polio vaccine for the prevention of poliomyelitis. Rev Med Virol 1997; 7:75-81.
Plotkin SA. Vaccines in the 21st century. Infect Dis Clin North Am 2001;15:307-27.
Plotkin SA, Orenstein WA. Vaccines. 3rd ed. Philadelphia: Saunders Company, 1999.
Poland GA, Murray D, Bonilla R. New vaccine development. BMJ 2002;324:1315-9.
Prevention health care, 2001 update: use of varicella vaccine in healthy populations. CMAJ 2001;94:1888-9.
Recommendations of the Advisory Committee on Immunization Practices (ACIP). Prevention and Control of Influenza. MMWR 2002;51(RR-3):1-36.
Rennels M. Combination vaccines. Pediatric Infect Dis J 2002;21-255-7.
Salleras L. Vacunaciones Preventivas: Principios y Aplicaciones. Barcelona: Masson, 1998.
Salleras L, Arístegui J. Vacunación frente a la varicela: ¿Selectiva o universal? Vac Invest Pract 2001;2(Supl 1):1-4.
Salleras L, Domínguez A, Vidal J, Plans P, Saleras M, Taberner JL. Seroepidemiology of varicella zoster virus infection in Catalonia (Spain). Rationale for universal vaccination programmes. Vaccine 2000;19:183-8.
Shinefield HR, Black S. Efficacy of pneumococcal conjugate vaccines in large scale field trials. Pediatr Infect Dis J 2000;19:394-7.
Skull SA, Wang EL. Varicella vaccination a critical review of the evidence. Arch Dis Child 2001;85:83-90.
Stratton KR, Durch JS, Lawrence RS. Vaccines for the 21st Century: A tool for decissionmaking. Institute of Medicine (IOM) 2001. Disponible en: www.nap.edu/catalog/5501.html
Vaqué J. Vacunas para el siglo xxi. Perspectivas y prioridades. En: Campins M, Moraga F, editores. Vacunas 2001. Barcelona: Prous Science, 2001; p. 271-83.