El melanoma es un tumor maligno derivado de los melanocitos, células dendríticas originadas en la cresta neural y causales de la síntesis de melanina. Puede diseminarse tanto por vía linfática como por vía sanguínea y suele asentar sobre piel normal. Cuando aparece sobre un nevo, los criterios mayores que nos deben hacer sospechar el diagnóstico de melanoma son el cambio de tamaño, la forma irregular de la lesión y la pigmentación desigual (tabla 1).
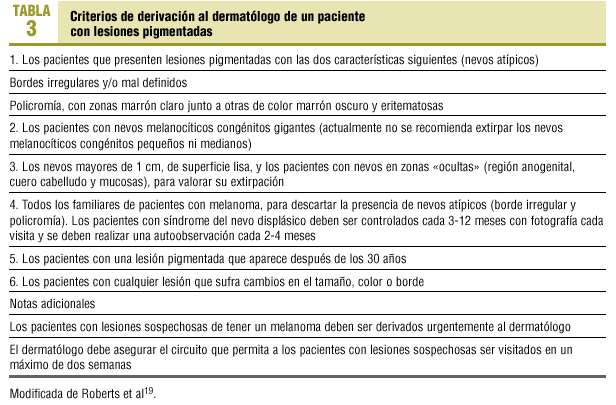
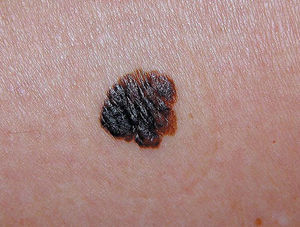
Figura 1. Melanoma cutáneo. Fase de crecimiento horizontal.
Hoy día, una gran parte de la población conoce que cuando un «lunar» sufre algún cambio se debe acudir al médico. Esto ha hecho que las consultas por nevos signifiquen actualmente alrededor de un 10% del total de las cerca de 30 consultas que un dermatólogo realiza en nuestros hospitales a diario.
En esta revisión presentamos algunos datos estadísticos sobre la incidencia del melanoma e intentaremos responder a algunos de los interrogantes sobre éste: papel de la radiación solar, medidas de fotoprotección, qué hacer ante un paciente con nevos displásicos, márgenes quirúrgicos, biopsia del ganglio centinela, tratamientos coadyuvantes, manejo del melanoma metastásico y seguimiento. Finalmente, daremos nuestra opinión sobre cuál debe ser el papel del médico de atención primaria ante este tumor.
Definición del problema
Desde principios de los años sesenta se ha detectado un incremento sostenido de la incidencia del melanoma, entre un 3 y un 7% anual en muchos países occidentales1, y es el tumor que ha sufrido un mayor incremento en el pasado decenio, junto con el cáncer de mama y el de pulmón en la mujer. Se calcula que durante el año 2000 se produjeron en el mundo desarrollado unos 100.000 casos nuevos, un 7-8% de todos los cánceres2, aunque la cifra varía de un país a otro. Las mayores tasas se encuentran entre los pacientes de raza blanca de Australia y Nueva Zelanda, donde ha alcanzado proporciones epidémicas, ya que es el cuarto tumor en frecuencia en el varón (50 casos por 100.000 habitantes/año) y el tercero en la mujer (37/100.000 habitantes/año). Se calcula que la incidencia en Estados Unidos oscila entre 7 y 22/100.000 al año según los estados.
En algunos países, la incidencia y la tasa de mortalidad empiezan a disminuir o se han estabilizado3, probablemente gracias a las campañas sanitarias de prevención del cáncer cutáneo, como la de Australia, que ha conseguido concienciar a la población para que reduzca la exposición solar, use ropas menos escotadas y se aplique fotoprotectores. En Nueva Zelanda se ha reducido la tasa de melanomas en un 20%4, mientras que en Canadá y en Escocia se ha alcanzado una meseta. En Estados Unidos sigue aumentando, aunque a un ritmo más lento, ya que en los años setenta crecía un 6,1% anual y actualmente lo hace un 2,5%; asimismo, ha mejorado la supervivencia a los 5 años, desde el 80% durante el período 1974-1976 al 89% en 1992-19971. Esto probablemente refleje un aumento del diagnóstico precoz.
En Europa, el hecho de que los habitantes del norte tengan una mayor tasa de melanomas que los que viven en el sur puede explicarse por el papel fotoprotector de la melanina. En nuestro país, algunos cálculos teóricos sitúan la tasa entre 7 y 8 casos por 100.000 habitantes, según las áreas geográficas, lo que coloca al melanoma en el octavo lugar entre los cánceres más frecuentes. Estos datos no se corresponden con los del Registro Nacional del Melanoma, que se actualiza periódicamente. Durante el año 2001 se declararon un total de 962 melanomas en España (2,43 casos por 100.000 habitantes), pero varias comunidades autónomas no hicieron declaración o ésta fue insuficiente. Las cifras de Cataluña y Valencia, las 2 comunidades con un mejor registro, fueron 271 (4,36/100.000 habitantes) y 232 casos (5,74/100.000 habitantes), respectivamente, mientras que la Comunidad de Madrid sólo había declarado 58 casos. Dicho registro se puede consultar en la web de la Academia Española de Dermatología (www.aedv.es/melanoma03.htm).
Aunque la frecuencia del melanoma no es tan alta como la del cáncer de pulmón, de mama y de colon, una ventaja fundamental es que una simple inspección visual, barata, sencilla e indolora, realizada por una persona experimentada, es capaz de facilitar un diagnóstico precoz y mejorar el pronóstico. Los equipos de atención primaria tienen la responsabilidad de aumentar el conocimiento público del melanoma. Además, gracias a las campañas de información en los medios de comunicación se ha conseguido que lleguen a la consulta melanomas más superficiales y en estadios más precoces.
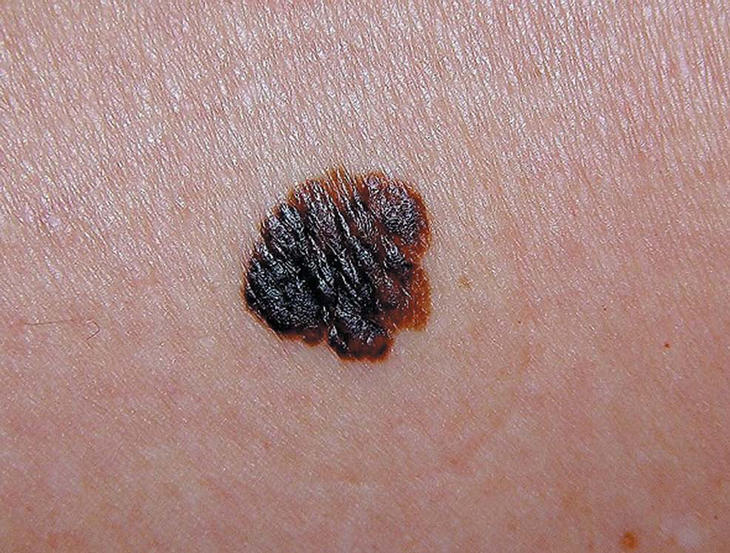
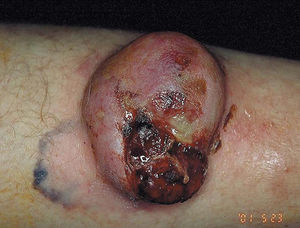
Figura 2. Melanoma cutáneo. Fase de crecimiento nodular.
¿La radiación solar es la causa del melanoma?
A pesar de que no está completamente demostrado, existen múltiples evidencias sobre el papel fundamental de la radiación ultravioleta (UV) en el desarrollo de al menos dos tercios del total de melanomas5. Se ha comprobado que existe una relación estadísticamente significativa entre melanoma y exposición solar intermitente (odds ratio [OR] = 1,71), sobre todo si se acompaña de quemadura solar (OR = 1,91), y que la incidencia y la mortalidad por melanoma son mayores en áreas cercanas al ecuador, donde la intensidad de la radiación UV es mayor6. El riesgo de desarrollar melanoma es superior en pacientes de piel blanca, de origen nórdico o celta7, y es menor entre los indígenas de Asia, África y Sudamérica y en los pacientes morenos de la región mediterránea1. El peligro es mayor cuando la radiación UV interacciona con un fenotipo determinado genéticamente, que se caracteriza por tener la piel clara, quemarse fácilmente (fototipos I y II) y ser portador de múltiples nevos, en especial si son atípicos.
¿Son útiles los fotoprotectores en la prevención del melanoma?
La principal función de los fotoprotectores debería ser evitar el paso de la radiación UV nociva, aunque hoy día se emplean mayoritariamente para facilitar los baños de sol («ponerse moreno sin quemarse») y para alargar las horas de ocio en actividades deportivas al aire libre. Su empleo ha crecido de forma exponencial en los últimos 10 años en todo el mundo. Los más efectivos son los físicos, a base de óxido de cinc, talco y/o dióxido de titanio, que bloquean y reflejan dicha radiación8. Recientemente se ha demostrado su efectividad en la prevención de los carcinomas cutáneos y las lesiones precancerosas9, pero todavía no existe suficiente evidencia sobre su papel protector en la prevención del melanoma. Incluso han sido cuestionados10 por los resultados obtenidos en diversos estudios de casos y controles, en los que se había comprobado que los pacientes afectados de melanoma eran los que habían utilizado más los fotoprotectores. Ahora bien, la mayoría se basa en encuestas en las que es difícil precisar la frecuencia de su uso. Además, como se acepta que el empleo de filtros solares es una conducta saludable, la mayoría dice que los usa más regularmente de lo que en realidad lo hace. Un análisis de multivarianza probablemente demostraría que los pacientes de piel clara con múltiples factores constitucionales de riesgo para el desarrollo de melanoma utilizan con mayor frecuencia los fotoprotectores, lo que no significa que el fotoprotector sea la causa del melanoma. Un hecho que parece incuestionable es que en países donde se han realizado campañas públicas de salud que recomiendan evitar el sol y usar regularmente fotoprotectores, como en Australia11, la incidencia de melanoma y la mortalidad derivada están empezando a descender.
Con los datos de que disponemos podemos afirmar que con las conductas de fotoprotección recomendadas por la Academia Española de Dermatología (tabla 2) probablemente se consiga reducir la tasa de melanomas. Gallagher et al12 han demostrado que el uso regular de fotoprotectores en niños puede actuar como agente quimiopreventivo, ya que desarrollan un menor número de nevos. Ahora bien, las campañas deberían incidir mucho más en la necesidad de reducir la exposición a la radiación ultravioleta más que al uso de fotoprotectores13, ya que éstos proporcionan una falsa sensación de seguridad y permiten que nos expongamos durante más horas a la radiación UV al evitar la quemadura solar.
¿Qué se debe hacer con un paciente con nevos displásicos?
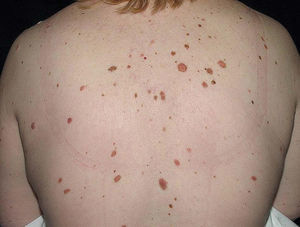
Cuando un nevo con una parte macular tiene el borde irregular o mal definido, una pigmentación desigual con varios tonos de marrón y con zonas eritematosas, una cierta asimetría y un tamaño mayor de 5 mm, se denomina displásico o atípico14. Las diferencias con el melanoma son sutiles, pero en éste, estas características son más acentuadas y, además, es una lesión cambiante en pocos meses. Podemos comparar ambos tipos de lesiones en el atlas de nuestra página web (www.dermatoweb.com). Al inicio se dijo que los nevos atípicos eran lesiones precursoras de melanoma y se llegó a recomendar su extirpación profiláctica. Dado que su grado de malignización es bajo, hoy día son consideradas marcadores de alto riesgo de melanoma. Cohen et al15 extirparon profilácticamente 1.630 nevos en 78 pacientes con melanoma en estadio I o II y descubrieron 12 melanomas no sospechados. Por tanto, se extirparon innecesariamente 136 nevos por melanoma. Kelly et al16, en un estudio prospectivo sobre 278 adultos con cinco o más nevos atípicos, detectaron un total de 20 melanomas en 16 de ellos. Si hubiesen realizado extirpación profiláctica de todos los nevos atípicos de sus pacientes (cerca de 6.000) se hubiesen evitado sólo 3 melanomas. Se dedujo que es preferible el seguimiento, ya que la extirpación profiláctica no reduce el riesgo lo suficiente para justificar el coste y la morbilidad del procedimiento.
Hablamos de síndrome del nevo displásico con melanoma familiar17 en las familias en las que se ha presentado un melanoma en uno o más familiares de primer o segundo grado y en las que varios de sus miembros son portadores de más de 50 nevos, algunos con características atípicas desde el punto de vista clínico e histopatológico.
El manejo de los pacientes con nevos displásicos requiere un seguimiento regular; se debe fotografiar toda la superficie corporal por sectores y biopsiar las lesiones sospechosas, con el fin de detectar melanoma precozmente. Además, se les debe enseñar los signos de alarma de una lesión pigmentada y recomendar de manera especial las medidas de fotoprotección. Los casos esporádicos se revisan una vez al año, pero en los pacientes con síndrome del nevo displásico con melanoma familiar, que desarrollarán melanoma con mucha probabilidad17, el seguimiento debe realizarse de por vida. En algunas circunstancias es preferible extirpar los nevos atípicos, como en el caso de que el paciente no acuda a los controles ni se haga los autoexámenes, o si el número de nevos displásicos es escaso o se localiza en áreas de difícil control (periné, cuero cabelludo, planta de los pies).
En lo que sí coincide la mayoría de los expertos es en que estos nevos no deben electrocoagularse ni ser tratados mediante láser, ya que en este caso no se podría realizar estudio anatomopatológico, ni debe realizarse su extirpación por afeitado porque quedan melanocitos en la dermis inferior que podrían malignizar.
¿Qué hay que hacer con un paciente cuando sospechamos que tiene un melanoma?
Si el índice de sospecha es elevado se recomienda la extirpación de la lesión con un margen lateral de 3-5 mm y en profundidad hasta la grasa subcutánea, con el fin de que la pieza pueda ser examinada en su totalidad y medida por un patólogo experto. Si la sospecha no es muy alta o la lesión es muy grande, podemos realizar una biopsia incisional, que no modifica la supervivencia18. Con ello se consigue la confirmación diagnóstica y se puede programar el tratamiento definitivo según el grosor de Breslow. Como hemos mencionado, una lesión sospechosa nunca debe ser electrocoagulada ni tratada con láser, ni tampoco extirpada mediante afeitado.
En la historia clínica debe quedar reflejada la localización de la lesión, su tamaño, si ha aumentado o cambiado de color o de forma en los últimos meses y si produce prurito o sangrado. Asimismo, se deben describir su forma, las características del borde y la existencia o no de ulceración y/o policromía.
Además, debe examinarse toda la piel del paciente para evaluar todas las lesiones pigmentadas y se debe anotar el tamaño, la localización y las características clínicas de las que muestren atipia. Como ya hemos mencionado, para el seguimiento son muy útiles las fotografías seriadas de toda la superficie de la piel, por áreas. También se debe realizar un examen físico meticuloso para descartar la presencia de adenomegalias y hepatomegalia.
¿Cuándo se debe derivar el paciente al dermatólogo?
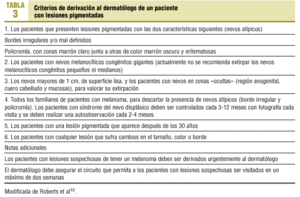
Creemos que debe remitirse al dermatólogo a los pacientes que sean portadores de una lesión sospechosa de ser melanoma y los que tengan un riesgo aumentado de desarrollarlo (tabla 3)19. Entre los pacientes de riesgo se incluye a los que tienen antecedentes personales o familiares de melanoma, los portadores de un número elevado de nevos, en especial si son atípicos, y los portadores de un nevo melanocítico congénito gigante (mayor de 20 cm)20. Este grupo de pacientes de alto riesgo debe ser advertido sobre las características de riesgo de un nevo, los cambios sugestivos de melanoma, las medidas preventivas y cómo realizar una autorrevisión de la piel cada 3-4 meses. El médico de atención primaria puede efectuar las primeras recomendaciones al respecto.
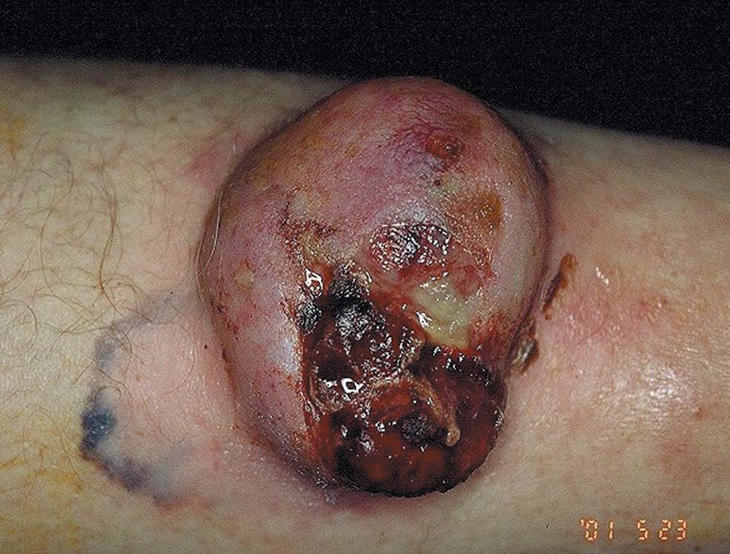
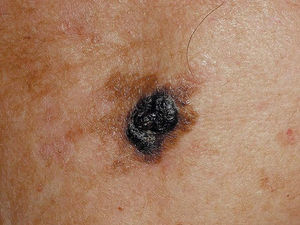
Figura 3. Melanoma sobre lentigo maligno.
Estadificación y pronóstico del melanoma
El pronóstico del melanoma depende principalmente de la existencia o no de metástasis ganglionares o a distancia en el momento del diagnóstico y, en caso de enfermedad confinada a la piel, de la profundidad que ha alcanzado21. La microestadificación requiere una evaluación cuidadosa de toda la pieza por un patólogo experimentado. Se mide su profundidad en mm con un micrómetro ocular (clasificación de Breslow). El grosor de Breslow mide indirectamente la masa tumoral y predice con bastante precisión la conducta posterior del melanoma.
En el año 2001, la American Joint Commission on Cancer (AJCC) propuso un nuevo sistema de estadificación22 (tablas 4 y 5). Se debe realizar tras la escisión completa y el análisis histológico del melanoma primario, con la valoración clínica de metástasis regionales y a distancia.
En esta clasificación, los pacientes con melanoma localizado se incluyen en los estadios I o II, según su grosor y la presencia o no de ulceración histológica; los que tienen metástasis en los ganglios regionales, en tránsito o satelitosis en la vecindad, en el estadio III, mientras que los que tienen metástasis a distancia son clasificados en estadio IV.
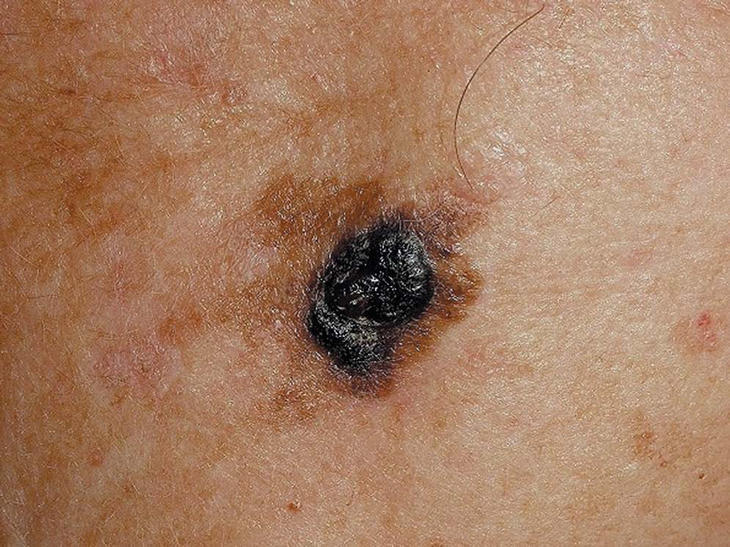
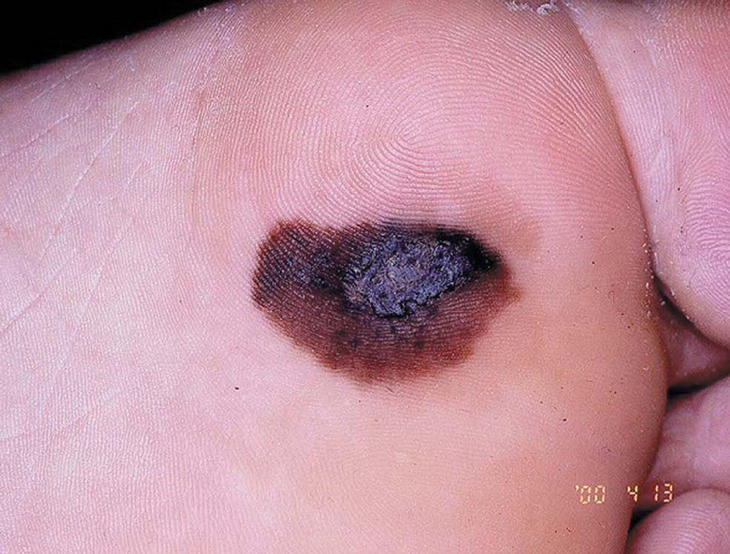
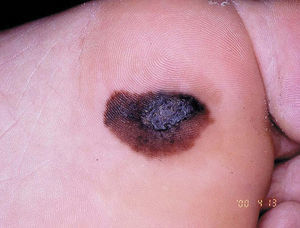
Figura 4. Melanoma lentiginoso acral.
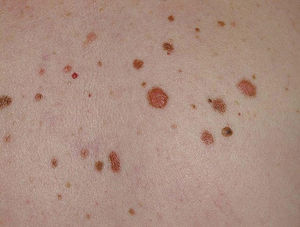
Figura 5. Nevo atípico.
Las lesiones finas, de menos de 1 mm, ulceradas o no, y las que miden entre 1 y 2 mm sin ulceración tienen un riesgo muy bajo de producir metástasis. Las lesiones ulceradas de 1-2 mm de grosor y las que miden entre 2 y 4 mm, sin ulceración histológica, tienen un riesgo moderado, mientras que son consideradas melanoma de alto riesgo todas las que miden entre 2 y 4 mm que están ulceradas y todas las que miden más de 4 mm. A partir del estadio III, la supervivencia del paciente disminuye aproximadamente en un 50% a los 5 años. Para completar la estadificación se recomienda biopsiar el ganglio centinela en los melanomas de más de 1 mm.
El 20% de los pacientes con melanoma I y II y el 60% de los pacientes con melanoma grupo III de la AJCC desarrollan metástasis a distancia. Éstas se producen en más del 80% de los casos durante los primeros 3 años de seguimiento. Los órganos más afectados son la piel, el tejido subcutáneo y los ganglios linfáticos regionales, con el 60%; le siguen en frecuencia el pulmón, que alberga el 20-40%; el hígado, entre un 15 y un 20%; el sistema nervioso central y los huesos, que se reparten un 12-20%, y el aparato gastrointestinal, que llega a un 5%.
La supervivencia a los 5 años en melanomas en estadio I es superior al 90% (mayor del 95% en estadio IA y alrededor del 90% en estadio IB); en estadio II, entre el 45 y el 80% (80% en estadio IIA, 65% en estadio IIB y 45% en estadio IIC), en el estadio III entre el 25 y el 70% (65-70% para el estadio IIIA, 45-53% para el estadio IIIB y 25-30% para el estadio IIIC) y del 6,7 al 18,8% en el estadio IV21,22.
Manejo del melanoma
Existe on line una excelente puesta al día en castellano sobre el tratamiento del melanoma en la dirección del National Cancer Institute (www.cancer.gov). Lo mismo podemos decir sobre la guía de manejo del melanoma de la Academia Americana de Dermatología23, del comité de expertos británico19 y de la reciente revisión de Eedy24.
Como se ha mencionado, la extirpación es el tratamiento estándar del melanoma primario localizado, con márgenes laterales de no más de 0,5 cm, para no alterar la morfología de los linfáticos aferentes y, con ello, la localización del ganglio centinela. Una vez recibido el informe anatomopatológico, la ampliación de márgenes de un melanoma invasivo depende del Breslow.
¿Con qué márgenes debe extirparse un melanoma?
La ampliación de márgenes se realiza el mismo día que la biopsia del ganglio centinela si el melanoma mide más de 1 mm de grosor.
Figura 6. Nevo atípico. Bordes irregulares y tamaño mayor de 5 mm, con tonalidades diferentes.
Lentigo maligno y melanoma in situ. El lentigo maligno habitualmente es una lesión grande que se localiza en la cara. Por ello, es preferible realizar primero una biopsia incisional para confirmar el diagnóstico y practicar posteriormente la extirpación completa. En los pacientes ancianos se pueden hacer tratamientos alternativos como crioterapia, radioterapia o simplemente observación25. En este y otros tipos de melanomas in situ es suficiente la extirpación-biopsia inicial, siempre que el margen histológico sea claro.
Melanoma de menos de 1 mm. Los márgenes recomendados se basan en un ensayo aleatorizado de la Organización Mundial de la Salud (OMS)26, en el que se comparaba el empleo de márgenes de seguridad de 1 y 3 cm en los melanomas de menos de 2 mm de profundidad. No se encontraron diferencias, de lo que se deduce que el margen de 1 cm es suficiente.
Melanoma >= 1 mm pero < 2 mm. Las recomendaciones se basan en dos amplios estudios aleatorizados. El de la OMS26 demostró que no existen diferencias significativas en cuanto a la supervivencia con 1 o 3 cm de margen, por lo que se dedujo que era preferible ampliar 2 cm. En el Intergroup Melanoma Trial27 se comparó la extirpación con márgenes de 2 y 4 cm, sin que se observaran diferencias en estos 2 grupos en cuanto a supervivencia o recidivas locales, por lo que se concluyó que no es necesario ampliar más de 2 cm.
Lesiones >= 2 mm pero < 4 mm. En tres estudios aleatorizados se ha demostrado que en melanomas de grosor intermedio (1-4 mm) no es necesario que los márgenes quirúrgicos sean mayores de 2 cm27-29. Con este margen, la mayoría de los pacientes puede ser operada de forma ambulatoria.
Lesiones de más de 4 mm. En este grupo no se han realizado estudios aleatorizados. La tasa de recidiva local es elevada y la diseminación metastásica es frecuente. Parece razonable un margen de 2-3 cm.
¿Es preciso realizar linfadenectomía si no se palpan adenomegalias?
En la actualidad, no se recomienda la práctica de linfadenectomía electiva y existe cada vez un mayor consenso sobre la realización de la biopsia del ganglio centinela en los pacientes con melanoma de más de 1 mm para su correcta estadificación30. Morton31, en 1990, demostró que las metástasis ganglionares del melanoma no se producen al azar, sino de una manera ordenada y secuencial, involucrando inicialmente al ganglio centinela. Por tanto, su histología debería reflejar la de los ganglios vecinos. Si se detectan micrometástasis, se practica un vaciamiento ganglionar completo. Hoy día se considera que el resultado del ganglio centinela es el factor de pronóstico más importante del melanoma localizado.
¿Qué hay que hacer si se palpan adenomegalias?
Si se duda de su carácter metastásico, se puede realizar una punción-aspiración con aguja fina (PAAF)32. Si la sospecha clínica es elevada, se realiza una biopsia a cielo abierto. Si el informe histológico es positivo, se recomienda efectuar una disección ganglionar radical por un cirujano con experiencia. Se han publicado varios casos de melanoma con metástasis en los ganglios regionales que se han curado mediante una extirpación amplia del tumor primario y de los ganglios afectados33,34.
¿Existe un tratamiento coadyuvante para el melanoma?
Todavía no existe un tratamiento coadyuvante efectivo19,35 aunque, a pesar de ser un tema muy controvertido, muchos expertos consideran que los pacientes con melanoma de alto riesgo (estadios IIB, IIC y III) son candidatos al tratamiento con interferón a altas dosis («pauta de Kirkwood»). Sin embargo, esta pauta no está exenta de efectos secundarios, en ocasiones importantes. Creemos que, de momento, este tratamiento debe ser considerado experimental y sólo debe emplearse por personal especializado y/o en estudios multicéntricos a doble ciego. En el protocolo sobre el manejo del melanoma elaborado por los miembros del comité de tumores, tanto del Hospital Universitario Arnau de Vilanova de Lleida como del Hospital Germans Trias i Pujol de Badalona, en los que participan, además de dermatólogos, oncólogos y radioterapeutas, se ha consensuado el uso de interferón alfa-2b a altas dosis en el tratamiento coadyuvante de los melanomas de alto riesgo.
¿Qué seguimiento y pruebas complementarias hay que realizar?
No existen recomendaciones estándar. En los pacientes con melanoma de bajo riesgo (estadios I y IIA), algunos expertos proponen realizar radiografía de tórax y analítica básica con LDH36, mientras otros consideran que no es preciso realizar pruebas complementarias, ya que la rentabilidad en la detección de metástasis es muy baja y el número de falsos positivos es alto, cerca de un 15%2. La mayoría coincide en la necesidad de incluir un escáner toracoabdominal periódico en caso de melanoma de riesgo intermedio o alto (estadios IIB, IIC y III).
En las visitas de seguimiento es muy importante la realización de una historia clínica detallada, por sistemas, con preguntas dirigidas hacia la detección de lesiones que ocupen espacio. Debemos de explorar meticulosamente las adenomegalias, en especial las del territorio de drenaje del melanoma, y las visceromegalias, y analizar con atención cualquier nevo que haya aparecido de nuevo. En caso de sintomatología focal se deben realizar las exploraciones pertinentes. Las revisiones deben efectuarse entre una y cuatro veces al año, según el grosor del tumor, durante un mínimo de 3 años. A los pacientes con melanoma en estadio I se les puede dar de alta a los 3 años, mientras que al resto se les realiza seguimiento durante 2 o 3 años más a intervalos de 6 meses37.
Debemos educar a los pacientes con melanoma en estadio IIB o superior en la autoexploración de la piel y los ganglios linfáticos, ya que en la mayoría de las ocasiones las metástasis son descubiertas por él mismo o sus familiares. Estos pacientes deben ser tratados en un centro especializado que posea un comité de tumores interdisciplinario que incluya dermatólogos, cirujanos, oncólogos, patólogos y especialistas en cuidados paliativos. A los pacientes con melanoma de alto riesgo se les debe ofrecer la entrada en un ensayo clínico, dentro de las primeras 8 semanas después de realizar la cirugía.
¿Qué hacer en caso de metástasis?
El melanoma metastásico es una enfermedad incurable, con una supervivencia media de 7-8 meses si se trata de metástasis únicas, y de unos 2 meses si se producen en tres o más localizaciones21,29. La tasa de supervivencia es menor del 10% a los 5 años y del 2% a los 15 años. Dado que es rebelde a la mayoría de los tratamientos, es recomendable que los casos nuevos sean valorados como candidatos a ensayos clínicos con nuevas formas de tratamiento.
Siempre que sea posible, debe intentarse la cirugía, en especial si se trata de metástasis solitarias. En algunos casos de metástasis viscerales confinadas a un solo lugar anatómico se han alcanzado supervivencias prolongadas mediante su extirpación completa38,39.
En caso de metástasis no resecables, el tratamiento estándar sigue siendo la monoquimioterapia con dacarbacina40, con la que se obtiene una tasa de respuesta objetiva del 10 al 20%, aunque ningún citostático aumenta la supervivencia global.
Finalmente, comentar que todos los pacientes con melanoma metastásico deben tener acceso a un equipo de cuidados paliativos experto en control sintomático y apoyo psicosocial.
¿Qué papel debe desempeñar el médico de atención primaria en el diagnóstico, manejo y seguimiento del melanoma?
Aunque algunos autores opinan que el médico de familia puede hacerse cargo, con el apoyo de un consultor, de un melanoma in situ41, nosotros creemos, tal como comentamos en un artículo previo42, que su papel está en la prevención, el diagnóstico precoz y el seguimiento de estos pacientes. Es importante la colaboración entre el médico de familia, epidemiólogos y dermatólogos, en las campañas sanitarias que informan sobre los riesgos de la exposición solar y promueven cambios de conducta hacia una fotoprotección eficaz (tabla 2), con el fin de reducir la incidencia del melanoma. Es fundamental que la prevención se inicie ya durante la infancia, porque hoy día es la época de mayor exposición solar en períodos de ocio. Los mensajes de las campañas deben reforzarse durante la entrevista clínica.
Para la detección precoz del melanoma cutáneo, con el fin de reducir su morbimortalidad, se debería incluir la exploración cutánea sistemática en la primera visita, tanto en niños como en adultos. Recomendamos derivar al dermatólogo a los niños con nevos melanocíticos congénitos, en especial si son gigantes, y a los pacientes con nevos atípicos, para una evaluación más precisa. Queremos insistir en que el diagnóstico precoz de melanoma puede salvar la vida del paciente y, por ello, es imprescindible recordar la regla nemotécnica del «ABCDE» de las lesiones pigmentadas (tabla 6), que debe ser comentada a los pacientes con múltiples nevos para su autoevaluación. Las poblaciones de mayor riesgo son los mayores de 50 años, en los que el examen cutáneo puede hacerse durante una visita sistemática, las personas de piel clara (fototipos I y II), los familiares de un paciente con melanoma, los pacientes con múltiples nevos, los pacientes con nevos displásicos y los que han estado expuestos al sol de forma excesiva43.
Si el médico de atención primaria observa a un paciente con una lesión sospechosa de ser un melanoma, debe derivar al paciente de forma urgente al dermatólogo y éste, a su vez, debe crear un circuito de atención rápida para estos pacientes con el fin de que la lesión sea extirpada lo antes posible, con una demora no superior a las 2 semanas. Si el diagnóstico se confirma y el paciente es portador de un melanoma de riesgo intermedio o alto, debe ser evaluado nuevamente por un comité de tumores cutáneos con el fin de realizar su estadificación y proponer el mejor tratamiento.
Durante el seguimiento, el médico de familia puede aportar apoyo psicológico, tanto al paciente como a sus familiares, y comentarles la información de forma cuidadosa, contrastando las opiniones y reforzando las acciones necesarias para su estadificación y seguimiento apropiados. También es importante la detección de la sintomatología sugestiva de metástasis, ya que, tratada precozmente, puede alargar la supervivencia de algunos enfermos.
Con el fin de diferenciar melanoma, nevos comunes y atípicos, existen en la red diversos atlas de imágenes. Los más consultados son el de la universidad de Erlingen (www.dermis.multimedica.de) y el de la Johns Hopkins University (www.dermatlas.med.jhmi.edu/derm) aunque también existe una amplia colección del imágenes en el atlas de nuestra página web (www.dermatoweb.net). Recomendamos la página «Tumores pigmentados» del apartado «Los 20 motivos de consulta más frecuentes en dermatología» y las páginas del atlas «Melanoma», «Nevus melanocíticos comunes», «Nevus atípicos», «Carcinoma basocelular pigmentado» y «Queratosis seborreicas», con el fin de apreciar sus particularidades.