Las enfermedades del sistema circulatorio son la primera causa de muerte para el conjunto de la población española. En el año 2016 causaron en España 119.778 muertes (55.307 en varones y 64.471 en mujeres), lo que supone el 29% de todas las defunciones (el 26% en varones y el 32% en mujeres), con una tasa bruta de mortalidad de 258 por 100.000 habitantes (243 en varones y 273 en mujeres)1. Los 2 principales componentes de las enfermedades del sistema circulatorio son la enfermedad isquémica del corazón y la enfermedad cerebrovascular, que en conjunto producen cerca del 50% de la mortalidad cardiovascular total. En España, la enfermedad isquémica del corazón es la que ocasiona un mayor número de muertes cardiovasculares (27%). Este porcentaje es mucho mayor en varones (35%) que en mujeres (20%). La preponderancia de la enfermedad isquémica del corazón se produjo por primera vez en el año 1996, y se debe al mayor descenso relativo del riesgo de muerte cerebrovascular respecto a la muerte por coronariopatía. Cabe destacar que en los varones empieza a predominar la enfermedad isquémica del corazón sobre la cerebrovascular casi 10 años antes, en 1987. En las mujeres, la diferencia de la enfermedad cerebrovascular sobre la coronariopatía se va acortando, aunque todavía predomina la primera. La segunda causa de muerte cardiovascular la constituye la enfermedad cerebrovascular, que representa cerca de la cuarta parte (23%) de la mortalidad cardiovascular global. Este porcentaje es mayor en las mujeres (24%) que en los varones (21%).
El riesgo de morir (tasas ajustadas por edad) por las enfermedades cardiovasculares está disminuyendo en España desde mediados de la década de 1970, sobre todo debido al descenso de la mortalidad cerebrovascular. Sin embargo, a causa del envejecimiento de la población, a pesar de que las tasas ajustadas de mortalidad por coronariopatía han disminuido en este período, el número de muertes ha aumentado, por lo que el impacto sanitario y social de estas enfermedades está aumentando.
En el ámbito internacional, las tasas de mortalidad ajustadas por edad de España para el conjunto de las enfermedades del sistema circulatorio, la enfermedad isquémica del corazón y para la enfermedad cerebrovascular son más bajas que en otros países occidentales2.
Morbilidad cardiovascularEn el año 2015, en España, la tasa de morbilidad hospitalaria de las enfermedades del sistema circulatorio fue de 1.354 por 100.000 habitantes (1.542 en los varones y 1.174 en las mujeres)1, y causó casi 5 millones de estancias hospitalarias. La tasa de morbilidad hospitalaria de la enfermedad isquémica del corazón fue de 259 por 100.000 habitantes (375 en los varones y 147 en las mujeres). Respecto a la enfermedad cerebrovascular, la tasa de morbilidad fue de 257 por 100.000 habitantes (280 en los varones y 236 en las mujeres). Por tanto, se observa que la morbilidad por enfermedad isquémica del corazón es superior a la cerebrovascular en los varones, mientras que en las mujeres ocurre al contrario, la morbilidad cerebrovascular es superior a la isquémica. La tendencia de las tasas de morbilidad hospitalaria de las enfermedades del sistema circulatorio ha sido de un constante aumento desde 1977 hasta 2003, con un ligero descenso en el período 2003-2012 y, a partir de ese año, nuevamente volvió a aumentar.
Factores de riesgo cardiovascularLa hipertensión arterial (HTA), la dislipemia y la diabetes son factores de riesgo mayores y causales de enfermedad cardiovascular y mortalidad vascular y total3.
La carga de estos factores de riesgo cardiovascular en la población española se describe en el Estudio de Nutrición y Riesgo Cardiovascular en España (ENRICA), que se realizó en el año 20104. Se trata de un estudio descriptivo, transversal, de base poblacional, representativo de la población general española mayor de 18 años, en el que se establece la prevalencia, el conocimiento, el tratamiento y el control de cada uno de los principales factores de riesgo cardiovascular.
Hipertensión arterialLa hipertensión, definida como unas cifras de presión arterial (PA) sistólica/diastólica obtenidas de forma protocolizada en la clínica ≥ 140/90 mmHg, o por estar tratado con medicamentos antihipertensivos, es un problema de salud pública importante por su alta prevalencia en muchos países, especialmente en las personas mayores. Además, la hipertensión está todavía insuficientemente controlada en la mayoría de poblaciones y ámbitos clínicos5,6. La prevalencia de la hipertensión en la población general adulta de España es del 33%5. Aproximadamente, el 40% de los hipertensos desconoce que lo es, el 20% de los diagnosticados no está tratado con medicamentos antihipertensivos y la mitad de los tratados no alcanza objetivos terapéuticos de control según las actuales guías de práctica clínica5,6. Por ello, solo 1 de cada 4 hiper- tensos en la población general está adecuadamente controlado, aunque ha mejorado en la última década7. Sin embargo, basada en monitorización ambulatoria de la PA, la prevalencia de hipertensión es apreciablemente inferior y el control mayor debido a la ausencia de la reacción de alerta o bata blanca8. Según datos del estudio DARIOS, realizado en 10 comunidades autónomas de España, se evidencia poca variación geográfica en la frecuencia de hipertensión en personas de 35 a 74 años9. Además, la prevalencia de enfermedad cardiovascular y de lesiones de órganos diana en el hipertenso es superior a la de la población general, y afecta a 1 de cada 4 pacientes10.
DislipemiaLa hipercolesterolemia, que se considera cuando las cifras de colesterol total > 200 mg/dl, o bien por tener un tratamiento farmacológico hipolipemiante, es el factor de riesgo más prevalente y afecta al 50% de la población adulta española411. Sin embargo, es el menos conocido (50%), el menos tratado (42%) y, aunque ha mejorado, el control sigue siendo moderado (< 50%)3,12. Un 26% de la población tiene un colesterol unido a lipoproteínas de alta densidad (cHDL) < 50 mg/dl9. La elevada prevalencia de la hipercolesterolemia persiste aun para cifras de colesterol total ≥ 250 mg/dl: el 43% de los varones y el 40% de las mujeres en población de entre 35 y 74 años11.
Diabetes mellitus tipo 2La prevalencia de diabetes en España en población general ≥ 18 años es de un 7-13%, según algunos estudios de base poblacional en España413, mayoritariamente conocida (79%), tratada con fármacos (85%) y controlada (69%)4. Un estudio poblacional en Cataluña14 muestra que solo un 13% de los pacientes diabéticos tipo 2 que estaban en prevención primaria tenía buen control de los principales factores de riesgo cardiovascular (hemoglobina glucosilada [HbAlc] ≤ 7%, PA ≤ 130/80 mmHg y colesterol unido a lipoproteínas de baja densidad [cLDL] < 130 mg/dl), y que un 12% de los que estaban en prevención secundaria tenía buen control (HbA1c ≤ 7%, PA ≤ 130/80 mmHg y cLDL < 100 mg/dl).
Estudios en atención primariaEl reciente estudio longitudinal IBERICAN, centrado en el riesgo cardiovascular en adultos atendidos en atención primaria en España, muestra que la prevalencia de los principales factores de riesgo cardiovascular es elevada y su control, escaso15. Así, el 50,3% de los sujetos tiene dislipidemia, el 47,4%, hipertensión, el 29,7%, sedentarismo, el 28,2%, obesidad abdominal, el 19%, diabetes y el 18% fuma. El grado de control de dislipidemia, hipertensión y diabetes fue del 25,8, 58,5 y 75,9%, respectivamente. El 15,6% tiene antecedentes de enfermedad cardiovascular, el 7,8%, de cardiopatía isquémica, el 4,6%, de ictus, el 9,6%, de microalbuminuria, el 5,5%, de fibrilación auricular (FA) y el 2,9%, de insuficiencia cardíaca.
Efecto agregado de factores de riesgoLa prevalencia de síndrome metabólico en adultos en España, según el estudio DARIOS, es del 31%, algo mayor en varones que en mujeres (el 32 y el 29%, respectivamente) y está asociado a mayor riesgo coronario16. Finalmente, basado en los principales factores de riesgo cardiovascular, el riesgo cardiovascular en España es moderado en el 56% de los varones y bajo en el 55% de las mujeres17. Sin embargo, el grado de control de estos factores en sujetos de alto riesgo es escaso.
Tablas de riesgo cardiovascularImportancia epidemiológica y clínicaLas guías clínicas sobre prevención de las enfermedades cardiovasculares utilizan mayoritariamente las tablas de riesgo cardiovascular para estratificar a los pacientes en función de su riesgo, establecer los criterios de tratamiento farmacológico o marcar los objetivos de control. Esto ocurre en el control y tratamiento de la HTA, pero, sobre todo, en la dislipemia; las tablas de riesgo también se han utilizado para indicar el tratamiento antiagregante en prevención primaria. De esta forma, se han convertido en una herramienta asistencial básica que ha condicionado la utilización de calculadoras en la historia clínica informatizada y, en muchos casos, se convierten en el elemento distintivo de las diferentes guías clínicas con carácter internacional18,19, nacional20 o autonómico21,22.
Cohortes de las tablas de riesgo y guías clínicasLa población que no ha padecido una enfermedad cardiovascular es en la que se tiene más interés en aplicar las tablas de riesgo, puesto que, en caso contrario, ya tendrían un riesgo elevado. Por otro lado, la diabetes se considera como un criterio de riesgo cardiovascular alto19 o como una variable más para calcular el riesgo23.
La elaboración de una tabla de riesgo requiere una cohorte de personas libres de enfermedad cardiovascular, un registro basal de los factores de riesgo (serían las variables independientes), un seguimiento durante un largo período (años) y, finalmente, registrar los sucesos que vayan presentándose (serían las variables dependientes), correspondiendo a la enfermedad o muerte de origen cardiovascular.
A partir del seguimiento de las cohortes, se construyen las ecuaciones de riesgo mediante modelos estadísticos, generalmente el modelo de Cox o el de Weibull, que predicen la probabilidad de aparición de un suceso y cuya expresión gráfica son las tablas de riesgo cardiovascular. En algunos casos, las ecuaciones de riesgo se someten a un proceso de recalibración para adaptarlas al riesgo cardiovascular de cada país.
En una revisión sistemática reciente24 se identificaron 9.965 referencias, de las que se incluyeron 212 artículos que describían el desarrollo de 363 modelos de predicción. La mayoría de los modelos se desarrolló en Europa (n = 167; 46%), y predecía el riesgo de enfermedad coronaria fatal o no fatal (n = 118; 33%) durante un período de 10 años. Los predictores más frecuentes fueron el tabaco (n = 325; 90%) y la edad (n = 321; 88%), y la mayoría de los modelos eran específicos por sexo (n = 250; 69%). Solo 132 de los modelos desarrollados se validaron externamente, y solo 70 (19%) por investigadores independientes. Las medidas de discriminación y calibración se describieron solo en un 65 y un 58% de las validaciones externas. Los autores concluyen que hay un exceso de modelos predictivos y que la utilidad de la mayoría es incierta debido a las limitaciones metodológicas. Recomiendan no desarrollar nuevos modelos, y más bien se debe profundizar en las validaciones externas, hacer comparaciones una a una de los modelos existentes e investigar si la adición de nuevos marcadores puede mejorar la capacidad predictiva.
En España se ha publicado el estudio Función de Riesgo Española de Acontecimientos Coronarios y Otros (FRESCO), que agrupó datos de 11 cohortes españolas, de las cuales una se utilizó como cohorte de derivación, con 14.090 varones y 16.180 mujeres, y otra, como cohorte de validación, con 9.199 varones y 10.939 mujeres25.
Actualmente, las más importantes desde el punto de vista práctico por estar incorporadas a las guías clínicas son las ecuaciones derivadas de las cohortes del estudio de Framingham, sobre todo la publicada en el año 199126, la ecuación del proyecto SCORE (Systematic Coronary Risk Estimation)27, que recientemente ha añadido una tabla para mayores de 65 años28 pendiente de validarse, o la del Pooled Cohort23. La ecuación de Framingham de 1991 se utilizó por las guías de las sociedades europeas desde el año 1994 hasta 2012 y por el PAPPS desde 1997 hasta 2003, y posteriormente se incluyó la tabla del SCORE en ambas recomendaciones; la cohorte del Pooled Cohort23 se diseñó para las recomendaciones del American College of Cardiology (ACC)/American Heart Association (AHA)18. También se ha utilizado la ecuación de Framingham de 199829 recalibrada en el estudio del Registre Gironí del Cor (REGICOR)30 en las guías clínicas de algunas comunidades autónomas como Baleares21 o Cataluña22.
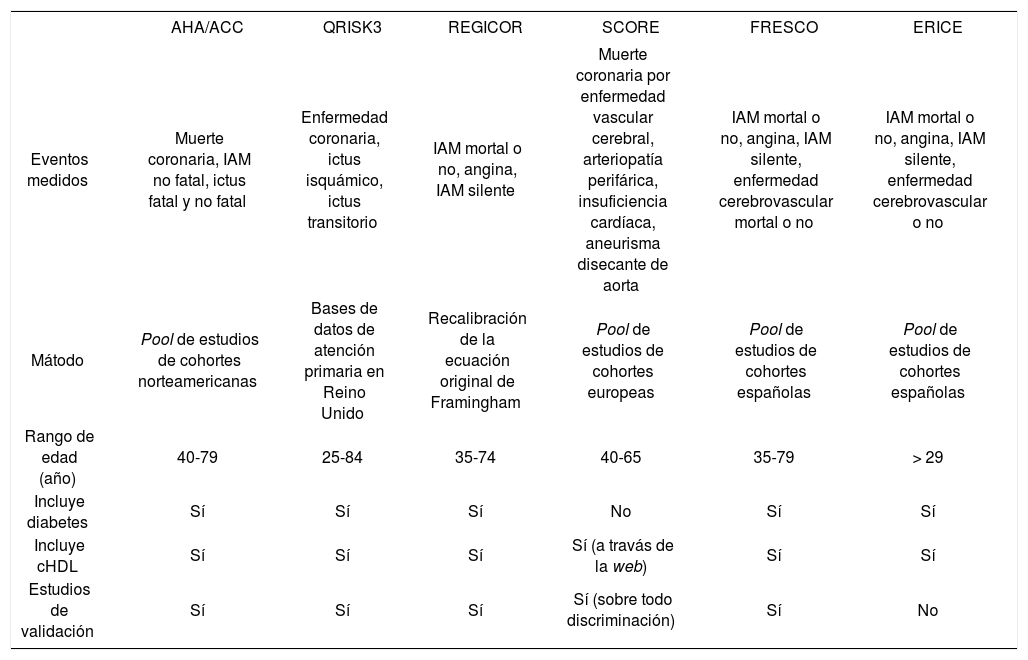
En la tabla 1 se describen las características de las diferentes tablas de riesgo nacional o internacional.
Métodos para el cálculo del riesgo cardiovascular
| AHA/ACC | QRISK3 | REGICOR | SCORE | FRESCO | ERICE | |
|---|---|---|---|---|---|---|
| Eventos medidos | Muerte coronaria, IAM no fatal, ictus fatal y no fatal | Enfermedad coronaria, ictus isquámico, ictus transitorio | IAM mortal o no, angina, IAM silente | Muerte coronaria por enfermedad vascular cerebral, arteriopatía perifárica, insuficiencia cardíaca, aneurisma disecante de aorta | IAM mortal o no, angina, IAM silente, enfermedad cerebrovascular mortal o no | IAM mortal o no, angina, IAM silente, enfermedad cerebrovascular o no |
| Mátodo | Pool de estudios de cohortes norteamericanas | Bases de datos de atención primaria en Reino Unido | Recalibración de la ecuación original de Framingham | Pool de estudios de cohortes europeas | Pool de estudios de cohortes españolas | Pool de estudios de cohortes españolas |
| Rango de edad (año) | 40-79 | 25-84 | 35-74 | 40-65 | 35-79 | > 29 |
| Incluye diabetes | Sí | Sí | Sí | No | Sí | Sí |
| Incluye cHDL | Sí | Sí | Sí | Sí (a travás de la web) | Sí | Sí |
| Estudios de validación | Sí | Sí | Sí | Sí (sobre todo discriminación) | Sí | No |
AHA/ACC: American Heart Association/American College of Cardiology; cHDL: cholesterol unido a lipoproteínas de alta densidad;
IAM: infarto agudo de miocardio.
La validez de las tablas de riesgo se mide mediante la calibración y la discriminación. La calibración hace referencia a cómo se ajustan los valores calculados con la ecuación de riesgo y los valores observados o reales. Esto se mide mediante la clasificación en deciles de riesgo a la población y el cálculo de la diferencia entre el valor calculado y el riesgo observado. La prueba estadística que se suele utilizar para evaluar esta cualidad en los modelos de riesgo es la de Hosmer-Lemeshow, en la que los valores más bajos representan una buena calibración y los más altos, la ausencia de calibración; así, valores por debajo de 15 se consideran aceptables.
La validez también se mide por la discriminación, que es la propiedad de un modelo de predicción del riesgo de separar a los enfermos de los sanos. Esta propiedad se calcula utilizando el área bajo la curva (ABC) ROC (receiver operating characteristics curve o curvas de características operativas para el receptor), y se establece que un ABC de 1 indica una discriminación perfecta y un valor de 0,5 representa una mala discriminación, semejante a la obtenida por el azar. Una discriminación aceptable para predicciones a largo plazo, como la que ocurre en los modelos de riesgo cardiovascular, debería tener un ABC entre 0,6 y 0,7 o superior31.
Para mejorar la calibración de las tablas de riesgo cuando se utilizan en poblaciones con una incidencia de enfermedad cardiovascular diferente a de la cohorte original, se han utilizado recalibraciones, y la más utilizada es la del método D'Agostino32. Este método consiste en mantener los mismos coeficientes de las ecuaciones de riesgo y sustituir los datos de prevalencia de factores de riesgo e incidencia de la enfermedad cardiovascular de la ecuación original por los datos locales de la población en la que se pretende aplicar. En España existen experiencias de recalibración de la ecuación de Framingham de 1998, como la del REGICOR30, Riesgo Coronario de Navarra (RICORNA)33, CDC-Canarias34 y también de la ecuación del SCORE35.
Resultados de la validaciónLa validación en España de la ecuación del REGICOR30 se ha realizado en las cohortes del estudio Validez de la Ecuación de Riesgo Individual de Framingham de Incidentes Coronarios Adaptada (VERIFICA)36, FRESCO25 y en una cohorte retrospectiva en Badajoz37, y los resultados obtenidos son heterogéneos. Así, la tabla del REGICOR presenta un ABC y una calibración aceptables en el estudio VERIFICA (ABC de 0,68 en varones y de 0,73 en mujeres, y una calibración mediante la prueba de Hosmer-Lemeshow de 5,1 para varones y de 2,7 para mujeres)36, sin embargo, cuando se valida sobre la cohorte del estudio FRESCO (el ABC es aceptable, 0,69 en varones y 0,73 en mujeres), la calibración no resulta ser tan buena (x2 de 13,5 y 8,9 para varones y mujeres, respectivamente, ambas p > 0,05) debido a una sobreestimación sistemática en todos los deciles de riesgo.
En el estudio, realizado en Badajoz37, la ecuación del SCORE obtuvo mejores criterios de validez (sensibilidad y especificidad) que la tabla del REGICOR, tanto en la población total como en varones y en mujeres, aunque hay que tener en cuenta las limitaciones propias de los estudios retrospectivos.
Un estudio reciente de validación del SCORE realizado en España muestra cómo todas las versiones de las funciones SCORE disponibles en España sobreestiman significativamente la mortalidad cardiovascular observada en la población española38. Estos resultados podrán ser contrastados con otros estudios de validación del SCORE para países de bajo riesgo actualmente en marcha.
La ecuación del SCORE para países de bajo riesgo también ofrece datos de sensibilidad y especificidad en la validación interna, es decir, en la cohorte original, y obtiene una sensibilidad del 35% y una especificidad del 88% para una definición de riesgo alto, ≥ 5%27.
Conclusiones sobre las tablas de riesgo cardiovascularLas tablas de riesgo cardiovascular tienen cualidades muy útiles para el médico práctico. Entre ellas se encuentra la de permitir estratificar el riesgo cardiovascular de una determinada población asignada y graduar la intensidad de la intervención. Además, aseguran que las intervenciones para reducir el colesterol39 o la PA40 producen un mayor beneficio absoluto cuanto mayor es el riesgo cardiovascular.
Los estudios comparativos de la validez entre una y otra tabla son escasos en España y con resultados dispares. Por lo tanto, actualmente no se dispone de criterios objetivos para recomendar una u otra tabla de riesgo. De esta manera las tablas del SCORE para países de bajo riesgo o del REGICOR, las más utilizadas en España, serían las aconsejadas.
Un aspecto esencial de las tablas de riesgo es el uso que hacen de ellas las guías clínicas: mientras unas las consideran como un elemento básico sobre el que pivotan las decisiones del tratamiento o no de los factores de riesgo y del objetivo de tratamiento, otras las utilizan como una información adicional complementaria para clasificar a los pacientes y priorizar la intensidad de la intervención. Pese a que tienen una discriminación aceptable en la mayoría de las validaciones, la calibración es variable, la sensibilidad moderada o baja y un porcentaje importante de personas que sufrirán una enfermedad cardiovascular no está incluido bajo el concepto de riesgo alto. Por lo tanto, y debido a estas carencias, la orientación de utilizar las tablas de riesgo como información adicional a la proporcionada por la elevación de los factores de riesgo o la presencia de otras características adicionales parece la forma más adecuada.
Aunque no hay datos suficientes para decantarnos por una intervención basada en las tablas de riesgo cardiovascular o en una aproximación utilizando los valores de los factores de riesgo sin un cálculo multifactorial, varias revisiones avalan la relación directa entre el riesgo calculado mediante tablas específicas y la mortalidad de los pacientes39, 40.
Cálculo del riesgo cardiovascularEn nuestro medio recomendaríamos las tablas SCORE para países de bajo riesgo, y los factores que se incluyen en las tablas son la edad, el sexo, la PA sistólica (PAS), el colesterol total y el tabaco. Se consideraría de riesgo muy alto cuando este resulta ser ≥ 10% de mortalidad cardiovascular a los 10 años. Entre el 5 y el 9% se considera alto, entre el 1 y el 4%, moderado, y < 1%, bajo. Actualmente se puede calcular directamente a través de la web y brinda la posibilidad de incluir el cHDL (https://heartscore.escardio.org/2012/calcResult.aspx?model=europelow), que ofrece una estimación mucho más precisa del riesgo.
Otras tablas que se utilizan en nuestro medio son las tablas de REGICOR; incluyen la edad, el sexo, la PAS, la PA diastólica y el colesterol total, y hay tablas específicas para diabéticos. Si el cHDL < 35 mg/dl, el riesgo debe multiplicarse por 1,5. Si el cHDL > 60 mg/dl, el riesgo debe multiplicarse por 0,5.
También se puede acceder directamente a la web, y se puede calcular directamente el riesgo de una forma más precisa (https://www.imim.cat/ofertadeserveis/software-public/regicor). REGICOR estima el riesgo de morbimortalidad coronaria a los 10 años, y cuando es > 15% se considera muy alto, entre el 10-14%, alto, entre 5-9%, moderado y < 5%, bajo. En el caso del cálculo mediante REGICOR se recomienda empezar tratamiento hipolipemiante cuando el riesgo es ≥ 10% a los 10 años, aunque alguna guía de carácter autonómico recomienda empezar a tratar cuando el riesgo es ≥ 15% a los 10 años41.
Estratificación del riesgoLas recientes guías europeas de prevención cardiovascular19 establecen una serie de categorías para la estratificación del riesgo cardiovascular, que se muestran en la tabla 2. Como se puede observar, a los pacientes diabéticos ya los considera de riesgo muy alto o alto, por lo que no sería necesario calcular el riesgo cardiovascular.
Categorias de riesgo
| Riesgo muy alto | Individuos con alguna de la siguientes: |
| • Enfermedad cardiovascular documentada, ya sea clínicamente o a través de imágenes, incluyendo infarto de miocardio, síndrome coronario agudo, revascularización coronaria o de otras arterias, ictus y accidente vascular transitorio, y enfermedad vascular periférica, así como la presencia de placas en la arteriografía coronaria o en la ecografía carotídea. No incluiría aumento del grosor de la íntima media carotídea | |
| • Diabetes con afectación de órgano diana como proteinuria o con la presencia de un factor de riesgo mayor, como tabaquismo, hipercolesterolemia o hipertensión | |
| • ERC grave (GFR < 30 ml/min/1,73 m2) | |
| • Un SCORE ≥ 10% | |
| Riesgo alto | Individuos con: |
| • Un factor de riesgo elevado, como colesterol > 8 mmol/l (310 mg/dl), PA ≥ 180/110 mmHg | |
| • El resto de diabéticos (con la excepción de jóvenes con diabetes tipo 1 y sin factores de riesgo, que podrían ser de riesgo moderado o bajo) | |
| • ERC moderada (GFR, 30-59 ml/min/1,73 m2) | |
| • Un SCORE ≥ 5% y < 10% | |
| Riesgo moderado | • SCORE ≥ 1% y < 5% a los 10 años |
| Riesgo bajo | • SCORE < 1% |
ERC: enfermedad renal crónica; GFR: tasa de filtrado glomerular; PA: presión arterial.
Junto a estas consideraciones, se han descrito una serie de modificadores de riesgo que servirían para tenerlos en cuenta a la hora de estratificar el riesgo, ya que su presencia nos indicaría la existencia de un riesgo mayor que el calculado con las tablas. Entre los más importantes estarían los siguientes:
- •
Personas que se aproximan a la siguiente categoría de edad.
- •
Evidencia preclínica de arteriosclerosis: por ejemplo, mediante ecografía, tomografía computarizada u otras técnicas de imagen.
- •
Antecedentes familiares de enfermedad cardiovascular prematura: antecedentes de enfermedad cardiovascular en familiares de primer grado, padres o hermanos, antes de los 55 años de edad en familiares varones y antes de los 65 años en familiares mujeres.
- •
Hipertrofia ventricular izquierda electrocardiográfica o ecográfica.
- •
Cifras bajas de lipoproteínas de alta densidad (HDL): < 40 mg/dl en varones y de 46 mg/dl en mujeres.
- •
Glucemia basal alterada.
- •
Obesidad abdominal o sedentarismo.
- •
Proteína C reactiva (ultrasensible) elevada.
- •
Aumento del calcio intracoronario.
- •
Enfermedades autoinmunes.
- •
Clase socioeconómica baja.
- •
Síndrome de apnea obstructiva del sueño.
- •
Disfunción eréctil.
| Calidad de la evidencia | Fuerza de la recomendacion | |
|---|---|---|
| Se recomienda el cálculo del riesgo cardiovascular a todos los adultos de 40 años o mayores que no tengan una enfermedad cardiovascular o que, por sus características, no sean de alto riesgo, mediante algún sistema validado como el SCORE (hasta los 65 años) o REGICOR (hasta los 75 años) | Moderada | Fuerte a favor |
| Las tablas de riesgo constituyen una información complementaria y útil para ayudar a estratificar el riesgo y a tomar decisiones en el tratamiento de la dislipemia y de la HTA | Moderada | Fuerte a favorde |
La HTA se define por unas cifras repetidamente elevadas de PA estimadas de forma convencional. Estos valores se basan en la evidencia obtenida por ensayos clínicos aleatorizados con objetivos de disminución de la morbimortalidad cardiovascular mediante la reducción de unas cifras tensionales a partir de ciertos límites. En la actualidad, las cifras para el diagnóstico de la PA difieren según los métodos de medida de la PA: a) 140/90 mmHg estimados con la toma de PA en consulta; b) 135/85 mmHg si se consideran los valores de las automedidas de la PA (AMPA) en el domicilio del paciente y, también, con las cifras diurnas (o de actividad) de monitorización ambulatoria de la PA (MAPA); c) 130/80 mmHg con medias promediadas de 24 h en la MAPA, y finalmente, d) 120/70 mmHg con cifras nocturnas de la MAPA42.
Las recientes guías del ACC/AHA43 en Estados Unidos han propuesto definir la HTA como cifras de PA > 130/80 mmHg. Fundamentalmente se basan en el reciente ensayo SPRINT, unos pocos recientes metaanálisis y en estudios observacionales que ponen de manifiesto el exceso de riesgo cardiovascular en niveles no estrictamente hipertensivos (p. ej., 130-9/80-9 mmHg). Sin embargo, nuestro grupo de trabajo, de forma similar a lo propuesto por la semFYC44, apuesta por seguir manteniendo las cifras convencionales de HTA (presiones ≥ 140/90 mmHg), porque los estudios que generaron las evidencias del SPRINT y otros ensayos estuvieron centrados en pacientes de alto riesgo cardiovascular o con enfermedad cardiovascular previa, es decir, no en otras poblaciones y, por ello, no permiten un diagnóstico universal de hipertensión con esas cifras de presión más bajas. Además, las implicaciones de esa nueva definición elevarían el número de hipertensos en el ámbito nacional en unos 5 millones (Gijón y Banegas, comunicación personal), sin una base de evidencia suficiente.
El PAPPS recomienda decididamente la confirmación de las cifras elevadas de PA tomada en la clínica para el diagnóstico de HTA por medio de la MAPA, excepto en casos en que es necesario el tratamiento farmacológico inmediato; la finalidad es evitar el sobrediagnóstico relacionado con el frecuente fenómeno de bata blanca y el consiguiente sobretratamiento45, 46, además es la estrategia más coste-efectiva para el diagnóstico de HTA47. También se admite el AMPA como alternativa cuando no existe disponibilidad (frecuente en nuestro medio, como demuestra el reciente estudio MAMPA)48 o no sea tolerable la MAPA, y ambas técnicas son, sobre todo la MAPA, superiores a la PA tomada en la clínica para estimar la posibilidad de desarrollar episodios cardio- y cerebrovasculares en los pacientes49. Esta recomendación también está recogida, entre otras, en las guías clínicas como el NICE45 o el US Preventive Services Task Force (USPSTF)50.
En la versión PAPPS de 2016 de este documento51 se discuten los períodos o los grupos de pacientes en los que se aconseja realizar el cribado de la HTA.
No hay evidencias que determinen los períodos o los grupos de pacientes en los que se deba realizar el cribado de la HTA. Tal como se aconseja en las recomendaciones anteriores del PAPPS y siguiendo los criterios del USPSTF50, la periodicidad del cribado de la HTA sería: los adultos de 18 a 39 años, con PA normal (< 130/85 mmHg) y sin factores de riesgo para desarrollar HTA (exceso de peso, afroamericanos, > 40 años o PA entre 130-130/85-90 mmHg), deben ser revaluados cada 3 a 5 años (excepto PA > 180/110 mmHg, lesión de órganos diana o HTA secundaria). Los adultos mayores de 40 años o con factores de riesgo para desarrollar HTA deben ser evaluados anualmente. La confirmación de las elevaciones debe realizarse por MAPA, preferentemente, o AMPA, si no hay disponibilidad.
Intervenciones de educación sanitariaLas intervenciones no farmacológicas, como la pérdida de peso52, la práctica de ejercicio físico aeróbico, o la reducción del consumo de alcohol o de sal de la dieta, consiguen un descenso moderado de las cifras de PA52-56.
Un reciente estudio español, en el que más del 80% de los pacientes era hipertenso, ha demostrado que una dieta mediterránea suplementada con consumo diario de frutos secos (30 g de frutos secos compuestos —15 g de nueces, 7,5 g de avellanas y 7,5 g de almendras—) o de aceite de oliva virgen extra (aproximadamente 1 l a la semana) frente a una dieta baja en grasas disminuyó la morbimortalidad cardiovascular en pacientes de alto riesgo vascular pero sin eventos vasculares presentes (prevención primaria)57, además de disminuir múltiples factores de riesgo (PA medida por MAPA, glucemia o lípidos)58 y prevenir la aparición de diabetes59.
Tratamiento farmacológicoReducción del riesgo de enfermedad vascularEl tratamiento farmacológico de la HTA disminuye la morbimortalidad vascular (enfermedad cerebrovascular principal- mente, cardiopatía isquémica, mortalidad cardiovascular y mortalidad total)60, 61.
Valores del factor de riesgo para introducir fármacosTal como se recomendaba en anteriores versiones del PAPPS51, se sigue aconsejando iniciar el tratamiento farmacológico cuando las cifras de PAS son ≥ 160/100 mmHg en población general (con riesgo cardiovascular bajo) o para cifras de PA ≥ 140/90 mmHg en pacientes de alto riesgo cardiovascular (incluida diabetes mellitus tipo 2, lesión de órganos diana o enfermedad cardiovascular). No obstante, es importante matizar que la guía de la European Society of Hypertension (ESH)42, la de la American Society of Hypertension (ASH)62 o la del Joint National Committee (JNC) 863 recomiendan iniciar el tratamiento farmacológico a partir del grado 1 de hipertensión (140-159/90-99 mmHg), siempre que las medidas de educación sanitaria no hayan sido efectivas durante varios meses, y esta aproximación se ha corroborado en el reciente ensayo SPRINT64 (en pacientes de alto riesgo vascular). Sin embargo, otras guías65-66 introducen el tratamiento farmacológico a partir del grado 2 (≥ 160/100 mmHg), independientemente de su riesgo cardiovascular o en HTA grado 1 con alto riesgo.
Respecto a la edad67, varias guías42, 62 y una revisión Cochrane68 recomiendan tratamiento farmacológico en pacientes > 60-65 años si la PA es ≥ 160/100 mmHg, o ante una PAS > 140 mmHg si el paciente no es frágil y el tratamiento es bien tolerado. En cambio, la guía del JNC 863 recomienda comenzarlo si la PA es > 150/90 mmHg. La evidencia del beneficio obtenido por el tratamiento farmacológico alcanza a las personas > 80 años (estudio HYVET)69 con HTA grado 2 (PA 160-179/100-109 mmHg), aunque la mayoría de los pacientes en este ensayo estaba en buenas condiciones físicas y mentales. En cambio, en la reciente guía AHA/ACC43 se recomiendan iniciar tratamiento farmacológico en > 65 años cuando la PAS esté por encima de 130 mmHg, basándose en los resultados del estudio SPRINT64.
Objetivos de presión arterialExiste una práctica unanimidad en recomendar unas cifras de PA < 140/90 mmHg como objetivo terapéutico en la población general, incluyendo a pacientes con diabetes, enfermedad renal crónica (ERC) o enfermedad cardiovascular previa. Sin embargo, en los últimos años varios estudios y revisiones sistemáticas han replanteado estos objetivos terapéuticos.
El estudio SPRINT64 concluyó que pacientes de alto riesgo vascular (enfermedad cardiovascular, insuficiencia renal, riesgo Framingham > 15% o mayores de 75 años), excluyendo diabetes e ictus, se benefician en el objetivo primario (mortalidad total y cardiovascular) tras un descenso más intensivo de la PA (120 frente a 140 mmHg de PAS). Sin embargo, en el estudio SPRINT, la presión se midió en ausencia de observador, lo que se traduce en cifras inferiores que se alejan de las obtenidas en la consulta clínica. Otras 2 revisiones recientes arrojan similares expectativas70,71. Aunque los niveles de PA que hay que alcanzar van a seguir en constante renovación72, y en espera de las nuevas guías europeas de hipertensión (previstas para junio de 2018), seguimos considerando que la postura razonable de momento es no recomendar cambios en las guías hasta que no se consoliden estos nuevos resultados. No obstante, si se consideran las evidencias anteriores, el médico puede considerar de manera individualizada en los pacientes en mayor riesgo, salvo los muy mayores (> 80 años) o frágiles (déficit en las condiciones físicas), la reducción de las cifras de presión a un entorno próximo a 130/80 mmHg y, en todo caso, evitar hipotensiones y asegurar una adecuada tolerancia del tratamiento.
En las recomendaciones del PAPPS de 201651 se discuten los fundamentos de objetivos terapéuticos en situaciones concretas de riesgo (ancianos, diabetes mellitus tipo 2, enfermedad coronaria, ERC). Recientemente se han publicado varios metaanálisis o revisiones de estudios en ancianos73, con insuficiencia renal74, diabéticos75 y de alto riesgo vascular76, sin encontrar diferencias significativas de mortalidad entre descensos más intensivos de PA (< 140 mmHg) frente al objetivo terapéutico de 140 mmHg. Aunque existen otras revisiones en diabetes77,78 o insuficiencia renal79, que encontrarían beneficios para niveles de PA de 120-140 mmHg, en consonancia con el estudio SPRINT64, en esta edición seguimos manteniendo el objetivo de 140/90 mmHg, salvo en situaciones muy particulares, como la presencia de proteinuria o la consideración individualizada en situaciones de alto riesgo recién comentada.
Fármacos para el tratamiento en monoterapiaVarios metaanálisis para comprobar las diferencias en morbimortalidad en función de los grupos terapéuticos utilizados no han demostrado diferencias significativas entre ellos59,80.
Prácticamente todas las guías de práctica clínica42, 51, 62, 63, 65 establecen 5 grupos terapéuticos como de primera elección: diuréticos tiazídicos, inhibidores de la enzima de conversión de la angiotensina (IECA), antagonistas de los receptores de la angiotensina II (ARA II), antagonistas del calcio, excepto las recomendaciones europeas y canadienses que siguen recomendando los bloqueadores beta en menores de 65 años o con HTA diastólica, respectivamente42, 66. Respecto a los diuréticos tiazídicos, en la guía NICE65 se eliminaron como fármacos de primera elección, y en caso de utilizarse se decantaría por los diuréticos tiazídicos-like (indapamida o clortalidona) frente a los clásicos (hidroclorotiazida, clorotiazida y benzoflumetiazida). En términos de morbimortalidad, un metaanálisis reciente81 confirma la mayor eficacia de los diuréticos tiazídicos-like frente a los clásicos. Una reciente revisión Cochrane82 concluyó que la hidroclorotiazida tiene un efecto dependiente de la dosis (6,25-12-25-50 mg), mientras que para los otros diuréticos no se observaron diferencias entre dosis bajas y más elevadas.
Por otro lado, los bloqueadores beta, y más concretamente el atenolol, han sido el grupo de antihipertensivos probablemente más asociado a peores resultados83. Además, su presunto efecto cardioprotector en pacientes coronarios se ha cuestionado por un metaanálisis84.
Respecto a los IECA, un reciente metaanálisis no ha encontrado diferencias significativas comparativamente con otros fármacos, al menos en mortalidad85, y tampoco cuando se comparan con un ARA II86. En caso de diabetes tipo 2 son de elección los IECA, que han demostrado superioridad frente a ARA II87, 88. Si se exceptúa la guía europea42 y el JNC 863, la mayoría de las guías de HTA recomiendan un IECA o ARA II en el tratamiento del diabético hipertenso como primera opción. Un reciente metaanálisis ha venido a contra decir esta última opción, al no encontrar superioridad de estos fármacos frente a otros grupos89. En nefropatía diabética, los IECA y ARA II fueron superiores en disminuir el paso a enfermedad renal terminal90. En cualquier caso, todas las guías coinciden en no recomendar los IECA-ARA II en pacientes de raza negra.
Así pues, en pacientes diabéticos sin presencia de enfermedad renal o albuminuria (de bajo o alto grado) podría optarse por cualquiera de las clases farmacológicas priorizadas en primera opción (IECA-ARA II, ACA-DHP o diuréticos tiazídicos-like), mientras que si existe alguna de las condiciones anteriores (sobre todo ERC o albuminuria) serían de elección los IECA-ARA II, con las peculiaridades anteriormente referidas respecto a la elección de uno u otro, en consonancia con varias guías de práctica clínica42,43,66.
Fármacos para el tratamiento en combinaciónVarios estudios han mostrado que la asociación farmacológica en un solo comprimido es más eficaz en reducir la PA que la monoterapia o la combinación de fármacos por separado91,92. Una revisión evaluó la eficacia y la seguridad de la triple terapia frente a la doble terapia en la HTA, y objetivó, como era de esperar, un mayor descenso de la PA con la asociación de 3 fármacos, y sin efectos secundarios relevantes93. Las contraindicaciones claramente aceptadas por todas las guías de práctica clínica42,62,63,65,66 son la asociación IECA y un ARA II (o IECA o un ARA II con inhibidores de renina), contraindicación refrendada por una revisión sistemática94, así como la asociación de un bloqueador beta con un antagonista del calcio no dihidropiridínico (verapamilo y diltiazem).
Adherencia al tratamientoUna reciente revisión sistemática analizó si las medidas destinadas a mejorar la adherencia en la HTA eran efectivas con tal efecto. Sus resultados fueron positivos, aunque alertaron de problemas metodológicos relacionados con medidas validadas de adherencia y diseño de ensayos95.
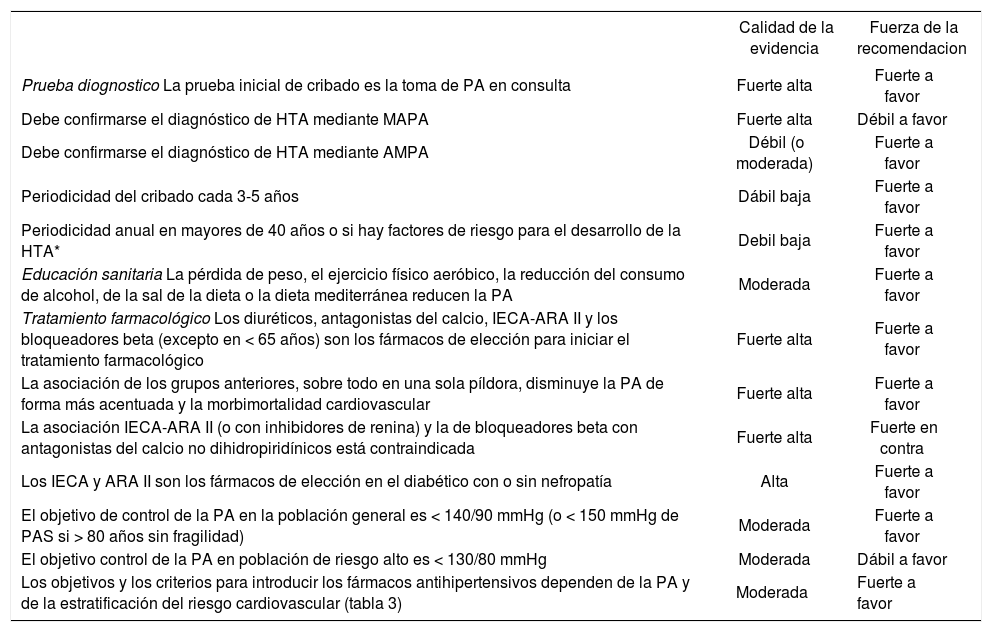
Recomendaciones en hipertensión arterial| Calidad de la evidencia | Fuerza de la recomendacion | |
|---|---|---|
| Prueba diognostico La prueba inicial de cribado es la toma de PA en consulta | Fuerte alta | Fuerte a favor |
| Debe confirmarse el diagnóstico de HTA mediante MAPA | Fuerte alta | Débil a favor |
| Debe confirmarse el diagnóstico de HTA mediante AMPA | Débil (o moderada) | Fuerte a favor |
| Periodicidad del cribado cada 3-5 años | Dábil baja | Fuerte a favor |
| Periodicidad anual en mayores de 40 años o si hay factores de riesgo para el desarrollo de la HTA* | Debil baja | Fuerte a favor |
| Educación sanitaria La pérdida de peso, el ejercicio físico aeróbico, la reducción del consumo de alcohol, de la sal de la dieta o la dieta mediterránea reducen la PA | Moderada | Fuerte a favor |
| Tratamiento farmacológico Los diuréticos, antagonistas del calcio, IECA-ARA II y los bloqueadores beta (excepto en < 65 años) son los fármacos de elección para iniciar el tratamiento farmacológico | Fuerte alta | Fuerte a favor |
| La asociación de los grupos anteriores, sobre todo en una sola píldora, disminuye la PA de forma más acentuada y la morbimortalidad cardiovascular | Fuerte alta | Fuerte a favor |
| La asociación IECA-ARA II (o con inhibidores de renina) y la de bloqueadores beta con antagonistas del calcio no dihidropiridínicos está contraindicada | Fuerte alta | Fuerte en contra |
| Los IECA y ARA II son los fármacos de elección en el diabético con o sin nefropatía | Alta | Fuerte a favor |
| El objetivo de control de la PA en la población general es < 140/90 mmHg (o < 150 mmHg de PAS si > 80 años sin fragilidad) | Moderada | Fuerte a favor |
| El objetivo control de la PA en población de riesgo alto es < 130/80 mmHg | Moderada | Dábil a favor |
| Los objetivos y los criterios para introducir los fármacos antihipertensivos dependen de la PA y de la estratificación del riesgo cardiovascular (tabla 3) | Moderada | Fuerte a favor |
HTA: hipertensión arterial; MAPA: monitorización ambulatoria de la presión arterial; AMPA: automedida de la presión arterial;
IECA: inhibidores de la enzima de conversión de la angiotensina;
ARA II: antagonistas de los receptores de la angiotensina II.
* Obesidad, raza negra, PA 130-130/85-90 mmHg.
La prueba recomendada para el cribado de la dislipemia es la determinación del colesterol total, debido a su relación con la mortalidad cardiovascular, y acompañado del cHDL, ya que permite calcular mejor el riesgo cardiovascular96. Aunque las cifras de colesterol se interpretan en función de la estratificación del riesgo cardiovascular, se suele considerar como hipercolesterolemia una cifra de colesterol total ≥ 200 mg/dl, mientras que el cHDL con efecto protector sería a partir de los 50 mg/dl y actuaría como factor de riesgo por debajo de los 45 mg/dl. Es a partir de estos valores cuando disminuye o aumenta el riesgo cardiovascular en estudios longitudinales como el de Framingham20.
Indicación del tratamiento farmacológico antihipertensivo y objetivos de control
| Estratificacion del riesgo | PA (mmHg) al inicio del tratamientoa | Objetivos de control (mmHg)b |
|---|---|---|
| Enfermedad cardiovascular | ≥ 140/90 | < 140/90 |
| Riesgo alto | ≥ 140/90 | < 140/90 |
| Riesgo moderado | ≥ 140/90 | < 140/90 |
| Riesgo bajo | ≥ 160/90 | < 140/90 |
PA: presion arterial.
No hay evidencias suficientes para establecer un rango de edad y una periodicidad determinados para realizar el colesterol sérico en población sana, por lo que la actitud más razonable es incluirla en cualquier análisis de sangre solicitado al paciente, con una periodicidad mínima de 4 años y a partir de los 18 años.
Intervenciones de educación sanitariaLa grasa saturada es uno de los factores dietéticos que más influencia tiene en la elevación del colesterol97, y se encuentra una asociación entre el consumo de ácidos grasos saturados de la dieta, la elevación del colesterol sérico y, posteriormente, la mortalidad coronaria97, 98. Sin embargo, una revisión más reciente de estudios epidemiológicos prospectivos concluye que no hay suficiente evidencia para relacionar la cantidad de grasa saturada de la dieta con un incremento del riesgo de enfermedad cardiovascular99. Por otro lado, en estudios de intervención dietética se observó que es más importante una modificación de las grasas, con la reducción de la saturada y su sustitución por la insaturada, que disminuir la cantidad total, tal como se expone en un reciente metaanálisis; el tipo ideal de ácido graso insaturado no está claro100.
Tratamiento farmacológicoReducción del colesterol con los fármacos hipolipemiantesEl metaanálisis en red de Naci et al concluye que la atorvastatina > 40 mg/día y la rosuvastatina > 10 mg consiguen reducciones del cLDL de, aproximadamente, un 45% (intervalo de confianza [IC], 23-66%), y con la atorvastatina ≤ 40 mg/día, la rosuvastatina ≤ 10 mg, la simvastatina 20-40 mg, la pravastatina 40 mg o fluvastatina 80, las reducciones son del 38% de media (IC, 6-61%)101.
Entre los otros fármacos hipolipemiantes están las resinas y la ezetimiba, que reducen fundamentalmente el cLDL y los fibratos y ácidos grasos omega 3, que reducen los triglicéridos. Recientemente se han introducido como nuevos fármacos hipolipemiantes los inhibidores de la PCSK9 (proproteína convertasa subtilisina/kexina tipo 9), que son anticuerpos monoclonales humanos (alirocumab y evolocumab son los primeros de esta familia) que aumentan el número de receptores LDL disponibles para eliminar la LDL plasmática y así reducen los niveles de cLDL más de un 50%, con un número de efectos adversos comparables con placebo o ezetimiba102.
Reducción del riesgo de enfermedad cardiovascularLas estatinas son, entre los diferentes fármacos hipolipemiantes, los que más evidencias disponen en la reducción de la enfermedad cardiovascular y con una excelente relación riesgo/beneficio en población de riesgo103, 104. Existe una relación lineal entre los miligramos de cLDL reducidos con estatinas y la reducción de la enfermedad cardiovascular, y se ha cuantificado que descensos de 1 mmol/l (39 mg/dl) de cLDL determinan una reducción de los episodios cardiovasculares mayores (infarto de miocardio e ictus mortal o no mortal y recibir un tratamiento de revascularización) de un 21%103 y se sugiere que reducciones de 2-3 mmol/l reducirían el riesgo un 40-50%105.
Además, de los episodios cardiovasculares mayores, las estatinas también reducen la mortalidad total, la cardiovascular, la coronaria y los ictus isquémicos106, pero sin resultados en la prevención de los ictus hemorrágicos107.
La utilización de estatinas a dosis altas (estatinas de alta intensidad) en pacientes que han padecido una cardiopatía isquémica reduce más los episodios cardiovasculares mayores que cuando las estatinas se utilizan a una dosis estándar, aproximadamente un 15% más105.
Se ha demostrado que los beneficios cardiovasculares ocurren en diferentes grupos de población. Entre estos se encuentran los pacientes con103 o sin108 enfermedad cardiovascular, con ictus4, diabéticos106, en varones y mujeres109, en ≥ 65 años107 e, incluso, en pacientes con riesgo cardiovascular bajo36. La extensa población en la que las estatinas han demostrado su eficacia hace que, prioritariamente, se recomiende el tratamiento en los grupos con mayor riesgo cardiovascular: enfermedad cardiovascular, diabéticos, riesgo alto mediante tablas de riesgo o pacientes con un cLDL elevado12,13.
Los fibratos presentan evidencias de reducción de la enfermedad cardiovascular cuando se comparan con placebo, pero en menor medida que las estatinas. Lo mismo ocurre con las resinas y los ácidos grasos omega 3. Una revisión sistemática que agrupó los datos de 24 ensayos clínicos de los inhibidores de la PCSK9 aporta, además, resultados de eficacia clínica, una reducción significativa de la mortalidad total (odds ratio [OR]: 0,45; IC, 0,23-0,86; p = 0,015; heterogeneidad p = 0,63; I2 = 0%) y con una reducción no significativa de la mortalidad cardiovascular (OR: 0,50; IC, 0,23-1,10; p = 0,084; heterogeneidad p = 0,78; I2 = 0%); la tasa de infarto de miocardio se redujo de forma significativa (OR: 0,49; IC, 0,26-0,93; p = 0,030; heterogeneidad p = 0,45; I2 = 0%), todo ello sin aumento significativo de los eventos adversos110.
Recientemente, en el estudio Fourier se ha demostrado una reducción significativa de un 15% de la morbimortalidad cardiovascular111 cuando se comparaba evolocumab con placebo a los 2,2 años de seguimiento en pacientes con enfermedad cardiovascular estable, y todos en tratamiento con estatinas y con cLDL ≥ 70 mg/dl. Los pacientes en el brazo de evolocumab consiguieron una media de cLDL de 30 mg/dl.
Más recientemente, el estudio Odissey ha demostrado que el evolucumab comparado con placebo reducía también de una manera significativa, un 15%, la morbimortalidad cardiovascular a los 4 años de seguimiento en pacientes que habían padecido un síndrome coronario agudo en el último año y todos en tratamiento con estatinas de alta intensidad, pero un cLDL ≥ 70 mg/dl (resultados presentados en el ACC 2018, todavía no publicados).
Mejor fármaco hipolipemianteEn general, las estatinas constituyen la piedra angular del tratamiento de la dislipemia y los otros fármacos hipolipemiantes tienen su principal indicación cuando existe intolerancia a las estatinas o combinados con estas.
Mejor combinación de fármacos hipolipemiantesLos estudios que comparan el efecto de añadir otro fármaco hipolipemiante a una población tratada con estatinas no han tenido demasiado éxito. Así, la combinación de estatinas con fibratos o niacina no incrementa el beneficio conseguido con la estatina sola. Sin embargo, en el estudio IMPROVE-IT112, la adición de ezetimiba a simvastatina produjo beneficios adicionales tras un síndrome coronario agudo y redujo el riesgo de la variable primaria (compuesta por muerte cardiovascular, infarto de miocardio, angina inestable, revascularización coronaria o ictus) en un 6% a los 7 años de seguimiento. Estos resultados serían equivalentes a los beneficios esperados al extrapolar a la relación lineal, descrita en el apartado de la reducción del riesgo cardiovascular, los miligramos de cLDL reducidos al asociar la ezetimiba. Un reciente análisis de subgrupos del IMPROVE-IT mostró que el mayor beneficio se observa en pacientes diabéticos y en pacientes de muy alto riesgo cardiovascular113.
Los otros fármacos que han demostrado un beneficio cardiovascular cuando se combinan con estatinas son los inhibidores del PCSK9. Actualmente, las indicaciones financiadas con cargo al Sistema Nacional de Salud de los inhibidores de la PCSK9 son en los siguientes grupos:
Pacientes con enfermedad cardiovascular establecida (cardiopatía isquémica, enfermedad cerebrovascular isquémica y enfermedad arterial periférica) no controlados con la dosis máxima tolerada de estatinas (cLDL > 100 mg/dl).
Pacientes con hipercolesterolemia familiar homocigota (HFHo) no controlados con la dosis máxima tolerada de estatinas (cLDL > 100 mg/dl).
Pacientes con hipercolesterolemia familiar heterocigota (HFHe) no controlados con la dosis máxima tolerada de estatinas (cLDL > 100 mg/dl).
Cualquiera de los pacientes de los grupos anteriores que sean intolerantes a las estatinas o en los que las estatinas están contraindicadas y cuyo nivel de cLDL > 100 mg/dl.
Las estatinas han demostrado su eficacia en un amplio grupo de poblaciones que se extiende desde pacientes con un riesgo cardiovascular elevado a un riesgo moderado, incluso bajo36. Esta misma circunstancia ocurre con el cLDL, es decir, tanto en personas con un cLDL alto como bajo. Por lo tanto, si nos ceñimos a la evidencia, al no existir un límite de riesgo o de cLDL que se pueda determinar para introducir un fármaco hipolipemiante, se ha establecido por convenio la confluencia de un determinado riesgo cardiovascular con un objetivo de cLDL.
Hasta hace escasos años, había un consenso internacional prácticamente unánime en proponer unas cifras objetivo de cLDL para la reducción de la morbimortalidad cardiovascular en la intervención con hipolipemiantes. Sin embargo, en la actualidad existe una gran controversia sobre si la estrategia de intervención con estatinas se ha de basar en el logro de determinadas cifras objetivo de cLDL o en la reducción del riesgo vascular sobre la base del riesgo absoluto del individuo. Este debate se ha suscitado tras la publicación, en 2013, de las guías del ACC/AHA18, que proponen el abandono de los objetivos de cLDL.
No hemos encontrado ninguna evidencia que demuestre la superioridad de una estrategia sobre la otra. Sin embargo, mantenemos un determinado valor del cLDL para introducir fármacos en riesgo alto moderado, ya que la reducción en mg/dl del cLDL condiciona el beneficio cardiovascular (tabla 4)100.
Objetivos terapéuticos de los lípidos
| • Riesgo muy alto: cLDL < 1,8 mmol/l (< ~70 mg/dl), o una reducción ≥ 50% si los valores basales sin tratamiento están entre 1,8 y 3,5 mmol/l (70 y 135 mg/dl) |
| • Riesgo alto: cLDL < 2,5 mmo/l (< ~100 mg/dl), o una reducción ≥ 50% si los valores basales sin tratamiento están entre 2,6 y 5,2 mmol/l (100 y 200 mg/dl) |
| • Riesgo moderado a bajo: cLDL < 3 mmol/l (< ~115 mg/dl) |
| Colesterol no HDL como objetivo secundario: < 2,6, 3,4 y 3,8 mmol/l (100, 130 y 145 mg/dl) para riesgo muy alto, alto y moderado, respectivamente cHDL: no objetivo terapéutico, pero > 1,0 mmol/l (40 mg/dl) en varones y > 1,2 mmol/l (48 mg/dl) en mujeres indican un riesgo más bajo Triglicéridos: no objetivo terapéutico, pero < 1,7 mmol/l (150 mg/dl) indica riesgo bajo y niveles más altos indican la necesidad de buscar otros factores de riesgo |
cHDL: colesterol unido a lipoproteinas de alta densidad;
cLDL: colesterol unido a lipoproteinas de baja densidad.
El cLDL en el grupo de intervención de los estudios de prevención secundaria que comparan una estrategia de estatinas a dosis estándar frente a un tratamiento más intensivo con estatinas a altas dosis95, o asociada a ezetimiba96, está rondando los 70 mg/dl en la mayoría de los estudios. Por otro lado, el cLDL del grupo de intervención de los ensayos clínicos que comparan estatinas frente a placebo se encuentra en torno a 100 mg/dl. Con la aparición de los resultados de los estudios Fourier y Odissey, la American Association of Clinical Endocrinologists (AACE) y el American College of Endocrinology (ACE)114 han establecido una categoría de riesgo extremo, con unos objetivos terapéuticos de cLDL < 55 mg/dl, c-no-HDL < 80 mg/dl, apolipoproteína B (apoB) < 70 mg/dl, y aquí se incluyen las siguientes categorías de pacientes:
- •
Enfermedad arteriosclerótica progresiva, que incluye angina inestable, en pacientes que han conseguido el objetivo de cLDL < 70 mg/dl.
- •
Enfermedad cardiovascular establecida en pacientes con diabetes, ERC estadios 3-4 o HFHe.
- •
Enfermedad cardiovascular prematura (< 55 años en varones, < 65 años en mujeres).
Nosotros nos mantenemos con lo que recomiendan las guías europeas de prevención cardiovascular19, que establecen una serie de objetivos terapéuticos en lípidos según el nivel de riesgo (tabla 4).
Recomendaciones en dislipemia| Calidad de la evidencia | Fuerza de la recomendacion | |
|---|---|---|
| Prueba diagnóstica La prueba de cribado recomendada (colesterol total y cHDL) | Moderada | Fuerte a favor |
| Periodicidad del cribado cada 4 años | Baja | Fuerte a favor |
| Recomendada a partir de los 18 años en ambos sexos | Baja | Fuerte a favor |
| Educación sanitaria Reducir la grasa saturada y sustituirla por insaturada sin modificar la cantidad | Moderada | Fuerte a favor |
| Tratamiento farmacológico Las estatinas son los fármacos de elección para el tratamiento de la dislipemia | Alta | Fuerte a favor |
| En caso de no alcanzar los objetivos terapéuticos con estatinas a dosis plenas o de intolerancia a las estatinas se recomienda la ezetimiba | Moderada | Fuerte a favor |
| En caso de pacientes con enfermedad cardiovascular establecida, o pacientes con HFHo o pacientes con HFHe, todos ellos con la dosis máxima tolerada de estatinas y un cLDL > 100 mg/dl, o bien cualquiera de esos pacientes con intolerancia a las estatinas y con cLDL > 100 mg/dl, se recomienda la utilización de inhibidores del PCSK9 (evolocumab o alirocumab) | Moderada | Fuerte a favor |
| Los objetivos y los criterios para introducir los fármacos hipolipemiantes dependen del cLDL y de la estratificación del riesgo cardiovascular | Moderada | Fuerte a favor |
cHDL: colesterol unido a lipoproteínas de alta densidad;
cLDL: colesterol unido a lipoproteínas de baja densidad;
HFHe: hipercolesterolemia familiar heterocigota;
HFHo: hipercolesterolemia familiar homocigota.
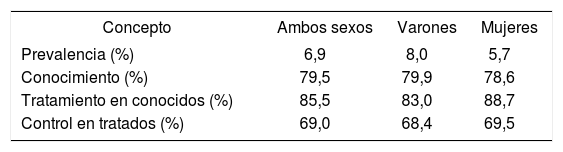
La prevalencia de diabetes en España en población ≥ 18 años es de un 6,9%, mayoritariamente conocida (79,5%), tratada con fármacos (85,5%) y controlada (69%), tal como se muestra en la tabla 54. Otro estudio, realizado con sobrecarga oral de glucosa (SOG), también con base poblacional y en ≥ 18 años, pero utilizando un muestreo agrupado por centros de salud, duplica la prevalencia de la diabetes (13,8%)13.
Prevalencia, conocimiento, tratamiento y control de la diabetes mellitus en el total de la población y por sexo en España9
| Concepto | Ambos sexos | Varones | Mujeres |
|---|---|---|---|
| Prevalencia (%) | 6,9 | 8,0 | 5,7 |
| Conocimiento (%) | 79,5 | 79,9 | 78,6 |
| Tratamiento en conocidos (%) | 85,5 | 83,0 | 88,7 |
| Control en tratados (%) | 69,0 | 68,4 | 69,5 |
Prevalencia de diabetes mellitus: glucemia > 126 mg/dl o en tratamiento farmacológico (oral y/o insulina).
Diabetes conocida: diabetes medida y referida por el sujeto.
Diabetes tratada: diabetes conocida y tratada farmacológicamente (oral y/o insulina).
Diabetes controlada: diabetes tratada con HbA1c < 7%.
El conocimiento se calculó en los individuos considerados diabéticos por las cifras de glucemia basal o por estar con medicación antidiabética.
Un estudio poblacional en Cataluña14 muestra el siguiente perfil del paciente diabético tipo 2: edad media de 68,2 años; 6,5 años de evolución de la enfermedad; HbA1c del 7,15%; PA de 137,2/76,4 mmHg; cLDL de 112,5 mg/dl, e índice de masa corporal de 29,6 kg/m2; antecedentes de enfermedad isquémica de miocardio, un 11,3%; de enfermedad cerebrovascular, un 6,5%, y de enfermedad arterial periférica, un 2,9%; tenía buen control (HA1c ≤ 7%, PA ≤ 130/80 mmHg y cLDL < 130 mg/dl) un 12,9% de los que estaban en prevención primaria y un 12,1% de los que estaban en prevención secundaria (HA1c ≤ 7%, PA ≤ 130/80 mmHg y cLDL < 100 mg/dl).
La diabetes supone un incremento del riesgo cardiovascular de aproximadamente 2 veces con respecto al paciente no diabético115. Además, también está asociada con una importante mortalidad prematura causada por algunos cánceres, enfermedades infecciosas, causas externas, suicidios y trastornos degenerativos, independientemente de los principales factores de riesgo116.
La prediabetes, definida como glucemia basal alterada (glucemia en ayunas 110-125 mg/dl), y la intolerancia a la glucosa (glucemia 140-200 mg/dl tras SOG con 75 g) se asocian con modestos incrementos en el riesgo de enfermedad cardiovascular. Así, la glucemia basal alterada tuvo un riesgo relativo (RR) de 1,20 (IC del 95%, 1,12-1,28) para valores entre 110-125 mg/dl y de 1,18 (IC del 95%, 1,09-2,10) entre 100 y 125 mg/dl, y la intolerancia a la glucosa un RR de 1,20 (IC del 95%, 1,07-1,34)117.
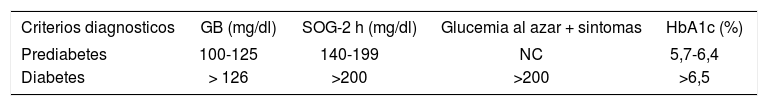
Prueba diagnósticaPrueba recomendada para el cribado y valores para el diagnóstico. Existen varias estrategias para el cribado de la diabetes y de la prediabetes, como el cribado oportunista, mediante la realización de glucemia en poblaciones con mayor riesgo, o los cuestionarios o escalas de riesgo, que permiten identificar subgrupos de población en los que estaría recomendado realizar una glucemia. La prediabetes y la diabetes se diagnostican mediante la medición de la glucemia basal en ayunas, la medición a las 2 h tras SOG o mediante la medición de la HbA1c (tabla 6).
Criterios diagnosticos de prediabetes y diabetes
| Criterios diagnosticos | GB (mg/dl) | SOG-2 h (mg/dl) | Glucemia al azar + sintomas | HbA1c (%) |
|---|---|---|---|---|
| Prediabetes | 100-125 | 140-199 | NC | 5,7-6,4 |
| Diabetes | > 126 | >200 | >200 | >6,5 |
GB: glucemia basal en ayunas; HbA1c: hemoglobina glucosilada; NC: no considerado; SOG-2 h: sobrecarga oral de glucosa a las 2 h. La medicion de la GB a las 2 h tras SOG-2 h con 75 g o HbA1c.
La HbA1c comparada con la glucemia basal proporciona pequeñas mejoras en la predicción del riesgo cardiovascular en pacientes no diagnosticados de diabetes118. Sin embargo, en los pacientes diabéticos, la HbA1c presenta una asociación más fuerte con el riesgo de microangiopatía (retinopatía y nefropatía) y enfermedades cardiovasculares que la media de las glucemias119. Por lo tanto, es una prueba tan útil como la glucemia basal para el diagnóstico y mejor para el control del diabético.
Una revisión sistemática observa que el cribado no reduce la mortalidad en un seguimiento a 10 años, y subraya la necesidad de más estudios que determinen la efectividad del tratamiento de la diabetes detectada por cribado120. Un ensayo clínico reciente (estudio ADDITION) observa que el cribado frente al no cribado no fue superior en la reducción del riesgo de mortalidad total (hazard ratio [HR]: 1,06; IC del 95%, 0,90-1,25), mortalidad cardiovascular (HR: 1,02; IC del 95%, 0,75-1,38) o mortalidad relacionada con la diabetes (HR: 1,26; IC del 95%, 0,75-2,10)121.
Se han publicado evidencias de que el tratamiento (estilo de vida o farmacológico) sobre los estados prediabéticos diagnosticados por cribado se asocia a reducción del riesgo de progresión a diabetes122-129. Pero la evidencia disponible no permite confirmar ni descartar posibles efectos perjudiciales del cribado. Una revisión sistemática no observó reducción en la mortalidad total y cardiovascular en personas tratadas con fármacos tras ser diagnosticadas de prediabetes por cribado130. En una revisión Cochranne131 en el año 2017, no se demuestra que la dieta o el ejercicio físico modifiquen la incidencia de diabetes o sus complicaciones en pacientes con riesgo de desarrollar diabetes.
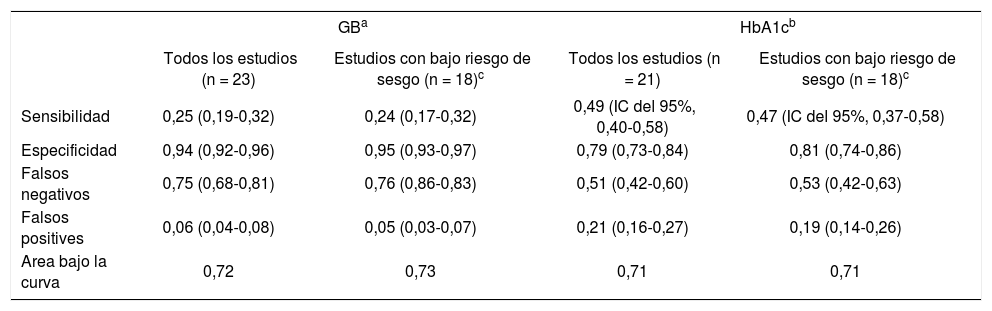
Otra revisión sistemática en el año 2017132, que incluyó 138 estudios, concluye que la HbA1c no tiene suficiente sensibilidad ni especificidad como prueba de cribado y que la glucemia en ayunas es específica pero poco sensible. Las diferentes pruebas empleadas en el cribado identifican poblaciones muy diferentes y sus indicadores de validez no son buenos, por lo que muchas personas estarán innecesariamente tratadas o falsamente despreocupadas, dependiendo de la prueba empleada (tabla 7). La prevalencia de prediabetes fue del 27% con criterios OMS y del 54% con criterios de la American Diabetes Association (ADA), con gran variabilidad según la prueba empleada, fuera la glucemia basal, la SOG o la HbA1c.
Validez de las pruebas de cribado en diabetes tipo 2
| GBa | HbA1cb | |||
|---|---|---|---|---|
| Todos los estudios (n = 23) | Estudios con bajo riesgo de sesgo (n = 18)c | Todos los estudios (n = 21) | Estudios con bajo riesgo de sesgo (n = 18)c | |
| Sensibilidad | 0,25 (0,19-0,32) | 0,24 (0,17-0,32) | 0,49 (IC del 95%, 0,40-0,58) | 0,47 (IC del 95%, 0,37-0,58) |
| Especificidad | 0,94 (0,92-0,96) | 0,95 (0,93-0,97) | 0,79 (0,73-0,84) | 0,81 (0,74-0,86) |
| Falsos negativos | 0,75 (0,68-0,81) | 0,76 (0,86-0,83) | 0,51 (0,42-0,60) | 0,53 (0,42-0,63) |
| Falsos positives | 0,06 (0,04-0,08) | 0,05 (0,03-0,07) | 0,21 (0,16-0,27) | 0,19 (0,14-0,26) |
| Area bajo la curva | 0,72 | 0,73 | 0,71 | 0,71 |
GB: glucemia basal; HbA1c: hemoglobina glucosilada; IC: intervalo de confianza.
Este metaanálisis pone en duda la validez de las políticas de “cribar y tratar” en diabetes. Con estas evidencias no podemos seguir recomendando el cribado de diabetes tipo 2 salvo en pacientes con factores de riesgo asociados y con antecedentes familiares de diabetes, y realizar la prueba de cribado aprovechando otra analítica.
Periodicidad recomendadaLa periodicidad de la determinación de la glucemia basal en la persona no diabética no tiene evidencias para establecer una recomendación. Sin embargo, la glucemia suele añadirse habitualmente en el contexto de la detección o seguimiento de otros factores de riesgo cardiovascular. El test FINDRISC permite evitar la glucemia, salvo que la puntuación sea ≥ 15 puntos (estudio DE-PLAN)133, 134.
Medidas de educación sanitaria o intervenciones no farmacológicasUna intervención dirigida a promover tras el cribado el abordaje multifactorial temprano intensivo en pacientes con diabetes tipo 2 se asoció con una pequeña, pero no significativa, reducción en la incidencia de episodios cardiovasculares y muerte135. Las intervenciones en estilo de vida basadas en alcanzar y mantener un 7% de pérdida de peso y en realizar 150 o más minutos por semana de actividad física moderada-intensa136 y, en menor medida, la metformina producen pérdida de peso y previenen o retrasan la incidencia de diabetes137. También, la educación individual en pacientes con diabetes tipo 2 reduce la HbA1C138, pero sin evidencias de reducción de la enfermedad cardiovascular. Por otro lado, las intervenciones pueden perder efectividad con el tiempo. En un metaanálisis139, la intervención dietética y de ejercicio produjo reducciones de HbA1c a los 3 y 6 meses, pero no a los 12 y 24 meses.
Existe una calidad moderada-alta de la evidencia en la recomendación de modificación de estilos de vida (dieta y/o ejercicio) a las personas con diabetes.
Tratamiento farmacológicoExisten ciertas incertidumbres sobre la eficacia y seguridad cardiovascular de los fármacos antidiabéticos, así como sobre la idoneidad de un tratamiento intensivo. Tras los buenos resultados con el UKPDS y el STENO-2 y los decepcionantes resultados de los estudios RECORD, PROactive,
ACCORD, ADVANCE y VADT, desde el año 2008 la Food and Drug Administration (FDA) y la European Medicines Agency (EMA) exigen estudios de seguridad cardiovascular para los nuevos fármacos hipoglucemiantes.
Eficacia y seguridad de los nuevos fármacosLos estudios con inhibidores de la dipeptidil peptidasa 4 (iDPP4) (SAVOR-TIMI, TECOS y EXAMINE) muestran una no inferioridad frente a placebo en seguridad cardiovascular, si bien en el SAVOR-TIMI se observó un aumento de la hospitalización por insuficiencia cardíaca.
Tras los estudios EMPA-REG y CANVAS, un metaanálisis140 reciente observa que en conjunto los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) reducen la mortalidad por cualquier causa (HR: 0,70; IC del 95%, 0,59-0,83), la mortalidad cardiovascular (HR: 0,43; IC del 95%, 0,36-0,53) y la tasa de infartos de miocardio (HR: 0,77; IC del 95%, 0,63-0,94), pero no la de ictus (HR: 1,09; IC del 95%, 0,86-1,38).
Tras los estudios LEADER, SUSTAIN y EXSCEL, un metaanálisis141 muestra que las terapias basadas en incretinas (iDPP4 y agonistas del receptor del péptido similar al glucagón tipo 1 [arGLP1]) no incrementan el riesgo de eventos cardiovasculares, y deja claro que específicamente la liraglutida sí lo reduce significativamente. Otro metaanálisis142 sobre eficacia cardiovascular de los arGLP1 evidencia reducciones significativas en mortalidad por cualquier causa (HR: 0,88; IC del 95%, 0,79-0,97), mortalidad cardiovascular (HR: 0,84; IC del 95%, 0,74-0,96) e infarto de miocardio (HR: 0,90; IC del 95%, 0,80-1,00). No se observa beneficio en ictus (HR: 0,89; IC del 95%, 0,76-1,04) ni en insuficiencia cardíaca (HR: 0,92; IC del 95%, 0,81-1,06).
Intervención intensiva sobre la glucemiaEn relación con los posibles beneficios cardiovasculares tras control glucémico intensivo, distintos metaanálisis observaron que el control intensivo de la glucemia (HbA1c < 7%) redujo el riesgo de eventos cardiovasculares en un 9% (HR: 0,91; IC del 95%, 0,84-0,99), fundamentalmente gracias a la reducción del 15% en el riesgo de infarto de miocardio, y no se observó disminución ni de la mortalidad total ni de la cardiovascular143, 144. Otros metaanálisis145, 146 subrayan que el control glucémico intensivo no solo no se asocia a reducción de mortalidad, sino que conlleva un incremento de hipoglucemias graves (RR: 2,39; IC del 95%, 1,71-3,34). Un metaanálisis más reciente147 concluye que frente al tratamiento estándar, el tratamiento intensivo reduce el riesgo de infarto de miocardio no fatal (RR: 0,90; IC del 95%, 0,83-0,96), pero no el de ictus no fatal (RR: 0,96; IC del 95%, 0,86-1,07), el de mortalidad cardiovascular (RR: 1,00; IC del 95%, 0,90-1,11) o el de mortalidad por cualquier causa (RR: 0,72; IC del 95%, 0,46-1,14). Un control intensivo de la diabetes puede estar justificado en pacientes con retinopatía o microalbuminuria.
Un reciente estudio poblacional realizado en España muestra que el control intensivo en personas ancianas (≥ 75 años) incrementa el riesgo de hipoglucemias148.
Intervenciones multifactorialsRespecto a la eficacia de una intervención multifactorial, los estudios UKPDS y STENO-2 mostraron la importancia del control de todos los factores de riesgo cardiovascular. En un metaanálisis, las intervenciones multifactoriales frente al control estándar mostraron una reducción del ictus no fatal (RR: 0,53; IC del 95%, 0,32-0,87), pero no de infarto de miocardio no fatal (RR: 0,66; IC del 95%, 0,38-1,03), de mortalidad cardiovascular (RR: 0,72; IC del 95%, 0,46-1,14) o de mortalidad por cualquier causa (RR: 0,82; IC del 95%, 0,64-1,05).
Estrategias terapéuticasSegún las guías de práctica clínica más relevantes, en general se recomienda un tratamiento escalonado que empieza por metformina, y va incorporando más fármacos orales (sulfonilureas, glitazonas, iDPP4 o iSGLT2) o inyectables (insulinas o arGLP1) si persiste el mal control.
Asimismo, se proponen algoritmos adaptados a perfiles de pacientes con diabetes mellitus tipo 2 si coexiste ERC, obesidad o enfermedad cardiovascular. En líneas generales, se debe observar un objetivo de control menos estricto en pacientes ancianos o con comorbilidades asociadas o con pobre calidad de vida, entendiendo por un control estándar una HbA1c del 7-8%. En pacientes con ERC se deben evitar fármacos contraindicados; en pacientes con obesidad se deben contemplar fármacos que ayuden a perder peso, y en pacientes con enfermedad cardiovascular se deben priorizar fármacos que reduzcan la morbimortalidad cardiovascular.
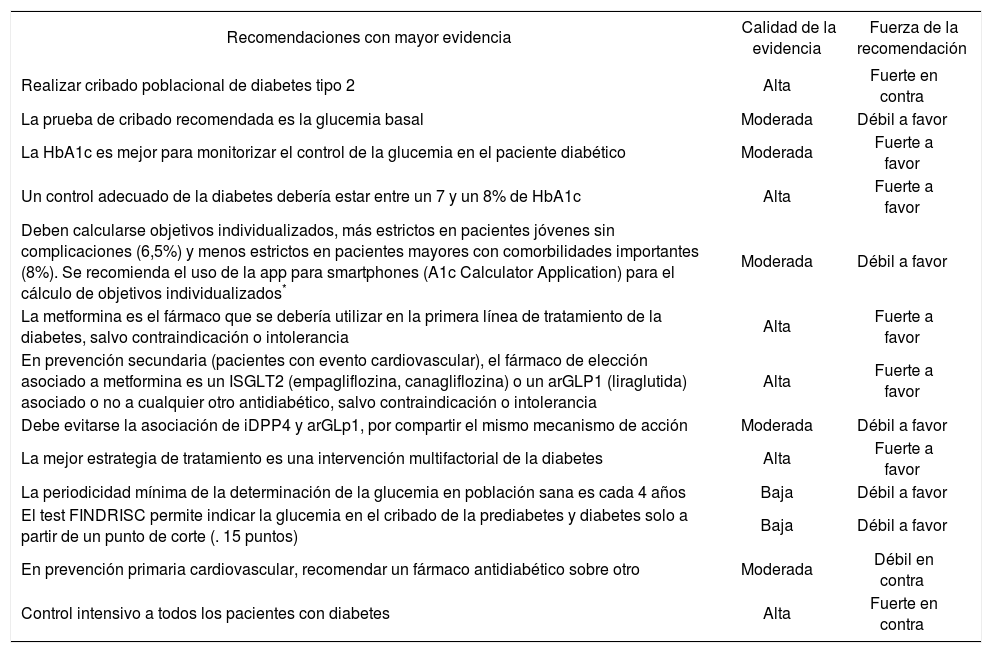
Recomendaciones en diabetes tipo 2| Recomendaciones con mayor evidencia | Calidad de la evidencia | Fuerza de la recomendación |
|---|---|---|
| Realizar cribado poblacional de diabetes tipo 2 | Alta | Fuerte en contra |
| La prueba de cribado recomendada es la glucemia basal | Moderada | Débil a favor |
| La HbA1c es mejor para monitorizar el control de la glucemia en el paciente diabético | Moderada | Fuerte a favor |
| Un control adecuado de la diabetes debería estar entre un 7 y un 8% de HbA1c | Alta | Fuerte a favor |
| Deben calcularse objetivos individualizados, más estrictos en pacientes jóvenes sin complicaciones (6,5%) y menos estrictos en pacientes mayores con comorbilidades importantes (8%). Se recomienda el uso de la app para smartphones (A1c Calculator Application) para el cálculo de objetivos individualizados* | Moderada | Débil a favor |
| La metformina es el fármaco que se debería utilizar en la primera línea de tratamiento de la diabetes, salvo contraindicación o intolerancia | Alta | Fuerte a favor |
| En prevención secundaria (pacientes con evento cardiovascular), el fármaco de elección asociado a metformina es un ISGLT2 (empagliflozina, canagliflozina) o un arGLP1 (liraglutida) asociado o no a cualquier otro antidiabético, salvo contraindicación o intolerancia | Alta | Fuerte a favor |
| Debe evitarse la asociación de iDPP4 y arGLp1, por compartir el mismo mecanismo de acción | Moderada | Débil a favor |
| La mejor estrategia de tratamiento es una intervención multifactorial de la diabetes | Alta | Fuerte a favor |
| La periodicidad mínima de la determinación de la glucemia en población sana es cada 4 años | Baja | Débil a favor |
| El test FINDRISC permite indicar la glucemia en el cribado de la prediabetes y diabetes solo a partir de un punto de corte (. 15 puntos) | Baja | Débil a favor |
| En prevención primaria cardiovascular, recomendar un fármaco antidiabético sobre otro | Moderada | Débil en contra |
| Control intensivo a todos los pacientes con diabetes | Alta | Fuerte en contra |
*Actualmente, ya se dispone de una app para smartphones (A1c Calculator Application), que es gratuita. Disponoble en: https://play.google.com/store/apps/details?id=com.crocodil.software.a1ccalc&hl=es. Se recogerá el valor de normalidad de HbA1c de cada laboratorio clínico para verificar la validez de la medición.
Se ha documentado que la utilización de ácido acetilsalicílico (AAS) en prevención secundaria alcanza un grado de utilización razonablemente alto, alrededor del 94%149, en consonancia con la abundante evidencia existente. Sin embargo, en prevención primaria existen incertidumbres sobre su balance beneficio-riesgo y las recomendaciones de las guías de práctica clínica se han modificado según han ido apareciendo nuevas evidencias, lo que se traduce en mucha heterogeneidad en el uso de AAS en pacientes que no han presentado una enfermedad cardiovascular, incluidos los pacientes de alto riesgo cardiovascular y los pacientes diabéticos. En el estudio EUROASPIRE III en prevención primaria, el tratamiento antiagregante se había prescrito en el 22% de los pacientes de alto riesgo sin enfermedad cardiovascular y en el 28,2% de los diabéticos150.
Los antiagregantes por vía oral actualmente disponibles en España son los siguientes: los inhibidores de la síntesis de tromboxano: AAS (el más utilizado) y el trifusal; inhibidores de la fosfodiesteresa: dipiridamol, y los inhibidores de la activación plaquetaria mediada por ADP (inhibidores del receptor P2Y12) ticlopidina, clopidogrel, prasugrel, ticagrelor.
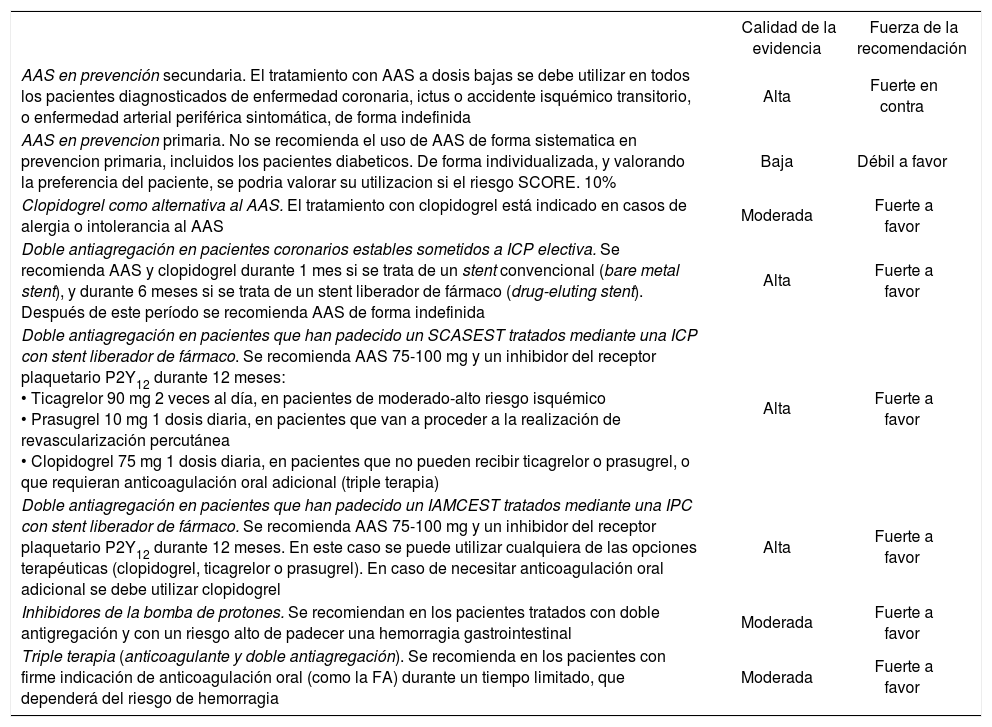
Revisión de la evidenciaPrevención secundariaEl tratamiento antiagregante con AAS a una dosis de entre 75 y 150 mg/día en pacientes con enfermedad cardiovascular previa (prevención secundaria) produce una reducción significativa de todos los episodios vasculares mayores y de la mortalidad cardiovascular y total151. En pacientes con alergia o intolerancia al AAS, el clopidogrel es la alternativa de elección152.
En el caso específico de la prevención de la recurrencia del ictus, se puede recomendar como primera línea de tratamiento tanto AAS 50-300 mg como clopidogrel 75 mg, trifusal 300 mg o la combinación AAS (25 mg)/dipiridamol (200 mg en liberación retardada), 2 veces al día (en España solo está comercializado dipiridamol de liberación rápi-da)153.
Prevención primariaSe han publicado diferentes metaanálisis en prevención primaria de la enfermedad cardiovascular. Baigent et al154 mostraron una reducción relativa de un 12% de todos los eventos cardiovasculares (AAS 0,51% frente a control 0,57% por año; p = 0, 0001), que se debió, en su mayoría, a una reducción relativa de un 23% para el infarto de miocardio no fatal (AAS 0,18% frente a control 0,23% por año; p < 0,0001). De Berardis et al155 analizaron los resultados según el sexo, y observaron que el AAS reduce significativamente el riesgo de infarto de miocardio en varones en un 43%, sin encontrar diferencias en mujeres, mientras que el AAS reducía el riesgo de ictus en mujeres en un 25% de una manera significativa, sin encontrar diferencias en varones.
No hay evidencia de que el AAS reduzca significativamente la mortalidad por enfermedad cardiovascular ni la mortalidad total, aunque, en un metaanálisis, la reducción observada alcanzó el límite de la significación (RR: 0,94; IC del 95%, 0,88-1,00; p = 0,05)156.
HemorragiasEn el metaanálisis de Baigent et al se observó un aumento significativo de riesgo de hemorragia mayor extracraneal con AAS (RR: 1,54; IC del 95%, 1,30-1,82; p < 0,0001), en su mayoría no fatal154. Respecto a los otros metaanálisis, uno de ellos mostró aumento significativo del riesgo de ictus hemorrágico (RR: 1,36; IC del 95%, 1,01-1,82; p = 0,04), hemorragia mayor (RR: 1,66; IC del 95%, 1,41-1,95; p < 0,00001) y hemorragia gastrointestinal (RR: 1,37; IC del 95%, 1,151,62; p = 0,0003)156, mientras que otro mostró el mismo incremento de riesgo, tanto para el ictus hemorrágico como para la hemorragia mayor157. El metaanálisis de Seshasai et al158 mostró un exceso de riesgo del 70% del total de las hemorragias y del 30% de las hemorragias no menores.
ácido acetilsalicílico y diabetesPrevención de eventos isquémicos. Ninguno de los 5 metaanálisis que se centraban en pacientes diabéticos156,159-162 mostró un efecto protector significativo del AAS en la prevención de eventos cardiovasculares. Todos los resultados favorecían al AAS (sin alcanzar significación estadística) y, en el metaanálisis de Butalia et al, la reducción de eventos resultó en el límite de la significación (p = 0,05)159.
Hemorragias. Stavrakis et al160 mostraron un aumento del riesgo de hemorragias mayores con AAS cuando utilizaban un estimador agrupado de efectos fijos (RR: 2,51; IC del 95%, 1,11-5,70; p = 0,028); sin embargo, no se encontraron diferencias entre ambos grupos cuando el estimador era de efectos aleatorios (RR: 3,02; IC del 95%, 0,48-18-86; p = 0,24)160. Del resto de metaanálisis, aun observando una tendencia a mayores hemorragias en el grupo con AAS, ninguno de ellos resultó estadísticamente significativo 155,159,161,162
Un análisis de subgrupos post hoc del estudio Hypertension Optimal Treatment (HOT)163 mostró que el beneficio del AAS era mayor en pacientes con hipertensión y ERC, con un aumento progresivo del beneficio en la reducción de los eventos cardiovasculares y la mortalidad total en los pacientes con un filtrado glomerular ≤ 45 ml/min/1,73 m2 164.
Un metaanálisis165 sobre el uso de antiagregantes en pacientes con ERC analizó el efecto del AAS en el contexto de un síndrome coronario agudo y también en pacientes con enfermedad coronaria estable o pacientes de alto riesgo. Concretamente, en este último grupo se observó una reducción significativa del infarto de miocardio fatal o no fatal, no así en el ictus o en la mortalidad cardiovascular o por todas las causas, con un aumento de las hemorragias menores. Los resultados fueron inciertos por la baja calidad de los estudios incluidos.
Pacientes tratados mediante revascularización coronaria Respecto a la doble antiagregación tras una revascularización coronaria, la estrategia a seguir dependerá del contexto clínico, de la urgencia y del tipo de intervención (intervención coronaria percutánea [ICP] o cirugía de bypass), así como del tipo de stent implantado en su caso166, 167. El stent metálico, sin embargo, es el dispositivo de elección, independientemente de la duración prevista para la doble antiagregación.
Pacientes coronarios estables tratados mediante una intervención coronaria percutánea electiva. Se recomiendan 6 meses de doble antiagregación con AAS y clopidogrel, independientemente del tipo de stent metálico implantado. El AAS se recomienda como tratamiento de por vida.
Pacientes que han padecido un síndrome coronario agudo sin elevación del ST (SCASEST) tratados mediante una intervención coronaria percutánea. Se recomienda doble antiagregación durante 1 año con AAS 75-100 mg más un inhibidor del receptor plaquetario P2Y12, siempre y cuando no exista una contraindicación formal (p. ej., exceso de riesgo de hemorragia).
Se recomienda ticagrelor 90 mg, 2 veces al día, en pacientes con un moderado o alto riesgo isquémico (como haber tenido elevación de troponinas), independientemente del tratamiento inicial. Se recomienda prasugrel 10 mg, 1 dosis diaria, en los pacientes con anatomía coronaria conocida tratados con ICP. Se recomienda clopidogrel 75 mg diarios en los pacientes que no pueden recibir ticagrelor o prasugrel, o que requieran adicionalmente anticoagulación oral (triple terapia).
Pacientes que han padecido un infarto agudo de miocardio con elevación del ST (IAMCEST) tratados mediante una intervención coronaria percutánea168,169. Doble antiagregación durante 1 año con AAS 75-100 mg más un inhibidor del receptor plaquetario P2Y12, siempre y cuando no exista una contraindicación formal (p. ej., exceso de riego de hemorragia). Se puede utilizar cualquiera de estas opciones terapéuticas: clopidogrel, ticagrelor o prasugrel.
Un metaanálisis que comparó los resultados de los pacientes que recibieron doble antiagregación durante < 12 meses, 12 meses exactos o más de 12 meses170 mostró que los pacientes que discontinuaban antes de los 12 meses después de una ICP con stent liberador de fármacos tenían significativamente menos riesgo de hemorragia sin un mayor riesgo de eventos isquémicos que los que alcanzaban 12 o más meses. Por contra, los pacientes que seguían un tratamiento con doble antiagregación más de 12 meses observaron una reducción de las complicaciones isquémicas, especialmente la trombosis del stent y la incidencia de nuevos infartos; sin embargo, aumentaban las complicaciones hemorrágicas con riesgo de muerte.
Pacientes con revascularización miocárdica mediante cirugía (bypass coronario). Se recomienda el AAS a dosis baja de forma indefinida, o el clopidogrel en caso de intolerancia al AAS, en los casos de cardiopatía isquémica estable.
Por el contrario, en los pacientes con SCA, la doble antiagregación ha probado su eficacia en reducir el riesgo isquémico con independencia de la forma de revascularización.
La doble antiagregación en los pacientes con enfermedad cardiovascular crónica y estable, ya sea coronaria o de otra localización, no es más eficaz que el AAS solo en la reducción de nuevos episodios cardiovasculares171.
Utilización de los inhibidores de la bomba de protones. Se recomienda la utilización de inhibidores de la bomba de protones a todos los pacientes con doble antiagregación.
Pacientes con diagnóstico de fibrilación auricular y enfermedad coronaria estable23Pacientes con un CHA2DS2-VASc > 2 y un riesgo bajo de hemorragia (HAS-BLED < 2). Implantación de stent no farmacoactivo: doble antiagregación y un anticoagulante oral (triple terapia), durante 1 mes, seguido de doble terapia con un anticoagulante oral y un antiagregante (AAS o clopidogrel) durante 1 año. Después un anticoagulante oral de por vida.
Implantación de stent farmacoactivo. Doble antiagregación y un anticoagulante oral (triple terapia) de 3 a 6 meses, dependiendo del tipo de stent, seguido de doble terapia con un anticoagulante oral y un antiagregante (AAS o clopidogrel) durante 1 año. Después un anticoagulante oral de por vida.
Pacientes con un CHA2DS2-VASc > 2 y un riesgo alto de hemorragia (HAS-BLED > 3). Se recomienda colocar un stent no farmacoactivo y triple terapia de 2-4 semanas, y después solo anticoagulante de por vida.
Pacientes con diagnóstico de fibrilación auricular y síndrome coronario agudoEn los pacientes con un HAS-BLED ≤ 2 se debe considerar la triple terapia durante 6 meses, seguida de un anticoagulante oral más AAS o clopidogrel hasta 12 meses.
En los pacientes con un HAS-BLED ≥ 3 se debe considerar la triple terapia durante 1 mes, seguida de AAS o clopidogrel y un anticoagulante oral.
Recomendaciones en tratamiento antiagregante| Calidad de la evidencia | Fuerza de la recomendación | |
|---|---|---|
| AAS en prevención secundaria. El tratamiento con AAS a dosis bajas se debe utilizar en todos los pacientes diagnosticados de enfermedad coronaria, ictus o accidente isquémico transitorio, o enfermedad arterial periférica sintomática, de forma indefinida | Alta | Fuerte en contra |
| AAS en prevencion primaria. No se recomienda el uso de AAS de forma sistematica en prevencion primaria, incluidos los pacientes diabeticos. De forma individualizada, y valorando la preferencia del paciente, se podria valorar su utilizacion si el riesgo SCORE. 10% | Baja | Débil a favor |
| Clopidogrel como alternativa al AAS. El tratamiento con clopidogrel está indicado en casos de alergia o intolerancia al AAS | Moderada | Fuerte a favor |
| Doble antiagregación en pacientes coronarios estables sometidos a ICP electiva. Se recomienda AAS y clopidogrel durante 1 mes si se trata de un stent convencional (bare metal stent), y durante 6 meses si se trata de un stent liberador de fármaco (drug-eluting stent). Después de este período se recomienda AAS de forma indefinida | Alta | Fuerte a favor |
| Doble antiagregación en pacientes que han padecido un SCASEST tratados mediante una ICP con stent liberador de fármaco. Se recomienda AAS 75-100 mg y un inhibidor del receptor plaquetario P2Y12 durante 12 meses: • Ticagrelor 90 mg 2 veces al día, en pacientes de moderado-alto riesgo isquémico • Prasugrel 10 mg 1 dosis diaria, en pacientes que van a proceder a la realización de revascularización percutánea • Clopidogrel 75 mg 1 dosis diaria, en pacientes que no pueden recibir ticagrelor o prasugrel, o que requieran anticoagulación oral adicional (triple terapia) | Alta | Fuerte a favor |
| Doble antiagregación en pacientes que han padecido un IAMCEST tratados mediante una IPC con stent liberador de fármaco. Se recomienda AAS 75-100 mg y un inhibidor del receptor plaquetario P2Y12 durante 12 meses. En este caso se puede utilizar cualquiera de las opciones terapéuticas (clopidogrel, ticagrelor o prasugrel). En caso de necesitar anticoagulación oral adicional se debe utilizar clopidogrel | Alta | Fuerte a favor |
| Inhibidores de la bomba de protones. Se recomiendan en los pacientes tratados con doble antigregación y con un riesgo alto de padecer una hemorragia gastrointestinal | Moderada | Fuerte a favor |
| Triple terapia (anticoagulante y doble antiagregación). Se recomienda en los pacientes con firme indicación de anticoagulación oral (como la FA) durante un tiempo limitado, que dependerá del riesgo de hemorragia | Moderada | Fuerte a favor |
AAS: ácido acetilsalicílico; FA: fibrilación auricular;
IAMCEST: infarto agudo de miocardio con elevación del ST;
ICP: intervención coronaria percutánea; SCASEST: síndrome coronario agudo sin elevación del ST.
Importancia epidemiológica y clínica del problema
La FA afecta al 1-2% de la población general, más cerca del 2% debido al infradiagnóstico y a la cada vez más reconocida fibrilación subclínica172,173. Recientemente se ha estimado, a través de un amplio estudio poblacional de la Sociedad Española de Cardiología174, que un 4,4% de la población española mayor de 40 años presenta FA, lo que supone que más de 1 millón de personas en España padece FA en sus distintas formas clínicas. En muchas ocasiones, la arritmia es silente o episódica y tarda tiempo en diagnosticarse, de modo que en muchos casos se reconoce de forma casual en pacientes asintomáticos o con escasos e inespecíficos síntomas175.
La complicación más grave de la FA es el ictus cardioembólico; sin embargo, los ictus relacionados con la fibrilación son en gran medida potencialmente prevenibles con el tratamiento anticoagulante.
Prueba diagnósticaEl diagnóstico de la FA es electrocardiográfico.Ya que, con raras excepciones, la fibrilación produce un pulso arrítmico, se ha planteado que la toma de pulso periférico podría ser una buena aproximación a su reconocimiento precoz176.
Para el cribado de la FA se han planteado distintas estrategias, de tipo oportunista o de tipo sistemático en población de riesgo (p. ej., mayores de 65 años, el grupo de mayor riesgo de presentar fibrilación y sus complicaciones) a través de la toma de pulso en la consulta, toma de presión por AMPA con dispositivos validados177 (actualmente avalado por el NICE)178 o de la realización de un electrocardiograma (ECG) directamente.
La toma de pulso (y realización de un ECG si este es irregular) es más económica, accesible y no supone ningún riesgo para el paciente ni exige dispositivos adicionales.
La detección de la FA permitiría instaurar tratamiento anticoagulante en los pacientes con riesgo embólico asociado según las recomendaciones de las guías179-181 y, de este modo, reducir las complicaciones tromboembólicas.
13Evidencia científicaDistintos estudios han evaluado el cribado de la FA en población de riesgo, generalmente desde atención primaria que involucra a profesionales de enfermería, médicos de familia o ambos176, 182, 183. El estudio de mayor tamaño y con un diseño apropiado (ensayo clínico multicéntrico por conglomerados, aleatorizado y controlado) fue realizado en Reino Unido en población atendida en 50 centros de atención primaria184. Se distribuyeron aleatoriamente 14.802 pacientes con edad ≥ 65 años a uno de los siguientes 3 brazos: a) grupo control (práctica clínica habitual); b) grupo de intervención mediante cribado oportunista (toma de pulso en consulta aprovechando otros motivos y ECG si el pulso era irregular), y c) cribado sistemático (se citaba mediante carta a los pacientes para realizar un ECG).
La variable principal del estudio fue el número de nuevos casos diagnosticados de fibrilación, y se observaron diferencias significativas entre los grupos de intervención y control, de forma que, cuando se realizaba cualquier cribado, se detectaban más personas con FA que con la práctica clínica habitual (un 64% más). En cambio, no se apreciaron diferencias en la detección de FA nueva entre el cribado sistemático y el oportunista.
La estrategia oportunista mediante toma de pulso permitió detectar similar número de pacientes con FA que el cribado sistemático con ECG, y se sugirió este cribado oportunista como método para incorporar a la práctica clínica en las consultas de atención primaria. Adicionalmente, esta estrategia ha probado ser coste-efectiva: el cribado oportunista anual se asocia a una menor incidencia de ictus isquémicos y a una mayor proporción de casos de fibrilación diagnosticados. El análisis de sensibilidad muestra una probabilidad del 60% de que la detección en mayores de 65 años (frecuencia anual en el modelo) sea rentable, tanto en varones como en mujeres185.
El estudio DOFA, ensayo clínico multicéntrico realizado en atención primaria en España186, sugiere que, en condiciones de práctica real, una búsqueda activa, a través de la palpación del pulso, de FA en pacientes de edad ≥ 65 años con síntomas o signos indicativos es una estrategia más eficaz que el cribado oportunista en pacientes asintomáticos.
En atención primaria se atienden y se siguen (tanto en consulta médica como de enfermería) pacientes con uno o múltiples factores de riesgo cardiovascular, también ligados a una mayor incidencia de FA175. La práctica de la toma del pulso con el objetivo de detectar irregularidad puede ser una práctica con bajo coste y alta rentabilidad clínica176,187. Debe tenerse en cuenta que el uso cada vez mayor de los sistemas oscilométricos para medición de la PA puede suponer una pérdida de oportunidad en la detección si no se toma el pulso adicionalmente.
No existe una evidencia directa de que la toma de pulso tenga un impacto en la reducción de episodios tromboembólicos, pero hay claros indicios de que esto debe ser así: a) la inequívoca relación entre FA e ictus; b) la fibrilación puede permanecer asintomática largo tiempo antes de diagnosticarse; c) en la gran mayoría de los casos, su diagnóstico condiciona la anticoagulación tras evaluar el balance de riesgo embólico frente al riesgo hemorrágico; d) el tratamiento ha demostrado ser muy eficaz para la prevención de ictus y otras embolias sistémicas, y e) la presencia de casos asintomáticos o subclínicos, por ejemplo, en pacientes portadores de ciertos dispositivos capaces de registrar la arritmia ha demostrado asociarse con un aumento de la incidencia de ictus isquémico, similar a la fibrilación clínica173.
Un estudio reciente realizado en Países Bajos, que trata de evaluar si el cribado de FA mediante ECG portátil de una única derivación en personas mayores de 65 años coincidiendo con el período de vacunación de la gripe es coste-efectivo, cocluye que su implantación en atención primaria podría reducir costes y aumentar los años de vida ajustados por calidad187.
Tratamiento farmacológicoEl tratamiento anticoagulante oral puede realizarse con agentes antivitamina K (acenocumarol, warfarina), que tienen indicación en cualquier tipo de FA (valvular o no valvular), o bien con los nuevos anticoagulantes de acción directa (dabigatrán, apixabán, rivaroxabán, edoxabán), que no precisan monitorización y han demostrado una similar eficacia a los agentes antivitamina K con menos complicaciones hemorrágicas graves, como la hemorragia intracraneal188. Estos agentes no están indicados en la FA valvular179-181.
La indicación del tratamiento anticoagulante se realiza sobre la base del riesgo embólico del paciente (estimado mediante escalas apropiadas como CHA2DS2-VASc Score cuando ≥ 2), cuando se estima que este es superior al riesgo de hemorragia inherente a la propia anticoagulación.
Otras recomendacionesLa European Society of Cardiology179 y la AHA/American Stroke Association181 recomiendan el cribado oportunista mediante la toma de pulso en población de riesgo (mayores de 65 años, mujeres mayores de 75 años), con un grado de recomendación I-B.
Una revisión Cochrane publicada en 2016189 sigue reconociendo la eficacia del cribado para el diagnóstico precoz de FA, aunque sugiere la necesidad de futuras investigaciones para evaluar el impacto sobre los resultados clínicos, así como nuevos posibles métodos de cribado.
En octubre de 2017 se publicó un documento de consenso de la European Heart Rhythm Association (EHRA), en el que participaron la Heart Rhythm Society (HRS), la Asia Pacific Heart Rhythm Society (APHRS) y la Sociedad Latinoamericana de Estimulación Cardíaca y Electrofisiología (SOLAECE)190. En dicho documento se establece la recomendación de cribado oportunista con toma de pulso a mayores de 65 años y plantea que se podría considerar el cribado sistemático con ECG a mayores de 75 años o personas con factores de riesgo de accidente cerebrovascular agudo.
ConclusionesAunque la evidencia científica es limitada y no está documentada una relación directa entre la toma de pulso en población de riesgo y una reducción de los episodios tromboembólicos o mortalidad, parece plausible que una mayor detección de la FA conllevara un beneficio clínico significativo a medio y largo plazo. La toma de pulso está incluida en cualquier examen clínico básico, tanto en la atención primaria como en el ámbito hospitalario. Por tanto, no parece probable atribuir costes adicionales a lo que se debería hacer de forma rutinaria en situaciones muy comunes en la práctica clínica ordinaria.
A pesar de estar basadas en un único y amplio estudio (y una revisión Cochrane que lo incluye), las guías de práctica clínica actualmente vigentes5 recomiendan el cribado de la FA por su bajo coste y potencial beneficio clínico debido a la magnitud del problema (alta prevalencia y esta va en aumento) y de sus consecuencias (ictus como primera causa de muerte en la mujer, segunda en el varón, alta discapacidad asociada en los supervivientes, costes hospitalarios y sociosanitarios elevados) y sus bien documentadas posibilidades de prevención mediante la anticoagulación oral.
Recomendaciones sobre el cribado de la fibrilación auricularConflicto de interesesLos autores declaran no tener ningún conflicto de intereses.