en que fracasa la pleurodesis, se debe de considerar la inserción de catéter endopleural.
Introducción
La disnea es muy común en pacientes oncológicos y con frecuencia está infratratada. Es un síntoma discapacitante en pacientes con un deterioro general de la calidad de vida. The American Thoracic Society define la disnea como «una experiencia subjetiva de molestia para respirar que consiste en sensaciones cualitativamente distintas que varían en intensidad»1.
La prevalencia varía con la localización del tumor primario, el estadio de la enfermedad y otros factores. Según los estudios publicados a este respecto, varía de un 19 a un 64% en pacientes con neoplasias de diferentes orígenes2. En un estudio realizado por el Equipo de Cuidados Paliativos de Badajoz, hasta un 56% de los enfermos incluidos manifestaron este síntoma durante la enfermedad3. Asimismo, aumenta a medida que avanza la enfermedad. Conill et al4 encontraron que la disnea ocurría hasta en el 39,8% de los pacientes oncológicos en el momento del diagnóstico y llegaba al 46,6% en la última semana de vida.
La disnea se ha incluido entre los factores en los modelos de predicción diagnóstica diseñados por Pirovano et al5. En un estudio llevado a cabo con 195 pacientes incluidos por el Equipo de Cuidados Paliativos de Badajoz, la estancia media en programa fue de 42 días, mientras que el tiempo desde que aparecía la disnea hasta la muerte era de 20-24 días. Asimismo, la disnea fue la causa más frecuente de sedación en nuestra población (37%)6.
Fisiopatología y etiología
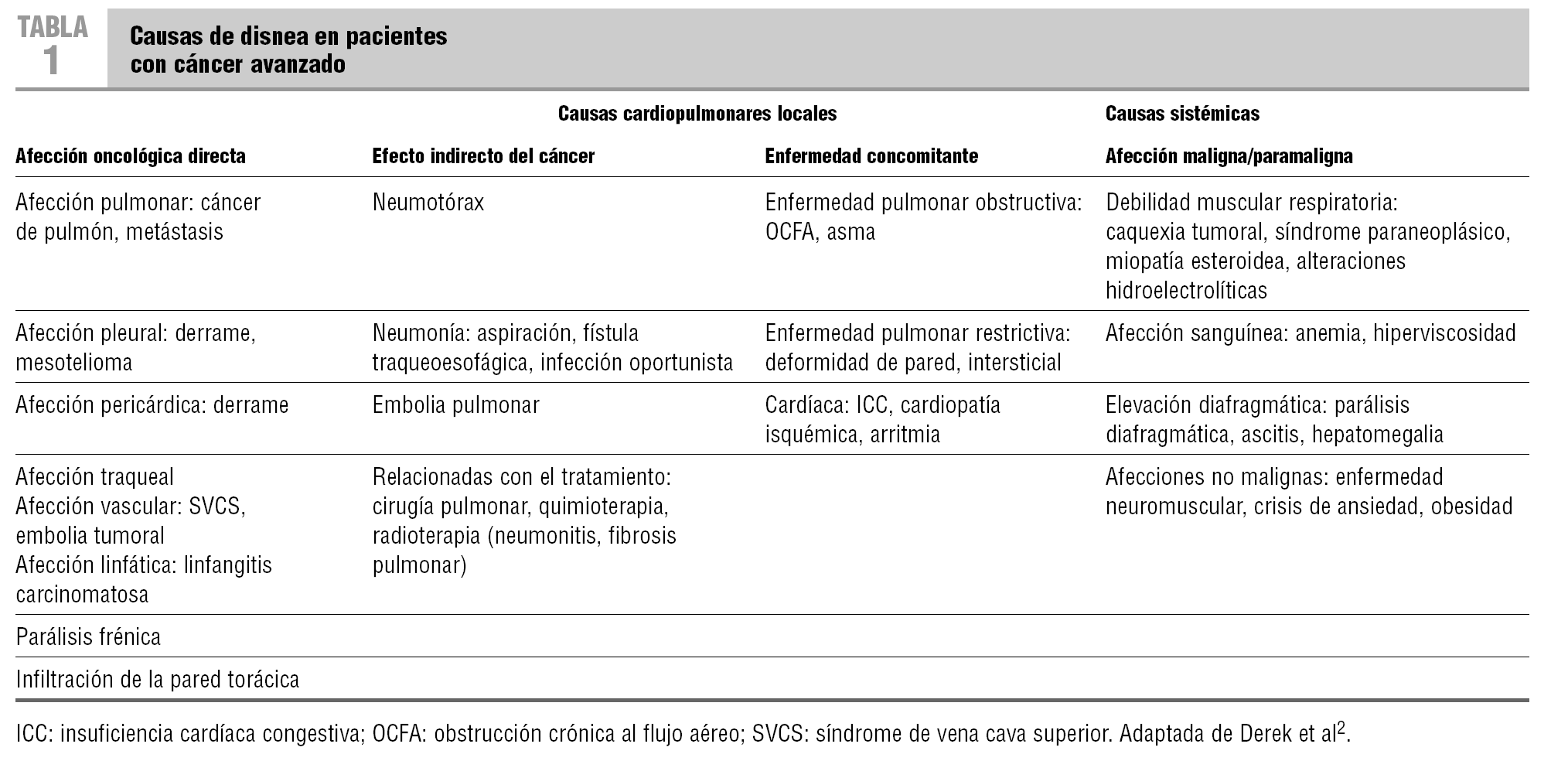
Las posibles causas de disnea se recogen en la tabla 1, adaptada de Derek et al2.
Intentar identificar la causa subyacente de la disnea guía su abordaje terapéutico, siempre teniendo en cuenta el estado general del paciente. La mayoría de los estudios han puesto de manifiesto más de una causa que justifique la disnea7. En un estudio retrospectivo6 sobre 195 enfermos en situación terminal, llevado a cabo en el Área de Salud de Badajoz, se observó que en el 82% de los pacientes con disnea se había registrado al menos 2 causas relacionadas.
Evaluación multidimensional de la disnea
Como en cualquier otro síntoma, en el paciente con disnea, la aproximación diagnóstica comprende una serie de aspectos:
Identificar las causas subyacentes, incluidos los síndromes específicos, mediante una historia clínica detallada, el examen físico y las pruebas complementarias dirigidas (pulsioximetría, gasometría arterial, radiografía de tórax, tomografía computarizada [TC] de tórax, hemograma, bioquímica).
Evaluación cualitativa y cuantitativa del síntoma.
En este apartado nos centraremos en el segundo punto: sabido es que una buena medida de la disnea sigue siendo un reto para los profesionales que atienden a enfermos terminales.
La disnea es un síntoma complejo que no tiene una relación constante con los parámetros funcionales respiratorios8. Al igual que ocurre en otros síntomas de enfermos oncológicos, la disnea es multidimensional, y el objetivo de las diferentes escalas utilizadas es poder medir todos los componentes que influyen en el síntoma. Una escala ideal, según Kirkova et al9, habría de reunir una serie de características. Existen diferentes tipos de escalas:
Escalas de diferentes síntomas que incluyen la disnea
La más utilizada es la ESAS (Edmonton Symptom Assesment System) que evalúa 9 síntomas. Se la puede aplicar el paciente, con ayuda, o los profesionales sanitarios. Es una escala numérica, en la que para cada síntoma hay una gradación del 0 (lo peor) al 10 (lo mejor), y se correlaciona muy bien con la escala visual analógica10 (EVA).
Escalas más frecuentemente utilizadas para medir sólo el síntoma disnea
EVA. Se trata de una línea horizontal o vertical, comúnmente de 100 mm de longitud, en cuyos extremos se sitúan: «Ausencia de disnea» y «La peor disnea que pueda imaginar».
VRS (Verbal Scale Rating). Mide la intensidad como: ninguna, ligera, moderada o severa, y su aplicación es más fácil en la mayoría de las ocasiones.
Cancer Dyspnea Scale (CDS). Se la ha validado recientemente para el cáncer de pulmón11. Es una escala autoaplicable que a través de 12 ítems valora la respuesta al esfuerzo, la ansiedad y el malestar.
Tratamiento sintomático de la disnea en el paciente oncológico
Amén de actuar contra los factores etiológicos y los desencadenantes y abordar específicamente las causas tratables, hemos de intentar mitigar el síntoma disnea del paciente oncológico. En este apartado describiremos cómo participan: a) el tratamiento farmacológico, centrándonos en los opioides; b) la oxigenoterapia, y c) las intervenciones no farmacológicas.
Tratamiento farmacológico
Opiáceos
Una revisión sistemática reciente examinó la efectividad de los opiáceos orales y parenterales para el manejo de la disnea12. Los autores identificaron 18 ensayos clínicos aleatorizados y a doble ciego que comparaban el uso de cualquier opiáceo y placebo para el tratamiento de la disnea en pacientes con enfermedad terminal (sólo 2 estudios llevados a cabo con pacientes oncológicos reunieron los criterios de inclusión para la revisión, uno con aplicación parenteral y otro, nebulizada). Esta revisión apoyaba el uso continuado de opiáceos orales y parenterales para el tratamiento de la disnea en pacientes con enfermedad avanzada. De los datos aportados por el metaanálisis no se podía concluir que los opiáceos por vía nebulizada fueran más efectivos que el suero salino nebulizado.
En 3 ensayos clínicos efectuados en pacientes con cáncer, uno abierto no controlado13 y 2 ensayos cruzados con controles frente a placebo14,15, la disnea mejoró significativamente después de una dosis única de morfina parenteral.
Allard et al16, estudiaron la efectividad de dosis suplementarias de opiáceos para mejorar la disnea, en pacientes terminales que estaban recibiendo ya dosis estables de opiáceos. Encontraron que el efecto era tan beneficioso cuando la dosis de rescate era del 25% como cuando era del 50% de la dosis oral o subcutánea de morfina administrada cada 4 h.
Navigante et al17 demostraron que el efecto beneficioso de la morfina en controlar la disnea basal podría mejorar agregando midazolam al tratamiento.
En los últimos meses estamos asistiendo a series de casos en que los autores describen la efectividad del citrato oral transmucoso de fentanilo para el control de las crisis de disnea en pacientes con cáncer en fase avanzada18.
Otros fármacos
El uso de benzodiacepinas se ha estudiado escasamente en el contexto de los pacientes con cáncer en situación terminal, pese a que se ha venido utilizándolas excesivamente para el manejo de la disnea19. A excepción del trabajo comentado anteriormente de Navigante et al, y en combinación con morfina, es difícil encontrar algún trabajo publicado que justifique el tratamiento de la disnea con benzodiacepinas, si no concurre un componente de ansiedad importante.
Sí hay cierta evidencia de que la clorpromazina disminuye la disnea sin afectar a la ventilación o producir sedación en voluntarios sanos20. En un ensayo clínico abierto, McIver et al21 demostraron que la clorpromazina mejoraba la disnea en pacientes con cáncer avanzado.
Oxigenoterapia
La oxigenoterapia se utiliza frecuentemente para el control de la disnea en pacientes oncológicos. Los suplementos de oxígeno, sin embargo, no deben ser la panacea para todos los pacientes con disnea, aunque es cierto que en muchas ocasiones los propios pacientes son quienes lo solicitan a los profesionales sanitarios22.
Muchos pacientes no experimentan mejoría con la oxigenoterapia; incluso, algunos pacientes hipoxémicos no encuentran alivio del síntoma a pesar de revertirse la hipoxemia arterial. Por otro lado y sorprendentemente, algunos enfermos normoxémicos se benefician de los suplementos de oxígeno23.
Aunque hay pocos estudios al respecto, resumimos las dos modalidades de oxigenoterapia utilizadas en los enfermos que nos ocupan.
Short-burst oxygen therapy (SBOT). Oxigenoterapia intermitente para el alivio de la disnea en reposo, antes del ejercicio o tras la recuperación después de un ejercicio. Tres estudios controlados han examinado el efecto paliativo del oxígeno en pacientes oncológicos en reposo24-26. Los estudios llevados a cabo por Bruera et al se centraban en pacientes hipoxémicos y revelaron beneficios con los suplementos de oxígeno. Booth et al también encontraron mejoría, pero su respuesta era similar a la de la utilización de aire.
Oxigenoterapia ambulatoria (durante el ejercicio o realización de las actividades básicas de la vida diaria). El ensayo clínico dirigido a pacientes no hipoxémicos realizado por Bruera et al27 no ha podido demostrar ningún efecto beneficioso del oxígeno en la disnea respecto al aire solo. Sin embargo, Ahmedzai et al28 encontraron que una mezcla del 72% de helio y del 28% de oxígeno se traducía en una disminución, estadísticamente significativa respecto al aire, de la disnea en pacientes con cáncer de pulmón.
Como guía práctica, parece razonable prescribir oxigenoterapia en pacientes con disnea y saturaciones de oxígeno basales < 90%2. En los demás casos habrá que individualizar su utilización.
Intervenciones no farmacológicas
Para poder abordar la disnea con intervenciones no farmacológicas, hay que partir de la base de la multidimensionalidad de este síntoma. Su aplicación en la práctica diaria requiere un cambio en el modelo de cuidados, desde el tradicional, centrado en intervenciones farmacoterapéuticas, al modelo biopsicosocial, necesario para el control sintomático en el contexto de cuidados paliativos.
Es fundamental documentar los factores que desencadenan la disnea, incluidas las actividades físicas y factores ambientales o emocionales. El resumen de este tipo de intervenciones se recoge en la tabla 2, adaptada de Carrie Kohlman29, donde se apuntan los objetivos, así como las estrategias adecuadas.
Derrame pleural en el paciente oncológico terminal
Aproximadamente en la mitad de los pacientes con cáncer metastático se produce una acumulación de líquido en el espacio pleural como consecuencia de su enfermedad. La mayoría de estos derrames se produce por siembra pleural directa o por la invasión tumoral en los ganglios mediastínicos30.
En la mayoría de los estudios, el cáncer de pulmón es la neoplasia que con más frecuencia motiva un derrame pleural (aproximadamente en un tercio de los casos); le siguen los tumores de mama y los linfomas. Los que menos frecuentemente tienen relación con derrame pleural son los tumores de ovario y los gastrointestinales. En un 5-10% de los casos de derrame pleural, el tumor primario es de origen desconocido31.
Un tumor puede causar derrame pleural de forma directa (en respuesta a la invasión tumoral de la pleura, se produce una serie de fenómenos inflamatorios locales que aumentan la permeabilidad capilar y causan el derrame) o indirecta (alteración del sistema linfático entre la pleura parietal y la mediastínica)32.
Se cree que el factor de crecimiento vascular endotelial está implicado en la producción del derrame pleural y en el crecimiento local del tumor33.
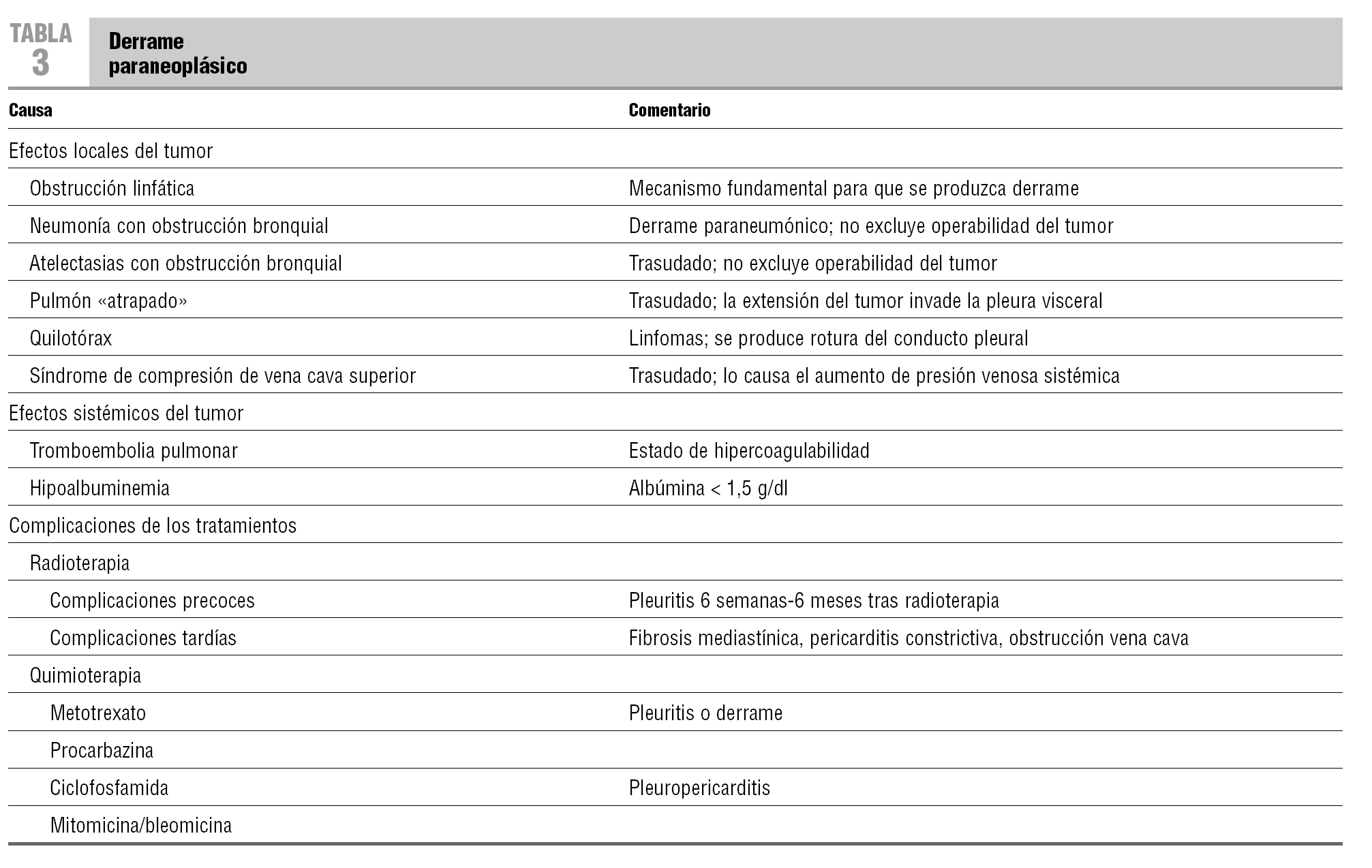
El término derrame paraneoplásico se reserva para derrames pleurales que no están causados por la infiltración directa del tumor pero que están relacionados con él (tabla 3). Enfermedades concomitantes también pueden originar derrame pleural: insuficiencia cardíaca congestiva, cirrosis hepática, síndrome nefrótico e incluso infecciones como la tuberculosis.
El derrame pleural maligno generalmente conlleva una disminución de la supervivencia (aproximadamente, 3-6 meses). Factores que se correlacionan de forma positiva con el pronóstico vital son el tipo de tumor, la extensión de la metástasis, el pH pleural y la puntuación del performance status34.
Aproximación diagnóstica
Manifestaciones clínicas. La disnea es el síntoma más frecuente de presentación de derrame pleural y aparece en más de la mitad de los casos. El dolor pleurítico localizado en la zona del derrame pleural es muy frecuente en los mesoteliomas. La aparición de hemoptisis en cuadro de derrame pleural es muy indicativo de carcinoma broncogénico32.
Pruebas complementarias. En la radiografía de tórax se objetivan derrames pleurales de intensidad moderada a severa (500-2.000 ml aproximadamente). En un 15% de los pacientes, aparecen derrames < 500 ml sin síntomas. Por el contrario, el 10% de los casos se inicia con derrame pleural severo.
Por otro lado, la TC puede identificar derrames pleurales imperceptibles y ayudar a valorar la probable afección linfática en mediastino o la afección de la pared torácica, así como para estudiar metástasis pulmonares, pleurales o a distancia. El papel de la resonancia magnética (RM) y la tomografía por emisión de positrones (PET) es más limitado, pero parece útil para valorar la afección de la pared o la extensión en el caso del mesotelioma.
Toracocentesis diagnóstica. La mayoría de los derrames pleurales malignos son exudados; sólo unos pocos son trasudados (derrames paraneumónicos y neumonitis tras radiación). Por lo tanto, en ausencia de insuficiencia cardíaca y con la lactato deshidrogenasa en pleura en los límites de exudado, debería realizarse un estudio de la celularidad del líquido pleural35.
Entre las contraindicaciones relativas para la realización de esta técnica se encuentran: mínimo derrame pleural (< 100 ml), anticoagulación, diátesis hemorrágica o ventilación mecánica. Las complicaciones más relevantes de la toracocentesis son neumotórax, hemorragia, infección y traumatismo accidental esplénico o hepático.
Otras de las pruebas para el estudio del derrame pleural son la toracoscopia, la broncoscopia y la biopsia quirúrgica.
Tratamiento
Toracocentesis evacuadora. Con el diagnóstico de derrame pleural maligno, se debe plantear un tratamiento paliativo en el que hay que considerar la evaluación de los síntomas del paciente, el estado general y funcional y la estimación de la supervivencia. La indicación principal para la realización de una toracocentesis evacuadora es el alivio de la disnea. El grado de disnea depende del tamaño del derrame pleural y el estado del pulmón y la pleura subyacentes. No se sabe qué volumen de líquido pleural se puede evacuar en una toracocentesis. Como en condiciones reales no se mide la presión, se recomienda extraer 1-1,5 l si el paciente no experimenta disnea severa, tos o dolor torácico. En casos de derrame pleural severo con desviación del mediastino contralateral, algunas autores proponen directamente colocar un tubo pleural para evacuar el derrame y después una pleurodesis. Si la disnea no experimenta mejoría a pesar de la toracocentesis, habrá que sospechar otras causas: linfangitis carcinomatosa, atelectasia o tromboembolia pulmonar. La toracocentesis puede desencadenar un edema pulmonar por la rápida extracción de aire o líquido.
Pleurodesis química. Se considera tratamiento paliativo en derrame pleural severo de repetición y sintomático. Se ha utilizado diferentes agentes químicos para la realización de la pleurodesis: antibióticos (eritromicina, doxiciclina), antineoplásicos (bleomicina) y modificadores de la respuesta biológica como Corynebacterium parvum. En un estudio realizado por Walker-Renard et al36, la tasa de respuesta completa con agentes fibrosantes fue de un 75%, frente al 44% con agentes antineoplásicos. El talco fue el agente más efectivo (un 93% de respuestas). En una revisión sistemática Cochrane30, se observó resultados similares. No se objetivó un aumento de la mortalidad tras la realización de la técnica. En los pacientes candidatos a esta técnica, debería haber evidencia de alivio de los síntomas con la evacuación de derrames previos, reexpansión pulmonar y ausencia de obstrucción bronquial o pulmón atrapado. Si están en tratamiento con corticoides, se aconseja disminuir progresivamente la pauta o incluso suspenderlo, ya que parece que disminuyen la eficacia de la técnica37. El talco38 es un agente barato, muy eficaz en el tratamiento del derrame pleural maligno. La tasa de respuestas completas llega a ser de un 93%. Los efectos adversos más comunes son: dolor, fiebre (16-69%) y, de forma inusual, infección local, síndrome de disnea aguda, neumonitis aguda o insuficiencia respiratoria (ésta parece tener relación con la dosis administrada y el tamaño de las partículas de talco). Pacientes seleccionados (rebeldes a la pleurodesis o con pulmón atrapado) actualmente se están beneficiando de la inserción de catéter pleural39. Se trata de un catéter flexible de silicona (Pleurx®) de 66 cm de longitud. La porción distal fenestrada se introduce en la cavidad pleural y otro tramo del catéter se tuneliza subcutáneamente, quedando expuestos al exterior unos pocos centímetros que terminan en una válvula de seguridad. Ésta sólo se abre cuando se introduce en ella un dilatador conectado por un tubo de plástico a un recipiente especial, que recoge el líquido pleural. Cada 24-48 h, el paciente o su cuidador pueden drenar la cavidad pleural cuando conecten el catéter con la botella de recogida. No se recomienda drenar más de 1 l cada 8 h. El dolor torácico es frecuente las primeras veces que se drena el espacio pleural, ya que el catéter contacta con ambas hojas pleurales. Cuando el paciente efectúa 3 drenajes escasos y la radiografía no muestra reacumulación de líquido, se retira el catéter, ya que se considera que se ha producido una pleurodesis espontánea. En los estudio realizados, el porcentaje de control sintomático es elevado (80-90%) y la tasa de complicaciones, baja; la más frecuente es la obstrucción del drenaje (20%), que puede deberse a la oclusión del catéter o la formación de cavidades en el espacio pleural40. En un estudio aleatorizado en el que se comparó la inserción de catéter intrapleural con la pleurodesis con doxiciclina, se objetivó que el primero era efectivo para tratar derrames pleurales recurrentes y precisaba menos tiempo de hospitalización41.
Otros tratamientos. Terapia sistémica: la quimioterapia se puede considerar en pacientes con derrames por algunos tipos de tumores, tales como el carcinoma de célula pequeña pulmonar, el carcinoma de mama y los linfomas. En los casos en que falle la pleurodesis, se puede considerar una derivación pleuro-peritoneal42 o pleurectomía43. En pacientes con marco temporal corto, se aconseja realizar toracocentesis evacuadoras para el alivio de los síntomas.
Tos
La tos de intensidad moderada a severa ocurre al 13% de los pacientes con enfermedad tumoral y casi la mitad de los casos de cáncer de pulmón (17-48%)44. Este síntoma puede causar cansancio e perjudicar la calidad de vida del enfermo pero, al ser intermitente, hay pocos estudios que examinen el trabajo causado por la tos45.
La tos es un mecanismo fisiológico que se produce para expulsar mucosidad y partículas del tracto respiratorio con una alta presión espiratoria. Con respecto a las causas más frecuentes de aparición de tos en el paciente con cáncer, las podemos observar en la tabla 431.
Manejo de la tos
Se puede categorizar en: tratamiento específico de la causa, potenciar la efectividad de la tos cuando esté indicado y suprimir la tos. Los fármacos46,47 que con más frecuencia se utilizan para suprimir la tos se detallan a continuación.
Opiáceos. Todos los opiáceos tienen efecto antitusígeno; el más utilizado es la codeína, en dosis de 15-30 mg/4 h.
Dextrometorfano. Es un antitusígeno no opiáceos de acción central que se ha demostrado efectivo en ensayos aleatorizados en dosis de 15-30 mg, con muy pocos efectos secundarios gastrointestinales y centrales respecto a la codeína.
Anestésicos locales. Se ha mostrado de utilidad en la supresión de la tos la inhalación de lidocaína o bupivacaína48.
Hipo
Es un reflejo patológico caracterizado por espasmos del diafragma resultado de una brusca inspiración y el cierre de la glotis. La incidencia de este síntoma en la población terminal es desconocida. En la enfermedad terminal, la causa más frecuente de hipo es la distensión gástrica; otras causas son la irritación diafragmática o de causa tóxica (uremia, infección)49.
En raras ocasiones, el hipo es la principal causa de malestar del paciente, pues interfiere en la comida, el habla y el sueño50.
En la medida de lo posible, hay que buscar su causa; por ejemplo, la saciedad precoz, la plenitud epigástrica o la pirosis como síntomas acompañantes indican distensión gástrica.
Tratamiento del síntoma
El hipo intermitente puede responder a maniobras físicas simples: estimulación de la faringe con un catéter, masaje del paladar blando con algodón y un sinfín de remedios caseros que, en ocasiones, lo frenan. La respiración profunda y la fisioterapia respiratoria también pueden ser efectivas en casos de espasmos diafragmáticos.
Otro de los factores que hay que tener en cuenta es la aparición de hipo al iniciar el tratamiento con fármacos que puedan desencadenarlo: corticoides, acetato de megestrol, opiáceos, antagonistas de la dopamina y otros. En caso de distensión gástrica, agregar un procinético alivia la clínica. En la actualidad se los considera de primera elección, ya que combaten el mecanismo más frecuentemente implicado y carecen de efectos secundarios graves.
Actualmente, hay más evidencias de la efectividad del baclofeno en dosis de 5-10 mg 2 veces al día para el tratamiento del hipo pertinaz, pero el número de pacientes
estudiados es pequeño. Aunque se la ha utilizado ampliamente en el pasado, no se recomienda el uso de la clorpromazina debido a sus efectos secundarios51.
Si el paciente tiene importante malestar por el síntoma, se puede iniciar tratamiento con midazolam 2,5 mg por vía subcutánea, repetido cada 15 min hasta que desaparezca52.
Otras alternativas de tratamiento son: gabapentina 300-600 mg/8 h; nifedipino 10-20 mg/8 h, y haloperidol en dosis variables.
Correspondencia:
María José Redondo Moralo.
Equipo de Soporte de Cuidados Paliativos.
Hospital Perpetuo Socorro.
Avda. Damián Téllez Lafuente, s/n.
06010 Badajoz. España.
Correo electrónico: mariredo@hotmail.com