Definición del problema
En la era de la información, los pacientes realizan frecuentemente consultas sobre novedades terapéuticas. Leen artículos, escuchan y ven programas de divulgación --más o menos científica-- en los medios de comunicación de masas y, sobre todo en los últimos años, consultan internet. Cada vez con más frecuencia no son los médicos quienes proponen un tratamiento o una prueba diagnóstica a sus pacientes, sino que son éstos quienes los solicitan. Muy a menudo las informaciones que consultan están redactadas o patrocinadas por la industria farmacéutica. Las técnicas de marketing empleadas buscan repetir una y otra vez un determinado mensaje. Este mensaje será tomado por el público general como una verdad y se habrá conseguido crear una falsa necesidad1.
Si hay un terreno abonado para la creación de falsas necesidades, ése es el de las actividades preventivas: con mínimo o ningún efecto secundario, se pretende que el paciente reduzca o elimine el riesgo de presentar una enfermedad. Si a esto le sumamos la dificultad para que los encuentros entre médicos y pacientes finalicen sin una prescripción, tenemos creado el ambiente idóneo para que se produzcan consultas como la que da origen a este trabajo.
Situación clínica
En febrero de 2007, una mujer consulta si debe vacunar a su hija de 14 años contra el virus del papiloma humano (VPH). La vacuna no se encuentra aún comercializada en España pero la puede conseguir en Estados Unidos, pagándola de su propio bolsillo. Su médico, pese a que ha oído hablar de esa vacuna, desconoce sus indicaciones concretas y decide citar a la paciente más adelante para realizar una revisión clínica con la que responder a su consulta.
Pregunta clínica
¿En una adolescente de 14 años, la vacunación combinada con la citología cervical es mejor que la citología cervical sola para prevenir el cáncer de cérvix?
Síntesis de las evidencias
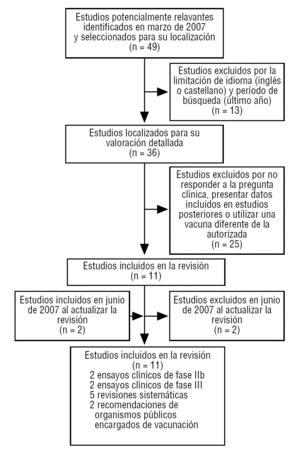
En marzo de 2007, se buscaron revisiones sistemáticas con el término MeSH «papillomavirus vaccines» en: Cochrane Database of Systematic Reviews, Database of Abstracts of Reviews of Effects, Health Technology Assessment Database, Clinical Evidence, TRIP Database, UpToDate y PubMed de MEDLINE. Se buscaron ensayos clínicos en: PubMed de MEDLINE, EMBASE y Cochrane Controlled Trials Register. Se revisaron las recomendaciones de los organismos encargados de la vacunación de Estados Unidos (Advisory Committee on Immunization Practices, ACIP), Reino Unido (Joint Committee on Vaccination and Immunisation, JCVI), Canadá (National Advisory Committee on Immunization, NACI) y España (Comisión Nacional de Salud Pública, CNSP). Se revisó el informe público europeo de evaluación de la vacuna realizado por la European Medicines Agency, EMEA2. Se consultó la bibliografía citada en las publicaciones seleccionadas.
Se ha restringido la búsqueda a documentos en inglés o castellano y, de las revisiones sistemáticas, a las realizadas en 2006 y 2007.
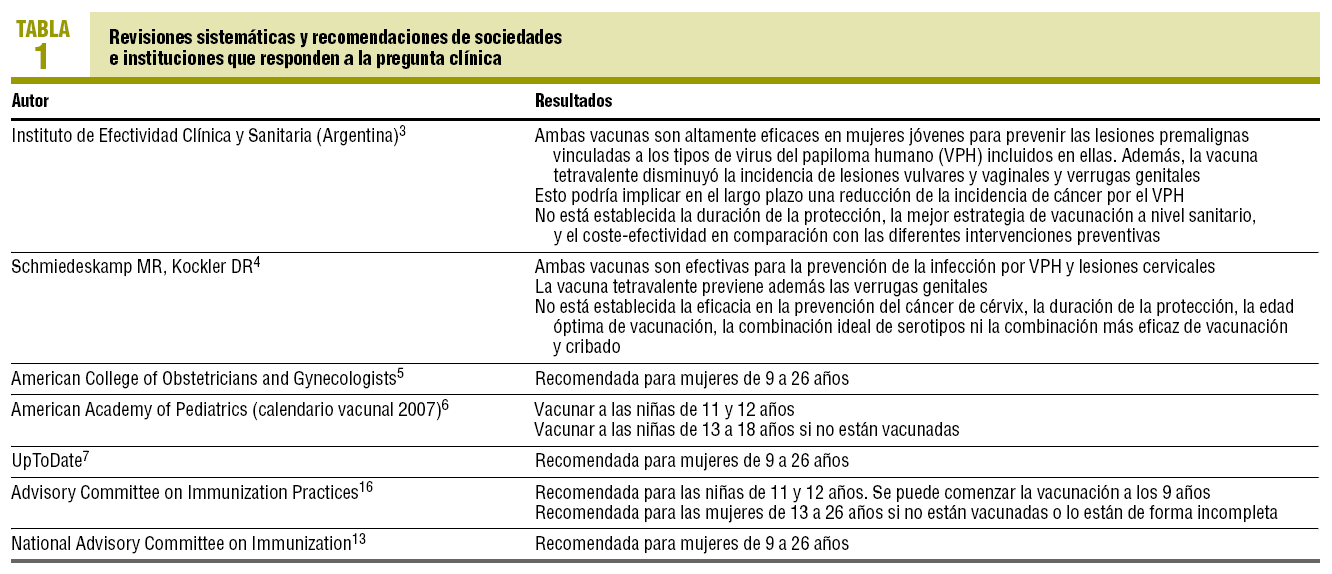
Se localizaron 18 revisiones sistemáticas potencialmente relevantes. Se excluyeron 13 (76,47%) por ser anteriores a 2006. No se excluyó ninguna por la limitación del idioma. De las 5 revisiones restantes3-7 ninguna fue excluida por no responder a la pregunta clínica. Sus resultados se resumen en la tabla 1.
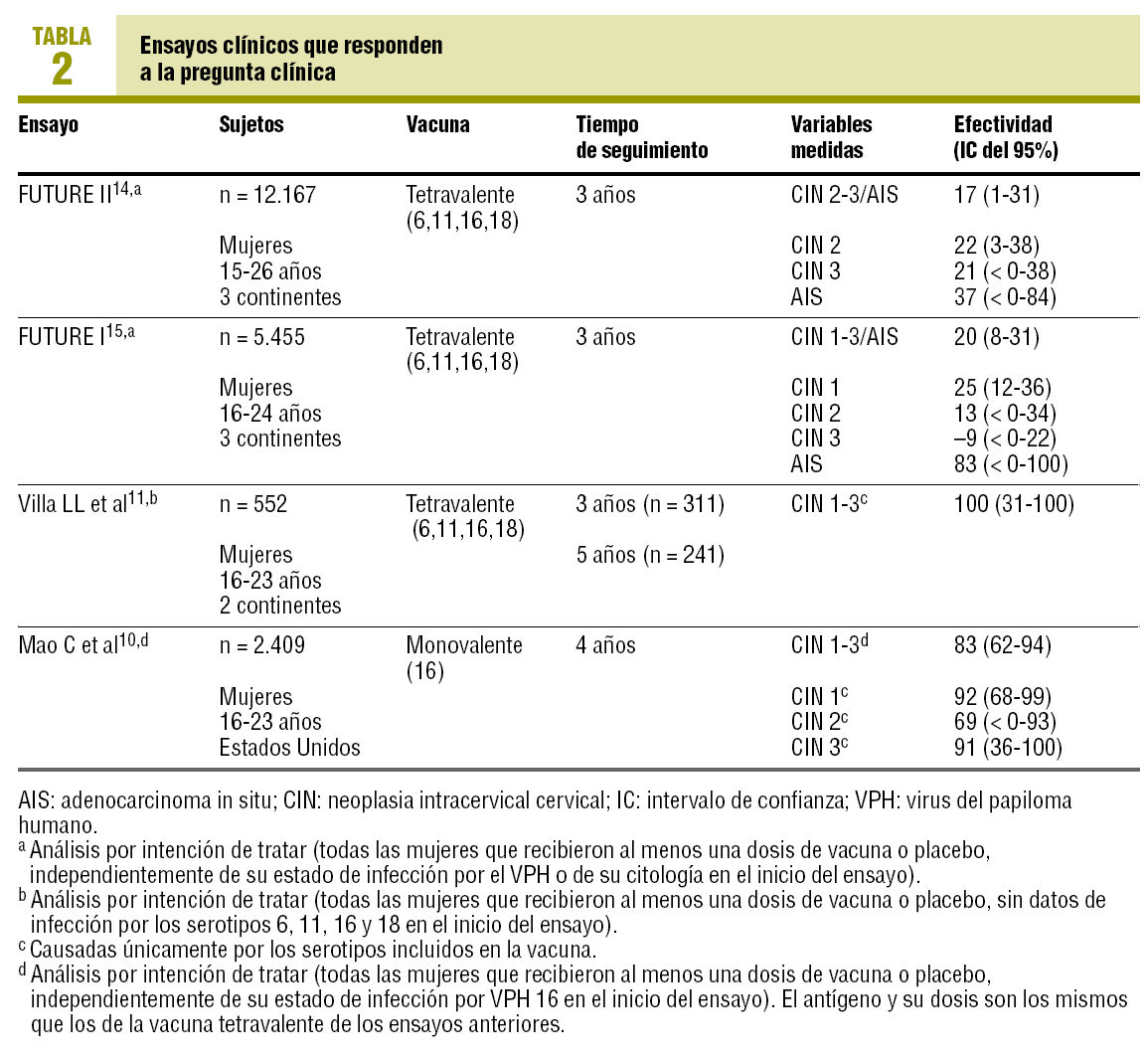
Se encontraron 28 ensayos clínicos (ECA) potencialmente relevantes; 24 (85,71%) se excluyeron porque no respondían a la pregunta clínica, sus resultados eran análisis intermedios de ECA publicados posteriormente por los mismos autores8,9 o porque utilizaban otra vacuna que no está aún autorizada. No se excluyó ninguno por la limitación del idioma. No se excluyó un ensayo de fase IIb de una vacuna monovalente10, pues empleaba una dosis idéntica de uno de los antígenos de la vacuna tetravalente actualmente autorizada. Los resultados de los 4 ECA2,10,11 que responden a la pregunta clínica se resumen en la tabla 2.
Se encontraron 2 recomendaciones de organismos estatales responsables de vacunaciones: una del ACIP estadounidense (provisional)12 y otra del NACI canadiense13 (tabla 1).
En junio de 2007, se volvió a realizar una búsqueda siguiendo la misma metodología, con el fin de actualizar los datos encontrados en la revisión anterior.
No se encontró ninguna revisión sistemática nueva. Se encontró una publicación con los resultados finales de dos ensayos clínicos14,15, de los que en marzo solamente había resultados de análisis intermedios10. Se encontró que las recomendaciones del ACIP estadounidense habían dejado de ser provisionales12 y se habían hecho definitivas16.
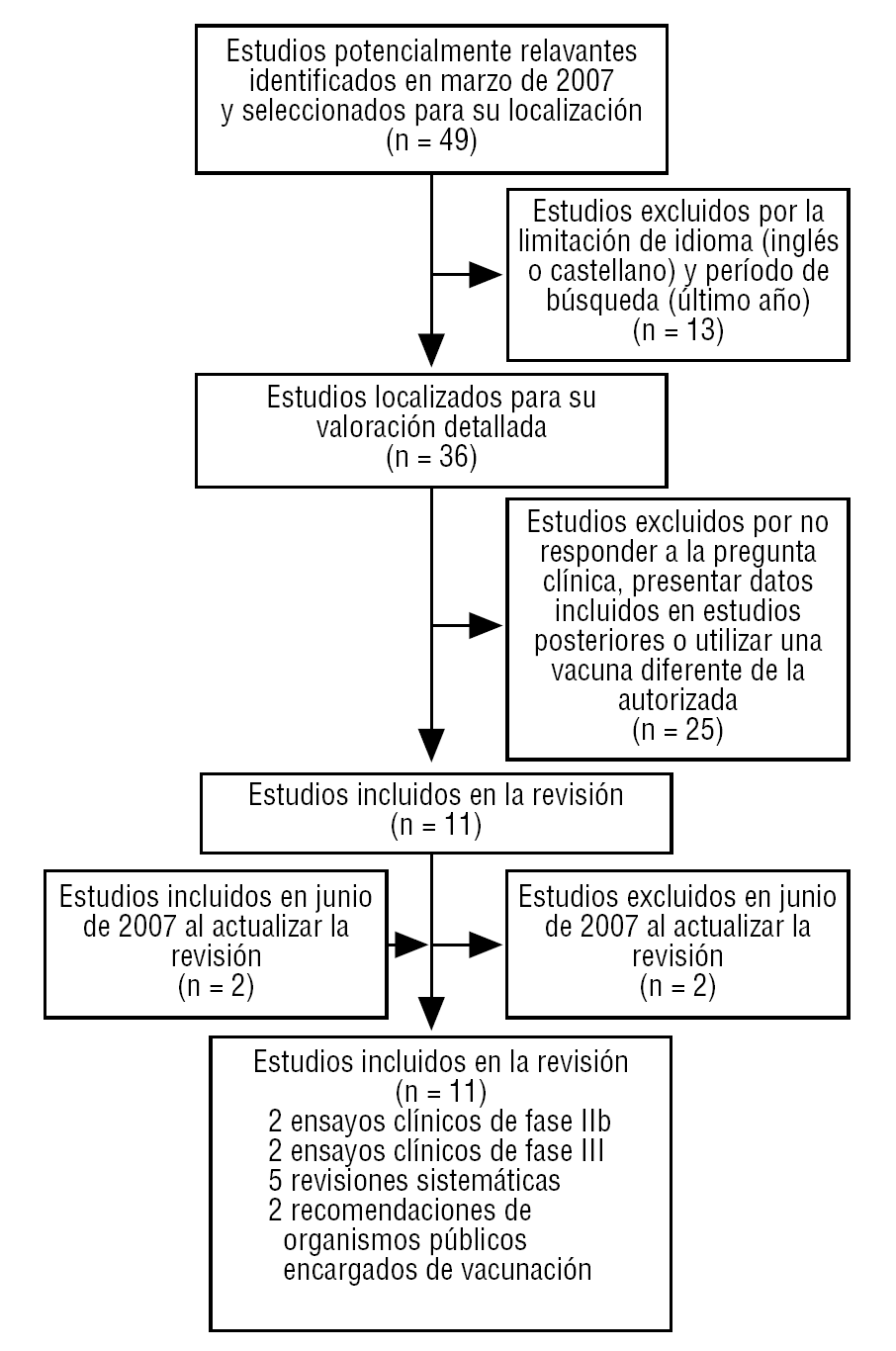
Tras analizar los documentos seleccionados (fig. 1), podemos concluir:
FIGURA 1 Revisión clínica de estudios y/o artículos sobre la vacuna contra el papilomavirus humano.
1. La vacuna ha demostrado ser eficaz para prevenir la infección persistente por VPH y algunas de las lesiones displásicas causadas por él, concretamente, la neoplasia cervical intraepitelial (CIN) 1 y 2.
2. La vacuna tetravalente previene además la aparición de verrugas genitales.
3. Estos hallazgos hacen pensar que probablemente sea también capaz de prevenir la aparición de cáncer de cérvix, pero no se ha observado todavía dicho efecto en ningún ensayo clínico. Es muy probable que esto se deba a que los pacientes han sido seguidos durante menos tiempo que el que necesita el VPH para producir lesiones malignas17,18, de modo que es razonable suponer que se observará una reducción en la aparición de cáncer de cérvix en algún momento de los 10 años que está previsto que duren los ensayos clínicos de fase III.
4. También queda por establecer si es necesario administrar dosis de recuerdo periódicamente para mantener la efectividad de la vacuna.
5. En resumen, en el momento actual (junio de 2007), no hay pruebas que demuestren que la vacunación de esta paciente reducirá su probabilidad de tener cáncer de cérvix.
Implicaciones para la práctica clínica
En la aplicación de las actividades preventivas hay que tener un especial cuidado no sólo con la efectividad, sino también con la no maleficencia de las novedades terapéuticas19. La pregunta clínica nos plantea administrar un tratamiento nuevo a una persona sana, en una situación que no es de emergencia, en una zona de baja prevalencia20 de una enfermedad para la que, además, ya existen medidas preventivas efectivas21. En este contexto, la introducción de una novedad preventiva debería basarse en pruebas sólidas.
Fabricar una vacuna es un proceso largo, difícil y costoso. Así, el primer ensayo publicado sobre una vacuna para el papilomavirus bovino data de 198822. Los laboratorios que las desarrollan esperan obtener una legítima rentabilidad por sus esfuerzos investigadores. Sin embargo, es preciso ser cautos con las expectativas que se han generado sobre esta vacuna, basadas en ECA de duración insuficiente y en recomendaciones de grupos de expertos, que en algunos casos presentan conflicto de intereses con los propios laboratorios.
Por el momento no deberíamos dejarnos llevar por el entusiasmo ante lo que, si se aportan las pruebas suficientes, será un importante avance en la prevención del segundo cáncer femenino más frecuente en el mundo23.
Otras consideraciones, ajenas a los objetivos de este artículo, serían necesarias para valorar las pruebas existentes con el fin de recomendar la inclusión o no de esta vacuna en los calendarios vacunales, tanto autonómicos como nacional.
Además de la efectividad que puedan demostrar los ECA en curso14,15, habría que considerar factores como la incidencia y la mortalidad por cáncer de cérvix en nuestro país (inferior a la de países de nuestro entorno)20, la necesidad de 3 dosis para la primovacunación, el desconocimiento de la necesidad de revacunación y el elevado coste actual de la vacuna (aproximadamente, 360 euros las 3 dosis). Asimismo, si la vacuna se demostrara realmente efectiva para reducir la prevalencia de cáncer de cérvix, el valor predictivo de la prueba de Papanicolau también disminuiría, de modo que podría ser necesario cambiar los métodos de detección precoz por otros más sensibles y más caros (prueba del VPH). Todo esto debería evaluarse en análisis de coste-efectividad y coste-oportunidad antes de efectuar recomendaciones poblacionales.
Conclusiones
Si nos ceñimos estrictamente a las pruebas y no a meros postulados, la vacuna contra el VPH autorizada no ha demostrado reducir el riesgo de cáncer de cérvix en pacientes como la que nos ha llevado a la realización de esta revisión.
Este trabajo ha obtenido el premio a la mejor comunicación oral en las IX Jornadas de Residentes de la Sociedad Madrileña de Medicina Familiar y Comunitaria. Madrid, 9 de marzo de 2007.
Puntos clave
Pregunta
¿En una adolescente de 14 años, es mejor la vacunación combinada con la citología cervical que la citología cervical sola para prevenir el cáncer de cérvix?
Respuesta y comentarios
• En el momento actual (junio de 2007), no hay pruebas que demuestren que la vacunación de esta paciente reducirá su probabilidad de tener cáncer de cérvix.
• La vacuna ha demostrado ser eficaz para prevenir la infección persistente por el virus del papiloma humano (VPH) y las lesiones displásicas causadas por los serotipos de VPH incluidos en ella.
• La vacuna tetravalente previene además la aparición de verrugas genitales.
• Debería esperarse a disponer de pruebas más numerosas y más sólidas para recomendar la inclusión de esta vacuna en los calendarios vacunales.
Correspondencia: C. Alameda González.
Centro de Salud Universitario Ciudad Jardín.
Pantoja, 3. 28002 Madrid. España.
Correo electrónico: alameda79@hotmail.com
Manuscrito recibido el 13-3-2007.
Manuscrito aceptado para su publicación el 1-10-2007.