Las infecciones virales del tracto respiratorio imponen una carga de enfermedad alta a la sociedad, de ahí que desde la segunda mitad del siglo xx se hayan centrado los esfuerzos en la vacuna frente a la influenza para minimizar o prevenir su impacto1.
Pero la eficacia de las vacunas frente a la gripe no es siempre alta, lo que se debe no tanto a la propia vacuna, sino a los cambios antigénicos frecuentes del virus2.
Por todo esto, se siguen investigando diferentes formas de aumentar la inmunogenicidad de la vacuna, como el uso de adyuvantes, concretamente el MF59, en la vacuna de la gripe.
El adyuvante MF593 es una emulsión de aceite en agua, que contiene escualeno, metabolito natural del colesterol que se encuentra en el ser humano como componente normal de las membranas celulares, y que de por sí no es inmunógeno, pero añadido a algunas vacunas puede contribuir a aumentar la inmunogenicidad de éstas.
Actualmente disponemos de vacunas frente a la gripe de subunidades, virosomas, y fraccionada (las llamamos convencionales), y la nueva vacuna de subunidades adyuvada con MF59, desarrollada con el objetivo de aumentar la efectividad de las vacunas convencionales sin aumentar los efectos adversos.
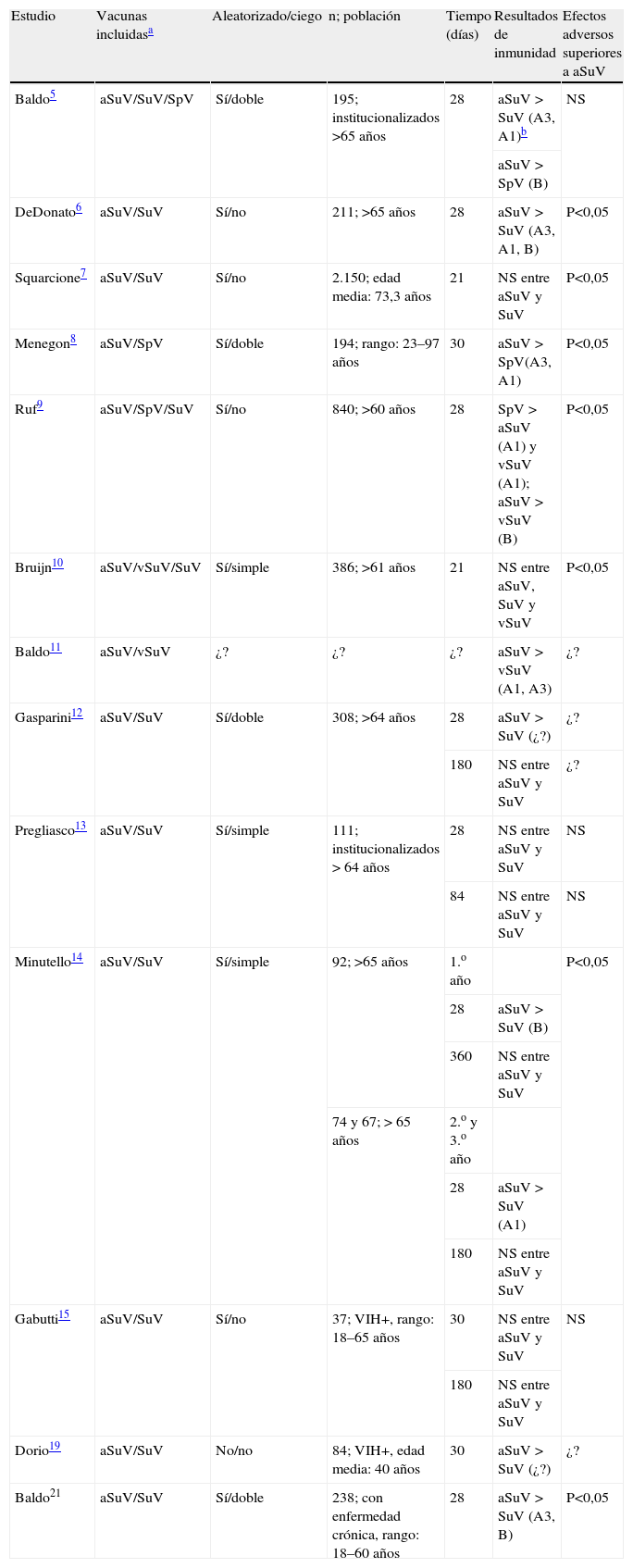
Sin embargo, al revisar los estudios que comparan la vacuna adyuvada con las vacunas convencionales (tabla 1) encontramos que:
- •
Los ensayos clínicos tienen problemas metodológicos.
- •
Cuando se compara la eficacia inmunológica de la vacuna adyuvada frente a las vacunas convencionales, a los 28 días tras la vacunación, se obtienen resultados dispares sobre la eficacia, ya que mientras algunos estudios muestran resultados favorables a la vacuna adyuvada, como Baldo et al4, De Donato et al5 o Menegon et al6, otros muestran resultados favorables a las vacunas convencionales, como Squarcione et al7, Ruf et al8 o Bruijn et al9.
- •
En los estudios de eficacia inmunológica a más largo plazo, a los 84, a los 180 o a los 360 días tras la vacunación, Pregliasco et al10 y Gabutti et al11 no reflejan superioridad inmunológica de la vacuna adyuvada frente a las vacunas convencionales. Incluso los que dieron resultados favorables a la vacuna adyuvada tras 28 días, no muestran diferencias significativas entre ambos tipos de vacuna a los 180 y a los 360 días, como Gasparini et al12 y Minutello et al13.
- •
El estudio de efectividad clínica de Iob et al14 compara la vacuna adyuvada con las vacunas convencionales, pero al no tener asignación aleatorizada se invalidan en buena medida sus resultados y conclusiones. Los estudios de efectividad de Puig-Barberà et al15,16 no tienen el diseño adecuado para los objetivos que se proponen estudiar. Solamente mediante estimaciones de riesgo absoluto, reducción de riesgo absoluto y número necesario a tratar es posible tomar decisiones clínicas, y estos estudios no permiten calcularlas. Además ambos trabajos están hechos frente a la no vacunación.
- •
En pacientes con VIH+, el estudio de Dorio et al17, sin asignación aleatorizada y no ciego, compara la vacuna adyuvada con la de subunidades convencional, y a los 30 días tras la vacunación muestra incrementos del nivel de anticuerpos significativamente mayores para la vacuna adyuvada. Estos resultados contrastan con los presentados en el ensayo de Gabutti et al15, donde no se encuentra superioridad de la vacuna adyuvada frente a la de subunidades convencional, ni a los 28 ni a los 180 días, tras la vacunación.
- •
Baldo et al18 comparan la inmunogenicidad y la seguridad de la vacuna adyuvada con la de subunidades convencional, en un ensayo aleatorizado, doble ciego, en adultos con enfermedades crónicas como cáncer, diabetes mellitus, enfermedad cardíaca o enfermedad pulmonar, y obtienen en los vacunados con la vacuna adyuvada una significativa mayor respuesta de anticuerpos para la cepa A/H3N2 a las 4 semanas comparada con la vacuna convencional.
- •
La mayoría de los ensayos clínicos citados encuentran un significativo mayor número de reacciones adversas, tanto locales como sistémicas, de la vacuna adyuvada frente a las vacunas convencionales, aunque ninguno fue grave.
- •
Los datos de inmunogenicidad sobre las cepas heterovariantes19,20 son favorables a la vacuna adyuvada, aunque su relevancia clínica es actualmente desconocida.
Principales estudios revisados de seguridad e inmunogenicidad
| Estudio | Vacunas incluidasa | Aleatorizado/ciego | n; población | Tiempo (días) | Resultados de inmunidad | Efectos adversos superiores a aSuV |
| Baldo5 | aSuV/SuV/SpV | Sí/doble | 195; institucionalizados >65 años | 28 | aSuV > SuV (A3, A1)b | NS |
| aSuV > SpV (B) | ||||||
| DeDonato6 | aSuV/SuV | Sí/no | 211; >65 años | 28 | aSuV > SuV (A3, A1, B) | P<0,05 |
| Squarcione7 | aSuV/SuV | Sí/no | 2.150; edad media: 73,3 años | 21 | NS entre aSuV y SuV | P<0,05 |
| Menegon8 | aSuV/SpV | Sí/doble | 194; rango: 23–97 años | 30 | aSuV > SpV(A3, A1) | P<0,05 |
| Ruf9 | aSuV/SpV/SuV | Sí/no | 840; >60 años | 28 | SpV > aSuV (A1) y vSuV (A1); aSuV > vSuV (B) | P<0,05 |
| Bruijn10 | aSuV/vSuV/SuV | Sí/simple | 386; >61 años | 21 | NS entre aSuV, SuV y vSuV | P<0,05 |
| Baldo11 | aSuV/vSuV | ¿? | ¿? | ¿? | aSuV > vSuV (A1, A3) | ¿? |
| Gasparini12 | aSuV/SuV | Sí/doble | 308; >64 años | 28 | aSuV > SuV (¿?) | ¿? |
| 180 | NS entre aSuV y SuV | ¿? | ||||
| Pregliasco13 | aSuV/SuV | Sí/simple | 111; institucionalizados > 64 años | 28 | NS entre aSuV y SuV | NS |
| 84 | NS entre aSuV y SuV | NS | ||||
| Minutello14 | aSuV/SuV | Sí/simple | 92; >65 años | 1.o año | P<0,05 | |
| 28 | aSuV > SuV (B) | |||||
| 360 | NS entre aSuV y SuV | |||||
| 74 y 67; > 65 años | 2.o y 3.o año | |||||
| 28 | aSuV > SuV (A1) | |||||
| 180 | NS entre aSuV y SuV | |||||
| Gabutti15 | aSuV/SuV | Sí/no | 37; VIH+, rango: 18–65 años | 30 | NS entre aSuV y SuV | NS |
| 180 | NS entre aSuV y SuV | |||||
| Dorio19 | aSuV/SuV | No/no | 84; VIH+, edad media: 40 años | 30 | aSuV > SuV (¿?) | ¿? |
| Baldo21 | aSuV/SuV | Sí/doble | 238; con enfermedad crónica, rango: 18–60 años | 28 | aSuV > SuV (A3, B) | P<0,05 |
NS: no significativo; VIH+: positivo para el virus de la inmunodeficiencia humana.
En resumen, la circulación del virus de la gripe y sus modificaciones antigénicas continuas contribuyen a la baja efectividad de las vacunas antigripales1,2. Es necesario seguir mejorando la efectividad de la vacunación contra la gripe dado que, hasta la fecha, las evidencias no muestran una ventaja clara de la vacuna adyuvada frente a las vacunas convencionales.