Evaluar la efectividad de la revisión sistemática de medicación realizada por farmacéutico sobre medicaciones potencialmente inapropiadas (MPI), resultados en salud y costes.
DiseñoEnsayo clínico prospectivo, abierto, controlado y aleatorizado por clústeres.
EmplazamientoSeis centros de atención primaria de las Islas Baleares.
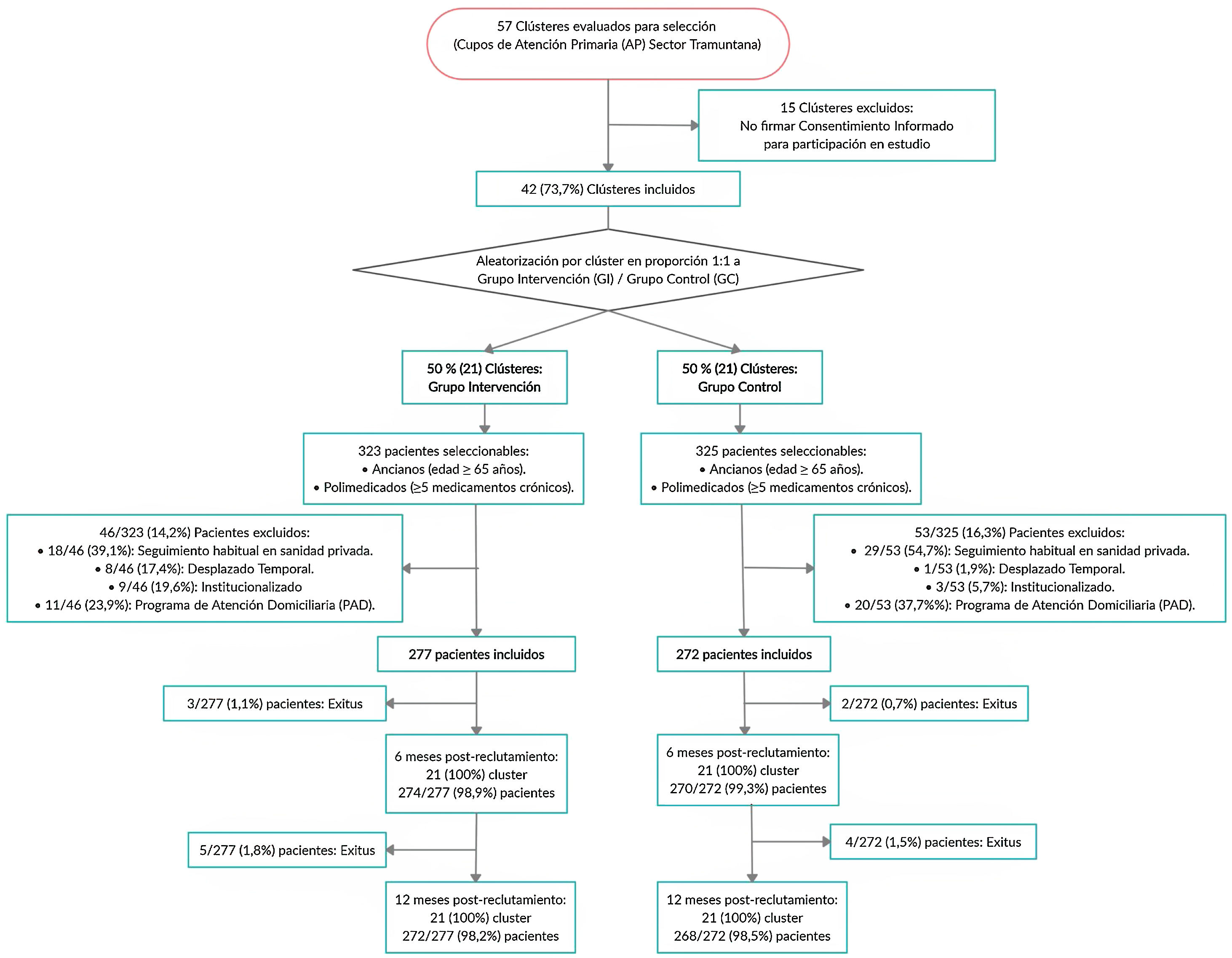
ParticipantesSe incluyeron 42 clústeres (21 por grupo), y 549 pacientes de ≥ 65 años y ≥ 5 medicamentos crónicos, de los cuales 277 se asignaron al Grupo Intervención (GI) y 272 al Grupo Control (GC). Se excluyeron pacientes: institucionalizados, desplazados, atendidos habitualmente por la sanidad privada, o en atención domiciliaria.
IntervenciónDetección de MPI por parte del farmacéutico mediante combinación de métodos explícitos e implícitos y comunicación de las alternativas terapéuticas más apropiadas al médico prescriptor.
MedicionesSe evaluaron la proporción de pacientes con MPI y número medio de MPI/paciente (variables principales); así como morbilidad, mortalidad, y costes (variables secundarias).
Análisis estadísticoSiguiendo el principio de intención de tratar, se compararon las variables cuantitativas y cualitativas mediante las pruebas t Student y X2, respectivamente. Los resultados se expresaron como diferencia de proporciones para variables cualitativas y diferencia de medias para cuantitativas, con los correspondientes intervalos de confianza 95% (IC 95%).
ResultadosDespués de la intervención, la proporción de pacientes con MPI disminuyó un 13,7% (IC 95%: 9,3; 18,2) más en GI que GC. El número medio de MPI/paciente y coste medio de MPI/paciente disminuyeron en 0,43 (IC 95%: 0,32; 0,54) y 72,11€ (IC 95%: 26,15; 118,06) más en GI que GC, respectivamente. Sin embargo, no se observaron diferencias estadísticamente significativas en morbilidad, mortalidad ni en costes de episodios asistenciales.
ConclusionesLa detección de MPI y emisión de recomendaciones por el farmacéutico pudo contribuir a reducir significativamente MPI y gasto en medicamentos, pero sin alcanzar diferencias estadísticamente significativas en morbimortalidad ni costes de episodios asistenciales.
To assess the effectiveness of a pharmacist-led systematic review of medications on: potentially inappropriate medications (PIM), health outcomes and costs.
DesignProspective, open, controlled and cluster-randomized clinical trial.
SettingSix primary care clinics from Balearic Islands.
ParticipantsForty-two clusters (21 per group), and 549 patients aged ≥65 years and ≥5 chronic medications were included; of which 277 were allocated to Intervention Group (IG) and 272 to Control Group (CG). Patients were excluded if they were: institutionalized, temporarily displaced, routinely monitored under private healthcare, or home care.
InterventionPIM detection by the pharmacist using a combination of explicit and implicit methods; and communication of the most appropriate therapeutic strategies to the physician.
MeasurementsProportion of patients with PIM and mean number of PIM/patient (main outcomes); and morbidity, mortality, and costs (secondary outcomes) were assessed.
Statistical planFollowing an intention-to-treat approach, quantitative and qualitative outcomes variables were compared by T-Student and Chi-square tests, respectively. Results were providing as difference in proportions for qualitative outcomes and difference in means for quantitative outcomes with respective 95% confidence intervals (95% CI).
ResultsAfter intervention, proportion of patients with PIM decreased by 13.7% (95% CI: 9.3; 18.2) more in IG than CG. Mean number of PIM/patient and mean cost of PIM/patient decreased by 0.43 (95% CI: 0.32; 0.54) and 72.11€ (95% CI: 26.15; 118.06) more in IG than CG, respectively. However, no statistically significant differences were observed in morbidity, mortality or costs of healthcare resources.
ConclusionsPIM detection and recommendations provided by pharmacist could contribute to reduce significantly PIM and drug expenditure; but without reaching statistically significant differences in morbidity, mortality, and healthcare resources costs.
El aumento de la esperanza de vida experimentado en las últimas décadas ha supuesto una mayor prevalencia de enfermedades crónicas y del consumo de medicamentos1–3. Este hecho, unido a las alteraciones fisiológicas asociadas al envejecimiento4, incrementan el riesgo de padecer reacciones adversas a medicamentos (RAM) en este grupo poblacional, siendo una de las principales causas la prescripción de medicación potencialmente inapropiada (MPI)5.
Se considera MPI cuando el balance beneficio-riesgo (incluyendo la no prescripción de fármacos potencialmente beneficiosos) y/o coste-efectividad es desfavorable, especialmente cuando existen alternativas terapéuticas más seguras, eficaces y/o coste-efectivas6. Para su detección existen métodos implícitos basados en juicios clínicos, como el «MAI: Medication Appropriateness Index»7; y métodos explícitos que utilizan criterios predefinidos basados en la evidencia y en el consenso de expertos, como por ejemplo los criterios «Beers»8, o los «Screening Tool of Older Person's potentially inappropriate Prescriptions/Screening Tool to Alert doctors to the Right Treatment (STOPP/START)»9. Por otro lado, existen indicadores de calidad de prescripción (ICP), que permiten detectar alternativas más coste-efectivas10. Ninguno de estos métodos, individualmente, se considera ideal para evaluar la adecuación de la prescripción en pacientes pluripatológicos y/o polimedicados, siendo interesante el desarrollo de estrategias basadas en la combinación de varios de ellos11.
Numerosos estudios han demostrado una elevada prevalencia de MPI mediante el empleo de alguna de estas herramientas12,13, así como cierta efectividad sobre reducción del número de MPI y de coste de medicamentos14,15, pero sin traducirse claramente en reducción de morbimortalidad16–18. Tampoco se han encontrado ensayos clínicos aleatorizados por clústeres que evalúen globalmente la efectividad de la implicación del farmacéutico en la optimización de la farmacoterapia del paciente geriátrico, mediante la combinación de diferentes estrategias, en términos de adecuación de la prescripción, resultados en salud, y costes19.
Por ello, el objetivo principal del presente estudio fue evaluar, a nivel paciente, la efectividad de la revisión sistemática de la medicación conducida por el farmacéutico (RSM-F) en mayores de 65 años polimedicados en atención primaria (AP), medida en base a la reducción de la proporción de pacientes con MPI y del número medio de MPI por paciente. Los objetivos secundarios fueron evaluar su impacto sobre los episodios asistenciales frecuentados y los costes sanitarios.
MétodosLa metodología del presente estudio se planteó siguiendo las recomendaciones de la declaración «Consolidated Standards of Reporting Trials (CONSORT): Extension to Cluster Randomised Trials»20, recogida en el Anexo 1.
Diseño y ámbitoEnsayo clínico paralelo, prospectivo, multicéntrico, abierto, controlado y aleatorizado por clústeres (cupos: conjuntos de pacientes atendidos por un mismo médico) en proporción 1:1 a grupo intervención (GI) o grupo control (GC). El estudio se realizó en seis centros de salud del Sector Sanitario Tramuntana (Islas Baleares), entre enero y mayo de 2015.
ParticipantesLos criterios de selección de los participantes, tanto a nivel clúster como paciente, se describen en el Anexo 2.
IntervencionesLa intervención se realizó a nivel clúster, es decir, las estrategias de manejo de las MPI se comunicaron al médico prescriptor. En la tabla 1 pueden observarse las actividades realizadas en cada grupo del ensayo.
Revisión Sistemática de la Medicación en GI y GC
| Común para GI y GC |
|---|
| Recogida de datos basales (Fuente: Historia Clínica Electrónica [HCE]):–Demográficos: Edad, sexo.–Clínicos: Condiciones crónicas.–Farmacológicos: Medicamentos crónicos prescritos. |
| Detección de MPI mediante combinación de métodos explícitos e implícitos:–Criterios STOPP/START9–Información de Fichas técnicas.–Recomendaciones «No Hacer» de Sociedades Científicascon ayuda del software CheckTheMeds®; junto con–Batería de ICP del Servicio de Salud de las Islas Baleares (para detectar prescripciones con alternativas más coste-efectivas). |
| Únicamente para GI |
| Comunicación al médico prescriptor de las alternativas terapéuticas adecuadas según las circunstancias particulares del paciente (por ejemplo: si/no tratamiento previo con alternativa propuesta, comorbilidades, tratamientos concomitantes, etc.) consistentes en:–Suspender medicamento–Ajustar posología–Sustituir medicamento–Añadir nuevo medicamento–Si ninguna de las alternativas anteriores fuera adecuada, mantener MPI vigilando estrechamente posibilidad de aparición de reacciones adversas.Dicha comunicación se efectuó:–A través de la HCE, mediante aviso a modo de ventana emergente (el cual permanecía visible hasta que el médico lo eliminara voluntariamente), y verbalmente en caso necesario.–El día anterior a la visita, para que el médico que atendía al paciente pudiera visualizar las recomendaciones al abrir la HCE en el momento de la consulta y realizar las modificaciones oportunas.–Independientemente si era médico habitual o sustituto, ya que los permisos para eliminar, modificar, o editar avisos eran idénticos para médico habitual y sustituto. |
- -
Variables independientes. Características basales:
- •
Demográficas: Edad, sexo.
- •
Clínicas: Índice de Comorbilidad de Charlson (ICC), proporción de pacientes con ≥ 2 enfermedades crónicas (PMCC).
- •
Farmacoterapéuticas: Número de medicamentos crónicos (FARM), proporción de pacientes polimedicados (POLIF: 5-9 fármacos) e hiperpolimedicados (HPOLIF: ≥10 fármacos)21.
- •
- -
Variables principales: Diferencia en la proporción de pacientes con MPI y en el número medio de MPI por paciente entre el momento de la intervención y seis meses después. Se consideró MPI aquella medicación que cumplía alguno de los siguientes criterios: no indicación clara basada en la evidencia, dosis/duración superior a la recomendada, duplicidad terapéutica, contraindicación, interacción, susceptibilidad a determinados efectos adversos (por ejemplo, benzodiacepinas en pacientes con historia de caídas), ausencia de tratamiento necesario, disponibilidad de alternativa más coste-efectiva6.
- -
Variables secundarias:
- •
Morbilidad (m): Diferencia en el número medio de episodios asistenciales frecuentados por los pacientes durante los 12 meses anteriores y posteriores a la intervención:
- •
- -
Hospitalarios (HOSP):
- •
Días de Ingreso Hospitalario (DIH): estancia ≥13 horas en planta de hospitalización o Urgencias para recibir atención especializada atención especializada22 +
- •
Visitas al Servicio de Urgencias Hospitalarias (vSUH)
- •
- -
Ambulatorios (AMBU):
- •
Visitas al Servicio de Urgencias de Atención Primaria (vSUAP) +
- •
Consultas de Atención Especializada (CAE) +
- •
Consultas de Atención Primaria (CAP).
- •
- -
Mortalidad (MORT): Diferencia en la proporción de pacientes fallecidos durante los 12 meses posteriores a la intervención.
- -
Coste de medicamentos: Diferencia en el coste medio anual estimado por paciente de los medicamentos implicados en las MPI (CA-MPI) entre el momento de la intervención y seis meses después, con base en el precio de facturación.
- -
Coste de episodios asistenciales (CMORBI): Diferencia en el coste medio por paciente de los episodios asistenciales frecuentados durante los 12 meses anteriores y posteriores a la intervención (DIH, vSUH, vSUAP, vCAE, vCAP) según tarifas oficiales22.
El tamaño muestral se calculó mediante contraste de proporciones para una diferencia del 15% de pacientes con MPI, en base a los resultados de un estudio previo no publicado, realizado por los mismos autores del presente artículo, que mostró una proporción de pacientes con MPI del 80% en GC y 65% en GI; y al artículo de Delgado et al., que considera que cualquier herramienta de cribado que reduzca entre 10-20% la proporción de MPI podría ser coste-efectiva5.
Asumiendo un poder estadístico del 80% y una tasa de pérdidas del 10%, el tamaño muestral requerido es 153. Teniendo en cuenta el ajuste por efecto de clúster, con un coeficiente de correlación intracluster de 0,0523, y tamaño medio de clúster de 12 pacientes (asumiendo igual tamaño para todos los clústeres), el factor de inflación es 1,55. Por tanto, el tamaño muestral final es 238 pacientes (20 clústeres) por grupo de estudio.
Reclutamiento y aleatorizaciónLos médicos de AP del Sector Sanitario Tramuntana (en representación de sus respectivos cupos) que firmaron el consentimiento informado fueron asignados a GI o GC en proporción 1:1 mediante aleatorización balanceada en bloques de cuatro clústeres generada por el software «Computer Program for Epidemiologists (WINPEPI)»24. El Instituto de Investigación en Salud de las Islas Baleares (IdISBa) generó la secuencia de asignación aleatoria de los distintos clústeres y aseguró la ocultación hasta el inicio del estudio.
Se seleccionó cada día un cupo del GI y GC en orden consecutivo, y se reclutó todos los pacientes citados para el día siguiente que cumplían criterios de selección. De los pacientes reclutados, se revisaron los medicamentos prescritos de forma crónica, independientemente de si se habían dispensado o no.
A continuación se describe el marco temporal de las diferentes fases del estudio:
- -
Reclutamiento de clústeres: abril-mayo 2014.
- -
Asignación de clústeres: enero 2015.
- -
Reclutamiento de pacientes: enero-mayo 2015.
- -
Intervención: enero-mayo 2015.
- -
Evaluación de características basales: enero-mayo 2015.
- -
Evaluación de variables principales: julio-noviembre 2015.
- -
Evaluación de costes de medicamentos: julio-noviembre 2015.
- -
Evaluación de morbimortalidad: enero-mayo 2016.
- -
Evaluación de costes de episodios asistenciales: enero-mayo 2016.
No se planteó interrupción del ensayo porque no se esperaron daños asociados con la intervención25. Además, en caso de recurrencia de síntomas secundarios a la retirada de la MPI, ésta podía ser reiniciada en cualquier momento según criterio médico.
CegamientoEl cegamiento de los clústeres no fue posible porque los médicos conocían la asignación al GI al recibir las recomendaciones del farmacéutico.
Análisis estadísticoLas variables se analizaron a nivel paciente siguiendo el principio de intención de tratar, teniendo en cuenta todos los pacientes reclutados según el grupo al que fueron originalmente asignados.
Se realizó un análisis descriptivo para resumir las características basales de los pacientes y los criterios de MPI, empleando medidas de frecuencia y porcentaje para las variables cualitativas, y de tendencia central y dispersión (Media ± Desviación Estándar) para variables cuantitativas.
En el análisis comparativo entre GI y GC para las variables primarias y secundarias se emplearon las pruebas X2 y t Student para las variables cualitativas y cuantitativas respectivamente; proporcionando en todos los casos el tamaño del efecto expresado como diferencia de proporciones para variables cualitativas y diferencia de medias para variables cuantitativas, con sus respectivos IC 95%, como se muestra a continuación:
- -
Variables Primarias:
- •
Cualitativa: Pacientes con MPI.
- •
Cuantitativa: MPI/Paciente.
- •
- -
Variables Secundarias:
- •
Cualitativa: MORT.
- •
Cuantitativas: HOSP, AMBU, CA-MPI, CMORBI.
- •
Para tener en cuenta el efecto clúster, se calculó el coeficiente de correlación Kappa para las variables principales.
El tratamiento estadístico de los datos se realizó mediante el software «Statistical Package for Social Sciences» (SPSS) v22.0, y se consideró diferencia estadísticamente significativa si p < 0,05.
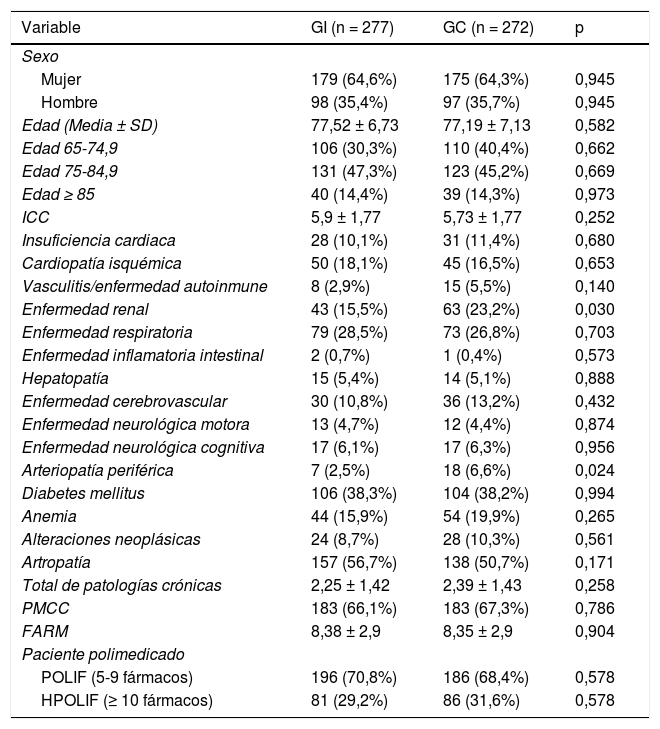
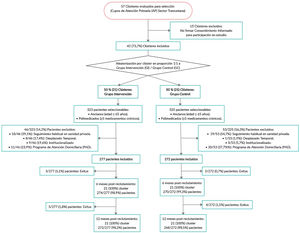
ResultadosSe reclutaron 21 clústeres en cada grupo con un total de 549 pacientes, cuyas características basales se detallan en la tabla 2. Fueron asignados al GI 277 pacientes (50,5%) y 272 (49,5%) al GC, resultando en un tamaño medio de clúster de 13,19 ± 6,91 y 12,9 5± 7,33 pacientes, respectivamente. Todos los pacientes fueron incluidos en el análisis de las variables primarias y secundarias según el grupo originalmente asignado.
Características basales de los pacientes
| Variable | GI (n = 277) | GC (n = 272) | p |
|---|---|---|---|
| Sexo | |||
| Mujer | 179 (64,6%) | 175 (64,3%) | 0,945 |
| Hombre | 98 (35,4%) | 97 (35,7%) | 0,945 |
| Edad (Media ± SD) | 77,52 ± 6,73 | 77,19 ± 7,13 | 0,582 |
| Edad 65-74,9 | 106 (30,3%) | 110 (40,4%) | 0,662 |
| Edad 75-84,9 | 131 (47,3%) | 123 (45,2%) | 0,669 |
| Edad ≥ 85 | 40 (14,4%) | 39 (14,3%) | 0,973 |
| ICC | 5,9 ± 1,77 | 5,73 ± 1,77 | 0,252 |
| Insuficiencia cardiaca | 28 (10,1%) | 31 (11,4%) | 0,680 |
| Cardiopatía isquémica | 50 (18,1%) | 45 (16,5%) | 0,653 |
| Vasculitis/enfermedad autoinmune | 8 (2,9%) | 15 (5,5%) | 0,140 |
| Enfermedad renal | 43 (15,5%) | 63 (23,2%) | 0,030 |
| Enfermedad respiratoria | 79 (28,5%) | 73 (26,8%) | 0,703 |
| Enfermedad inflamatoria intestinal | 2 (0,7%) | 1 (0,4%) | 0,573 |
| Hepatopatía | 15 (5,4%) | 14 (5,1%) | 0,888 |
| Enfermedad cerebrovascular | 30 (10,8%) | 36 (13,2%) | 0,432 |
| Enfermedad neurológica motora | 13 (4,7%) | 12 (4,4%) | 0,874 |
| Enfermedad neurológica cognitiva | 17 (6,1%) | 17 (6,3%) | 0,956 |
| Arteriopatía periférica | 7 (2,5%) | 18 (6,6%) | 0,024 |
| Diabetes mellitus | 106 (38,3%) | 104 (38,2%) | 0,994 |
| Anemia | 44 (15,9%) | 54 (19,9%) | 0,265 |
| Alteraciones neoplásicas | 24 (8,7%) | 28 (10,3%) | 0,561 |
| Artropatía | 157 (56,7%) | 138 (50,7%) | 0,171 |
| Total de patologías crónicas | 2,25 ± 1,42 | 2,39 ± 1,43 | 0,258 |
| PMCC | 183 (66,1%) | 183 (67,3%) | 0,786 |
| FARM | 8,38 ± 2,9 | 8,35 ± 2,9 | 0,904 |
| Paciente polimedicado | |||
| POLIF (5-9 fármacos) | 196 (70,8%) | 186 (68,4%) | 0,578 |
| HPOLIF (≥ 10 fármacos) | 81 (29,2%) | 86 (31,6%) | 0,578 |
Después de la aleatorización no se produjeron pérdidas de clústeres, ya que ningún médico solicitó revocación del consentimiento informado; 5/277 (1,8%) pacientes del GI y 4/272 (1,5%) pacientes del GC no completaron los 12 meses, como se puede observar en el Diagrama de Flujo (fig. 1).
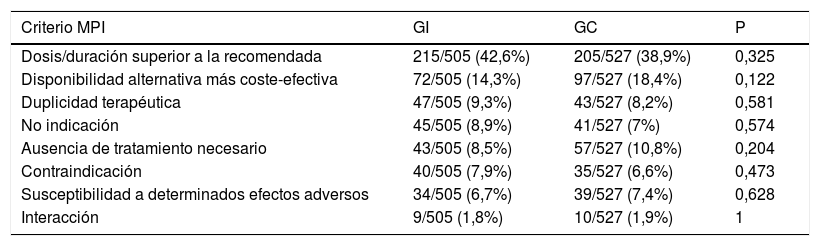
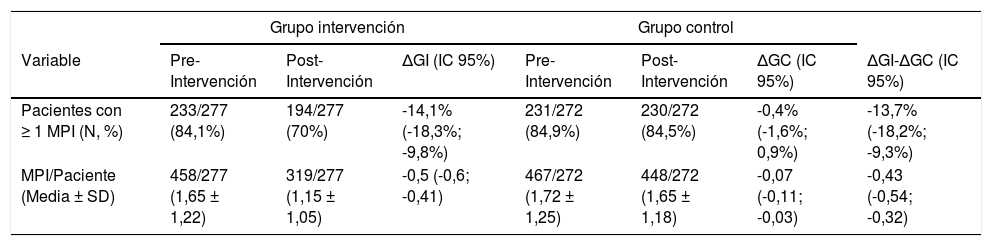
Se identificaron un total de 505 criterios de MPI en el GI y 527 en el GC, cuya distribución se muestra en la tabla 3. La proporción de pacientes con MPI disminuyó un 13,7% (IC 95%: 9,3; 18,2) más en el GI que en el GC, y el número medio de MPI se redujo en 0,43 MPI/paciente más en el GI que en el GC (IC 95%: 0,32; 0,54). El coeficiente de correlación Kappa resultante fue de 0,743 (IC 95%: 0,666; 0,810) y de 0,692 (IC 95%: 0,645; 0,735), respectivamente.
Distribución de MPI detectadas en GI y GC
| Criterio MPI | GI | GC | P |
|---|---|---|---|
| Dosis/duración superior a la recomendada | 215/505 (42,6%) | 205/527 (38,9%) | 0,325 |
| Disponibilidad alternativa más coste-efectiva | 72/505 (14,3%) | 97/527 (18,4%) | 0,122 |
| Duplicidad terapéutica | 47/505 (9,3%) | 43/527 (8,2%) | 0,581 |
| No indicación | 45/505 (8,9%) | 41/527 (7%) | 0,574 |
| Ausencia de tratamiento necesario | 43/505 (8,5%) | 57/527 (10,8%) | 0,204 |
| Contraindicación | 40/505 (7,9%) | 35/527 (6,6%) | 0,473 |
| Susceptibilidad a determinados efectos adversos | 34/505 (6,7%) | 39/527 (7,4%) | 0,628 |
| Interacción | 9/505 (1,8%) | 10/527 (1,9%) | 1 |
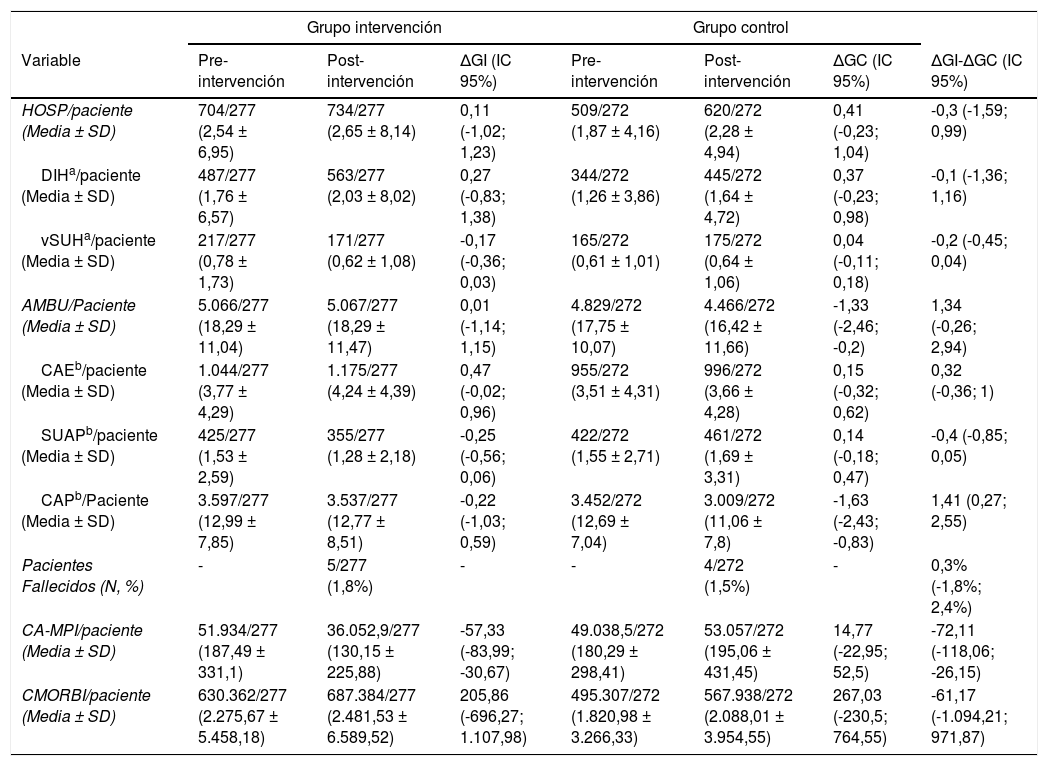
El incremento en HOSP fue menor para GI que para GC en 0,3 (IC 95%: -0,99; 1,59) episodios/paciente, mientras que el incremento en AMBU y en MORT fue mayor para GI que para GC en 1,34 (IC 95%: -2,94; 0,26) episodios/paciente y 0,3% (IC 95%: -1,8%; 2,4%), respectivamente. Respecto al impacto económico, se observó una reducción en CA-MPI de 72,11 (IC 95%: 26,15; 118,06) €/paciente mayor en GI que en GC y un incremento en CMORBI de 61,17 (IC 95%: -971,87; 1.094,21) €/paciente menor para GI que para GC.
Las comparaciones de los resultados obtenidos entre GI y GC en las fases pre- y post-intervención para las variables primarias y secundarias se muestran más detalladamente en las tablas 4 y 5, respectivamente.
Variables Principales: Proporción de pacientes con MPI y Número medio de MPI/paciente
| Grupo intervención | Grupo control | ||||||
|---|---|---|---|---|---|---|---|
| Variable | Pre-Intervención | Post-Intervención | ΔGI (IC 95%) | Pre-Intervención | Post-Intervención | ΔGC (IC 95%) | ΔGI-ΔGC (IC 95%) |
| Pacientes con ≥ 1 MPI (N, %) | 233/277 (84,1%) | 194/277 (70%) | -14,1% (-18,3%; -9,8%) | 231/272 (84,9%) | 230/272 (84,5%) | -0,4% (-1,6%; 0,9%) | -13,7% (-18,2%; -9,3%) |
| MPI/Paciente (Media ± SD) | 458/277 (1,65 ± 1,22) | 319/277 (1,15 ± 1,05) | -0,5 (-0,6; -0,41) | 467/272 (1,72 ± 1,25) | 448/272 (1,65 ± 1,18) | -0,07 (-0,11; -0,03) | -0,43 (-0,54; -0,32) |
ΔGI (IC 95): Diferencia entre las fases pre- y post-intervención en el Grupo Intervención (Intervalo de Confianza 95%); ΔGC (IC 95): Diferencia entre las fases.
Pre y post-intervención en el Grupo Control (IC 95%).
Variables secundarias: Número medio de episodios asistenciales (hospitalarios y ambulatorios) por paciente; proporción de pacientes fallecidos y coste medio/paciente (de medicamentos implicados en las MPI y episodios asistenciales)
| Grupo intervención | Grupo control | ||||||
|---|---|---|---|---|---|---|---|
| Variable | Pre-intervención | Post-intervención | ΔGI (IC 95%) | Pre-intervención | Post-intervención | ΔGC (IC 95%) | ΔGI-ΔGC (IC 95%) |
| HOSP/paciente (Media ± SD) | 704/277 (2,54 ± 6,95) | 734/277 (2,65 ± 8,14) | 0,11 (-1,02; 1,23) | 509/272 (1,87 ± 4,16) | 620/272 (2,28 ± 4,94) | 0,41 (-0,23; 1,04) | -0,3 (-1,59; 0,99) |
| DIHa/paciente (Media ± SD) | 487/277 (1,76 ± 6,57) | 563/277 (2,03 ± 8,02) | 0,27 (-0,83; 1,38) | 344/272 (1,26 ± 3,86) | 445/272 (1,64 ± 4,72) | 0,37 (-0,23; 0,98) | -0,1 (-1,36; 1,16) |
| vSUHa/paciente (Media ± SD) | 217/277 (0,78 ± 1,73) | 171/277 (0,62 ± 1,08) | -0,17 (-0,36; 0,03) | 165/272 (0,61 ± 1,01) | 175/272 (0,64 ± 1,06) | 0,04 (-0,11; 0,18) | -0,2 (-0,45; 0,04) |
| AMBU/Paciente (Media ± SD) | 5.066/277 (18,29 ± 11,04) | 5.067/277 (18,29 ± 11,47) | 0,01 (-1,14; 1,15) | 4.829/272 (17,75 ± 10,07) | 4.466/272 (16,42 ± 11,66) | -1,33 (-2,46; -0,2) | 1,34 (-0,26; 2,94) |
| CAEb/paciente (Media ± SD) | 1.044/277 (3,77 ± 4,29) | 1.175/277 (4,24 ± 4,39) | 0,47 (-0,02; 0,96) | 955/272 (3,51 ± 4,31) | 996/272 (3,66 ± 4,28) | 0,15 (-0,32; 0,62) | 0,32 (-0,36; 1) |
| SUAPb/paciente (Media ± SD) | 425/277 (1,53 ± 2,59) | 355/277 (1,28 ± 2,18) | -0,25 (-0,56; 0,06) | 422/272 (1,55 ± 2,71) | 461/272 (1,69 ± 3,31) | 0,14 (-0,18; 0,47) | -0,4 (-0,85; 0,05) |
| CAPb/Paciente (Media ± SD) | 3.597/277 (12,99 ± 7,85) | 3.537/277 (12,77 ± 8,51) | -0,22 (-1,03; 0,59) | 3.452/272 (12,69 ± 7,04) | 3.009/272 (11,06 ± 7,8) | -1,63 (-2,43; -0,83) | 1,41 (0,27; 2,55) |
| Pacientes Fallecidos (N, %) | - | 5/277 (1,8%) | - | - | 4/272 (1,5%) | - | 0,3% (-1,8%; 2,4%) |
| CA-MPI/paciente (Media ± SD) | 51.934/277 (187,49 ± 331,1) | 36.052,9/277 (130,15 ± 225,88) | -57,33 (-83,99; -30,67) | 49.038,5/272 (180,29 ± 298,41) | 53.057/272 (195,06 ± 431,45) | 14,77 (-22,95; 52,5) | -72,11 (-118,06; -26,15) |
| CMORBI/paciente (Media ± SD) | 630.362/277 (2.275,67 ± 5.458,18) | 687.384/277 (2.481,53 ± 6.589,52) | 205,86 (-696,27; 1.107,98) | 495.307/272 (1.820,98 ± 3.266,33) | 567.938/272 (2.088,01 ± 3.954,55) | 267,03 (-230,5; 764,55) | -61,17 (-1.094,21; 971,87) |
Episodios asistenciales individuales que componen la variable HOSP (DIH: Días de Ingreso Hospitalario; vSUH: Visitas al Servicio de Urgencias Hospitalarias).
Episodios asistenciales individuales que componen la variable AMBU (CAE: Consultas de Atención Especializada; SUAP: Visitas al Servicio de Urgencias de Atención Primaria; CAP: Consultas de Atención Primaria). ΔGI (IC95): Diferencia entre las fases pre- y post-intervención en el Grupo Intervención (Intervalo de Confianza 95%); ΔGC (IC 95): Diferencia entre las fases pre- y post-intervención en el Grupo Control (IC 95%)
La intervención resultó en una reducción significativamente mayor para GI que para GC de 13,7% (IC 95%: 9,3; 18,2) de pacientes con MPI; 0,43 (IC 95%: 0,32; 0,54) MPI/paciente y 72,11 (IC 95%: 26,15; 118,06) €/paciente para CA-MPI. Sin embargo, no se observaron diferencias estadísticamente significativas en morbilidad, mortalidad ni en costes de episodios asistenciales.
Nuestros resultados podrían corroborar la hipótesis de que la RSM-F reduce MPI, en línea con los resultados del estudio OPTI-SCRIPT, aunque este obtuvo mayor reducción tanto para GI como para GC en proporción de pacientes con MPI (47% vs. 22%, respectivamente) y MPI/paciente (45% vs. 15%, respectivamente)26; posiblemente debido a la mayor proporción inicial de pacientes con MPI, que en el estudio OPTI-SCRIPT fue del 100% en ambos grupos ya que era criterio de inclusión presentar ≥1 MPI, y al envío de feed-back informativo al GC sobre las MPI detectadas. Otro ejemplo es el estudio REMEI, que mostró reducción del 80,9% de MPI mediante reuniones presenciales médico-farmacéutico27, las cuales no fueron posible en nuestro estudio, porque el reclutamiento de pacientes se realizó el día anterior a la consulta, y por la elevada dispersión geográfica de los centros participantes.
Sin embargo, esta reducción significativa de MPI no se correlaciona claramente con reducción de morbimortalidad, acorde con los resultados observados en diversos estudios16–18,27,28; posiblemente porque el tamaño muestral, calculado para demostrar reducción significativa en la proporción de pacientes con MPI y el tiempo de seguimiento, resultaron insuficientes para obtener diferencias significativas en estas variables.
Nuestra reducción no significativa de episodios asistenciales hospitalarios está en línea con la amplia variabilidad observada en diversas revisiones sistemáticas, que muestran valores de riesgo relativo (RR) de ingreso hospitalario que oscilan desde 0,87 (IC 95%: 0,52; 1,47) hasta 1,11 (IC 95%: 0,99; 1,24)16,18,28, sin diferencias estadísticamente significativas. Sin embargo, nuestra intervención conllevó un aumento no significativo de episodios asistenciales ambulatorios, acorde con el estudio REMEI27; quizás porque el mayor número de modificaciones de tratamiento en GI supuso un mayor seguimiento a nivel ambulatorio, redundando en una menor frecuentación hospitalaria.
Respecto al impacto económico, nuestra reducción del 30,6% en coste de medicamentos para GI e incremento del 8,2% para GC coinciden en parte con los resultados obtenidos por Campins (reducción de 14,3% y 7,7% para GI y GC, respectivamente)15, posiblemente porque Campins evaluó el coste de todos los medicamentos que tomaba el paciente y nosotros únicamente aquellos implicados en las MPI. Sin embargo, nuestros resultados sobre costes asistenciales muestran una tendencia inversa a la evaluación económica del estudio OPTI-SCRIPT, donde el incremento es 407€ (IC 95%: -357; 1170) mayor para GI29. Una posible explicación podría ser que los principales medicamentos retirados en el estudio OPTI-SCRIPT fueron inhibidores de la bomba de protones26, sin impacto relevante sobre la salud de los pacientes ni sobre el consumo de recursos sanitarios.
Como fortalezas cabe destacar la aleatorización por clústeres, para prevenir contaminación entre pacientes del GI y del GC atendidos por el mismo médico27. Además, al ser un estudio pragmático, realizado en condiciones reales y estableciendo criterios de selección poco restrictivos, sus conclusiones podrían ser generalizables a otras regiones y/o ámbitos asistenciales con elevada prevalencia de estos pacientes, tanto consultas de AP, como determinadas unidades de hospitalización (medicina interna, geriatría), o centros sociosanitarios. Finalmente, la combinación de diversas herramientas de detección de MPI, incluyendo criterios de eficiencia, permitió detectar mayor cantidad de MPI y más oportunidades de optimización del tratamiento.
Sin embargo, nuestro estudio presenta algunas limitaciones. La principal hace referencia al diseño abierto, ya que los médicos conocían su pertenencia al GI al recibir las recomendaciones del farmacéutico. Este hecho pudo provocar aparición de sesgos, minimizados mediante la aleatorización de clústeres por personal ajeno al estudio. Otra posible limitación fue emplear la HCE como única fuente de información. Por una parte, se pudo haber producido infra- o sobre-detección de MPI al no tener en cuenta, por ejemplo, medicamentos no financiados o condiciones clínicas no registradas. Por otra parte, no se evaluó la adherencia, a pesar de ser una importante preocupación en los pacientes crónicos30, ya que se consideraron los medicamentos prescritos independientemente de las dispensaciones efectuadas, por lo que se desconoce el impacto en morbimortalidad del manejo MPI con baja adherencia. En ambos supuestos, debido al diseño aleatorizado, es previsible que este hecho afectara de forma similar a GI y GC, sin influir significativamente en el efecto de la intervención. Finalmente, aunque no formaba parte de los objetivos realizar un análisis de coste-efectividad, se comparó el coste de la intervención calculado en base al tiempo empleado en la RSM-F y al salario del farmacéutico, el cual resultó inferior al ahorro en medicamentos (7.706€ vs 19.899,6€, respectivamente). No obstante, sería conveniente realizar análisis de coste-efectividad adecuadamente planteados.
En conclusión, la RSM-F en pacientes mayores polimedicados en AP pudo haber contribuido a reducir significativamente la proporción de pacientes con MPI y el número medio de MPI/paciente, así como el coste de los medicamentos implicados en las mismas, pero sin influir significativamente en morbilidad, mortalidad o coste de episodios asistenciales.
Registro: El protocolo fue registrado en ClinicalTrials.gov con identificador NCT02224833, y está disponible públicamente en: https://clinicaltrials.gov/ct2/show/NCT02224833. Los cambios acontecidos después del reclutamiento se pueden consultar en: https://clinicaltrials.gov/ct2/history/NCT02224833.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Joan Llobera Cànaves por proporcionar asesoramiento metodológico. A Aina María Yañez Juan y al Instituto de Investigación Sanitaria de Baleares por la aleatorización de clústeres. A Alfonso Leiva Rus por proporcionar asesoramiento estadístico. A Pilar Gayoso Diz por revisar el formulario de recogida de datos.