El uso prolongado de metformina puede causar efectos secundarios como deficiencia de vitamina B12. El objetivo de este estudio fue evaluar la seguridad y la eficacia del uso de complejo B intramuscular para mejorar los niveles séricos de vitamina B12 en pacientes con uso prolongado de metformina y niveles subóptimos de vitamina B12.
Materiales y métodosEn este estudio de fase IV participaron adultos con diabetes tipo 2, tratados con metformina (de 3 o más años) y vitamina B12 sérica inferior a 300 pg/ml. La intervención consistió en inyecciones intramusculares de complejo B, con seguimiento presencial y telefónico.
ResultadosDe 201 pacientes evaluados, 40 pacientes en la visita inicial tenían deficiencia de cianocobalamina (19,9%) y de estos, solo 33 (82%) completaron el seguimiento de 6 semanas. Se observo un cambio estadísticamente significativo al comparar los niveles basales de vitamina B12 contra finales (p < 0,001) en el 99,5% de los pacientes. No se observaron cambios significativos en signos y síntomas de neuropatía, exceptuando los calambres en las piernas y debilidad general. Los síntomas de anemia se mantuvieron sin cambios en la mayoría de los pacientes. No se notificaron efectos adversos.
ConclusionesLa administración intramuscular de complejo B es segura y eficaz en incrementar los niveles séricos de vitamina B12 en pacientes con diabetes tipo 2 y uso prolongado de metformina. No se observaron mejoras significativas en los síntomas de neuropatía ni anemia. El tratamiento fue bien tolerado y sin efectos adversos.
Prolonged use of metformin can cause side effects such as vitamin B12 deficiency. The objective of this study was to evaluate the safety and efficacy of intramuscular B-complex to improve serum vitamin B12 levels in patients with prolonged use of metformin and suboptimal vitamin B12 levels.
Materials and methodsThis Phase IV study included adults with type 2 diabetes treated with metformin (≥3 years) and serum vitamin B12 levels below 300 pg/ml. The intervention consisted of intramuscular injections of B-complex, with face-to-face and telephone follow-up.
ResultsOf the 201 patients evaluated, 40 patients at the initial visit had cobalamin deficiency (19.9%), and of these, only 33 (82%) completed the 6-week follow-up. A statistically significant change was observed when comparing baseline vitamin B12 levels with final levels (p < 0.001) in 99.5% of the patients. No significant changes were observed in signs and symptoms of neuropathy, except for leg cramps and general weakness. Anemia symptoms remained unchanged in most patients. No adverse effects were reported.
ConclusionsIntramuscular administration of B-complex is safe and effective in increasing serum vitamin B12 levels in patients with type 2 diabetes and prolonged use of metformin. No significant improvements were observed in neuropathy or anemia symptoms. The treatment was well tolerated, and no adverse effects were reported.
La diabetes mellitus tipo 2 (DM2) es una enfermedad crónica que requiere esquemas de tratamiento en constante cambio, desde monoterapia hasta la combinación de varios medicamentos para lograr control glucémico. De todos los medicamentos disponibles, la metformina es una de las más utilizadas, debido a su eficacia y seguridad. Como con cualquier medicamento, puede haber efectos secundarios que afecten la adherencia al tratamiento. Además de síntomas gastrointestinales, existen otros efectos secundarios menos conocidos en pacientes con uso prolongado de metformina, como la deficiencia de vitamina B121. En el estudio EMBER se encontró que aquellos con exposición a metformina durante 4 años o más, tuvieron un riesgo relativo del 41% para la presencia de niveles bajos de vitamina B122.
La vitamina B12 es una vitamina que actúa como cofactor en vías metabólicas importantes, incluyendo el funcionamiento del sistema nervioso y el desarrollo de eritrocitos3,4. Aunque no está claro cómo la metformina reduce la vitamina B125, se ha registrado un aumento de los casos de deficiencia de vitamina B12 en pacientes con diabetes que toman metformina6,7. Algunos autores reportan deficiencia de vitamina B12 en 6–30% de los pacientes que toman metformina de forma prolongada8,9, y otros comentan que niveles subóptimos de vitamina B12 podrían empeorar los síntomas de neuropatía10. Además, no hay una guía clínica o consenso detallado, sobre cómo tratar y cuándo medir los niveles séricos de vitamina B12 en pacientes con diabetes en tratamiento con metformina.
El objetivo de este estudio fase IV es evaluar la seguridad y eficacia de la administración de complejo B intramuscular sobre el incremento en los niveles séricos de vitamina B12 en pacientes con DM2, exposición prolongada a metformina y niveles subóptimos de vitamina B12.
Material y métodosDiseño del ensayoEstudio fase IV, el cual investiga la seguridad y la eficacia de complejo B intramuscular en el incremento de los niveles séricos de vitamina B12 en pacientes con DM2, uso prolongado de metformina y niveles subóptimos de vitamina B12. Todos los procedimientos realizados se ajustaron a las normas éticas de la Declaración de Helsinki de 1964 y fueron planeados a priori. El protocolo fue aprobado por el Comité de Ética en Investigación y Comité de Investigación del Centro Especializado en Diabetes, Obesidad y Prevención de Enfermedades Cardiovasculares y autorizado por COFEPRIS con el número de protocolo GMX-001-2021.
ParticipantesAdultos con DM2 que hayan utilizado metformina por más de 3 años en una dosis diaria mayor de 2.000 mg y con niveles de vitamina B12 menores a 300 pg/ml (221 pmol/l)11,12 fueron invitados a participar. Se excluyeron participantes con antecedente de: hipersensibilidad a los componentes del complejo B utilizado(Bedoyecta® Tri), cetoacidosis diabética o estado hiperglucémico hiperosmótico en las últimas 12 semanas, enfermedad cardiovascular (últimos 12 meses), enfermedades hepáticas como hepatitis vírica crónica, insuficiencia hepática o cirrosis, abuso de sustancias o alcohol, enfermedades o tratamiento oncológico, enfermedad endocrinológica no controlada, gota o enfermedades hematológicas, exposición en los últimos 3 meses a cualquier fármaco supresor de la médula ósea, y antecedente de deficiencia de hierro o ácido fólico. Se excluyeron pacientes potencialmente fértiles sin un método anticonceptivo seguro, distinto del preservativo, que buscaran quedarse embarazadas durante el periodo de seguimiento del estudio, a pacientes que tuvieran programada una intervención quirúrgica u hospitalización durante el periodo del estudio y a pacientes que estuvieran participando en otro ensayo clínico.
Se realizó una historia clínica completa y revisión de los criterios de inclusión y exclusión; se tomaron muestras de sangre para obtener una determinación de cianocobalamina en sangre, y en 2–4 semanas posteriores, se incluyeron en el estudio aquellos con niveles de vitamina B12 menores de 300 pg/ml (221 pmol/l). Se obtuvo un consentimiento informado en la fase de tamizaje inicial y un segundo consentimiento informado para la inclusión en el estudio. Los participantes con niveles de vitamina B12 de 300 pg/ml (221 pmol/l) o más, fueron eliminados. Antes de la primera administración de complejo B intramuscular se realizó un examen físico completo, medición de sus signos vitales y un cuestionario validado para neuropatía (Instrumento de detección de neuropatías de Michigan [MNSI]) y preguntas directas para detectar signos y síntomas de anemia.
IntervencionesSe realizó una biometría hemática completa, panel metabólico básico, panel lipídico y hemoglobina glucosilada. Se aplicó una inyección intramuscular de complejo B y se informó al paciente de los posibles efectos adversos, junto con instrucciones y un número de contacto. La segunda y cuarta inyecciones fueron administradas en el sitio de investigación por personal cualificado. Cada vial de complejo B (Bedoyecta® Tri) contenía 10.000 μg de hidroxocobalamina, 100 mg de vitamina B1, 50 mg de vitamina B6 y 2 ml de vehículo.
El seguimiento se llevó mediante llamadas telefónicas y visitas en persona al centro de investigación. Siete días después de la visita inicial, se contactó vía telefónica a los participantes para hablar de posibles efectos adversos, tratamiento adicional y verificar el uso adecuado de la medicación del estudio. El día 14 los pacientes volvieron al centro de investigación para un examen físico completo, evaluación de signos vitales y administración de la tercera dosis. El día 21 se realizó un seguimiento telefónico similar al día 7. El día 28 los pacientes regresaron al centro para revisión física y administración de la dosis final. La medicación fue administrada por personal sanitario calificado los días 1, 14 y 28 en el centro, y los días 7 y 21 en el domicilio con instrucciones detalladas y asistencia de profesionales sanitarios seleccionados por los pacientes.
Cuarenta y dos días después de la visita inicial, en el centro de investigación, se realizó un examen físico y registro de signos vitales, se aplicó nuevamente el MNSI13 y se interrogó sobre signos o síntomas de anemia, como fatiga, malestar, debilidad, piel pálida o amarillenta o caída del cabello. Se realizó un segundo hemograma completo con un diferencial de glóbulos blancos, un panel metabólico básico, un panel lipídico y niveles de hemoglobina glucosilada, así como los niveles de cianocobalamina en sangre, evaluados inicialmente durante la primera visita.
DesenlacesEl desenlace primario fue el cambio en niveles séricos de vitamina B12 tras la aplicación intramuscular de complejo B, y su perfil de seguridad tras administración de 5 dosis. Los desenlaces secundarios incluyeron: 1) proporción de pacientes que alcanzan niveles séricos normales de cianocobalamina 2) cambio medio en estos niveles posterior al tratamiento 3) porcentaje de pacientes con niveles bajos de cianocobalamina y signos de neuropatía, 4) proporción de pacientes con niveles subóptimos de cianocobalamina y signos de anemia 5) el porcentaje de pacientes que muestran mejoría en estas áreas; 6) efectos adversos; y 7) satisfacción de los pacientes con la medicación.
Tamaño de la muestraMediante una fórmula para muestras dependientes14, potencia del 90%, alfa de 0,05, beta de 0,1 y desviación estándar de 16515,16, resultando un total de 77 sujetos, agregando 15% por posibles pérdidas, dio un total de 88 participantes. Se planificó un análisis intermedio de 50 sujetos, aplicando la fórmula para muestras emparejadas y tomando como referencia: los valores comunicados por Kuzminski et al. (325 ± 165 [n = 18])15, y el error reportado por la fórmula de Cortes et al., (76,27) para el tamaño muestral17. Debido a dificultades en el reclutamiento, tiempo y restricciones presupuestarias, el reclutamiento se detuvo en 33 participantes con niveles subóptimos de vitamina B12 en suero. Tras un análisis de poder post hoc para el tamaño muestral obtenido, se encontró una potencia de 1,0 (100%), lo que sugiere que, con el tamaño muestral actual de 33 participantes y la gran diferencia observada en los niveles de cianocobalamina, el estudio tiene una alta probabilidad de detectar un efecto significativo, si es que realmente existe.
Métodos estadísticosSe realizó un análisis por intención a tratar utilizando la última observación trasladada. Se presentan medias y desviaciones estándar o medianas y rangos intercuartílicos. Las comparaciones antes y después de la intervención se realizaron mediante T de student pareada o la prueba de rangos con signo de Wilcoxon, previa comprobación de su distribución. Las variables categóricas se resumieron mediante frecuencias y porcentajes y se analizaron mediante Ji cuadrada. Un valor p < 0,05 se consideró estadísticamente significativo.
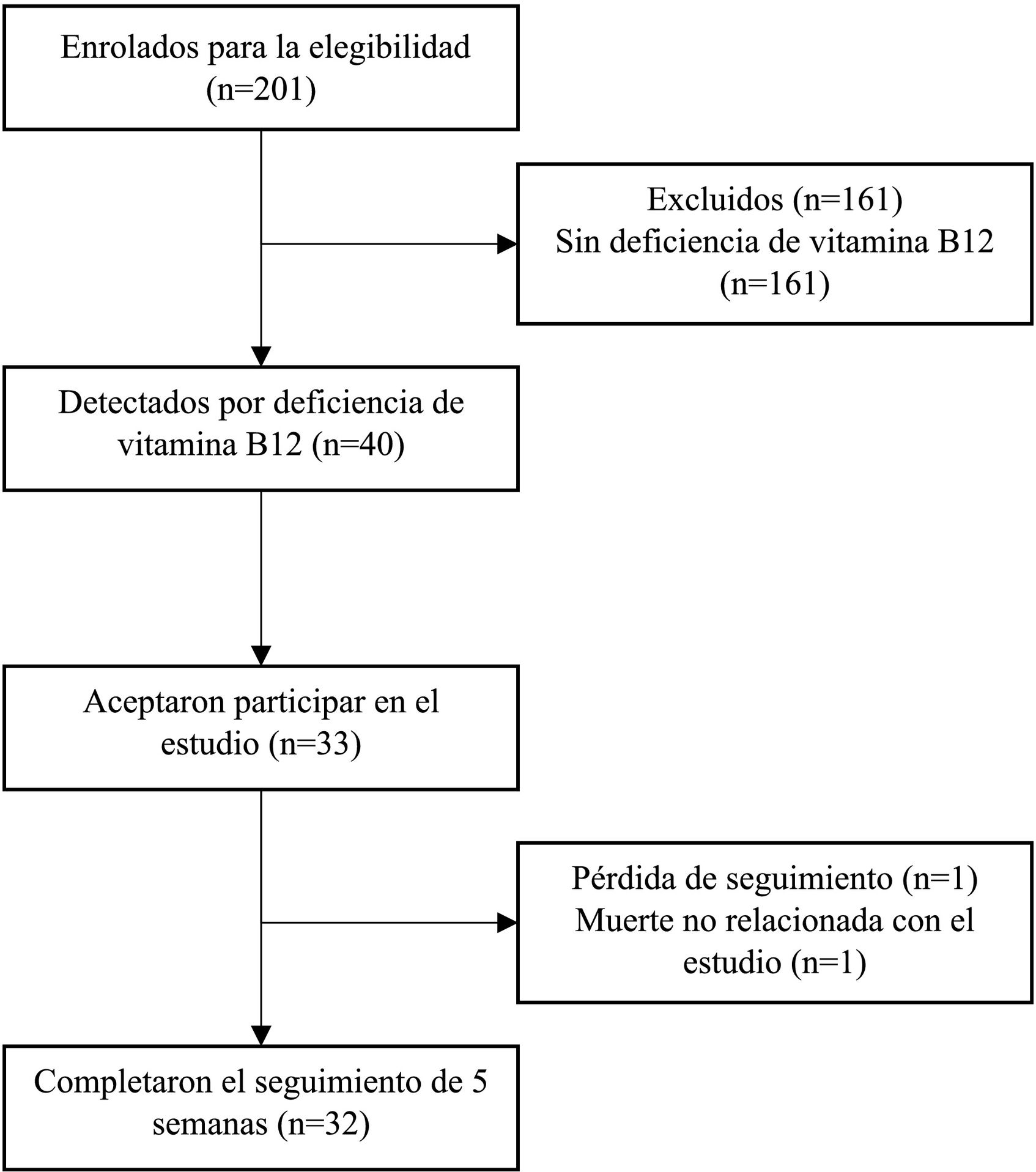
ResultadosFlujo de participantesDe los 201 pacientes examinados durante el enrolamiento, 40 (19,9%) presentaban niveles de cianocobalamina menores de 300 pg/ml. La mediana de cianocobalamina fue de 466 (IQR 326–708) pg/ml. Al comparar pacientes con deficiencia de cianocobalamina y sin deficiencia, se encontró una mediana de 225 (IQR 178–262) pg/ml y 548 (427–823) pg/ml, respectivamente.
De los 40 pacientes con deficiencia de cianocobalamina, siete negaron a participar, resultando 33 pacientes incluidos, 32 completaron el seguimiento de 6 semanas (fig. 1).
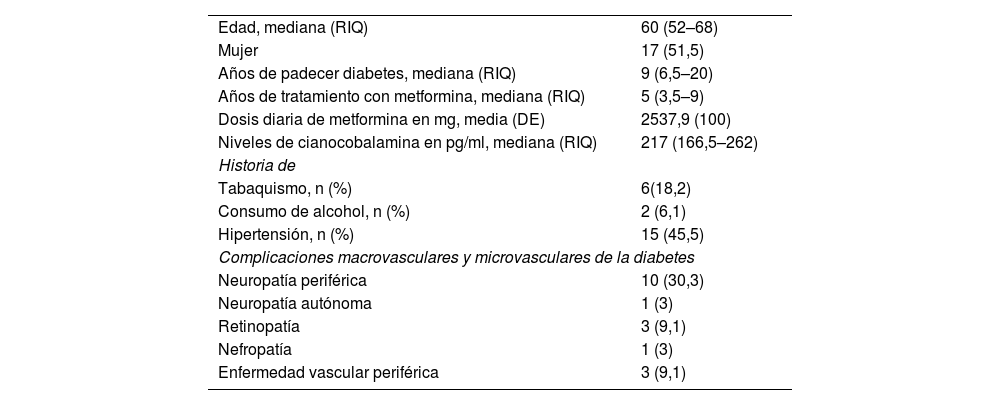
Características de los participantesLa edad de los participantes osciló entre 38 y 76 años (mediana: 60 años; RIQ 52–68), con un 51,5% de mujeres, 45,5% presentaban hipertensión, 18,2% tabaquismo y 6,1% bebían alcohol. Diez (30,3%) presentaban neuropatía periférica (tabla 1).
Características basales de los pacientes incluidos (n = 33)
| Edad, mediana (RIQ) | 60 (52–68) |
| Mujer | 17 (51,5) |
| Años de padecer diabetes, mediana (RIQ) | 9 (6,5–20) |
| Años de tratamiento con metformina, mediana (RIQ) | 5 (3,5–9) |
| Dosis diaria de metformina en mg, media (DE) | 2537,9 (100) |
| Niveles de cianocobalamina en pg/ml, mediana (RIQ) | 217 (166,5–262) |
| Historia de | |
| Tabaquismo, n (%) | 6(18,2) |
| Consumo de alcohol, n (%) | 2 (6,1) |
| Hipertensión, n (%) | 15 (45,5) |
| Complicaciones macrovasculares y microvasculares de la diabetes | |
| Neuropatía periférica | 10 (30,3) |
| Neuropatía autónoma | 1 (3) |
| Retinopatía | 3 (9,1) |
| Nefropatía | 1 (3) |
| Enfermedad vascular periférica | 3 (9,1) |
RIQ: rango intercuartílico; SD: desviación estándar.
La mediana del nivel basal de cianocobalamina en los 33 pacientes fue de 217 (RIQ 166,5–262) pg/ml. Al final, los niveles aumentaron a 4.000 (RIQ 2.971–4.000) pg/ml, (p < 0,001). Inicialmente, los 33 pacientes presentaban niveles bajos de cianocobalamina; solo un paciente (3%) siguió teniendo niveles bajos (p < 0,001), el cual se perdió durante el seguimiento debido a fallecimiento no relacionada con la intervención.
Los resultados de laboratorio no difirieron en comparación con los valores iniciales, excepto la hemoglobina glucosilada, que disminuyó de 6,8 a 6,6 (p < 0,004). Material Suplementario 1.
Cianocobalamina y neuropatíaLa mediana en neuropatía evaluada mediante MNSI no mostró diferencias significativas (p = 0,16). Aunque, al comparar individualmente cada ítem de MNSI, los calambres en piernas y pies y la sensación de debilidad si mostraron cambio (p = 0,04 y p = 0,01, respectivamente) (tabla 2).
Michigan Neuropathy Screening Instrument resultados en frecuencias y porcentajes
| Basal n = 33 | A 6 semanas de seguimiento n = 33 | p* | |
|---|---|---|---|
| Antecedentes | |||
| 1. ¿Tienes las piernas y/o los pies entumecidos? | 15 (45,5) | 8 (24,2) | 0,12 |
| 2. ¿Siente alguna vez ardor en las piernas y/o en los pies? | 13 (39,4) | 10 (30,3) | 0,6 |
| 3. ¿Son sus pies demasiado sensibles al tacto? | 7 (21,2) | 6 (18,2) | 0,99 |
| 4. ¿Tienes calambres musculares en las piernas y/o en los pies? | 18 (54,4) | 9 (27,3) | 0,04 |
| 5. ¿Siente alguna vez punzadas en las piernas o en los pies? | 11 (33,3) | 4 (12,1) | 0,07 |
| 6. ¿Te duele cuando las sábanas tocan tu piel? | 1 (3) | 1 (3) | 0,99 |
| 7. Cuando te metes en la bañera o en la ducha, ¿eres capaz de distinguir el agua caliente del agua fría? | 30 (90,9) | 28 (84,8) | 0,70 |
| 8. ¿Ha tenido alguna vez una llaga abierta en el pie? | 9 (27,3) | 6 (18,2) | 0,55 |
| 9. ¿Le ha dicho alguna vez su médico que padece neuropatía diabética? | 14 (42,4) | 19 (57,6) | 0,32 |
| 10. ¿Te sientes débil la mayor parte del tiempo? | 12 (36,4) | 3 (9,1) | 0,01 |
| 11. ¿Los síntomas empeoran por la noche? | 11 (33,3) | 11 (33,3) | 0,99 |
| 12. ¿Te duelen las piernas al andar? | 12 (36,4) | 12 (36,4) | 0,99 |
| 13. ¿Eres capaz de sentir tus pies cuando caminas? | 30 (90,9) | 31 (93,8) | 0,99 |
| 14. ¿La piel de los pies está tan seca que se agrieta? | 6 (18,2) | 4 (12,1) | 0,73 |
| 15. ¿Ha sufrido alguna vez una amputación? | 2 (6,1) | 1 (3) | 0,99 |
| Evaluación física | |||
| Aspecto normal del pie derecho | 26 (78,8) | 27 (81,8) | 0,99 |
| Aspecto normal del pie izquierdo | 25 (75,8) | 27 (81,8) | 0,76 |
| Ulceración en el pie derecho | 0 (0) | 0 (0) | 0,99 |
| Ulceración en el pie izquierdo | 1 (3) | 1 (3) | 0,99 |
| Reflejos del tobillo en ambos pies | 0,42 | ||
| Presente | 27 (81,8) | 28 (87,9) | |
| Presente/Reforzamiento | 5 (15,2) | 2 (6,1) | |
| Ausente | 1 (3) | 2 (6,1) | |
| Percepción de vibraciones en los dedos gordos de los pies | 0,05 | ||
| Presente | 21 (63,6) | 29 (87,9) | |
| Reducido | 9 (27,3) | 2 (6,1) | |
| Ausente | 3 (9,1) | 2 (6,1) | |
| Monofilamento | 0,09 | ||
| Normal | 21 (63,6) | 27 (84,8) | |
| Reducido | 10 (30,3) | 3 (9,1) | |
| Ausente | 2 (6,1) | 2 (6,1) | |
| MNSIQ; mediana (RIQ) | 3 (1–5) | 2 (1–4) | 0,16 |
*Ji2, prueba exacta de Fisher; prueba de rangos con signo de Wilcoxon; RIQ, rango intercuartílico; MNSIQ, MNSI Questionnaire (cuestionario del paciente).
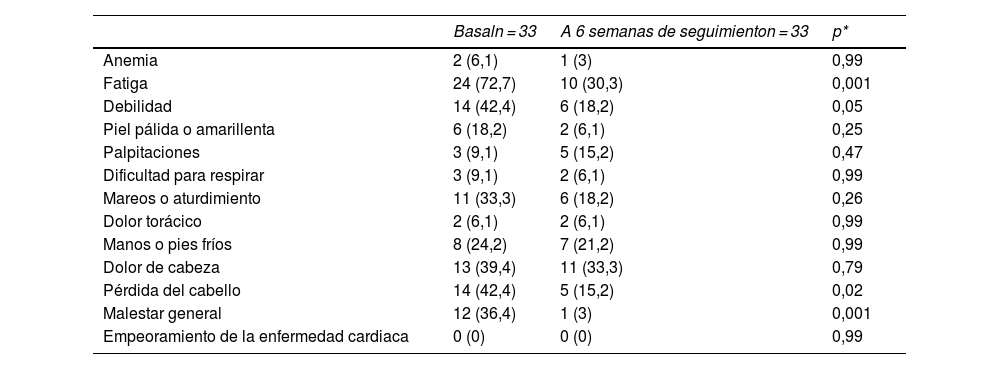
Al inicio del estudio, 2 (6,1%) de 33 pacientes tenían anemia, y al final 1 (3%) la presentaba (p = 0,99). Respecto a los signos y síntomas de anemia, ninguno mostró una diferencia, salvo el malestar general (p = 0,001), pérdida de cabello (p = 0,028) y la fatiga (p = 0,001). No se observó ningún empeoramiento de la enfermedad cardiaca durante el estudio (tabla 3).
Frecuencias y porcentajes de respuestas afirmativas a los signos y síntomas de anemia
| Basaln = 33 | A 6 semanas de seguimienton = 33 | p* | |
|---|---|---|---|
| Anemia | 2 (6,1) | 1 (3) | 0,99 |
| Fatiga | 24 (72,7) | 10 (30,3) | 0,001 |
| Debilidad | 14 (42,4) | 6 (18,2) | 0,05 |
| Piel pálida o amarillenta | 6 (18,2) | 2 (6,1) | 0,25 |
| Palpitaciones | 3 (9,1) | 5 (15,2) | 0,47 |
| Dificultad para respirar | 3 (9,1) | 2 (6,1) | 0,99 |
| Mareos o aturdimiento | 11 (33,3) | 6 (18,2) | 0,26 |
| Dolor torácico | 2 (6,1) | 2 (6,1) | 0,99 |
| Manos o pies fríos | 8 (24,2) | 7 (21,2) | 0,99 |
| Dolor de cabeza | 13 (39,4) | 11 (33,3) | 0,79 |
| Pérdida del cabello | 14 (42,4) | 5 (15,2) | 0,02 |
| Malestar general | 12 (36,4) | 1 (3) | 0,001 |
| Empeoramiento de la enfermedad cardiaca | 0 (0) | 0 (0) | 0,99 |
*ji2, prueba exacta de Fisher.
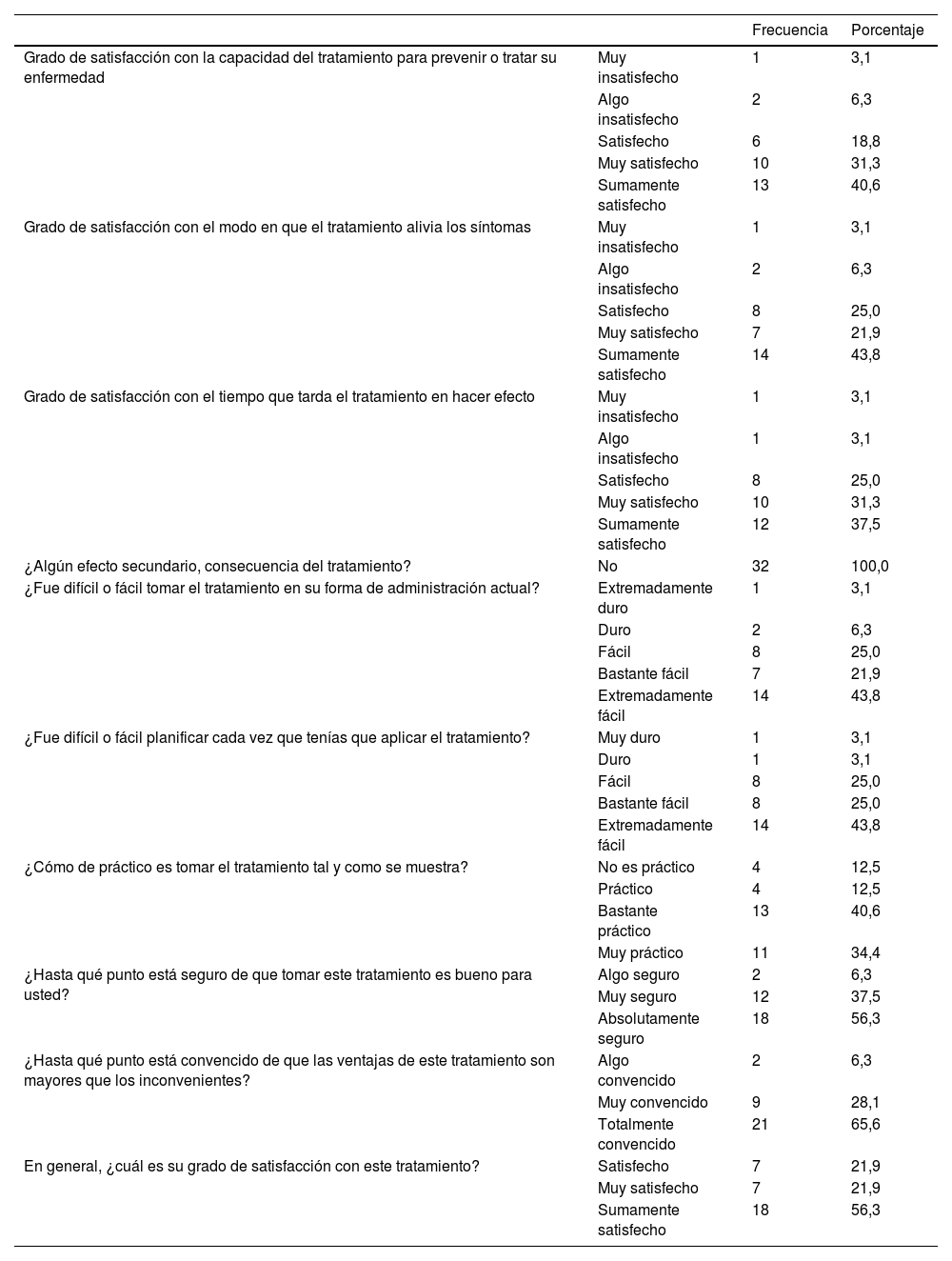
De los 32 pacientes que completaron el seguimiento, 3 pacientes (9,4%) no se sintieron satisfechos con el tratamiento, y 2 (6,2%) con el tiempo en que el tratamiento hizo efecto. Ninguno reportó la presencia de algún efecto adverso, excepto por la sensación de dolor al momento de la aplicación intramuscular (tabla 4).
Perfil de seguridad y satisfacción del tratamiento
| Frecuencia | Porcentaje | ||
|---|---|---|---|
| Grado de satisfacción con la capacidad del tratamiento para prevenir o tratar su enfermedad | Muy insatisfecho | 1 | 3,1 |
| Algo insatisfecho | 2 | 6,3 | |
| Satisfecho | 6 | 18,8 | |
| Muy satisfecho | 10 | 31,3 | |
| Sumamente satisfecho | 13 | 40,6 | |
| Grado de satisfacción con el modo en que el tratamiento alivia los síntomas | Muy insatisfecho | 1 | 3,1 |
| Algo insatisfecho | 2 | 6,3 | |
| Satisfecho | 8 | 25,0 | |
| Muy satisfecho | 7 | 21,9 | |
| Sumamente satisfecho | 14 | 43,8 | |
| Grado de satisfacción con el tiempo que tarda el tratamiento en hacer efecto | Muy insatisfecho | 1 | 3,1 |
| Algo insatisfecho | 1 | 3,1 | |
| Satisfecho | 8 | 25,0 | |
| Muy satisfecho | 10 | 31,3 | |
| Sumamente satisfecho | 12 | 37,5 | |
| ¿Algún efecto secundario, consecuencia del tratamiento? | No | 32 | 100,0 |
| ¿Fue difícil o fácil tomar el tratamiento en su forma de administración actual? | Extremadamente duro | 1 | 3,1 |
| Duro | 2 | 6,3 | |
| Fácil | 8 | 25,0 | |
| Bastante fácil | 7 | 21,9 | |
| Extremadamente fácil | 14 | 43,8 | |
| ¿Fue difícil o fácil planificar cada vez que tenías que aplicar el tratamiento? | Muy duro | 1 | 3,1 |
| Duro | 1 | 3,1 | |
| Fácil | 8 | 25,0 | |
| Bastante fácil | 8 | 25,0 | |
| Extremadamente fácil | 14 | 43,8 | |
| ¿Cómo de práctico es tomar el tratamiento tal y como se muestra? | No es práctico | 4 | 12,5 |
| Práctico | 4 | 12,5 | |
| Bastante práctico | 13 | 40,6 | |
| Muy práctico | 11 | 34,4 | |
| ¿Hasta qué punto está seguro de que tomar este tratamiento es bueno para usted? | Algo seguro | 2 | 6,3 |
| Muy seguro | 12 | 37,5 | |
| Absolutamente seguro | 18 | 56,3 | |
| ¿Hasta qué punto está convencido de que las ventajas de este tratamiento son mayores que los inconvenientes? | Algo convencido | 2 | 6,3 |
| Muy convencido | 9 | 28,1 | |
| Totalmente convencido | 21 | 65,6 | |
| En general, ¿cuál es su grado de satisfacción con este tratamiento? | Satisfecho | 7 | 21,9 |
| Muy satisfecho | 7 | 21,9 | |
| Sumamente satisfecho | 18 | 56,3 | |
Es importante mencionar un evento adverso serio, que a juicio del investigador no estuvo relacionado con la administración del complejo B (coma hiperosmolar y cetosis asociado a urosepsis y neumonía).
DiscusiónEn este estudio fase IV, se encontró que 19,9% de los pacientes tenía niveles subóptimos de vitamina B12 al inicio y asociado con ingesta crónica de metformina. Aplicar complejo B intramuscular semanal durante 5 semanas fue bien tolerada, segura y aumentó significativamente los niveles séricos de cianocobalamina, el incremento de cianocobalamina se asoció con una mejoría significativa en calambres musculares en las piernas, disminución de la sensación de debilidad general, y disminución en los signos y síntomas de anemia (malestar general, pérdida de cabello y fatiga).
L a prevalencia de deficiencia de vitamina B12 (19,9%) fue similar a la descrita en la bibliografía, que varía entre 17,8 y 27%18,19. En 546 pacientes con DM2, la prevalencia reportada de deficiencia de vitamina B12 fue de 12,7%19. Vargas-Uricoechea et al., emplearon el punto de corte para definir deficiencia a 200 pg/ml (12,7%) y para un valor limítrofe-subóptimo a un valor inferior a 300 pg/ml (19,2%).
En los reportes de Vargas19 y Didangelos20 el nivel medio de vitamina B12 fue de 187 pg/ml y un valor subóptimo de 231 pg/ml, respectivamente, lo cual concuerda con nuestros hallazgos (nivel basal de B12 de 217 (RIQ 166,5–262) pg/ml.
Didangelos et al., realizaron un estudio doble ciego, controlado con placebo, con 90 pacientes con DM2 y neuropatía, tratados con metformina por al menos 4 años. Evaluaron el impacto del aumento de los niveles de vitamina B12 administrando 1.000 mcg de metilcobalamina en la mejoría de la neuropatía periférica y autonómica. Observaron niveles promedio de 771 pg/ml20, en contraste con los 4000 (RIQ 2.971–4.000) pg/ml en nuestro estudio. Esta discrepancia podría explicarse por la vía de administración (oral vs. intramuscular) y el periodo de seguimiento (52 vs. 6 semanas).
Alvarez et al., encontraron en un estudio observacional, mayor prevalencia de neuropatía en aquellos con ingesta crónica de metformina y niveles subóptimos de vitamina B12 (versus aquellos con niveles normales de vitamina B12)21. Nuestro estudio no mostró diferencias significativas en la neuropatía evaluada por el MNSI, excepto al evaluar los calambres en piernas y pies.
Sharma et al. informaron una mejora en la percepción de las vibraciones, sensación táctil y el dolor, pero con 1.500 mg de metilcobalamina22, mientras que Talaei et al. informaron disminución del dolor y parestesias al administrar vitamina B12 intramuscular23. Estas diferencias podrían derivarse por la duración del seguimiento de los distintos estudios, siendo el presente estudio el de menor duración.
Otros ensayos y un reciente metaanálisis informan un modesto efecto benéfico de la vitamina B12 en la neuropatía diabética23,24, cabe señalar que los estudios revisados en el meta-análisis tienen limitaciones, como heterogeneidad en cuanto al grado de control glucémico, diferentes herramientas para valorar neuropatía, y presencia de otros confusores no ajustados en el análisis.
La deficiencia de vitamina B12 puede causar una anemia megaloblástica por un retraso en el desarrollo de los eritrocitos, aunque la evidencia apoya la asociación entre el uso de metformina y la deficiencia de vitamina B12, existe incertidumbre sobre si la metformina favorece la aparición o empeoramiento de la anemia en pacientes con diabetes25. Existen varios estudios que relacionan la anemia megaloblástica con el uso prolongado de metformina en pacientes con DM25,26. Donnelly et al., utilizaron datos de 2 ensayos y un estudio observacional, mostrando que el uso de metformina se asoció con el descenso en los niveles de la hemoglobina en pacientes con DM227. Sin embargo, en el presente estudio solo encontramos diferencia en los síntomas de fatiga, pérdida de cabello y malestar general. Los sujetos incluidos no tenían ninguna enfermedad subyacente, lo que podría aliviar la incertidumbre de otros factores relacionados con la anemia. Ninguno de los pacientes en este estudio informó algún efecto adverso, lo que coincide con otros reportes22,23,28.
Limitaciones importantes: la primera y más significativa, es la ausencia de un grupo control debido al diseño pre-post. Aunque pudimos documentar la mejora de la deficiencia de vitamina B12 en el 97% de los participantes, carece de la capacidad para establecer relación causal definitiva entre la intervención y los cambios observados, así como el control de factores ajenos a la intervención. Sin embargo, este enfoque metodológico se justifica ya que al incluir participantes con deficiencia confirmada de B12, no sería ético excluirlos del tratamiento. No obstante, un exhaustivo examen médico y de laboratorio al inicio del estudio reveló que los sujetos incluidos no padecían ninguna otra enfermedad subyacente, lo que podría disminuir la incertidumbre de esos confusores.
El seguimiento de 6 semanas, en comparación con otras publicaciones, podría ser poco tiempo para evaluar mejoría en neuropatía, a pesar de esto, se observó cambio en la cianocobalamina sérica al final del seguimiento. Se necesitan ensayos aleatorizados metodológicamente estrictos para poder recomendar complejo B intramuscular durante periodos más largos, en pacientes con diabetes y uso crónico de metformina. El punto de corte para los niveles de vitamina B12 fue de 300 pg/ml, a diferencia de otros que consideran una deficiencia inferior a 200 pg/ml; sin embargo, se ha sugerido que, especialmente en pacientes con diabetes mayores de 60 años, el punto de corte para los niveles de B12 que pueden provocar una disfunción neurológica debería desplazarse de ≤150 a ≤ 400 pmol/l29.
El estudio estaba diseñado para tener 88 participantes, este tamaño de muestra se calculó teniendo en cuenta la variabilidad esperada en los niveles de cianocobalamina y el efecto mínimo deseado a detectar. Pese a esto, desafíos en el reclutamiento, limitaciones de tiempo y presupuestales, llevaron a finalizar el reclutamiento con una muestra de 33 participantes. A pesar de esto, un análisis de poder estadístico post hoc aplicado al tamaño muestral obtenido reveló una potencia de 1,0 (o 100%). Esto indica que, dada la significativa diferencia observada en los niveles de cianocobalamina con el tamaño muestral actual, nuestro estudio posee la capacidad para identificar un efecto significativo en caso de existir. Sin embargo, la interpretación de este resultado debe hacerse con cautela, considerando el contexto del estudio y la metodología empleada para el cálculo, pero sin duda invita a realizar un ensayo clínico controlado para reproducir nuestros hallazgos.
Aunque la electromiografía y los estudios de conducción nerviosa son los métodos diagnósticos estándar para neuropatía diabética desde las alteraciones más sutiles, incluso antes de que los síntomas se manifiesten en el paciente, no fueron utilizados en nuestro estudio. En su lugar, se utilizó el MNSI, una herramienta eficaz en el cribado de la neuropatía diabética periférica. Aunque no es el estándar de oro, los resultados del MNSI pueden ser útiles para identificar a aquellos en riesgo o que ya están experimentando neuropatía periférica.
ConclusiónEn este estudio la aplicación intramuscular de complejo B no se asoció con la aparición de eventos adversos y fue bien tolerada a las 6 semanas y, además, se observó un incremento significativo en los niveles séricos de vitamina B12. No se observaron mejoras significativas en los síntomas de neuropatía o anemia, excepto en la presencia de calambres en extremidades inferiores y debilidad.
Puntos clave- •
La diabetes tipo 2 requiere esquemas de tratamiento en constante evolución, que van desde la monoterapia hasta la combinación de múltiples medicamentos para lograr un control glucémico óptimo.
- •
La metformina, uno de los medicamentos más utilizados para la DM2, puede causar efectos secundarios como la deficiencia de vitamina B12 con el uso prolongado.
- •
El uso prolongado de metformina está asociado con una prevalencia del 6–30% de deficiencia de vitamina B12, lo cual puede empeorar los síntomas de neuropatía.
El complejo B intramuscular aumenta significativamente los niveles séricos de vitamina B12, desde una mediana de 217 pg/ml a 4000 pg/ml en pacientes con diabetes tipo 2 y uso crónico de metformina
Aunque las puntuaciones generales de neuropatía no mostraron cambios significativos, síntomas como calambres en las piernas y debilidad mejoraron después de la administración de complejo B intramuscular
Los síntomas de anemia como malestar general, pérdida de cabello y fatiga mostraron una mejoría significativa, mientras que otros valores de laboratorio se mantuvieron estables, excepto por una ligera disminución en los niveles de HbA1c.
Responsabilidades éticasEl estudio fue aprobado por el Comité de Ética en Investigación y el Comité de Investigación del Centro Especializado en Diabetes, Obesidad y Prevención de Enfermedades Cardiovasculares con el número de protocolo GMX-001-2021, así como fue autorizado por la entidad regulatoria mexicana Comisión Federal para la Protección Contra Riesgos Sanitarios COFEPRIS. Se obtuvo un consentimiento informado de todo paciente incluido en el estudio.
FinanciaciónEl presente trabajo ha sido financiado por Laboratorios Grossman; S.A, quien contrató a la Organización de Investigación por Contrato CRO Visión Integral en Investigación Klini-K SA de CV para la gestión y monitorización del estudio clínico. El patrocinador tuvo responsabilidad en el diseño del estudio, pero no en la conducción y desarrollo del protocolo, ni en el análisis de datos y realización del presente manuscrito.
Conflicto de interesesNeri Alvarez-Villalobos recibió honorarios por servicios de escritura, edición y análisis estadístico de Laboratorios Grossman a través de Visión Integral en Investigación Klini-K S.A. de C.V. (CRO) el patrocinador no intervino en la recolección de datos ni en el informe de resultados de la investigación.