El manejo de la diabetes inestable constituye un indudable reto tanto para pacientes como para profesionales. Las oscilaciones glucémicas impredecibles que la caracterizan, además de dificultar enormemente el control metabólico del paciente, también condicionan un deterioro importante en su calidad de vida y determinan que el abordaje terapéutico de este cuadro sea complejo y a menudo frustrante. Sin embargo, tenemos hoy en día en nuestras manos múltiples herramientas que, junto a la adecuada colaboración entre médicos, enfermería y los propios pacientes, nos permitirán enfrentarnos a esta entidad con ciertas garantías de éxito. En este artículo se repasan las características generales de la diabetes inestable, así como las distintas opciones terapéuticas disponibles para su abordaje.
Management of brittle diabetes is undoubtedly a challenge for both patients and professionals. The unpredictable glycemic variations that characterize it, and also greatly hinder the patient's metabolic control, cause a significant deterioration in their quality of life and makes the therapeutic approach complex and often frustrating. However, we now have multiple tools in our hands that, in conjunction with the appropriate cooperation between doctors, nurses and patients themselves, will enable us to deal with this condition with high chances of success. This article reviews the general characteristics of brittle diabetes and the various treatment options available to manage it.
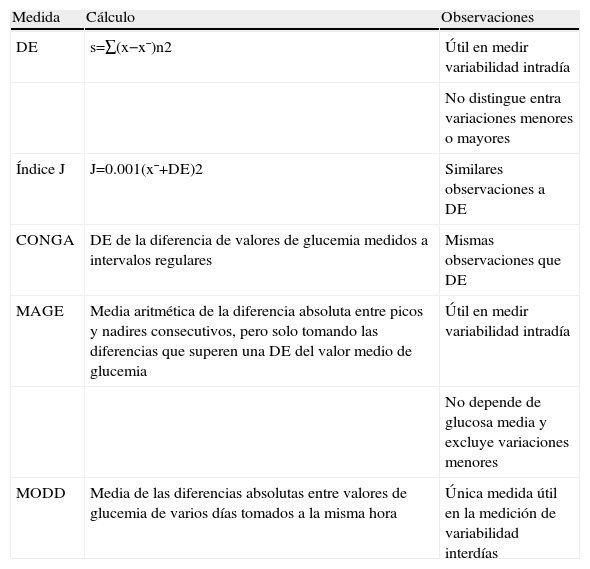
El concepto de diabetes inestable (DI), o «brittle diabetes», fue acuñado por Woodyatt en los años 30 para referirse a pacientes con diabetes mellitus (DM) insulinodependiente con oscilaciones glucémicas extremas sin causa aparente1. Tattersall, a finales de los 70, estableció una nueva definición, que se ha mantenido hasta la actualidad sin grandes variaciones: pacientes cuyas vidas se ven constantemente alteradas por episodios de hipo o hiperglucemia, independientemente de la causa de los mismos, y que condicionan frecuentes ingresos hospitalarios2. Clásicamente, se considera que presentar 3 episodios de cetoacidosis en 2 años y/o 3 hipoglucemias severas en un año es diagnóstico de DI, pero estas cifras son arbitrarias, por lo que etiquetar un paciente de DI encierra un alto componente de subjetividad. Sería deseable disponer de criterios objetivos que determinasen exactamente la variabilidad glucémica (VG), permitiendo así definir claramente cuándo un individuo presenta una DI. Por desgracia, la VG es un concepto muy complejo y, a pesar de disponer de múltiples indicadores para medirla (tabla 1), no existe consenso respecto a cuál o cuáles de ellos definirían mejor la presencia de DI3,4.
Principales indicadores de variabilidad glucémica
| Medida | Cálculo | Observaciones |
| DE | s=∑(x−x¯)n2 | Útil en medir variabilidad intradía |
| No distingue entra variaciones menores o mayores | ||
| Índice J | J=0.001(x¯+DE)2 | Similares observaciones a DE |
| CONGA | DE de la diferencia de valores de glucemia medidos a intervalos regulares | Mismas observaciones que DE |
| MAGE | Media aritmética de la diferencia absoluta entre picos y nadires consecutivos, pero solo tomando las diferencias que superen una DE del valor medio de glucemia | Útil en medir variabilidad intradía |
| No depende de glucosa media y excluye variaciones menores | ||
| MODD | Media de las diferencias absolutas entre valores de glucemia de varios días tomados a la misma hora | Única medida útil en la medición de variabilidad interdías |
DE: desviación estándar; CONGA: continuous overall net glycemicaction; MODD: mean of daily differencies; MAGE: mean amplitude of glycemicexcursions; σ: desviación estándar; X¯: media aritmética; Σ: sumatorio.
Aunque los pacientes con DM1 son los que presentan mayor predisposición a la inestabilidad glucémica (IG), cada vez se describen más casos de DI en DM2. Los principales estudios epidemiológicos provienen del Reino Unido5 y establecen una prevalencia de DI en torno a 0,3:1.000 pacientes diabéticos, o entre 5 y 6: 1.000 pacientes con DM1. Predomina en el sexo femenino, con un pico de incidencia en la adolescencia, y se describe más frecuentemente en pacientes con sobrepeso/obesidad, altos requerimientos de insulina y péptido C indetectable. Etiológicamente, suelen coexistir varias causas en la aparición de DI, siendo los aspectos conductuales, emocionales y psicosociales los más frecuentemente reconocidos (tabla 2).
Principales causas etiológicas de diabetes inestable
| Pérdida de la respuesta contrarreguladora en diabetes mellitus de larga evolución |
| Neuropatía autonómica |
| Anomalías hormonales en la secreción de hormona de crecimiento o cortisol |
| Trastornos gastrointestinales: gastroparesia, celiaquía |
| Alteraciones en la degradación o absorción de la insulina en el tejido subcutáneo |
| Trastornos conductuales, emocionales y psicosociales |
Desde el punto de vista pronóstico, hay datos in vitro que demuestran que las oscilaciones glucémicas aumentan el estrés oxidativo, resultando más dañinas para el endotelio vascular que la hiperglucemia sostenida6, mientras que otros estudios relacionan la VG con un aumento de mortalidad7. En una cohorte británica8, tras un seguimiento de 22 años a un grupo de pacientes con DI, se objetivó una mortalidad del 50%, en la mayoría de los casos por complicaciones relacionadas directamente con la DM, presentando además el 100% de los supervivientes complicaciones microvasculares. Por tanto, dado que la DI condiciona un mal pronóstico evolutivo, resulta fundamental optimizar en lo posible el abordaje terapéutico de la misma.
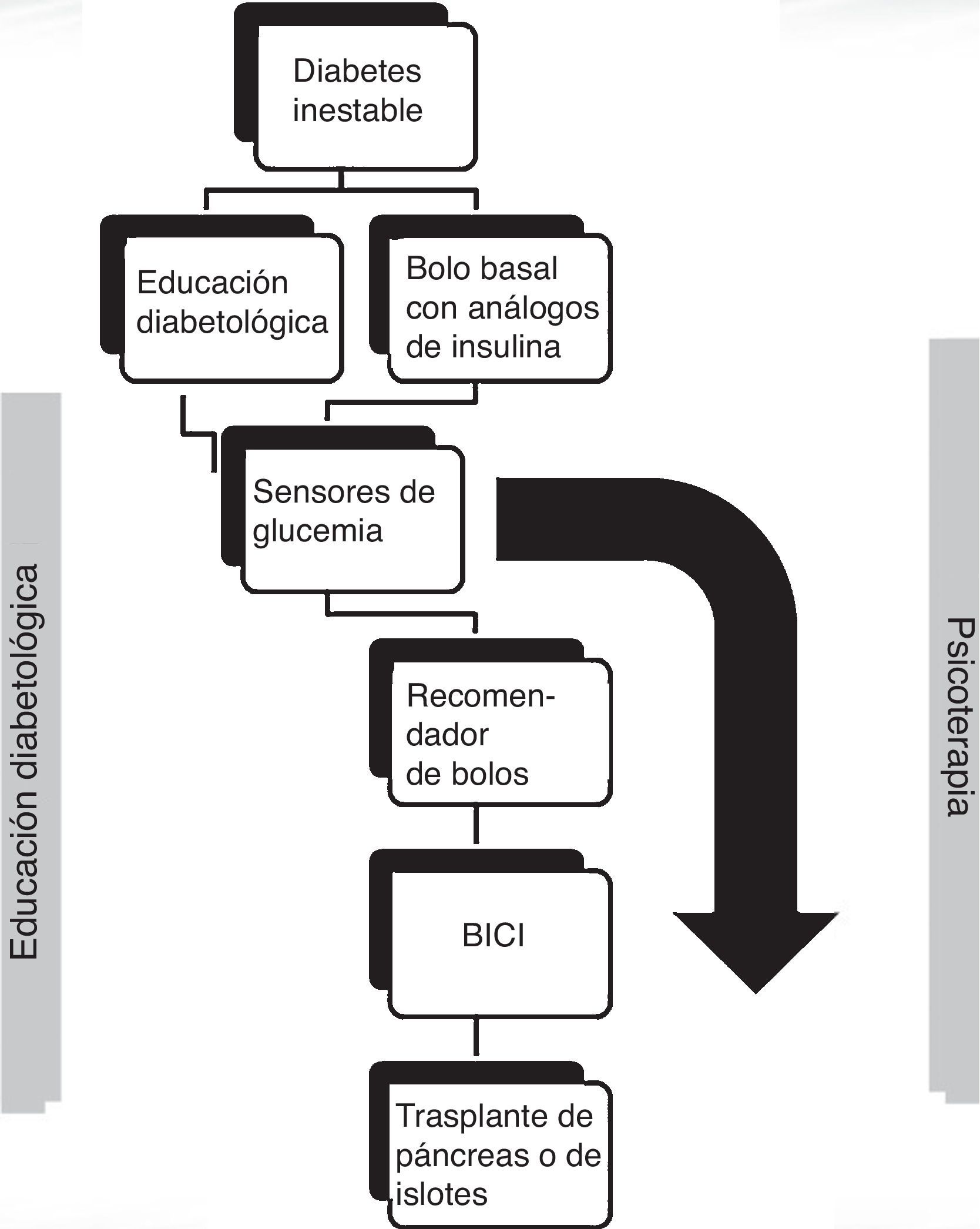
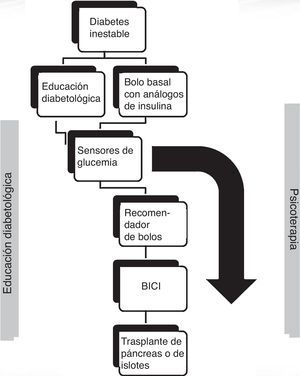
Abordaje terapéutico de la diabetes inestableDada la etiología multifactorial de la DI, el tratamiento de la misma podrá también plantearse desde diferentes vertientes. Así, cualquier tratamiento que aborde los factores etiológicos implicados en la DI mejorará también la misma; por ejemplo, cuando la gastroparesia diabética sea la principal responsable de la DI, el tratamiento con medidas higiénico-dietéticas (ingestas frecuentes y escasas con bajo contenido graso) o con procinéticos, como metoclopramida, domperidona, levosulpirida o eritromicina, mejorará tanto la gastroparesia como la propia DI9. En lo que se refiere al abordaje directo de las oscilaciones glucémicas, no hay normas definidas, siendo preciso individualizar cada caso para determinar la alternativa más eficaz. A continuación, se repasarán brevemente las medidas terapéuticas que pueden resultar más útiles en la DI, aunque sin pretender realizar una revisión detallada de cada una de ellas.
Estilo de vida. Educación diabetológicaLa aparición de DI puede deberse a incapacidad del paciente de manejar adecuadamente las complejas correlaciones existentes entre glucemia, ingesta, actividad física y otros aspectos cotidianos que puedan afectar al control glucémico. Por ello, el primer aspecto a revisar ante la aparición de IG es que el paciente haya recibido una adecuada educación diabetológica. En este sentido, la individualización resulta imprescindible, en función de horarios, hábitos, preferencias, así como objetivos de control glucémico particulares para cada individuo. Especial atención merece el capítulo de las hipoglucemias, pues basta una hipoglucemia severa para provocar un desajuste en los sistemas de contrarregulación que favorecería la aparición de hipoglucemias desapercibidas10. Se debe comprobar que el paciente conoce las estrategias para afrontar aquellas situaciones que favorecen la aparición de hipoglucemias (ejercicio físico, retraso de ingesta…), así como las medidas a tomar para recuperar la misma sin incurrir en «sobrecorrecciones» que conllevarían un rebote hiperglucémico que, a su vez, generaría mayor IG.
Teniendo en cuenta lo expuesto, así como los frecuentes errores en la estimación de la dosis de insulina rápida a administrar antes de las comidas, los dispositivos conocidos como «recomendadores de bolos» suponen una aportación de gran interés. Se orientan especialmente al control posprandial, dado que a través de complejos algoritmos matemáticos permiten calcular la dosis de insulina rápida adecuada para cubrir la ingesta, así como para corregir las glucemias fuera de objetivo. Se basan en estimaciones personalizadas y permiten tener en cuenta situaciones puntuales, como estrés, ejercicio o enfermedad. Algunos estudios han demostrado ya que su empleo permite mejorar la estabilidad del control glucémico en pacientes con DM111.
Análogos de insulinaEn comparación con la insulina humana convencional, los análogos de insulina simulan más fielmente los tiempos de acción de la insulina endógena, lo que se traduce en un menor riesgo de hipoglucemias y menos oscilaciones glucémicas, por lo que todos los pacientes con DI deberían emplear análogos de insulina. Aunque se hayan reportado casos puntuales de mejoría del control glucémico y reducción de los episodios de hipoglucemia tras cambiar un análogo por otro12, no hay datos suficientes que indiquen superioridad de alguno de ellos frente al resto. La terapia intensiva, empleando análogos de acción basal junto a análogos de insulina rápida con cada ingesta (pauta basal-bolo), debe considerarse la opción preferente en la DI.
Mención aparte merecen 2 nuevos análogos de insulina de acción prolongada. Degludec se acumula en el tejido subcutáneo en forma de multihexámeros, a partir de los cuales se liberarán al torrente sanguíneo de forma lenta y sostenida monómeros de insulina, lo que le confiere un perfil farmacocinético muy estable, con escasas oscilaciones; esto se traduce en una reducción en el número de hipoglucemias, fundamentalmente nocturnas, hasta del 25%, así como una mayor flexibilidad en el horario de administración13. Igualmente, Glargina U 300 (300 UI/ml) ha demostrado poseer un perfil más estable que la actual presentación de Glargina U 100, lo que se traduce en una menor tasa de hipoglucemias14. Estos 2 análogos de insulina no están actualmente comercializados en España, por lo que habrá que esperar para confirmar en la práctica las hipotéticas ventajas que ofrecerían en los pacientes con DI.
Sensores continuos de glucosaDisponer de la mayor cantidad posible de información sobre las fluctuaciones de la glucemia sanguínea ayudará al paciente con DI a tomar las decisiones más adecuadas en cada momento. La determinación de glucemia capilar mediante glucómetros clásicos presenta limitaciones, por ejemplo, el hecho de que la información que aportan es puntual y puede no reflejar adecuadamente la evolución en el tiempo de los niveles de glucemia. Esto puede solventarse mediante el empleo de un sensor continuo de glucemia. La descripción de estos dispositivos escapa a los objetivos de esta revisión, pero baste decir que suministran una detallada información sobre la evolución del perfil glucémico a lo largo de las 24 h, aportando múltiples lecturas de glucemia a nivel del líquido intersticial. En una revisión publicada el año 2008 se concluye que el uso del sensor de glucosa de modo retrospectivo no aporta beneficios en comparación con las mediciones capilares habituales, pero, por contra, su uso para ajustar el tratamiento en tiempo real, sí mejoró la HbA1C y disminuyó el tiempo transcurrido tanto en hipo como en hiperglucemia15. Por tanto, estos dispositivos parecen aportar beneficios interesantes en los pacientes con DI, aunque no debemos olvidar que todos los datos disponibles han sido obtenidos con grupos de pacientes heterogéneos y poco numerosos, lo que limita las conclusiones que se pueden extraer. Puntualizar que a día de hoy el sistema público de salud solo subvenciona los sensores de lectura retrospectiva y no los de tiempo real; estos últimos suponen una inversión inicial que puede oscilar en torno a los 1.000-1.700 €, a los que habría que añadir la compra periódica de fungibles, con un coste aproximado entre 60-120 € semanales.
Insulina subcutánea en perfusión continuaEntre los argumentos que explican la IG en los pacientes con DI se encuentran la irregularidad en la absorción de la insulina a nivel subcutáneo y el hecho de que, una vez inyectada esta, su efecto permanecerá independientemente de las oscilaciones glucémicas que tengan lugar. Estas y otras dificultades pueden ser abordadas con ciertas garantías de éxito mediante el empleo de bombas de infusión subcutánea continua de insulina (BICI).
La perfusión continua de insulina fue introducida hace más de 30 años, con la idea de imitar la liberación fisiológica de la hormona16. Las BICI permiten al paciente modificar y ajustar tanto el ritmo de infusión basal, como los bolos preprandiales, permitiendo así una mayor flexibilidad a la hora de adaptarse a ingestas, ejercicio y otras circunstancias cambiantes que generan fluctuaciones glucémicas a lo largo del día. Diversos estudios han demostrado que las BICI, frente a las múltiples inyecciones de insulina subcutánea, permiten disminuir la variabilidad glucémica, gracias en gran parte a la pequeña cantidad de insulina liberada en el tejido subcutáneo, lo que implica un menor coeficiente de variación en la absorción de la misma. Además, se ha demostrado mejoría en los niveles de HbA1c, una reducción del 10-20% en las necesidades de insulina, así como una menor incidencia de hipoglucemias severas17,18. Todos estos beneficios parecen mayores cuanto peor es la situación inicial del paciente, de manera que aquellos individuos que partan de una situación caracterizada por hipoglucemias graves y gran variabilidad glucémica serían los que más ventajas potenciales podrían obtener del empleo de BICI19,20. La calidad de vida es uno de los aspectos más afectados en los pacientes con DI y, en este sentido, a pesar de la heterogeneidad de las escalas empleadas, una revisión reciente concluye que las BICI son superiores a los regímenes intensivos de múltiples dosis de insulina en lo referente a satisfacción con el tratamiento, la calidad de vida y la autopercepción de la salud general y mental21. Aunque los criterios para el empleo de la insulina en perfusión continua pueden variar según las guías consultadas22,23, en general, debe reservarse para aquellos pacientes en los que hayan fracasado las pautas de terapia intensiva con dosis múltiples de insulina. Destacar que la DI es una indicación universalmente aceptada para la implementación de este tipo de terapia.
Los continuos avances técnicos y la posibilidad de combinar BICI y sistemas de monitorización continua de glucosa permiten ser optimistas y pensar que el ansiado páncreas artificial comienza a ser una posibilidad real24. Por ejemplo, existen ya trabajos en pequeños grupos de pacientes con DM1 en los que se demuestra cómo el empleo de un sistema de asa cerrada que combina la liberación dual de insulina y glucagón, junto a un sensor continuo de glucosa en tiempo real, permite, en comparación con una BICI estándar, mejorar a corto plazo el control glucémico y reducir el riesgo de hipoglucemia25.
Trasplante de páncreas y de islotes pancreáticosFracasadas las alternativas anteriores, una opción válida en la DI sería el trasplante de páncreas (TP), que permite restaurar completamente la funcionalidad del islote pancreático, recuperando así el sensor fisiológico de glucosa y la liberación tanto de insulina como de glucagón26. Los pacientes con DI presentan una alteración en la respuesta contrarreguladora frente a la hipoglucemia, en parte como consecuencia de la disminución del glucagón sérico; el TP recuperará dicho mecanismo de contrarregulación, así como el reconocimiento de los síntomas de hipoglucemia. Además, en la mayoría de los casos, permitirá normalizar la glucemia sin precisar insulina exógena, con la consecuente mejoría en la calidad de vida. El éxito del TP dependerá fundamentalmente de la experiencia del centro, con una tasa de supervivencia media del 95% y de independencia de insulina del 60% a los 3 años, según datos del Registro Internacional de Trasplantes de Páncreas27. El principal inconveniente que presenta, aparte del riesgo quirúrgico inherente a la técnica en sí, es la necesidad de inmunosupresión crónica, imprescindible para prevenir el rechazo del injerto, así como la potencial recurrencia del proceso autoinmune sobre el nuevo órgano. Los inmunosupresores tienen efectos secundarios frecuentes y en ocasiones severos, motivo por el que el TP deberá considerarse como una alternativa válida solo en pacientes con progresión severa de complicaciones o en aquellos en los que la calidad de vida sea inaceptable, como muchas veces ocurre en la DI. Por ello, los mejores candidatos al TP serán aquellos pacientes con enfermedad renal terminal candidatos a trasplante de riñón, de manera que la inmunosupresión asociada al mismo cubriría también la requerida por el TP. Además, el trasplante pancreato-renal combinado, al mejorar significativamente el control glucémico, ayudará a prolongar la supervivencia del injerto renal28. En el caso que no haya enfermedad renal, la Asociación Americana de Diabetes recomienda el TP aislado tan solo en circunstancias muy concretas, entre las cuales podrían encajar los pacientes con DI29 (tabla 3).
Indicaciones de trasplante aislado de páncreas
| Indicaciones de trasplante aislado de páncreas según la Asociación Americana de Diabetes27 | Historia de complicaciones agudas frecuentes como hipoglucemias inadvertidas o hiperglucemias severas que no respondan a otros abordajes más convencionales y afecten seriamente a la calidad de vida del paciente |
| Pacientes con problemas clínicos o psicológicos tan importantes que no sean capaces de utilizar insulina exógena |
El trasplante de islotes pancreáticos (TIP) se presenta como una alternativa al TP. Igualmente, permitirá restaurar la funcionalidad del islote pancreático, con los mismos efectos metabólicos positivos ya señalados anteriormente30, pero no se debe olvidar que, al contrario que el TP, el TIP es, a día de hoy, una técnica considerada como experimental. Tras la introducción en el año 2000 del protocolo de Edmonton, mejoraron significativamente los resultados obtenidos con el TIP en lo referente a control glucémico e independencia de la insulina exógena31; a partir de la generalización de este protocolo, varios estudios han demostrado los beneficios del TIP en pacientes con DI32. Existe muy poca literatura comparando TIP frente a TP y las tasas de éxito de ambos van a depender fundamentalmente de la experiencia del centro y los criterios de selección del paciente. Un reciente estudio comparó a 33 pacientes sometidos a TP aislado frente a 33 pacientes con TIP, siendo la DI uno de los criterios de inclusión en ambas ramas33. Al año se evidenció una mayor tasa de independencia insulínica en los pacientes con TP aislado (75%) frente a los sometidos a TIP (59%), observándose además los beneficios semanas o meses antes en los pacientes con TP. Por tanto, se concluyó que el TP aislado debería considerarse una mejor opción que el TIP, fundamentalmente en pacientes cuya calidad de vida esté claramente afectada por la DI y requieran una rápida restauración de la homeostasis glucídica. Sin embargo, también se objetivó que las complicaciones perioperatorias aumentaban con el TP, con mayor número de reintervenciones, más tiempo de hospitalización y más morbilidad asociada a los inmunosupresores, incluyendo un aumento en la tasa de infecciones. Por tanto, conviene sopesar los riesgos-beneficios individuales en cada caso, pudiendo ser el TIP una mejor opción que el TP en aquellos pacientes con riesgo quirúrgico alto. Además, aunque la independencia insulínica es deseable, no debe ser el principal objetivo a plantear en los pacientes con DI, puesto que lograr la estabilidad glucémica, evitar las hipoglucemias severas, mejorar la calidad de vida o frenar la progresión de las complicaciones crónicas son objetivos igualmente importantes y factibles de alcanzar mediante un TIP.
Papel de la psicoterapia en el abordaje de la diabetes inestableAl enfrentarnos a un paciente con DI, debemos prestar gran atención a los aspectos psicosociales, pues estos desempeñan un papel esencial en el estado metabólico, siendo básicamente 2 los factores que parecen fundamentales en la patogenia psicosomática de la DI34:
- –
El estrés emocional provoca liberación de hormonas contrarreguladoras que elevan la glucemia. Existe evidencia de que los pacientes con más inestabilidad emocional responden al estrés con mayores incrementos de glucemia35.
- –
La manipulación terapéutica que, consciente o inconscientemente, el paciente lleva a cabo como expresión de conflictos psíquicos.
Asimismo, es sabido que variables de percepción personal como la autoestima, ejercen influencia directa sobre el control glucémico, demostrándose una mejoría del mismo y mayor estabilidad metabólica en aquellos pacientes en los que se fomenta el autocuidado y se mejora la conciencia de enfermedad. La IG surge con frecuencia en el periodo puberal, asociada al cambio emocional y al desarrollo psicosexual propios del momento. La frecuente falta de implicación del adolescente en el control de su DM no suele obedecer a un comportamiento autodestructivo, más bien es la manifestación de un deseo de autonomía frente a familiares y cuidadores. En la psicoterapia con adolescentes es recomendable definir claramente unos compromisos mínimos a cumplir por el paciente; sin embargo, se desaconseja mostrar una actitud de reproche en los casos de incumplimiento terapéutico, siendo más provechoso tratar de demostrar una correlación entre las oscilaciones glucémicas y las alteraciones del comportamiento o los fallos terapéuticos. La regularidad en las visitas, con una estrecha colaboración entre diabetólogos y psicoterapeutas, es la fórmula que se ha mostrado más eficaz.
En definitiva, el reto del manejo de la DI resulta complejo y, en ocasiones, frustrante, pero disponemos actualmente de múltiples herramientas que permiten afrontar esta entidad con ciertas garantías de éxito. Es evidente la necesidad de individualización en cada caso, pero a modo de referencia orientativa se propone en la figura 1 un algoritmo para el abordaje de la DI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.