Dos aspectos particularmente relevantes para los pacientes diabéticos en tratamiento con insulina son la prevención de las hipoglucemias y la flexibilidad en la administración diaria de la insulina. Ambos aspectos tienen un impacto importante en la consecución de los objetivos de control glucémico y en la calidad de vida del paciente. Los avances en insulinoterapia en los últimos años con los análogos de insulina de acción rápida y de acción prolongada han contribuido a reducir el riesgo de hipoglucemia. Degludec, un nuevo análogo de insulina basal de larga duración, parece reducir aún más y de forma consistente el riesgo de hipoglucemias nocturnas, que son especialmente inoportunas al interferir con la calidad y la duración del sueño. Además, al tener una duración de acción superior a las 42h, puede permitir una mayor flexibilidad en la administración, sin comprometer el control glucémico ni la seguridad.
Two aspects particularly relevant for people with diabetes treated with insulin are prevention of hypoglycemia and flexibility in its administration. Both aspects have an important impact in the achievement of blood glucose targets and in the patient quality of life. In the last few years, advances in insulin therapy, with rapid-acting and long-acting insulin analogs, have contributed to reducing the risk of hypoglycemia. Degludec, a new long-acting basal insulin analogue, seems to reduce even more and consistently the risk of nocturnal hypoglycemia, which are particularly inconvenient as they interfere with sleep quality and duration. In addition, due to its duration of action over 42hours, it may allow higher injection flexibility without compromising glycemic control and safety.
La diabetes mellitus (DM) es una enfermedad metabólica crónica que con el tiempo puede asociarse a complicaciones crónicas que tienen un importante impacto sobre la calidad de vida relacionada con la salud (CdVRS) e inducir una reducción de la esperanza de vida de los pacientes y de los años libres de enfermedad1. También las diferentes estrategias terapéuticas pueden tener un impacto distinto sobre la CdVRS, dado que algunas circunstancias, como el miedo a la hipoglucemia, el pánico a las inyecciones o la complejidad de algunos tratamientos son, en algunos casos, motivo de gran preocupación para determinados pacientes2.
En los pacientes con DM tipo1 (DM1) los requerimientos del tratamiento diario y la sobrecarga emocional asociada a la propia enfermedad y al riesgo de complicaciones agudas y crónicas tienen un impacto importante sobre el bienestar físico, social y psicológico de los pacientes3. Además, las variables psicosociales tienen un efecto relevante sobre el autocuidado, la aceptación de una estrategia terapéutica determinada y el éxito del tratamiento4. La estrategia terapéutica de elección será aquella que permita a los pacientes alcanzar/mantener un excelente control glucémico y, al mismo tiempo, interfiera lo menos posible con un estilo de vida flexible e independiente5. Utilizando un instrumento específico para evaluar la calidad de vida en pacientes con DM1, Bott et al.6 ya demostraron que el mayor nivel de calidad de vida se asociaba con un tratamiento insulínico flexible, una dieta liberalizada, la ausencia de complicaciones crónicas y un status social más elevado.
La hipoglucemia y el miedo a las hipoglucemias son importantes barreras para alcanzar la casi-normoglucemia en los pacientes diabéticos en tratamiento con insulina. Las hipoglucemias pueden tener importantes efectos indeseables sobre el paciente en su rutina diaria, en el estilo de vida y en la sensación de bienestar, pero también un importante impacto social por la pérdida de productividad y el incremento de costes asociados a su tratamiento7. En este manuscrito se revisarán 2 aspectos particularmente relevantes para los pacientes diabéticos en tratamiento con insulina, como son la prevención de las hipoglucemias y la flexibilidad en la administración diaria de la insulina. Discutir las ventajas que la infusión subcutánea continua con insulina (ISCI) tiene en pacientes seleccionados en la prevención de las hipoglucemias y en la flexibilidad en la dosificación de la insulina queda fuera del objetivo de esta revisión. Tampoco se hará referencia al uso de sensores de glucosa en la prevención de las hipoglucemias, dado que la monitorización continua de glucosa no se utiliza de forma generalizada, y menos de forma prospectiva (en tiempo real), y su exactitud en caso de hipoglucemias es controvertida.
Prevención de las hipoglucemiasLa hipoglucemia se define como aquella situación asociada a un valor anormalmente bajo de glucemia plasmática (≤70mg/dl [≤3,9mmol/l]) en la que el paciente puede quedar expuesto a una situación de riesgo potencial8. Las hipoglucemias se clasifican en graves o leves, dependiendo o no de la actuación de una tercera persona en su resolución, bien mediante la administración de hidratos de carbono, glucagón u otras medidas. Las hipoglucemias leves pueden ser sintomáticas o asintomáticas. Las hipoglucemias nocturnas son las que ocurren durante el periodo de descanso nocturno, típicamente entre las 0:00h y el momento de levantarse.
Las hipoglucemias son más frecuentes en los pacientes con DM1 y en aquellos con DM tipo2 (DM2) avanzada, con un mayor deterioro en la secreción de insulina9. La incidencia de hipoglucemias también aumenta con la duración de la enfermedad9. En la práctica, las hipoglucemias ocurren en los pacientes en tratamiento con insulina, sulfonilureas o glinidas, tanto en monoterapia como en combinación con otros fármacos.
Las hipoglucemias graves pueden tener graves consecuencias, incluso ser fatales. La incidencia de hipoglucemias graves en pacientes con DM1 varía entre 115-320 episodios/100 pacientes-año9,10. En pacientes con DM2 la incidencia de hipoglucemias graves es menor, entre 35-70 episodios/100 pacientes-año9,10. Sin embargo, dada la mayor prevalencia de DM2, la mayoría de episodios de hipoglucemias graves atendidos en los hospitales ocurren en pacientes con DM211.
Las hipoglucemias leves son más frecuentes12. Cuando ocurren de forma recurrente pueden resultar en el síndrome de hipoglucemia inadvertida (hypoglycemia unawareness), una situación en la que los pacientes no reconocen los síntomas adrenérgicos asociados al descenso de la glucemia13. Esta circunstancia, que es potencialmente reversible14,15, incrementa hasta en 25 veces o más el riesgo de hipoglucemias graves en pacientes en tratamiento intensivo16.
Riesgos asociados a las hipoglucemiasEl impacto de las hipoglucemias es variable dependiendo de la edad del paciente y del tipo de diabetes. Las hipoglucemias son frecuentes en los niños y adolescentes con DM1, que tienen generalmente patrones erráticos de comidas y actividad física variable. Los niños con DM1 de corta edad (<5años) son especialmente vulnerables a las hipoglucemias. Estudios recientes sugieren que las hipoglucemias graves en estos niños pueden alterar el desarrollo cognitivo17. En los adultos con DM1 las hipoglucemias graves no parecen tener repercusiones neurológicas relevantes, al menos evidenciables con los tests neurocognitivos, realizados hasta 12años después de la finalización del estudio Diabetes Control and Complications Trial (DCCT)18. En este estudio, las hipoglucemias graves fueron 3,28 veces más frecuentes en el grupo en tratamiento intensivo que en el grupo convencional19.
Los pacientes con DM2 parecen ser especialmente vulnerables a las hipoglucemias. En 3estudios (Action to Control Cardiovascular Risk in Diabetes [ACCORD], Action in Diabetes and Vascular Disease [ADVANCE] y Veterans Affairs Diabetes Trial [VADT]) que evaluaron los potenciales beneficios del tratamiento intensivo en pacientes con DM2 y elevado riesgo cardiovascular, los pacientes en tratamiento intensivo tuvieron entre 2-3veces más episodios de hipoglucemias graves que aquellos en tratamiento convencional20–22. En el estudio ACCORD el brazo intensivo fue interrumpido prematuramente por un aumento de mortalidad del 20%20. Aunque no se ha podido demostrar una relación directa entre mortalidad e hipoglucemias graves, la hipoglucemia grave fue el predictor más importante de muerte cardiovascular en el estudio VADT22. Se ha sugerido que las hipoglucemias graves podrían ser consideradas como un marcador de vulnerabilidad, dado que análisis posteriores del estudio ADVANCE indican un mayor riesgo de episodios adversos graves en estos pacientes, incluso meses después de sufrir un episodio de hipoglucemia grave23.
En los pacientes de avanzada edad, las hipoglucemias pueden tener consecuencias desastrosas. Estos pacientes son especialmente vulnerables a la hipoglucemia. En condiciones experimentales de hipoglucemia, los pacientes de mayor edad (≥65años) tienen una menor sintomatología autonómica y de neuroglucopenia que los controles de menos edad24. Por lo tanto, estos pacientes están expuestos a hipoglucemias más graves dado que los síntomas iniciales de alarma suelen pasar inadvertidos. Adicionalmente, se ha comunicado que los pacientes con historia previa de hipoglucemias graves tienen mayor riesgo de demencia25. Y a la inversa, el deterioro cognitivo también incrementa el riesgo de sufrir hipoglucemias. Además, estos pacientes con diabetes tienen mayor riesgo de sufrir caídas, fragilidad, incontinencia urinaria y depresión.
Repercusiones de las hipoglucemias en la vida diariaLas hipoglucemias y el miedo a sufrirlas pueden tener un impacto significativo en la calidad de vida de los pacientes con diabetes26. Las hipoglucemias nocturnas resultan especialmente inoportunas al alterar la sensación de bienestar al día siguiente, ya que se ha demostrado que interfieren con la calidad y la duración del sueño27. Cuando las hipoglucemias son recurrentes, se ha sugerido que estos pacientes están más expuestos a sufrir depresión y ansiedad28. Adicionalmente, las hipoglucemias pueden interferir en el rendimiento en el trabajo afectando a la productividad29. Finalmente, también pueden interferir con la capacidad de conducción de vehículos30.
Prevención de las hipoglucemiasExisten diversas aproximaciones que pueden reducir el riesgo de hipoglucemia. Mejorar la educación terapéutica del paciente, el uso adecuado de la monitorización de la glucemia capilar y la utilización de estrategias terapéuticas que reduzcan el riesgo de hipoglucemia son claves para minimizar el riesgo de hipoglucemia. En particular, los pacientes en tratamiento con insulina, sulfonilureas y/o glinidas deben ser informados del riesgo potencial de hipoglucemias. Los pacientes con historia de hipoglucemias recurrentes y/o hipoglucemias inadvertidas son particularmente vulnerables a las hipoglucemias y deben recibir una atención especializada.
Hace más de 20años, Michael Berger y su grupo, en Düsseldorf (Alemania), demostraron que utilizando un programa de educación terapéutica estructurado, que incluía flexibilización del tratamiento insulínico y dieta liberalizada, se podían alcanzar objetivos terapéuticos similares a los del DCCT sin incrementar el riesgo de hipoglucemia31. Estos programas también demostraron su validez cuando fueron extendidos a otros centros, tanto en Alemania como en otros países32. También existen programas para restaurar la sintomatología autonómica perdida en pacientes con síndrome de hipoglucemia inadvertida, que han demostrado su eficacia ya después de 2semanas y que, después de 3meses, permiten una recuperación completa33.
El uso de la monitorización de la glucemia capilar es esencial para instruir a los pacientes en la prevención de las hipoglucemias. Los pacientes en tratamiento con sulfonilureas, glinidas e insulina deben realizar controles periódicos adaptados a las características de su tratamiento en cada momento34. Los pacientes en terapia basal-bolo deben realizar entre 3-6controles de glucemia diarios, y siempre antes de las comidas principales, para ajustar las dosis de insulina al nivel de glucemia antes de la ingesta.
Finalmente, los avances en insulinoterapia en los últimos años, con la introducción de análogos de insulina de acción rápida (AIAR; lispro, aspart, glulisina) y análogos de insulina de acción prolongada (AIAP; glargina, detemir), han contribuido a reducir aún más el riesgo de hipoglucemia asociado al uso de insulina, tanto en la DM1 como en la DM2. Los AIAR, administrados justo antes de la ingesta reducen la hiperglucemia posprandial y el riesgo de hipoglucemia tardía antes de la siguiente comida, frente a la insulina regular humana (IRH) inyectada 30-40min antes de la ingesta35,36. En pacientes con DM1, los AIAR redujeron significativamente la HbA1c solo con insulinización basal optimizada con insulina NPH fraccionada37, con AIAP (análogos de insulina de acción prolongada)38 o en terapia con ISCI39. En relación con la hipoglucemia, los AIAR reducen el riesgo de hipoglucemias nocturnas y de hipoglucemias graves en pacientes con DM1 frente a la IRH40. En un metaanálisis reciente se estimó con AIAR una reducción de las hipoglucemias del 14% frente a la IRH41.
Respecto a los AIAP (glargina, detemir), un reciente metaanálisis en pacientes con DM1 sugiere una eficacia comparable a la insulina NPH (neutral protamine Hagedorn), excepto para la insulina detemir, 2veces al día, que resultó en un descenso adicional, aunque significativo, de HbA1c (–0,14%; IC95%: –0,21 a –0,08)42. Otros metaanálisis demuestran un descenso menor pero significativo con insulina glargina (–0,11%; IC95%: –0,21% a –0,02%), con descensos en el riesgo de hipoglucemias graves y nocturnas con ambos AIAP40. En pacientes con DM2, tanto en combinación con agentes orales como en terapia basal-bolo, ambos AIAP fueron tan eficaces como la insulina NPH en la reducción de la HbA1c, aunque con mayores descensos de la glucemia basal con los análogos40. Adicionalmente, detemir se asoció con una menor ganancia ponderal que glargina o insulina NPH43. En relación con las hipoglucemias, el uso de AIAP resultó en reducciones de las hipoglucemias, especialmente las nocturnas, tanto en combinación con agentes orales como en terapia basal-bolo40.
Recientemente se ha comercializado en algunos países de Europa y en Japón un nuevo AIAP, la insulina degludec. Degludec es un AIAP de larga duración (∼42h). La formación de estructuras multihexaméricas tras la inyección subcutánea es responsable de la liberación prolongada de monómeros a la circulación44,45. Como resultado, degludec tiene un perfil de acción estable durante 24h y menor variabilidad en su efecto hipoglucemiante que glargina (fig. 1)46,47. En un metaanálisis recientemente publicado se analizaron los beneficios adicionales de la degludec frente a glargina48. Ambas insulinas tienen una eficacia comparable en pacientes con DM1 y DM249-51. Sin embargo, degludec se asoció con un consistente menor riesgo de hipoglucemias nocturnas confirmadas (entre las 0:00am y las 5:59am, en todos los estudios) para una reducción comparable de la HbA1c (degludec vs. glargina, en DM1 [periodo de mantenimiento], RR: 0,75 [IC95%: 0,60-0,94]; en DM2, RR: 0,68 [IC95%: 0,57-0,82])48. Estas diferencias son probablemente el resultado de la mayor duración y la menor variabilidad diaria de degludec47. Típicamente, los episodios de hipoglucemia nocturna dependen de la insulina basal utilizada y no están relacionados con la insulina prandial de la cena. Es por ello por lo que es en este periodo donde pueden observarse mayores diferencias entre ambas insulinas. Aunque la FDA ha cuestionado las diferencias encontradas en la frecuencia de hipoglucemias nocturnas entre ambas insulinas, al comprobar que estas desaparecían al incrementar en 2h el periodo de observación52, esta ventaja potencial de degludec ha sido admitida por otras agencias reguladoras y países (EMA, Japón). Desde el punto de vista clínico, el menor riesgo de hipoglucemia nocturna debería permitir una titulación forzada más agresiva en la práctica clínica diaria. Así mismo, degludec sigue pendiente de aprobación en Estados Unidos debido a un exceso inesperado en la mortalidad cardiovascular (>1,8 en el extremo superior del IC95%), al incluir en el análisis las fases de extensión de los estudios de faseiii, y que no fue observada en el periodo regular de observación53.
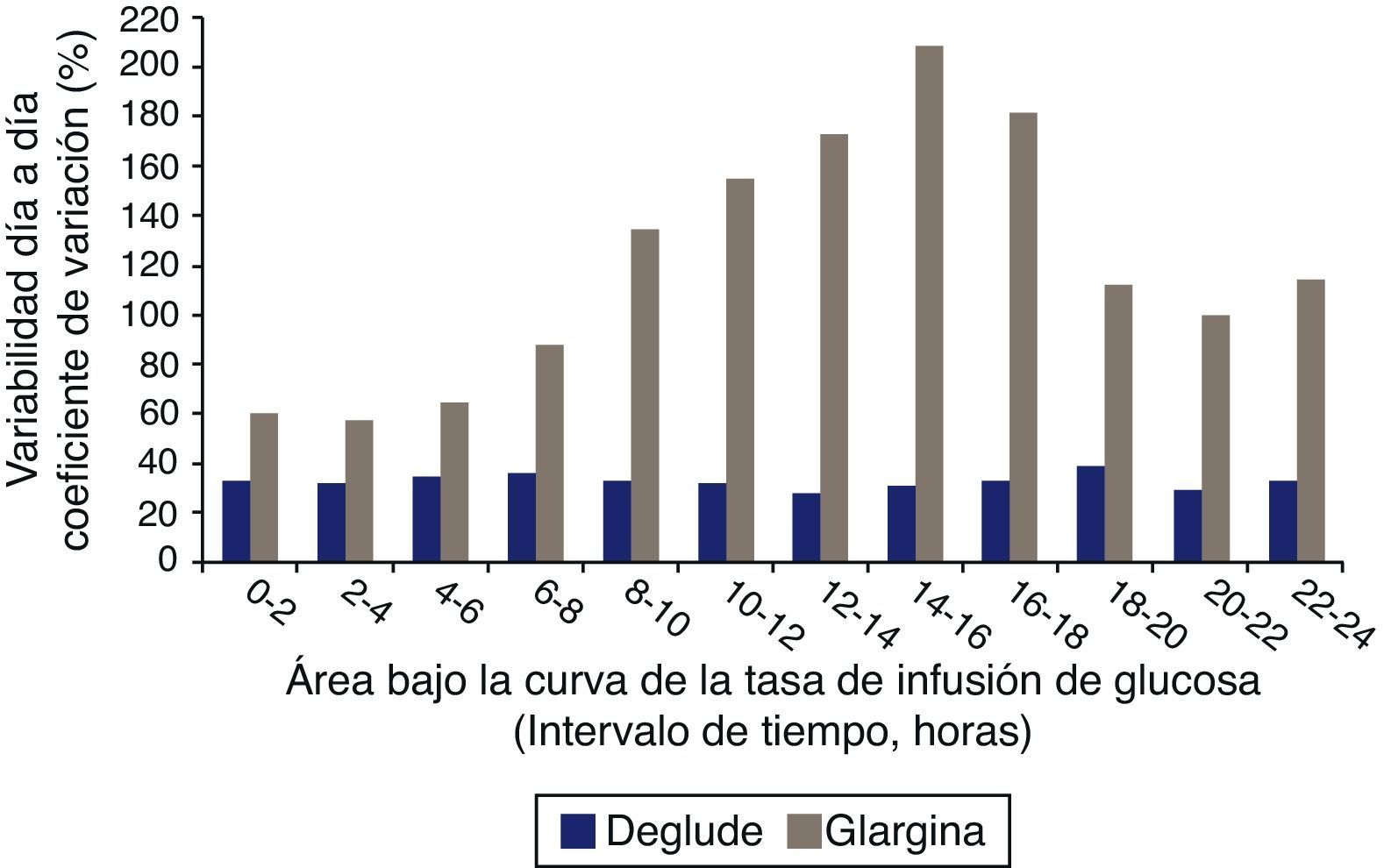
Menor variabilidad farmacodinámica de la insulina degludec vs. glargina en pacientes con diabetes tipo1. La variabilidad de día a día del efecto hipoglucemiante de degludec vs. glargina (0,4U/kg, una vez al día) se investigó en 54 pacientes con diabetes tipo1 que se sometieron a un clamp euglucémico de glucosa de 24h en los días 6, 9 y 12 de tratamiento. La variabilidad intraindividual se estimó mediante un modelo mixto lineal a partir de las tasas de infusión de glucosa (GIR). La variabilidad día a día en el efecto hipoglucemiante fue 4 veces menor con degludec que con glargina respecto al efecto metabólico total (AUC [GIR,0-24h, SS], CV 20% vs 82%) y a las últimas 22h (AUC [GIR,2-24, SS], CV 22% frente a 92%). Estos resultados sugieren que degludec como insulina basal es mucho más predecible que glargina.
Modificado de Heise et al.46.
Finalmente, Freemantle et al.54 evaluaron el impacto de degludec sobre diversos aspectos de la calidad de vida de los pacientes. Frente a glargina, degludec se asoció con un mejor estado de salud, tanto físico como mental, de los pacientes con DM2 en tratamiento con insulina. Es posible que estos resultados estén influidos por el menor riesgo de hipoglucemias nocturnas observado con degludec.
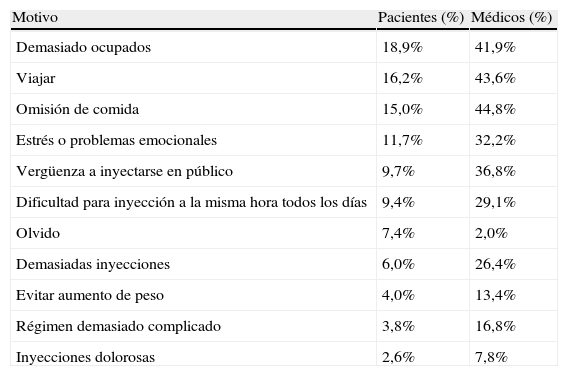
Flexibilidad en la administraciónLa omisión y el retardo en la administración de insulina son relativamente frecuentes y pueden resultar en un deterioro del control glucémico2,55,56. La necesidad de administrar la insulina basal en un momento del día determinado puede complicar en algunos casos la adherencia del paciente, y con ello comprometer los objetivos de control55,57. Uno de los motivos reconocidos por los pacientes de la omisión/no-adherencia en la administración de insulina es la interferencia ocasional de la inyección en las actividades diarias (tabla 1)2,58. En los pacientes con DM2, la adherencia al esquema terapéutico de dosificación de insulina es especialmente baja (∼70%)57,59. En un estudio reciente, el 50% de los pacientes con DM2 omitieron intencionalmente la dosis de insulina basal, el 22% lo hicieron en los últimos 30días (promedio de 3dosis omitidas en 30días), y hasta el 24% comunicaron un retardo en la administración de insulina de más de 2h (promedio de 4,2veces en 30días)60. También la obligación de adaptar el estilo de vida al perfil de acción de una insulina determinada, como ocurre con la insulina NPH y las insulinas premezcladas, puede dificultar el manejo de la diabetes. Finalmente, una variabilidad mayor de la esperada en el perfil de acción de la insulina puede también predisponer al paciente a sufrir episodios de hipoglucemia no esperados.
Razones reportadas por pacientes (n=530) y médicos (n=964) para la omisión de insulina/no adherencia
| Motivo | Pacientes (%) | Médicos (%) |
| Demasiado ocupados | 18,9% | 41,9% |
| Viajar | 16,2% | 43,6% |
| Omisión de comida | 15,0% | 44,8% |
| Estrés o problemas emocionales | 11,7% | 32,2% |
| Vergüenza a inyectarse en público | 9,7% | 36,8% |
| Dificultad para inyección a la misma hora todos los días | 9,4% | 29,1% |
| Olvido | 7,4% | 2,0% |
| Demasiadas inyecciones | 6,0% | 26,4% |
| Evitar aumento de peso | 4,0% | 13,4% |
| Régimen demasiado complicado | 3,8% | 16,8% |
| Inyecciones dolorosas | 2,6% | 7,8% |
Modificado de Peyrot et al.58.
La introducción de los AIAR (lispro, aspart, glulisina) en la clínica supuso un paso adelante en flexibilidad de la terapia insulínica. La posibilidad de administración justo antes, durante o incluso después de las comidas frente la IRH, que debe administrarse 30-45min antes de la ingesta, presenta innumerables ventajas. Aunque un estudio reciente en pacientes con DM2 cuestiona esta recomendación general respecto a la IRH, el estudio tiene importantes limitaciones dado que no fue realizado a doble ciego, no hubo seguridad de que los pacientes respetaran exactamente los 20min de espera recomendados y, además, los pacientes incluidos tenían un importante grado de obesidad (IMC ∼34kg/m2) y en consecuencia mayor espesor del tejido subcutáneo, lo cual pudo interferir en la cinética de la absorción de la insulina61. En un estudio de 6meses de duración, aspart se asoció a una mejora significativa en la satisfacción con el tratamiento y en la calidad de vida frente a la IRH62. La mejora en la satisfacción fue debida fundamentalmente al aumento en la flexibilidad en la dieta y en el tiempo de ocio (p<0,0001). Además, aspart también se asoció con efectos positivos en la reducción del riesgo de hipoglucemia y menor fluctuación de la glucemia.
Los AIAP (glargina, detemir) se acompañan de forma indiscutible con un menor riesgo de hipoglucemia, tanto en pacientes con DM1 como con DM2. Esta característica permite una mayor agresividad en la titulación de insulina y debería posibilitar una mayor flexibilización de los horarios de la ingesta. A pesar de ello, se recomienda que los AIAP actuales (glargina, detemir) se administren en el mismo periodo del día para conseguir un efecto biológico óptimo, una respuesta consistente sobre la glucemia y disminuir la variabilidad glucémica63. Con el nuevo AIAP degludec esta recomendación genérica ha sido superada. Degludec, al tener una duración de acción superior a las 42h, puede permitir una mayor flexibilidad en la administración, sin comprometer el control glucémico ni la seguridad64. Esta ventaja de degludec podría ser de utilidad en aquellos pacientes que se administran glargina o detemir en la cena o antes de acostarse y que con glucemias en ayunas dentro de los objetivos presentan glucemias elevadas antes de la cena del día siguiente.
En pacientes con DM1, la administración de degludec durante 26semanas en un régimen de inyección variable preestablecido, con un intervalo entre las dosis diarias entre 8-40h, no resultó en un peor control metabólico ni en un mayor riesgo de hipoglucemia (degludec-horario flexible vs. degludec-horario fijo vs. glargina-horario fijo)65. De hecho, incluso con la mayor flexibilización en la administración hubo una reducción del 40% en las hipoglucemias nocturnas con degludec-variable frente a glargina después de 26semanas. Estos datos se confirmaron también en la fase de extensión posterior de 26semanas adicionales, en la que se permitió a los pacientes previamente aleatorizados a un régimen de administración variable/fijo con degludec que siguieran con un régimen de administración variable libre, pero dentro del rango de 8-40h.
En otro estudio realizado en pacientes con DM2 utilizando un diseño similar (degludec-horario flexible vs. degludec-horario fijo vs. glargina-horario fijo), la administración de degludec en un régimen flexible preestablecido (con inyecciones entre 8-40h) durante 26 semanas resultó en un control metabólico similar, sin diferencias en el riesgo de hipoglucemia ni en la ganancia de peso frente a los otros 2comparadores (fig. 2)63. Estos datos confirman los resultados observados con degludec en pacientes con DM1, ofreciendo la posibilidad de la administración de insulina en horario cambiante (ocasionalmente), sin riesgo de comprometer el control metabólico o de exponer al paciente a un riesgo aumentado de hipoglucemia.
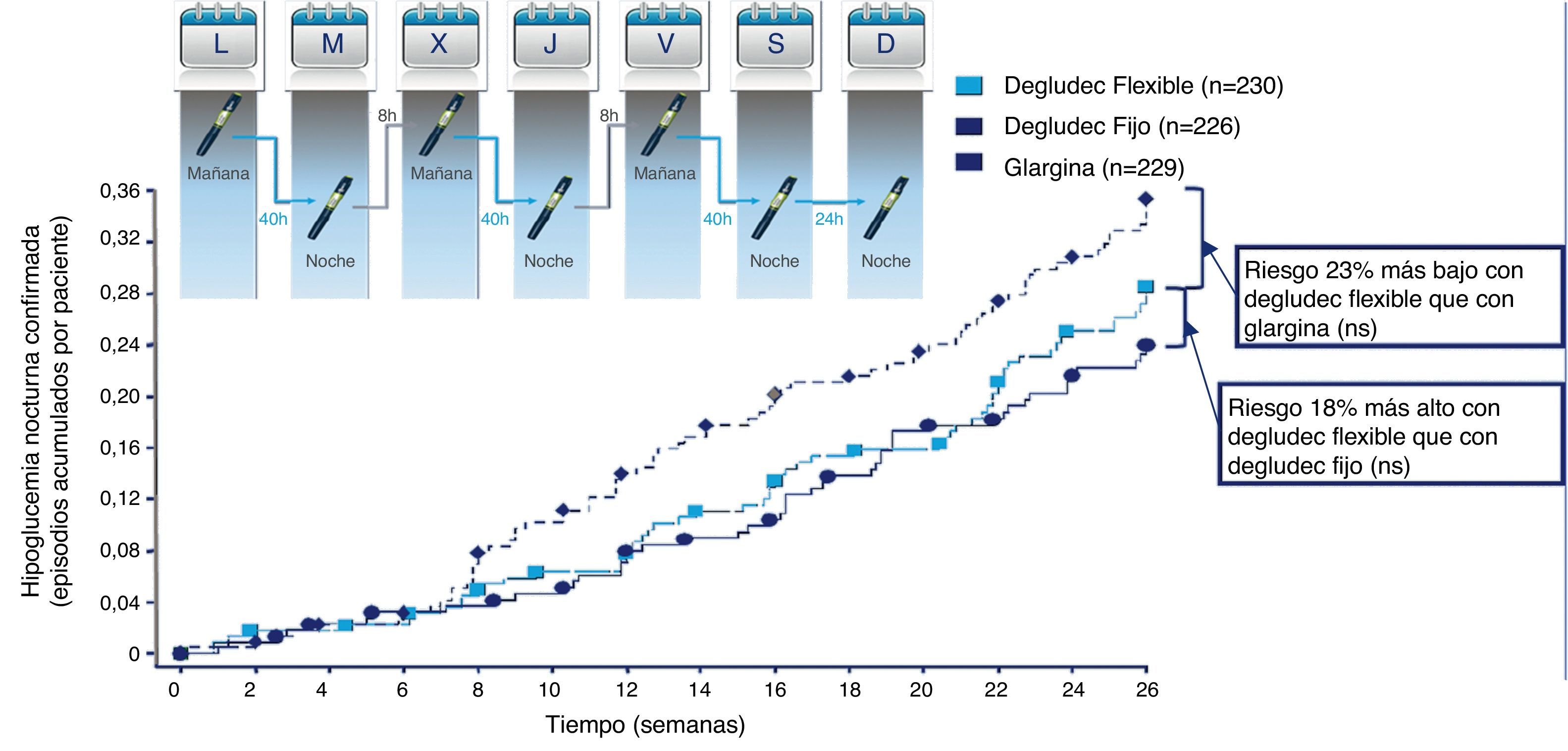
Flexibilidad en la administración de insulina con degludec en pacientes con diabetes mellitus tipo2. Este estudio, realizado en 459pacientes con diabetes tipo2 y de 26semanas de duración, fue diseñado para evaluar el impacto de la flexibilización en el momento de la administración de la insulina degludec. La insulina degludec se administró de forma alternativa a intervalos entre dosis extremos (entre 8 y 40h), frente a insulina glargina y degludec administrada al mismo tiempo cada día. La insulina basal fue titulada en base a un objetivo de glucosa en ayunas de entre 71-89mg/dl (entre 3,9-4,9mmol/l). La reducción de la HbA1c basal (8,4%) fue similar en los 3 grupos (degludec [ambos] vs. glargina, 1,28 vs 1,26%, respectivamente, p=NS). La frecuencia de hipoglucemias totales (3,6 vs. 3,5 episodios/paciente-año) o nocturna (0,6 vs. 0,8 episodios/paciente-año) fue similar entre degludec (ambos grupos) y glargina. En la figura, el número de episodios son aproximadamente la mitad de los calculados como paciente-año, dado que solo se representa el periodo de 26semanas del estudio.
Modificado de Meneghini et al.63.
La estrategia terapéutica utilizada y las complicaciones crónicas pueden tener un impacto importante sobre la calidad de vida de los pacientes con diabetes. En la DM1, la mayor flexibilidad en el tratamiento insulínico, una dieta liberalizada y la ausencia de complicaciones crónicas se asocian con un mayor nivel de calidad de vida. La hipoglucemia y el miedo a las hipoglucemias son importantes barreras para alcanzar los objetivos glucémicos. Mejorar la educación terapéutica del paciente, el uso adecuado de la monitorización de la glucemia capilar y la utilización de estrategias terapéuticas que reduzcan el riesgo de hipoglucemia son claves para minimizar el riesgo de hipoglucemia. Los avances en insulinoterapia en los últimos años con los análogos de insulina de acción rápida y de acción prolongada han contribuido a reducir aún más el riesgo de hipoglucemia. Degludec, un nuevo análogo de insulina de larga duración, parece reducir aún más y de forma consistente el riesgo de hipoglucemias nocturnas.
Respecto a la flexibilidad en la administración de insulina, la necesidad de inyectar la insulina basal en un momento del día determinado puede complicar en algunos casos la adherencia del paciente y comprometer los objetivos de control. Aunque en general no se recomienda seguir un patrón irregular en el horario de administración de insulina, la mayor flexibilidad en la administración de degludec puede permitir a determinados pacientes con horarios cambiantes, viajes frecuentes, comidas habituales fuera de casa, etc., o simplemente cuando no es posible mantener horarios fijos en la administración de insulina, la posibilidad de seguir manteniendo un excelente control metabólico sin aumento en el riesgo de hipoglucemias.
Conflicto de interesesEl Dr. Ampudia-Blasco ha recibido honorarios de charlas y/o consultoría de Abbott, Bristol-Mayers-Sqquibb, GSK, LifeScan, Lilly, Madaus, MannKind Corp., Medtronic, Menarini, Merck Farma y Química, S.A., MSD, Novartis, Novo Nordisk, Pfizer, Roche, sanofi-aventis, Schering-Plough y Solvay. El Dr. Ampudia-Blasco ha participado en ensayos clínicos financiados total o parcialmente por Astra-Zeneca, Bayer, GSK, Life-Scan, Lilly, MSD, Novo Nordisk, Pfizer, sanofi-aventis y Servier.




![Menor variabilidad farmacodinámica de la insulina degludec vs. glargina en pacientes con diabetes tipo1. La variabilidad de día a día del efecto hipoglucemiante de degludec vs. glargina (0,4U/kg, una vez al día) se investigó en 54 pacientes con diabetes tipo1 que se sometieron a un clamp euglucémico de glucosa de 24h en los días 6, 9 y 12 de tratamiento. La variabilidad intraindividual se estimó mediante un modelo mixto lineal a partir de las tasas de infusión de glucosa (GIR). La variabilidad día a día en el efecto hipoglucemiante fue 4 veces menor con degludec que con glargina respecto al efecto metabólico total (AUC [GIR,0-24h, SS], CV 20% vs 82%) y a las últimas 22h (AUC [GIR,2-24, SS], CV 22% frente a 92%). Estos resultados sugieren que degludec como insulina basal es mucho más predecible que glargina. Modificado de Heise et al.46. Menor variabilidad farmacodinámica de la insulina degludec vs. glargina en pacientes con diabetes tipo1. La variabilidad de día a día del efecto hipoglucemiante de degludec vs. glargina (0,4U/kg, una vez al día) se investigó en 54 pacientes con diabetes tipo1 que se sometieron a un clamp euglucémico de glucosa de 24h en los días 6, 9 y 12 de tratamiento. La variabilidad intraindividual se estimó mediante un modelo mixto lineal a partir de las tasas de infusión de glucosa (GIR). La variabilidad día a día en el efecto hipoglucemiante fue 4 veces menor con degludec que con glargina respecto al efecto metabólico total (AUC [GIR,0-24h, SS], CV 20% vs 82%) y a las últimas 22h (AUC [GIR,2-24, SS], CV 22% frente a 92%). Estos resultados sugieren que degludec como insulina basal es mucho más predecible que glargina. Modificado de Heise et al.46.](https://static.elsevier.es/multimedia/11343230/0000003000000001/v1_201402110003/S113432301300135X/v1_201402110003/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Flexibilidad en la administración de insulina con degludec en pacientes con diabetes mellitus tipo2. Este estudio, realizado en 459pacientes con diabetes tipo2 y de 26semanas de duración, fue diseñado para evaluar el impacto de la flexibilización en el momento de la administración de la insulina degludec. La insulina degludec se administró de forma alternativa a intervalos entre dosis extremos (entre 8 y 40h), frente a insulina glargina y degludec administrada al mismo tiempo cada día. La insulina basal fue titulada en base a un objetivo de glucosa en ayunas de entre 71-89mg/dl (entre 3,9-4,9mmol/l). La reducción de la HbA1c basal (8,4%) fue similar en los 3 grupos (degludec [ambos] vs. glargina, 1,28 vs 1,26%, respectivamente, p=NS). La frecuencia de hipoglucemias totales (3,6 vs. 3,5 episodios/paciente-año) o nocturna (0,6 vs. 0,8 episodios/paciente-año) fue similar entre degludec (ambos grupos) y glargina. En la figura, el número de episodios son aproximadamente la mitad de los calculados como paciente-año, dado que solo se representa el periodo de 26semanas del estudio. Modificado de Meneghini et al.63. Flexibilidad en la administración de insulina con degludec en pacientes con diabetes mellitus tipo2. Este estudio, realizado en 459pacientes con diabetes tipo2 y de 26semanas de duración, fue diseñado para evaluar el impacto de la flexibilización en el momento de la administración de la insulina degludec. La insulina degludec se administró de forma alternativa a intervalos entre dosis extremos (entre 8 y 40h), frente a insulina glargina y degludec administrada al mismo tiempo cada día. La insulina basal fue titulada en base a un objetivo de glucosa en ayunas de entre 71-89mg/dl (entre 3,9-4,9mmol/l). La reducción de la HbA1c basal (8,4%) fue similar en los 3 grupos (degludec [ambos] vs. glargina, 1,28 vs 1,26%, respectivamente, p=NS). La frecuencia de hipoglucemias totales (3,6 vs. 3,5 episodios/paciente-año) o nocturna (0,6 vs. 0,8 episodios/paciente-año) fue similar entre degludec (ambos grupos) y glargina. En la figura, el número de episodios son aproximadamente la mitad de los calculados como paciente-año, dado que solo se representa el periodo de 26semanas del estudio. Modificado de Meneghini et al.63.](https://static.elsevier.es/multimedia/11343230/0000003000000001/v1_201402110003/S113432301300135X/v1_201402110003/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
