Las células responden a niveles bajos de oxígeno (hipoxia) activando un programa génico específico para potenciar la adaptación al metabolismo anaeróbico y promover la conservación de la energía. Los factores de transcripción HIF (del inglés hypoxia inducible factor) juegan un papel central en la respuesta a hipoxia. La actividad de HIF está regulada por el gen supresor de tumores VHL, que degrada a HIF en presencia de oxígeno. Recientemente varios estudios han puesto de manifiesto la importancia de la ruta de respuesta a hipoxia HIF en la homeostasis de la glucosa. Cambios en los niveles de actividad de esta ruta en la célula beta endocrina alteran la capacidad de secreción de insulina. Además, la ruta de respuesta a hipoxia HIF parece regular la función metabólica de órganos implicados en la patogénesis de la diabetes y el síndrome metabólico como el hígado, el tejido adiposo y el músculo. Estas observaciones sugieren la posibilidad de que alteraciones en la ruta de hipoxia HIF puedan contribuir al desarrollo de diabetes.
Under low oxygen pressure (hypoxia), cells activate a specific genetic program, modulating genes involved in anaerobic metabolism and cellular energy metabolism. The transcriptional hypoxia inducible factors (HIFs) are central to this response. HIF activity is regulated by the von Hippel-Lindau tumour suppressor protein (pVHL). In the presence of oxygen, pVHL targets HIF for ubiquitination and subsequent proteasomal degradation. Several recent reports have revealed a critical role of the hypoxia response mediated by HIF on glucose homeostasis. Changes in HIF pathway activity in beta-cells impair insulin secretion. Furthermore, the HIF pathway regulates the metabolic function in organs involved in the pathogenesis of diabetes and metabolic syndrome such as liver, fat and muscle. These observations raise the question of whether changes in HIF levels might contribute to the progression of type 2 diabetes.
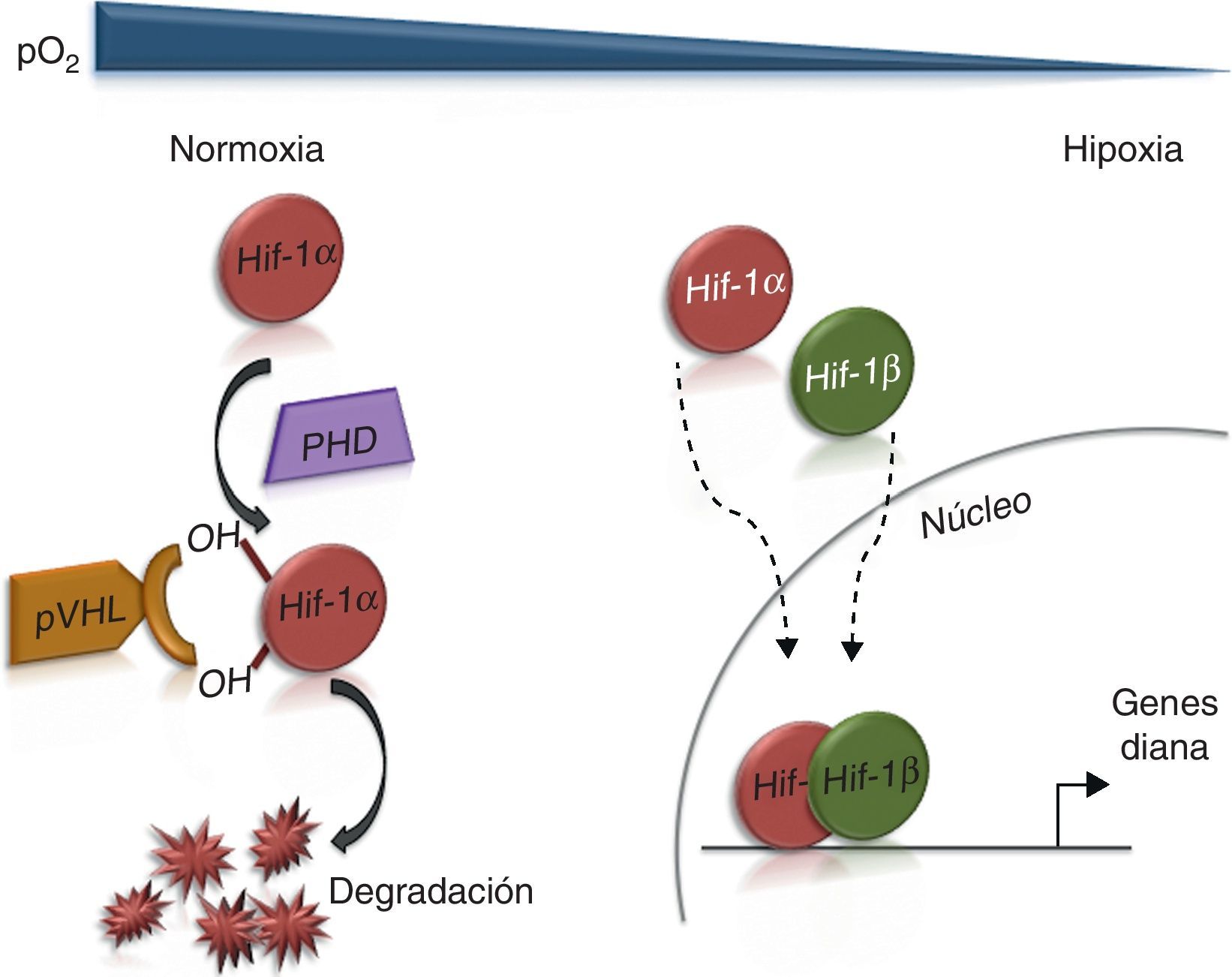
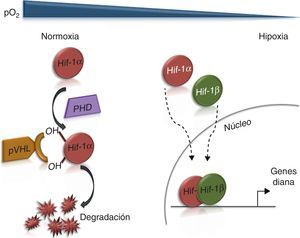
El mantenimiento de unos niveles adecuados de oxígeno es crítico para la función celular. Las células responden a los niveles bajos de oxígeno o hipoxia activando un programa génico específico que incluye genes para adaptarse al metabolismo anaeróbico, para potenciar el suministro de sangre y promover la conservación de la energía. Los factores de transcripción HIF (del inglés hypoxia inducible factor) juegan un papel central en la respuesta a hipoxia, ya que regulan la mayor parte de los genes que responden a hipoxia1,2. HIF es un heterodímero compuesto de 2 subunidades: HIFα y HIFβ. Existen 3 subunidades HIFα (HIF1α, HIF2α y HIF3α) que se diferencian en los genes diana que activan y en los tejidos en que se expresan. La actividad de HIFα está regulada por oxígeno, principalmente mediante un complejo mecanismo que regula la estabilidad de la proteína (fig. 1), mientras que HIFβ está constitutivamente activa. En presencia de oxígeno, una familia de dioxigenasas denominadas prolilhidroxilasas (PHD) hidroxila unos residuos específicos de prolina de los factores HIFα, una reacción dependiente de oxígeno. Estos motivos hidroxilados son reconocidos por el producto del gen VHL (del síndrome Von Hippel Lindau), pVHL. La proteína pVHL forma parte de un complejo E3 ubiquitin-ligasa que marca al factor HIFα para su poliubiquitinación y posterior degradación por el proteosoma3. En condiciones de hipoxia, los residuos de prolina de HIFα no se hidroxilan y por tanto no son reconocidos por pVHL, permitiendo que el factor HIFα no se degrade. La acumulación de HIFα permite formar un complejo con la subunidad HIF1β para translocarse al núcleo celular y modular la expresión de genes diana, incluyendo genes necesarios para el metabolismo de la glucosa y la captación de oxígeno. En ausencia de actividad pVHL, como ocurre en pacientes con síndrome de Von Hippel Lindau con mutaciones en el gen VHL, HIFα se acumula en presencia de niveles normales de oxígeno y se produce la activación aberrante de genes diana de HIF, entre ellos los que inducen la formación de vasos sanguíneos1. Este mecanismo explica la presencia de tumores muy vascularizados en pacientes con síndrome de Von Hippel Lindau3.
Efecto de la presión parcial de oxígeno (pO2) sobre la actividad HIF1α. En condiciones normales de pO2, HIF-1α es ubiquitinada y degradada muy rápidamente. Las enzimas prolilhidroxilasas (PHD) hidroxilan los residuos de prolina de HIF1α, lo que permite su reconocimiento por pVHL y su posterior degradación. A niveles bajos de oxígeno, las PHD no catalizan la hidroxilación de los residuos de prolina y, por tanto, HIF1α no es degradada. El complejo formado por HIF1α y HIF1β se transloca al núcleo activando la expresión de genes diana.
Recientemente se ha descubierto que la ruta HIF tiene un papel esencial en la función de las células beta pancreáticas. Cuatro estudios independientes han descrito el efecto de la activación de HIF en células beta en ratones4-7. En estos estudios se utilizó el sistema Cre-loxP para inactivar condicionalmente el gen VHL en células beta, ya que los ratones mutantes para VHL son letales en estadios embrionarios. El sistema Cre-loxP es una herramienta genética que permite la inactivación o activación del gen de interés en un tejido o tipo celular específico sin afectar su actividad en el resto del organismo8. La eliminación de VHL específicamente en células beta causa la activación de HIF1α y esto provoca que los ratones desarrollen intolerancia a la glucosa4-6. El análisis de la función de las células beta en estos ratones reveló que aunque la producción y la secreción basal de insulina no estaban afectadas, las células beta no secretaban insulina en respuesta al aumento de la concentración de glucosa. Esto era debido a defectos en la producción de ATP, a la despolarización de membrana y a la movilización de calcio en respuesta a la glucosa5,6. Estos resultados coinciden con estudios más antiguos realizados en cultivos in vitro que mostraban que las células beta perdían su capacidad de secreción de insulina en respuesta a la glucosa en condiciones de hipoxia9.
¿Cómo interfiere la activación de la ruta HIF con la secreción de insulina? Las células beta endocrinas detectan concentraciones de glucosa y responden secretando la cantidad de insulina apropiada mediante un mecanismo que requiere el metabolismo de la glucosa. La glucosa es transportada al interior de la célula beta por el transportador de glucosa de baja afinidad de tipo2 (GLUT-2) y metabolizada originando un aumento de la relación ATP/ADP intracelular. Esto produce el cierre de los canales de potasio sensibles a ATP causando una despolarización de la membrana celular y la apertura de los canales de calcio. El aumento de los niveles de Ca++ intracelular es el estímulo directo de la secreción de insulina. Una característica metabólica casi exclusiva de las células beta es la escasa (prácticamente nula) actividad de la lactato deshidrogenasa y los transportadores monocarboxilatos, un mecanismo que favorece la respiración oxidativa de la glucosa y que parece ser crítico para un funcionamiento preciso de la secreción de insulina en respuesta a glucosa10. En los ratones deficientes en VHL las células beta mostraban alteraciones en la expresión de genes relacionados con el transporte de glucosa, la glucólisis y la utilización del piruvato4,5. También se observó la activación de genes relacionados con la producción y secreción del lactato y un aumento en la secreción de lactato4. Estos resultados indicaban que la activación de la ruta HIF causaba un cambio de metabolismo aeróbico a anaerobio a pesar de la presencia de niveles normales de oxígeno, un efecto similar al efecto Warburg observado en tumores11. Este aumento del metabolismo anaerobio bloquea la capacidad de secreción de insulina en respuesta a la glucosa de las células beta, poniendo de manifiesto la estrecha relación entre metabolismo intracelular de la glucosa y regulación de la secreción de insulina12. Además del metabolismo de la glucosa, la activación de HIF parece afectar muchas otras funciones celulares en las células beta. Un análisis de microarrays en islotes de ratones deficientes en VHL realizado en nuestro laboratorio ha mostrado cambios significativos en más de 600 genes (datos sin publicar). Entre ellos y en consonancia con los resultados discutidos anteriormente, se encuentran genes relacionados con el metabolismo de la glucosa. Sin embargo, hemos encontrado también genes relacionados con funciones celulares tan importantes como proliferación, muerte celular y reorganización del citoesqueleto, indicando que la ruta HIF es un regulador general de la función de la célula beta.
Es llamativo que la inactivación de HIF1α también parece tener un efecto deletéreo sobre la función de las células beta en ratones, disminuyendo la capacidad de secreción de insulina en respuesta a la glucosa13. Es decir, tanto el exceso como el defecto de la actividad de HIF1α interfiere con la función de la célula beta endocrina, lo que indica que la ruta HIF debe mantenerse en un intervalo muy estrecho de actividad para un funcionamiento correcto de la célula beta.
Relación entre la actividad de HIF y la disfunción de la célula beta en diabetesTodos estos estudios realizados en modelos animales ponen de manifiesto la importancia de la ruta HIF en la función de la célula beta y plantean la posibilidad de que cambios en los niveles de HIF puedan influir en el deterioro de la función (disfunción) de la célula beta durante el desarrollo de la diabetes tipo2. Las células beta son muy sensibles a la hipoxia y, de hecho, los islotes pancreáticos se encuentran muy vascularizados. En algunos modelos animales de diabetes tipo2, como las ratas Zucker y las ratas Goto-Kakizaki, hay un aumento de la expresión de genes diana de HIF y de metabolismo glucolítico en los islotes pancreáticos14,15. Se ha propuesto como hipótesis que el aumento del tamaño de los islotes que ocurre es compensación al aumento de la resistencia a la insulina puede ocasionar una vascularización deficiente y el consiguiente estrés hipóxico, de forma similar a lo que se ha descrito en grasa de ratones obesos (véase más adelante). Por otra parte, es bien conocido que las células beta tienen un consumo muy elevado de oxígeno a concentraciones altas de glucosa, lo que potencialmente puede causar una disminución transitoria de los niveles de oxígeno intracelulares. De hecho, se ha observado la acumulación de HIF y la activación de un número significativo de genes diana de HIF en células beta (de ratas y humanas) en la hiperglucemia16,17.
La ruta HIF puede activarse por otros estímulos además de la hipoxia. Algunas de estos estímulos son condiciones fisiopatológicas asociadas a la diabetes tipo2 y que podrían, por tanto, causar la activación de HIF en las células beta. Los niveles de ROS (del inglés reactive oxygen species) parecen regular los niveles de HIF, probablemente por inhibición de las prolilhidroxilasas que actúan sobre HIF18. La hiperglucemia crónica observada en pacientes diabéticos provoca un aumento de la producción de ROS19 y sería interesante determinar si HIF se encuentra activado en las células beta de estos pacientes. El óxido nítrico es otro factor descrito como activador de HIF independiente de la presencia de oxígeno, también actuando sobre las prolilhidroxilasas20, y se ha descrito que en islotes de diabéticos tipo2 existe un aumento de la producción de óxido nítrico21. En los últimos años ha habido un gran número de estudios, tanto en líneas celulares como in vivo, que han demostrado que las citoquinas activan la ruta HIF22. De hecho, un estudio muy reciente sugiere que HIF puede mediar la disfunción de células beta inducida por citoquinas23. En este estudio se analizó por microarrays la respuesta a citoquinas proinflamatorias en células beta de rata en cultivo y se encontró un gran número de genes diana de HIF inducidos. Esto parecía deberse a un efecto directo de HIF, ya que la actividad HIF también se incrementaba en respuesta a las citoquinas. En conjunto, todas estas observaciones sugieren que la activación de la ruta HIF podría contribuir al deterioro de la función de la célula beta durante el desarrollo de la diabetes tipo2.
La asociación ente la ruta de hipoxia y el desarrollo de la resistencia a la insulinaLa ruta de hipoxia HIF parece tener un papel fisiológico importante en órganos relevantes en el desarrollo de la resistencia a la insulina como el hígado, el tejido adiposo y el músculo (tabla 1). La activación de la ruta HIF en músculo esquelético en ratones disminuye el consumo de oxígeno de estas células produciendo un cambio en el metabolismo celular similar al descrito anteriormente en células beta con activación de HIF, pasando de un metabolismo oxidativo a un metabolismo de la glucosa eminentemente anaeróbico24. En este estudio no se examinó la tolerancia a glucosa o la sensibilidad a la insulina de estos ratones, por lo que queda por determinar si la activación de la ruta HIF en el músculo puede tener efecto sobre la homeostasis de la glucosa. Sin embargo, es llamativo que en personas con resistencia a la insulina el músculo esquelético presenta unas características similares, actividad glucolítica elevada pero baja actividad oxidativa25, y sería interesante definir si este efecto está mediado por HIF. Varios estudios han descrito un aumento de la hipoxia y la acumulación de HIF en el hígado graso de ratones alimentados con una dieta rica en grasa26,27. Estos resultados coinciden con estudios en los que la sobreactivación de la ruta HIF (mediante inactivación genética de VHL) en hepatocitos de ratones provoca una esteatosis hepática muy severa asociada con defectos en la beta oxidación de ácidos grasos28. La disminución de los niveles de HIF en el hígado de ratones alimentados con dieta rica en grasa mejora la esteatosis hepática y la resistencia a la insulina sugiriendo una posible línea de intervención terapéutica. Sin embargo, la disminución de los niveles de HIF tendría que ser moderada, puesto que la inactivación genética de la ruta HIF en el hígado en ratones causa dislipidemia y un aumento de la gluconeogénesis hepática y de los niveles de insulina29. Por tanto, en el hígado, y de forma similar a lo que ocurre en células beta endocrinas, tanto la activación como la inactivación de HIF tienen un efecto perjudicial sobre la función metabólica.
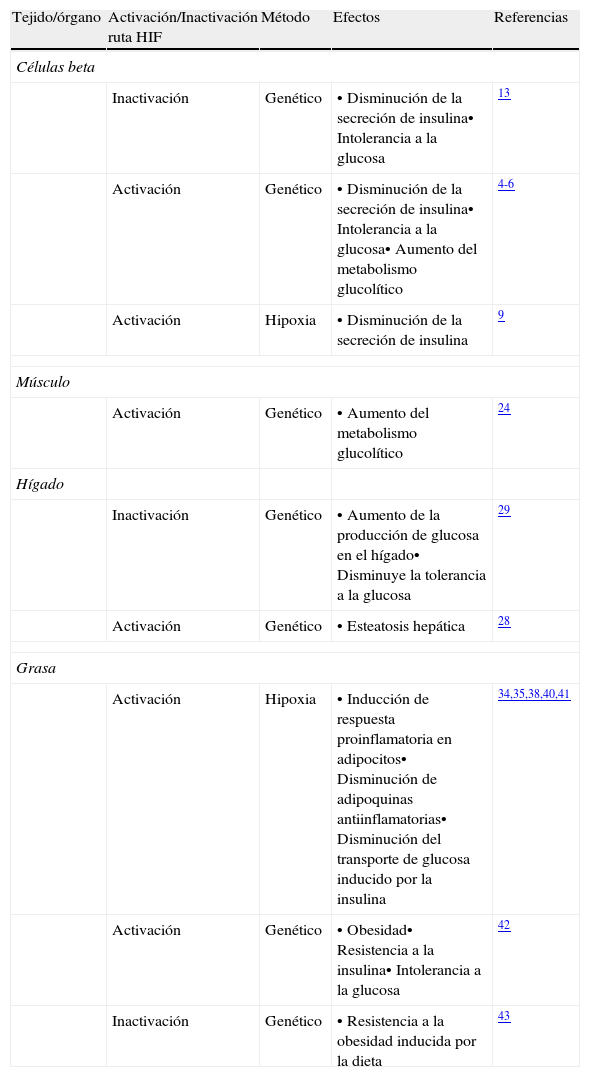
Efectos de la manipulación de la ruta de hipoxia HIF en diferentes tejidos
| Tejido/órgano | Activación/Inactivación ruta HIF | Método | Efectos | Referencias |
| Células beta | ||||
| Inactivación | Genético | • Disminución de la secreción de insulina• Intolerancia a la glucosa | 13 | |
| Activación | Genético | • Disminución de la secreción de insulina• Intolerancia a la glucosa• Aumento del metabolismo glucolítico | 4-6 | |
| Activación | Hipoxia | • Disminución de la secreción de insulina | 9 | |
| Músculo | ||||
| Activación | Genético | • Aumento del metabolismo glucolítico | 24 | |
| Hígado | ||||
| Inactivación | Genético | • Aumento de la producción de glucosa en el hígado• Disminuye la tolerancia a la glucosa | 29 | |
| Activación | Genético | • Esteatosis hepática | 28 | |
| Grasa | ||||
| Activación | Hipoxia | • Inducción de respuesta proinflamatoria en adipocitos• Disminución de adipoquinas antiinflamatorias• Disminución del transporte de glucosa inducido por la insulina | 34,35,38,40,41 | |
| Activación | Genético | • Obesidad• Resistencia a la insulina• Intolerancia a la glucosa | 42 | |
| Inactivación | Genético | • Resistencia a la obesidad inducida por la dieta | 43 | |
Sin ninguna duda, el área donde más se ha estudiado la posible relación entre la ruta de hipoxia y los defectos en el metabolismo celular es el tejido adiposo. El consenso generalizado en esta área de investigación es que el tejido adiposo de personas obesas muestra una hipoxia moderada30,31. Sin embargo, 2 estudios muy recientes han obtenido resultados completamente opuestos32,33. El estudio de Hodson et al.32 es especialmente llamativo, ya que ha mostrado que aunque el tejido adiposo de personas obesas presenta niveles de oxígeno reducidos, no muestra características metabólicas de encontrarse en un estado de hipoxia porque el consumo de oxígeno en este tejido también es bajo. Una posible causa para esta discrepancia es la distinta metodología utilizada, así como el grupo de pacientes evaluados en los distintos estudios, y serán necesarios nuevos estudios para esclarecer este punto. Los estudios realizados en modelos animales de obesidad (tanto genéticos como inducidos por dieta) no dejan lugar a dudas y han demostrado de forma fehaciente que el tejido adiposo en la obesidad se encuentra en condiciones de hipoxia34,35. El mecanismo subyacente que se postula es la falta de la angiogénesis necesaria durante un aumento de peso tan súbito en estos modelos.
La obesidad se caracteriza por un estado crónico de inflamación sistémica de bajo grado. El tejido adiposo tiene un papel determinante en este estado de inflamación produciendo citoquinas proinflamatorias que promueven el desarrollo de resistencia a la insulina36,37. Los estudios realizados tanto en modelos animales como en adipocitos (tanto de ratones como de humanos) en cultivo han demostrado que los niveles bajos de oxígeno en adipocitos inducen una respuesta proinflamatoria (con aumento de adipoquinas proinflamatorias como IL-6 y el factor de inhibición de la migración de los macrófagos) y una disminución de adipoquinas antiinflamatorias como la adiponectina34,35,38. La hipoxia también parece inducir una respuesta inflamatoria en otros tipos celulares presentes en el tejido adiposo. Se ha descrito que, en condiciones de hipoxia, la producción de citoquinas aumenta en la fracción vascular estromal de tejido adiposo humano39. El proceso inflamatorio puede ser sin duda uno de los mecanismos por los que la hipoxia puede contribuir al desarrollo de la resistencia a la insulina en el tejido adiposo durante la obesidad, pero la hipoxia también puede afectar directamente a la señalización de insulina en los adipocitos. Varios estudios han revelado que la hipoxia disminuye el transporte de glucosa inducido por insulina en adipocitos humanos y de ratones40,41. Este efecto parece estar causado por un descenso en la fosforilación del receptor de insulina41. Los estudios realizados en ratones en los que se ha activado la ruta HIF específicamente en el tejido adiposo (mediante inactivación genética de VHL) confirman que la sobreactivación de la ruta HIF puede causar la disfunción del adipocito. Los ratones deficientes en VHL en el tejido adiposo desarrollan obesidad moderada, resistencia a la insulina e intolerancia a glucosa42. En contraposición, los ratones con inactivación de HIF1α en el tejido adiposo son resistentes a la obesidad inducida por la dieta43. Estos hallazgos plantean la posibilidad de utilizar inhibidores farmacológicos de la ruta HIF en el tratamiento de la disfunción metabólica asociada a la obesidad.
La posible relación causal entre la ruta de hipoxia y la resistencia a la insulina puede tener relevancia clínica en el contexto del síndrome de apnea obstructiva del sueño (SAOS). El SAOS parece asociarse con resistencia a la insulina (e intolerancia a la glucosa y diabetes tipo2) independientemente de la obesidad44. Uno de los mecanismos propuestos para explicar esta asociación es la hipoxia intermitente causada por la apnea, y de hecho, estudios experimentales en humanos han demostrado que la hipoxia intermitente disminuye la sensibilidad a la insulina45. Si esta hipótesis fuera cierta sería de esperar que la oxigenación hiperbárica o la presión positiva continua en la vía respiratoria (CPAP) que se emplea para el tratamiento del SAOS disminuyeran la resistencia a la insulina en estos pacientes. Sin embargo, los ensayos clínicos realizados hasta el momento no parecen demostrar un efecto del tratamiento con CPAP sobre el metabolismo de la glucosa46-48, aunque algunos autores sugieren que son necesarios ensayos mejor aleatorizados y con un mayor número de pacientes para obtener conclusiones más definitivas49.
Los fenotipos observados en ratones en los que se ha inactivado el gen VHL nos llevan a plantear si algunos de los efectos asociados a la activación de la ruta HIF se observan también en pacientes con síndrome de Von Hippel Lindau. Ninguno de los escasos estudios realizados hasta la fecha ha descrito una asociación entre Von Hippel Lindau y diabetes o síndrome metabólico. Sin embargo, hay que tener en cuenta que estos pacientes portan mutaciones en el gen VHL en heterocigosis3 (los tumores en estos pacientes se desarrollan cuando ocurre otra mutación que afecta al otro alelo de VHL). En ratones, la eliminación de un único alelo de VHL no parece causar fenotipo alguno, lo que indica que una heterocigosis de VHL no es suficiente para inducir una respuesta constitutiva de la ruta de hipoxia HIF.
ConclusionesLos estudios experimentales realizados en los últimos años han puesto de manifiesto la importancia de la ruta de respuesta a hipoxia HIF en la regulación metabólica de diversos órganos implicados en la homeostasis de la glucosa. La ruta HIF parece tener un papel especialmente relevante en la función de la célula beta. La activación de la ruta HIF en células beta bloquea la secreción de insulina mediante un mecanismo que afecta al metabolismo intracelular de la glucosa, pasando de un metabolismo oxidativo a un metabolismo eminentemente glucolítico. Estos estudios ilustran la estrecha relación entre metabolismo celular y secreción de insulina y confirman que la célula beta es particularmente sensible a la activación del metabolismo glucolítico50.
La ruta de la hipoxia HIF también afecta al metabolismo celular de órganos relevantes en el desarrollo de la resistencia a la insulina como el hígado, el tejido adiposo y el músculo, por lo que cambios en la actividad de esta ruta podrían ser un factor patogénico importante en la diabetes tipo2. No obstante, se necesitan más estudios experimentales, farmacológicos y clínicos que nos ayuden a establecer de forma más precisa la relación entre la ruta de respuesta a la hipoxia HIF y la diabetes e identificar los posibles mecanismos biológicos subyacentes. Estos estudios nos permitirán determinar si la manipulación de la ruta de la hipoxia HIF puede ser una nueva diana terapéutica en el tratamiento de la diabetes tipo2 y el síndrome metabólico.
FinaciaciónEste trabajo está financiado por el Ministerio de Ciencia e Innovación de España y la Consejería de Salud de la Junta de Andalucía.
Conflicto de interésLos autores declaran que no existe ningún conflicto de interés