Tanto la obesidad como la diabetes mellitus tipo2 (DM2) son 2 problemas sanitarios fuera de control y con un coste sanitario muy significativo. El principal factor de riesgo para el desarrollo de DM2 es padecer obesidad, y cerca del 90% de los pacientes con DM2 tienen sobrepeso u obesidad. La cirugía bariátrica (CB) induce una resolución a largo plazo de la DM2 en más de la mitad de las personas con obesidad y diabetes que se operan. La CB pone en evidencia las limitaciones del tratamiento médico de la obesidad en la actualidad y nos hace plantear importantes cuestiones, tales como: ¿debemos ofrecer tratamiento quirúrgico a los pacientes con diabetes y obesidad cuando fracasa el tratamiento médico? ¿Qué lugar debe ocupar la CB en el algoritmo de tratamiento de la DM2? ¿Qué técnica quirúrgica sería más indicada y a qué índice de masa corporal debe recomendarse? Profundizar en un mejor entendimiento de los mecanismos fisiopatológicos responsables de resolución de la DM2 tras la CB ayudará sin duda a contestar de forma apropiada las preguntas arriba formuladas y potencialmente contribuirá al desarrollo de tratamientos médicos eficaces y alternativos a la CB.
Both obesity and type2 diabetes mellitus (T2DM) are two major health problems out of control and with a significant health cost. The main risk factor for the development of T2DM is suffering from obesity, and nearly 90% of patients with T2DM are overweight or obese. Bariatric Surgery can lead to a long-term resolution T2DM in more than half of people with obesity and diabetes who undergo this surgery. Bariatric surgery highlights the current limitations of medical treatment of obesity, and brings up important issues, such as: should we offer surgical treatment to patients with diabetes and obesity when medical therapy fails?, where in the T2DM therapy algorithm, should bariatric surgery be placed?, what surgical technique would be more indicated, and at what body mass index should it be recommended? A better understanding of the pathophysiological mechanisms responsible for the resolution of T2DM after the bariatric surgery will help to properly answer the questions above raised above, and potentially contribute to the development of effective medical treatments, alternatives to bariatric surgery.
Existe un amplio consenso en la literatura sobre el importante papel que la obesidad juega en la etiopatogenia de la diabetes mellitus tipo 2 (DM2) (el 90% de casos de DM2 son atribuibles a la obesidad) y en el efecto beneficioso que la pérdida de peso tiene al mejorar los niveles de glucemia y hemoglobina glucosilada (HgA1c) en pacientes con obesidad y diabetes (diabesidad)1.Sus proporciones son ya epidémicas en la mayor parte del mundo: se estima que actualmente existen 246 millones de personas que padecen DM2, una cifra que puede llegar a los 380 millones en el año 2025, si se cumplen las últimas predicciones2. En España, los resultados del estudio Di@bet.es sitúan la prevalencia de DM2 en el 13,8%, mientras que la prevalencia de obesidad se sitúa alrededor de 28%3, con 1-3% de la población incluida en el rango de obesidad mórbida (OM) (índice de masa corporal [IMC]≥40kg/m2). La situación es muy preocupante, tanto desde una perspectiva asistencial como económica, ya que solo el coste del tratamiento de la obesidad y sus comorbilidades supone alrededor del 7% del presupuesto nacional de la salud.
Aunque tenemos métodos dietéticos que pueden ser útiles al inducir pérdidas de peso a corto plazo, carecemos actualmente de programas médicos eficaces a largo de plazo que causen una pérdida de peso mantenida en pacientes con OM, comparable a la pérdida de peso y a la mejoría de las comorbilidades obtenidas tras la cirugía bariátrica (CB) en estos pacientes obesos. Diferentes estudios han demostrado el efecto beneficioso que planes dietéticos (incluyendo dietas hipocalóricas), programas de terapia de comportamiento y ejercicio físico tienen sobre la pérdida de peso a corto plazo y la consecuente mejora de las enfermedades asociadas a la obesidad4. En concreto, Shai et al.5 mostraron que tanto la dieta mediterránea como la dieta baja en hidratos de carbono son alternativas eficaces a la dieta baja en grasa, obteniendo pérdidas de peso de alrededor de 4-5kg después de 2 años de intervención. Mayores pérdidas de peso (7-8kg) se pueden obtener si, además de dieta, se lleva a cabo un programa de terapia de comportamiento6.
Igualmente, varios trabajos han mostrado el efecto beneficioso de medicamentos como la sibutramina, el orlistat y los análogos de GLP-1 en la reducción del peso y la mejora de los perfiles glucémico y lipídico en pacientes obesos7,8. Los sujetos participantes en estos ensayos clínicos también recibían consejo dietético. El IMC en estos individuos era de 30-35kg/m2 y la duración media de estos estudios fue de un año. Además de los ensayos aquí recogidos, nuestra experiencia clínica nos indica que en muy pocos casos los pacientes con obesidad son capaces de mantener la pérdida de peso a largo plazo y suelen recuperar su peso inicial (y más) tras del cese de un tratamiento dietético o farmacológico si no llevan a cabo importantes cambios en sus hábitos de vida, tanto en aspectos de nutrición como de actividad física. El papel que puede jugar la terapia de grupo en la puesta en marcha (y mantenimiento) de hábitos de vida saludables en pacientes con OM es actualmente un tema de gran interés.
Sin embargo, y aunque todavía sea difícil de aceptar por muchos endocrinólogos, técnicas de CB como el bypass gástrico (BPG) y la derivación biliopancreática sí son eficaces para ayudar a perder peso y remitir la DM2 a largo plazo en la mayoría de los pacientes que se operan, y esta circunstancia pone en evidencia la eficacia limitada de los tratamientos no-quirúrgicos actuales para el abordaje de la diabesidad. Consecuentemente, el número de pacientes con obesidad y diabetes que son enviados a CB está aumentando de forma muy significativa y cada año operamos a más pacientes con obesidad, por lo que las listas de espera de CB ya alcanzan los 3 años en muchos hospitales españoles.
Llama la atención, sin embargo, el hecho de que todavía no tenemos un claro entendimiento de los mecanismos fisiológicos responsables de la resolución de la DM2 tras la CB y que aún carecemos de ensayos clínicos aleatorizados que nos permitan identificar qué técnica quirúrgica es más eficaz y segura a largo plazo, aliviando la DM2. A pesar de estas circunstancias, en el año 2008 se realizaron 344.000 CB en el ámbito mundial9, de los cuales alrededor de 5.000 intervenciones se realizaron en España. En este contexto, cada vez más autores se cuestionan si la CB debe ocupar un papel relevante en el organigrama terapéutico de la DM2, e incluso si debe considerarse en pacientes con IMC<35kg/m2, en los cuales su DM2 no esté siendo controlada eficazmente con tratamiento médico.
En esta revisión nos centraremos en el papel de las técnicas de CB más empleadas como posible tratamiento de la DM2 en sujetos con obesidad.
Cirugía bariátrica como tratamiento de la obesidad mórbidaLa CB es actualmente el tratamiento más efectivo para inducir pérdida de peso en pacientes con OM10,11. En 1991, una conferencia consenso en el Instituto Nacional de la Salud Americano estableció las pautas para el tratamiento quirúrgico de la obesidad10. Este panel concluyó que los pacientes con obesidad claseIII (IMC>40kg/m2) o aquellos con obesidad claseII (IMC de 35,0-39,9kg/m2) con una o más complicaciones médicas severas causadas por la obesidad (hipertensión, DM2, osteoartritis, hiperlipidemia o apnea del sueño) eran candidatos a CB. Sin embargo, estos pacientes deberían haber mostrado incapacidad para perder peso con tratamiento médico y tener un riesgo quirúrgico aceptable11. Con el tratamiento quirúrgico se puede obtener una importante reducción ponderal y la mejoría e incluso curación de la mayoría de las comorbilidades que acompañan a la obesidad10–13.
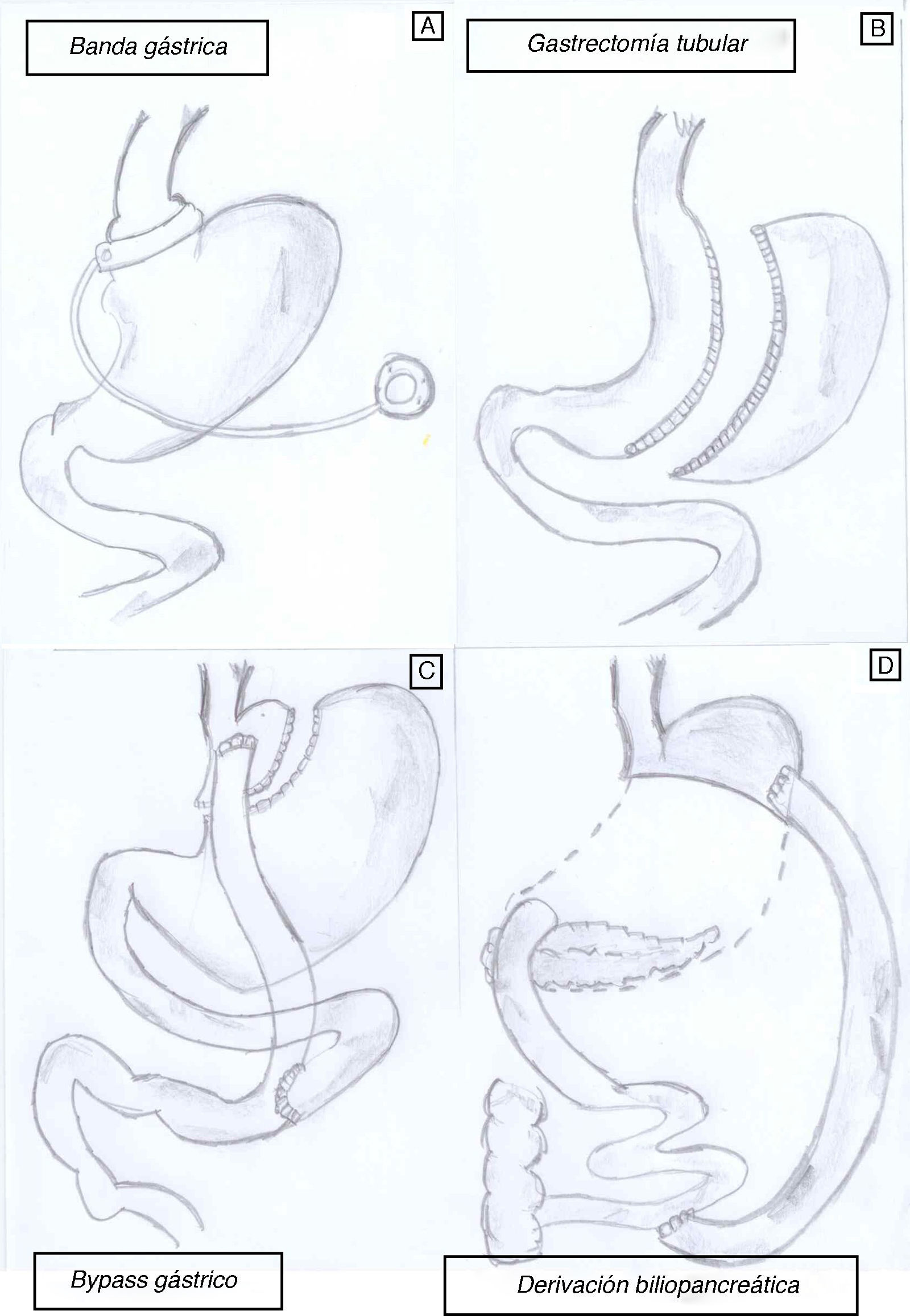
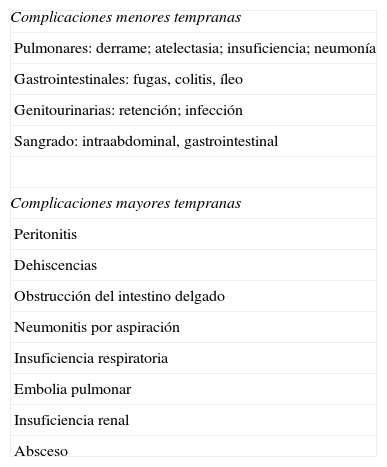
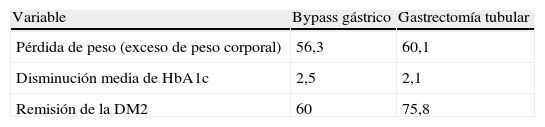
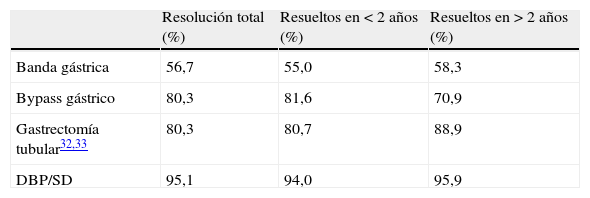
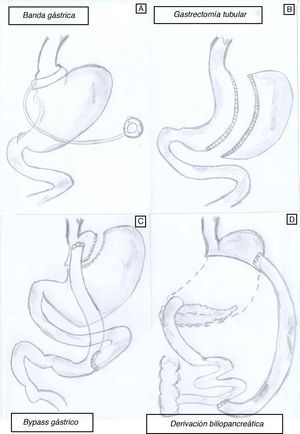
Aunque la CB es actualmente la opción más viable en el tratamiento de la OM, no todas las técnicas quirúrgicas tienen el mismo impacto sobre la pérdida de peso y resolución de la DM2. De hecho, existen varios procedimientos quirúrgicos (fig. 1) para el tratamiento de la OM, y sus objetivos principales son disminuir la ingesta calórica, disminuir la absorción de calorías o una combinación de ambos. Actualmente no tenemos estudios clínicos que nos permitan identificar un modelo ideal de CB y cada paciente, según sus características personales (y según el centro en el que se realice la cirugía), puede recibir un tipo de cirugía u otro.
Existen técnicas restrictivas, que son modalidades de cirugía que se basan simplemente en restringir la capacidad del estómago para que el paciente tenga una sensación de saciedad más temprana y, consecuentemente, disminuya la ingesta.
La técnica conocida como banda gástrica (BG) ajustable (adjustable gastric banding, fig. 1A) causa pérdida de peso principalmente por disminución de la ingesta oral. Esta técnica consiste en la colocación de una banda alrededor del estómago, de tal manera que lo divida en forma de «reloj de arena». Esta banda se puede ajustar según se necesite, mediante la manipulación de un reservorio que se coloca debajo de la piel y está conectado por un catéter a la BG con el objetivo de inducir saciedad precoz14. La pérdida de peso suele ser lenta y puede requerir el ajuste de la banda para obtener una restricción de calorías y pérdida de peso adecuadas. La BG muestra datos variables en cuanto a pérdida de peso a largo plazo, y entre el 20 y el 50% de los pacientes acaban sometiéndose a otra técnica bariátrica adicional. La mayor pérdida de peso suele ocurrir a los 24-36 meses tras la colocación de la banda y es alrededor del 20-25% del peso prequirúrgico15. La BG se acompaña de una baja morbimortalidad, pero no se recomienda aplicarla a obesos «glotones» ni «picadores», dado la facilidad de sabotearla con ingestas hipercalóricas.
La gastroplastia vertical en banda fue una operación muy utilizada en el pasado, pero debido al alto índice de reoperaciones por fallos en la cicatrización de la línea de grapas y que hasta el 75% de los pacientes recuperan la mayoría del peso perdido a los 5 años, ha dejado paso a técnicas más efectivas, como la gastrectomía tubular o tubulización gástrica (TG) (sleeve gastrectomy, fig. 1B). Esta técnica fue descrita por Marceau et al. en 199316, y consiste en realizar una tubulación gástrica guiada por una sonda orogástrica seccionando la curvatura mayor del estómago. La tubulación gástrica fue propuesta inicialmente por Gagner como un primer paso terapéutico con menor riesgo en pacientes superobesos o en pacientes con riesgo perioperatorio elevado, antes de realizar el cruce duodenal o el BPG por laparoscopia. Aunque la TG fue originalmente descrita como una operación meramente restrictiva, los resultados de varios estudios hormonales han sugerido un efecto metabólico importante, a veces muy similar a los cambios observados después del BPG. De la misma forma, aunque las pérdidas ponderales obtenidas pueden ser menores que con otras técnicas, en la mayoría de los pacientes ya no resulta necesario proceder a la realización del segundo paso. Es de destacar que la TG se ha mostrado muy eficaz resolviendo la DM2 en estudios previos17-20, como revisaremos más adelante. Igualmente, la adopción de esta técnica en muchos centros de Estados Unidos y Europa va a proporcionar datos importantes en un futuro próximo, y como tal, la gastrectomía en tubo puede ser una opción importante a considerar en ensayos clínicos18.
Bypass gástricoEl mecanismo de acción del BPG (fig. 1C) es tanto restrictivo como malabsoptivo. El pequeño reservorio gástrico (15-30ml) consecuencia de la cirugía limita la ingesta oral y causa saciedad precoz. Este reservorio se conecta al intestino delgado mediante un asa en Y de Roux de una longitud variable, según se trate de un bypass proximal o distal. Asas de más de 150cm añaden un componente malabsortivo significativo. Es la técnica quirúrgica bariátrica más utilizada en Estados Unidos. El 75% de los pacientes son capaces de mantener una pérdida de peso superior al 50% del exceso de peso corporal, característica que define el éxito de cualquier CB. En la mayoría de los casos la pérdida de peso se produce de forma rápida13,15 tras la cirugía, presentando un porcentaje de complicaciones del 10% y una mortalidad global del 0,2-1%21-23. El peso suele estabilizarse a los 8-10 años tras la cirugía con una pérdida media de peso del 27% del peso inicial21-24. El impacto del BPG sobre las comorbilidades de la obesidad, tales DM2, hipertensión y SAOS, es superior a la BG.
Otra técnica mixta importante es la derivación biliopancreática (DBP) (fig. 1D), en la que predomina un componente de malabsorción de alimentos. Esta técnica consiste en reducir parcialmente la capacidad del estómago (aproximadamente a 1/3) y alterar significativamente el proceso digestivo para que parte de los alimentos no se absorban en el intestino y se eliminen con las heces. Hay que separar el intestino delgado en 2 partes: una se anastomosa al estómago para transportar los alimentos («asa alimentaria o digestiva») y la otra transporta solo los jugos pancreático e intestinal proximal («asa biliopancreática»). Ambas se unen en la parte terminal del intestino, donde los alimentos se juntan con los jugos digestivos («asa común»). En general se recomienda esta cirugía a individuos con IMC superior a 50kg/m2, ya que la pérdida de exceso de peso suele darse en alrededor del 80% de los casos24. La pérdida de peso ocurre pronto y suele estabilizarse a los 24-36 meses después de la cirugía. Proporciona buena calidad de vida porque no hay restricciones a la ingesta. Hay varias modalidades de esta técnica, como el cruce duodenal (duodenal switch), en el cual se mantiene la integridad funcional del estómago al conservarse el píloro, o la modificación de Larrad, con una mayor longitud de la rama alimentaria y potencialmente menos efectos adversos. Las complicaciones de estas técnicas quirúrgicas se resumen en la tabla 1.
Complicaciones tras la cirugía bariátrica
| Complicaciones menores tempranas |
| Pulmonares: derrame; atelectasia; insuficiencia; neumonía |
| Gastrointestinales: fugas, colitis, íleo |
| Genitourinarias: retención; infección |
| Sangrado: intraabdominal, gastrointestinal |
| Complicaciones mayores tempranas |
| Peritonitis |
| Dehiscencias |
| Obstrucción del intestino delgado |
| Neumonitis por aspiración |
| Insuficiencia respiratoria |
| Embolia pulmonar |
| Insuficiencia renal |
| Absceso |
El principal factor de riesgo para el desarrollo de DM2 es la obesidad, y el 90% de todos los pacientes con DM2 tienen sobrepeso u obesidad2. Del mismo modo, el riesgo de desarrollar DM2 es aproximadamente del 50% en pacientes con un IMC>30kg/m2 y de más del 90% en sujetos con un IMC>40kg/m2. De hecho, prácticamente todos los adultos con OM tienen intolerancia a la glucosa, y alrededor del 35% de las personas con intolerancia de glucosa progresarán a DM2 en un plazo de 10 años1.
Hasta hace poco carecíamos de datos sólidos y fiables sobre las consecuencias de la pérdida de peso a largo plazo en el contexto de ensayos clínicos multicéntricos. Sin embargo, los recientes ensayos clínicos aleatorizados (Estudio Sueco de Obesidad y otros)13,23 han demostrado una reducción significativa en el peso corporal, así como importantes beneficios a largo plazo sobre comorbilidades de la obesidad (especialmente DM2) y una reducción de la mortalidad. Así, la CB consiguió la remisión de la DM2 (glucemia plasmática en ayunas <126mg/dl sin necesidad de tratamiento farmacológico) en el 72% de los pacientes tras 2 años de seguimiento, que se mantuvo en el 36% a los 10 años13. Sjostrom et al.13 mostraron que la incidencia de DM2 es del 8% en el grupo de pacientes operados, mientras que asciende al 25% en individuos obesos no operados, tras 10 años de seguimiento.
Es importante señalar que no todas las técnicas de CB tienen el mismo impacto sobre la resolución de la DM2; los mejores resultados en la mejora del control glucémico se han obtenido con las intervenciones que combinan restricción con malabsorción, si se las compara con las intervenciones meramente restrictivas. Buchwald et al.23 han publicado recientemente en forma de metaanálisis la evidencia científica (aportada por múltiples grupos científicos) a favor de que la CB puede causar tanto la resolución bioquímica (glucemia en ayunas y HgA1c) como de las manifestaciones clínicas de la DM2. Debemos tener en cuenta que la mayoría de estos estudios no son ensayos clínicos aleatorizados, prospectivos y controlados, sino evaluaciones retrospectivas de series más o menos extensas de pacientes operados en hospitales universitarios donde tampoco ha existido uniformidad en la técnica quirúrgica elegida, sino que más bien imperaron los condicionamientos técnicos de equipo quirúrgico participante en el estudio.
Banda gástrica vs. tratamiento médicoDixon et al.25 publicaron uno de los pocos ensayos clínicos aleatorizados que comparaba el efecto de la BG con el tratamiento médico convencional en la tasa de resolución de DM2. La remisión de la DM2 fue alcanzada por 22 pacientes (el 73%) en el grupo quirúrgico y solo por 4 pacientes (el 13%) en el grupo de terapia convencional. La pérdida de peso en el grupo quirúrgico fue del 20,7%, mientras que en el grupo de terapia convencional fue del 1,7% (el 5,2%) de peso, tras 2 años de intervención. Su estudio concluyó que los pacientes incluidos en el grupo quirúrgico tenían una mayor probabilidad de alcanzar remisión de su DM2 a consecuencia principalmente de la mayor pérdida de peso. Varios grupos compararon el efecto de la BG con el BPG (y la DBP).
Banda gástrica vs. bypass gástrico/gastrectomía tubular/diversión biliopancreáticaEn un estudio prospectivo publicado en 2007 (no aleatorizado)26, en el que participaron 282 pacientes, la BG se mostró menos eficaz que el BPG, causando remisión de la DM2; el número de medicamentos antidiabéticos utilizados también era superior a los 2años tras la BG, aunque los autores concluyeron que «las tasas de resolución de DM2 tras los 3 tipos de cirugía eran equivalentes». Igualmente, un estudio de Pontiroli et al.27 mostró que la tasa de remisión de la DM2 tras la BG fue similar a la obtenida tras DBP en un estudio con 170 pacientes y 65 meses de seguimiento. Estudios posteriores no han sido tan favorables para la BG y sugieren que esta es menos eficaz que el BPG o la DBP en la resolución de la DM2 en pacientes con OM.
En concreto, Frezza et al.28 también compararon de forma retrospectiva el efecto de la BG en la remisión de la DM2 en pacientes con OM con otras 2 técnicas restrictivas: TG y gastrectomía parcial (resección de una parte del estómago). Los resultados a 12 y 18 meses mostraron que la TG causó mayor pérdida de peso y consiguió mejor control glucémico comparado con la BG o la gastrectomía, lo que sugiere que la resección del fundus gástrico característica de la TG desempeña una función importante en el alivio de la DM2, aunque todavía por definir.
De la mismo forma, Abbatini et al.20 compararon la eficacia de la BG vs. el BPG y la TG en la tasa de resolución de DM2 en un estudio retrospectivo de 3 años de seguimiento. Sus datos mostraron que la BG consiguió una tasa de resolución de la DM2 del 60,8%, mientras que tras el BPG fue del 81,2% y tras la TG del 80,9%. El tiempo transcurrido hasta la retirada del tratamiento médico de la DM2 fue de 12,6 meses para los pacientes tratados con BG, de 3,2 meses para los que fueron tratados con un BPG y de 3,3 meses para los que se sometieron a una TG. Aunque las 3 técnicas fueron eficaces en la mejora de la DM2 tras 3 años de seguimiento, la BG (aunque menos invasiva) fue la menos efectiva.
En el metaanálisis de Buchwald et al.21 también se mostró que la remisión de la DM2 fue inferior en los pacientes que se sometieron a BG (56,7%), frente al BPG (80,3%).
Datos recientemente comunicados por Okerson et al.29 pertenecientes a subanálisis de 66 pacientes incluidos en el ensayo APEX que padecían DM2 han mostrado que la remisión de esta patología ocurrió en el 48,5% de los pacientes a los 2 años tras la CB. Los pacientes que mostraron mejor respuesta tras la CB fueron los que padecían DM2 durante un periodo de tiempo más corto.
Bypass gástrico vs. gastrectomía tubularAunque todavía no se han desarrollado ensayos clínicos aleatorizados que comparen la eficacia de ambas técnicas, sí disponemos de una serie de estudios con un número limitado de pacientes que revisaremos a continuación. Desde los estudios pioneros de Walter Pories y Jose Caro en Greenville30 que mostraron que la DM2 remitía tras la CB, diversos grupos han evaluado el efecto del BPG y la TG para mejorar las comorbilidades de la OM, entre ellas la DM2. Nocca et al.19 compararon mediante un ensayo clínico multicéntrico en Francia el efecto del BPG con la TG en la tasa de resolución de DM2 a un año. Sus datos mostraron que las 2 técnicas bariátricas fueron similares en términos de reducción de niveles de HbA1c y reducción de tratamiento farmacológico de la DM2. El IMC antes de la cirugía era de 47,9kg/m2 en el grupo tratado con BPG y de 50,6kg/m2 en el grupo que recibió una TG. Un año después de la cirugía, el 60% del grupo de BPG y el 75,8% del grupo tratado con TG mostraron remisión de su DM2 y ya no recibían ningún tratamiento farmacológico (tabla 2), mientras que el 31,4% del grupo de BPG y el 15,5% del grupo que se sometió a TG continuaban recibiendo tratamiento con dosis bajas de insulina. La resección del fundus gástrico y un vaciado gástrico más rápido podrían explicar en parte el importante efecto beneficioso de la TG en la regulación de la glucosa. En esta línea, Boza et al.31 mostraron que la tasa de remisión de DM2 tras la TG fue similar a la obtenida tras el BPG (TG 90,9% vs. BPG 86,6%) en el contexto de un estudio caso-control en el que participaron 811 pacientes. De interés es que tanto la tasa de complicaciones como la estancia media hospitalaria fueron menores tras la TG. Estudios de Vidal et al.32 y de Gordejuela et al.33 sugieren una eficacia similar de ambas técnicas sobre la tasa de remisión de DM2 uno y 2 años después de la CB, respectivamente. Sin embargo, no todos los autores coinciden, ya que un estudio retrospectivo multicéntrico de Chouillard et al.34 en el que se incluyeron 200 pacientes mostró que aunque la morbilidad fue superior en el grupo de pacientes que se sometieron a BPG (20,5%) comparado con el grupo que recibió TG (6,5%; p<0,05), la tasa de remisión total de la DM2 fue significativamente superior en el grupo del BPG (p<0,05). Sin embargo, el porcentaje de pérdida de exceso de peso a los 6, 12 y 18 meses, así como la resolución de comorbilidades (no-diabetes), fueron comparables en ambos grupos.
Cambios en peso, HbA1c y tasa de remisión de la DM2 después de un año tras bypass gástrico o gastrectomía tubular1
| Variable | Bypass gástrico | Gastrectomía tubular |
| Pérdida de peso (exceso de peso corporal) | 56,3 | 60,1 |
| Disminución media de HbA1c | 2,5 | 2,1 |
| Remisión de la DM2 | 60 | 75,8 |
Sin duda, la TG se muestra como una técnica efectiva para perder peso que contribuye eficazmente a remitir la DM2 y presenta menos efectos adversos si se la compara con el BPG. Tendremos que esperar sin embargo a disponer de datos a largo plazo relativos a la duración de la remisión de la DM2 tras esta técnica y su seguridad, antes de poder tener una idea clara de su utilidad frente a BPG.
Bypass gástrico vs. derivación biliopancreáticaSkroubis et al.35 compararon de forma prospectiva el efecto del BPG y de la DBP sobre la tasa de remisión de DM2, en una población de 130 pacientes con OM durante 24 meses. Sus datos mostraron que la DBP fue más eficaz que el BPG para ayudar a perder peso e igualmente causar remisión de la DM2. En concreto, la DM2 remitió en todos los pacientes que se sometieron a DBP (n=7) y en 7 de los 10 pacientes tratados con BPG.
Bypass vs. tratamiento médicoUn ensayo clínico recientemente publicado por Mingrone et al.36 demostró que en pacientes con OM la CB es más eficaz para mejorar el control glucémico que el tratamiento médico. En concreto, tras 2 años de evolución el 75% de los pacientes con DM2 que se sometieron a BPG y el 95% de los pacientes que recibieron una DBP mostraban remisión de su DM2, mientras que esta remisión no había ocurrido en ninguno de los pacientes que habían recibido tratamiento médico. De interés es el hecho de que no encontraron correlación entre el grado de mejora de la glucemia en ayunas y la pérdida de peso tras la CB. Además, la cronología de la remisión de la DM2 fue diferente entre las 2 técnicas quirúrgicas (BPG y DBP), a pesar de una pérdida de peso similar. Ambas circunstancias apoyarían la hipótesis de que la CB podría ejercer efectos beneficiosos al mejorar la DM2 independientemente de la pérdida de peso.
En los 621 estudios revisados en su metaanálisis, Buchwald et al.23 mostraron que los pacientes diabéticos tenían una resolución del 78,1% de las manifestaciones clínicas de su enfermedad y la DM2 mejoró (o remitió) en el 86,6% de ellos. La remisión de la DM2 fue superior en los pacientes que se sometieron a DBP (95,1%), seguido del BPG (80,3%). Los niveles de glucosa en ayunas y de insulina postoperatoria disminuyeron rápidamente y de forma significativa tras los 2 tipos de cirugía.
Es importante tener en cuenta que diferentes estudios han evidenciado que la mejoría (o remisión) de la DM2 está directamente relacionada con la magnitud de la pérdida de peso alcanzada por los pacientes diabéticos y con OM. Sin embargo, no toda la mejoría sobre el control de la diabetes se debe a la pérdida de peso, ya que sorprendentemente la necesidad de tratamiento farmacológico de la DM2 desaparece a las pocas horas/días tras la cirugía, antes de que se haya obtenido una pérdida de peso significativa12,13,19,23,37. De la misma forma, alrededor del 10% de los pacientes con DM2 no son obesos y la CB mejora igualmente su DM2 sin causar gran pérdida de peso. La tabla 3 representa una relación entre pérdida de peso en función del tipo de cirugía y el tiempo de remisión de la DM2 (menos de 2 años y más de 2 años) tras GBP y TG.
Tasa de remisión de diabetes mellitus tipo 2 en función de la técnica quirúrgica
| Resolución total (%) | Resueltos en <2 años (%) | Resueltos en >2 años (%) | |
| Banda gástrica | 56,7 | 55,0 | 58,3 |
| Bypass gástrico | 80,3 | 81,6 | 70,9 |
| Gastrectomía tubular32,33 | 80,3 | 80,7 | 88,9 |
| DBP/SD | 95,1 | 94,0 | 95,9 |
Modificado de Schauer et al.21.
Estas circunstancias sugieren que cambios en el entorno hormonal intestinal (especialmente incretinas) después de la CB podrían desempeñar un papel importante en el mecanismo de resolución de la DM2 tras la CB.
Posible papel de las incretinas en la resolución de la diabetes mellitus tipo 2 tras la cirugía bariátricaEn concreto en el intestino, la llegada temprana de nutrientes al íleum (consecuencia probablemente de un vaciado gástrico más rápido) podría ser responsable de una mayor estimulación de GLP-1, que tendría efectos beneficiosos sobre la secreción de insulina y la regulación de glucosa tras la CB. Es conocido que los niveles de GLP-1 aumentan tanto tras el BPG como tras DBP y TG38,39; en esta línea, la administración de un inhibidor del receptor de GLP-1 (exedin 9-39) causó una reducción en la liberación de insulina en pacientes que se habían sometido a BPG40.
Estudios de interposición ileal (tanto en humanos como en modelos animales) apoyan esta hipótesis del intestino distal41. De una forma similar al BPG, la TG no lleva asociada una recanalización del intestino (se caracteriza por la resección de la curvatura mayor del estómago) y se asocia a una secreción aumentada de GLP-142. Esta hipótesis parece más solida que la hipótesis proximal, que sugiere que la exclusión de alimento del duodeno y del yeyuno proximal consecuencia de la CB, y no tanto la pérdida de peso, podría ser la responsable del beneficio sobre el metabolismo glucídico tras la CB. Los datos que apoyan esta hipótesis se basan principalmente en estudios en modelos murinos43.
Varios grupos han descrito elevaciones significativas en la secreción de GLP-1 (y PYY) consecuencia tanto del BPG como tras la TG39,44,45. Es probable que estos cambios en los niveles de incretinas sean secundarios a un vaciamiento gástrico acelerado y a la posterior estimulación por parte de los nutrientes del intestino distal46.
Por último, es importante destacar que los pacientes con mayor tasa de curación tras su CB fueron los pacientes con un mayor grado de reserva pancreática, en que su DM2 tenía una duración más corta (<5 años) y era más leve (tratada con dieta±antidiabéticos orales) y habían conseguido una mayor pérdida de peso37, datos que sugieren que cuanto antes se intervenga a estos pacientes, mayor probabilidad habrá de conseguir su euglucemia.
En resumen, la CB parece eficaz para la remisión de la DM2; la DBP podría ser un poco más eficaz que la TG y el BPG, aunque potencialmente también podría tener más efectos secundarios. Todavía desconocemos el mecanismo responsable del impacto beneficioso sobre el metabolismo de la glucosa consecuencia de la CB, pero sin duda esta responsabilidad es probablemente compartida por varios factores. Estudios futuros ayudarán a identificar qué pacientes (en función de sus características genéticas, hábitos de vida y comorbilidades) tienen más posibilidades de beneficiarse de la cirugía, cuáles son los factores predictivos de éxito y la tasa real de recurrencia de la DM2, a medio y largo plazo, después de la CB.
Ante las circunstancias aquí señaladas, parece imperativo que tratemos de evaluar qué tratamiento quirúrgico es más efectivo en la resolución de la DM2 en pacientes con OM. Para ello, además de analizar en detalle los estudios ya publicados, será necesaria la puesta en marchas de ensayos clínicos controlados que nos permitan evaluar qué tratamiento quirúrgico es más efectivo para mejorar la diabesidad y que contribuyan a definir a partir de qué IMC debemos considerar la cirugía.