Hasta ahora los desafíos a los que se enfrentaban los pacientes con diabetes mellitus tipo 2 (DM2) estaban relacionados con la disminución progresiva de la funcionalidad de la célula beta, el incremento de peso y la presencia de hipoglucemias relacionadas con los tratamientos farmacológicos, así como de las implicaciones que estas acciones pudieran tener en el grado de control metabólico y el subsiguiente riesgo vascular a largo plazo. En este ámbito la cirugía bariátrica se erige como la solución más convincente en frenar esta tendencia clínica en pacientes con obesidad grave. Sin embargo la irrupción de nuevos fármacos en estos 3 últimos años, con mejor perfil beneficio-riesgo, parece arrinconar a la cirugía bariátrica a un segundo plano como una alternativa competitiva en el tratamiento de la DM2.
El interés por la cirugía bariátrica, como un posible tratamiento electivo de la DM2, despega tras la publicación en 1995 por parte de Walter Pories en la que describe cómo el 83% de los 165 diabéticos tratados con cirugía bariátrica permanecían en remisión clínica 14 años más tarde de la cirugía1. Con el advenimiento de la cirugía laparoscópica al ámbito de la cirugía de la obesidad, el número de procedimientos se dispara superando más de 340.000 intervenciones anuales en el mundo en 20112, consiguiendo disminuir la morbimortalidad asociada a la cirugía por vía abierta a cotas inferiores al 1%. Los resultados en los pacientes con DM2 son claramente llamativos; en la revisión sistemática y metaanálisis realizada por Buchwald H et al. en aproximadamente 5.000 pacientes con DM2, se señalan unas tasas globales de remisión (glucemia <100mg/dL o HbA1c <6%, sin tratamiento farmacológico), en el 78% de los pacientes y mejoría (glucemia 100-125mg/dL) en el 83% de los sujetos incluidos en el estudio3. Con estas cifras de éxito tan abrumadoras hubiésemos esperado una avalancha de solicitudes de cirugías bariátricas en pacientes con DM2, pero en la práctica no ha tenido ese efecto llamada. Por ejemplo, en España se realizaron entre 2001 y 2010, 13.038 cirugías bariátricas (de acuerdo al registro del conjunto mínimo básico de datos) de los que el 23,6% (n: 3.080) tenían DM2, un dato que refleja realmente la frecuencia habitual de DM2 como comorbilidad asociada a la obesidad mórbida4.
Basado en el metaanálisis más arriba referido y en otros documentos con diferentes niveles de evidencia, la ADA desde 2009 sugiere que la cirugía bariátrica puede ser considerada en pacientes con DM2 e índice de masa corporal (IMC) >35kg/m2, especialmente cuando la diabetes sea difícil de controlar con cambios en el estilo de vida y fármacos5. También es favorable porque las tasas de mortalidad con esta modalidad de cirugía son del 0,28%, una cifra inferior a la que se produce en una colecistectomía6. A diferencia de la ADA, otras sociedades científicas han explorado la posibilidad de incluir esta modalidad de cirugía cuando el IMC está por debajo de 35kg/m2, aunque bajo ciertas circunstancias7–9. Posiblemente este posicionamiento adquiere más relevancia en países asiáticos donde la DM2 es altamente prevalente en sujetos con IMC mucho más bajos que en occidente10.
La mayoría de los estudios epidemiológicos han demostrado una relación entre obesidad y mayores tasas de enfermedad cardiovascular. La pérdida de peso y la mejoría de comorbilidades como la DM2 debería contribuir a reducir el impacto sobre la mortalidad cardiovascular, pero hasta ahora los estudios de intervención que conllevan pérdida intencional de peso no han podido verificar esta hipótesis. Ni estudios clásicos como el Finish Diabetes Prevention Study11, el de China Da Qing Diabetes Prevention Study12 o el más reciente Look-Ahead13 han conseguido reducir el impacto sobre las tasas de mortalidad cardiovascular con los cambios en el estilo de vida. Es plausible que la pérdida moderada de peso entre el 5-10% no contribuya a modificar esa tendencia y se necesiten pérdidas ponderales más cuantiosas y duraderas para objetivar una diferencia significativa.
Hay datos interesantes que apuntan a que la cirugía bariátrica se asocie con menor mortalidad global a largo plazo cuando se compara con una población control de obesos no sometidos a cirugía de la obesidad, con unas tasas de reducción entre el 25-50% según los diferentes estudios14–16. En el estudio Swedish Obese Subjects, un estudio prospectivo, controlado, no aleatorizado con participación de 2.010 obesos sometidos a cirugía bariátrica y equiparados con 2.037 obesos control no intervenidos, al cabo de un promedio de 14 años de seguimiento se constató una reducción significativa de muertes cardiovasculares en el grupo de cirugía bariátricia (hazard ratio ajustado: 0,47; intervalo confianza al 95%: 0,29-0,76; p=0,002)17. Se pudo apreciar en este estudio que, ni la pérdida de peso alcanzada tras la cirugía ni el grado de IMC inicial se asociaba con menores tasas de mortalidad cardiovascular, mientras que sí existía una interacción significativa con las concentraciones elevadas de insulina. Este dato podría sugerir que los pacientes con resistencia a la insulina (con o sin DM2) serían los que más se beneficiarían de la reducción de eventos cardiovasculares cuando se someten a cirugía bariátrica. No obstante, ninguno de estos estudios epidemiológicos fue diseñado para conocer resultados en una subpoblación con DM2, por lo que no podemos extraer aún conclusiones definitivas en este campo. Se requieren diseños específicos y al menos con una duración superior a 10 años para obtener resultados consistentes.
El impacto sobre complicaciones microvasculares no ha sido estudiado con la misma intensidad y, aunque carecemos de datos concluyentes, las reseñas disponibles indican que las lesiones de órganos diana tienden a estabilizarse o incluso mejorar18. El reto ahora reside en igualar estos resultados a los pacientes con DM2 y menor grado de adiposidad.
La estática del índice de masa corporal (IMC)En 1991 el National Institute of Health19 estableció un consenso sobre obesidad donde se proponían unos puntos de corte del IMC que permitían implementar de manera escalonada los tratamientos disponibles para el tratamiento de la obesidad. De ese consenso surgió la idea de que la cirugía de la obesidad solo tenía aplicación cuando los pacientes tuviesen IMC >40kg/m2 o >35kg/m2, en presencia de comorbilidades mayores como la DM2. Y esto parecía lógico cuando la cirugía bariátrica se realizaba en pocos centros, mediante laparotomía y con solo 3 variantes técnicas que implicaban mayor morbimortalidad. Veintitrés años más tarde estas mismas limitaciones ligadas al IMC han permanecido inalterables, cuando la laparoscopia es la vía de acceso más frecuente y las técnicas han evolucionado de tal manera que las tasas de complicaciones y mortalidad se han reducido considerablemente. El impacto de las normas del National Institute of Health siguen teniendo su huella en la la mayoría de las sociedades científicas del mundo que han perfilado sus consensos de acuerdo a las normas imperantes desde entonces. Y sin embargo la cirugía bariátrica ha demostrado que consigue mayores remisiones de la DM2 respecto a programas intensivos de cambios en el estilo de vida13,20,21.
Y es que ya sabemos que el IMC es un indicador de adiposidad global, mientras que es la distribución de la grasa corporal la que se relaciona con las alteraciones metabólicas asociadas al exceso de tejido adiposo. Desde el punto de vista clínico no puede considerarse que sea muy diferente una persona que tenga DM2, dislipemia mixta, hipertensión arterial y esteatosis hepática con un IMC de 33 o de 37kg/m2. Y sin embargo hasta ahora la indicación de la cirugía sólo se prioriza en función del parámetro IMC. Recientemente se ha podido constatar que el 29% de los sujetos con normopeso y el 80% de aquellos con sobrepeso tienen un porcentaje de grasa corporal similar a los obesos, cuando la adiposidad no se limita a la medición antropométrica obtenida mediante el índice de Quetelet, sino mediante el análisis de composición corporal. Además, estos individuos no obesos, con mayor porcentaje de grasa corporal, presentan marcadores biológicos de factores de riesgo cardiovascular similar a los obesos22. Por tanto, parece razonable que la guía terapéutica se establezca en función de las alteraciones metabólicas de un individuo y no solamente por su IMC. Porque la paradójica alternativa es que podríamos sugerir o esperar a que el sujeto aumentara de peso para que franquease la barrera de IMC de 35kg/m2 y poder operarse sin impedimentos.
En este contexto, varias sociedades científicas ya se han manifestado en considerar la cirugía bariátrica aplicada a la diabetes tipo 2 en sujetos con IMC entre 30-35kg/m2, cuando coexistan otras comorbilidades metabólicas asociadas y el grado de control metabólico no sea adecuado habiendo empleado la mayoría de las estrategias terapéuticas posibles7–9,23–26.
Cirugía metabólica: más allá de la remisión de la diabetesEn un concepto amplio, la cirugía metabólica se refiere a la cirugía bariátrica aplicada a alteraciones propias del síndrome metabólico (DM2, dislipemia aterogénica, HTA), pero previsiblemente pueda incluir también a la esteatosis hepática-esteatohepatitis y síndrome de apneas-hipopneas del sueño, que suelen coexistir con los procesos anteriores, por compartir mecanismos fisiopatológicos comunes. Por tanto, aquí el concepto ligado al IMC desempeña un papel secundario, aunque popularmente algunos prefieran asignar el término de cirugía metabólica cuando el IMC está por debajo de 35kg/m2. Sin embargo, como se ha narrado anteriormente, la adiposidad sigue estando presente en un amplio rango de IMC y los cambios metabólicos tras la cirugía son mixtos: independientes o dependientes del peso. Precisamente, la observación de que la mejoría de la DM2 se produce en pocos días tras la cirugía bariátrica, cuando aún no se ha modificado significativamente el peso, ha dado lugar a estudios detallados de las implicaciones de hormonas gastrointestinales en la regulación de la secreción de insulina. Aunque no están completamente dilucidados los mecanismos de remisión de la DM2, las acciones de la ghrelina, incretinas (GLP-1, GIP, PYY), junto a ácidos biliares y microbiota son algunos de los actores que influyen en la mejoría de la sensibilidad de la insulina tras cirugía metabólica y que por su extensión e interés se pueden consultar en otras publicaciones de revisión27,28.
Otro de los aspectos interesantes a debatir es ¿qué buscamos con la cirugía metabólica? porque la mayoría de las publicaciones solo centran sus objetivos en los porcentajes de remisión de la DM2. Lo lógico es pensar que deseamos una mejoría global de todas las alteraciones metabólicas que tenga el paciente, más allá de la propia remisión de la DM2, ayudando a que en este proceso su calidad de vida y años de vida ganados sumen puntos. Y pese a que la remisión de la DM2 ocupa el eje central de los trabajos, sin embargo no existe unanimidad en los criterios aplicados. Así que podemos encontrar diferentes tasas de remisión entre el 50-85%, según lo estrictos o no que se apliquen unos determinados criterios29,30. Y en esta variabilidad también influye si en las series de casos se incluyen mayor número de pacientes tratados solo con dieta o con insulina, con mayor o menor tiempo de evolución de la enfermedad, etc.31, de tal manera que a menudo resulta complejo realizar comparaciones entre diferentes estudios.
Cada vez se tienen más en cuenta en las publicaciones los criterios del comité de expertos de la ADA32 que consideran como remisión completa cuando el paciente lleva un año con glucemias basales <100mg/dL y HbA1c <6%, en ausencia de tratamiento farmacológico, mientras que remisión parcial comprendería cuando las glucemias se encuentren entre 100-125 y HbA1c <6,5%, sin tratamiento farmacológico. Una manera de simplificarlo sería tener en cuenta los mismos puntos de corte de HbA1c que ha sugerido la ADA para el diagnóstico de diabetes, de tal manera que podríamos hablar de remisión completa –en ausencia de medicación– si la HbA1c fuese <5,7%; de mejoría, cuando la HbA1c se encontrara entre 5,7-6,4% y de no remisión ante cualquier valor igual o superior a 6,5%33.
La cirugía metabólica desempeña un papel aún mayor que la búsqueda de una determinada tasa de remisión de la DM2. Y aunque en las publicaciones esta variable suele ser a menudo el único criterio que se tiene en cuenta a la hora de establecer comparaciones, otros aspectos deben primar en el paciente, más allá de una mera cifra de HbA1c. Nos referimos a que la cirugía metabólica debe contribuir a alcanzar un objetivo de control combinado en la mayoría de los pacientes no solo en el control glucémico (HbA1c <7%), sino también de lípidos (c-LDL <100mg/dL, c-HDL >40 o 50 en hombres o mujeres, triglicéridos <150mg/dL) y de presión arterial (<140/80mm Hg)21,34.
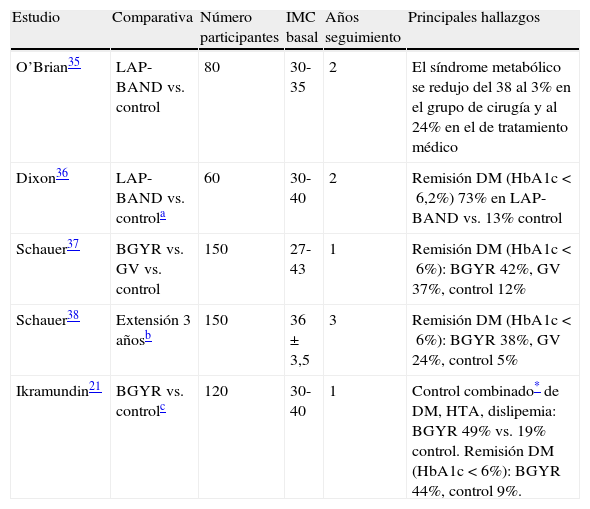
¿Por qué cirugía metabólica con IMC entre 30 a 35kg/m2?Es solo cuestión de tiempo que la cirugía bariátrica entre a formar parte del tratamiento de la DM2 en este intervalo de IMC, si bien no se descarta la posibilidad de que, en algunas circunstancias muy concretas, pueda realizarse esta cirugía en algún paciente con IMC por debajo de 30kg/m2. Varios son los factores que limitan aún esta práctica de manera más asidua en este tipo de pacientes. En primer lugar porque el abanico de posibilidades de tratamientos farmacológicos en el campo de la DM2ha crecido de manera abrumadora en los últimos 5 años, permitiendo que se puedan alcanzar adecuados controles metabólicos, previsiblemente durante largo plazo, evitando incrementos de peso (incluso disminución ponderal) e hipoglucemias. Seguramente estas nuevas modalidades de tratamientos conlleven aparejado un retraso en el deterioro de la célula beta y una repercusión menor en las complicaciones micro y macrovasculares. Pese a ello es mayor el impacto de la cirugía bariátrica sobre el control de la diabetes reduciendo la HbA1c entre 1,8-3,8% y por extensión sobre la preservación de la reserva pancreática. En segundo lugar, porque solo disponemos de 3 ensayos clínicos aleatorizados que incluyan pacientes con IMC <35kg/m2, comparando cirugía metabólica frente a tratamiento no farmacológico21,35–38, con un número global de sujetos tratados aún escaso. Sin embargo y como cabría esperar los resultados son superponibles a los realizados en individuos con diabetes e IMC >35 Kg/m2, en cuanto a tasas de remisión y seguridad a corto plazo (hasta 3 años)39 (tabla 1). A pesar del creciente número de publicaciones de series de casos (más de 50 publicaciones hasta 2013, con 2.258 pacientes) en este intervalo de IMC40, la evidencia para justificar un tratamiento alternativo de la DM2 en los algoritmos de tratamiento se resiste a las principales sociedades científicas ante la ausencia de estudios de nivel 1. En realidad el reclutamiento de pacientes para un ensayo de cirugía metabólica vs. tratamiento convencional es difícil, ya que a pesar de que la cirugía conlleva mayor reducción de peso, remisión de la DM2 y mejoría de las comorbilidades, no cabe duda de que sigue pesando la posibilidad (aunque sea muy baja) de mortalidad inmediata y razonablemente mayor morbilidad peroperatoria que la oferta de un cómodo tratamiento farmacológico sin esos riesgos aunque los resultados sean inferiores. A pesar de estas limitaciones hay varios estudios aleatorizados en marcha que, con seguridad, nos brindará más luces que sombras sobre el lugar preeminente que debe ocupar la cirugía bariátrica en el tratamiento de la DM2 en cualquier rango de IMC.
Ensayos clínicos aleatorizados que comparan tratamiento médico (grupo control) vs. quirúrgico que incluyen a pacientes con diabetes mellitus tipo 2 e IMC <35kg/m2
| Estudio | Comparativa | Número participantes | IMC basal | Años seguimiento | Principales hallazgos |
| O’Brian35 | LAP-BAND vs. control | 80 | 30-35 | 2 | El síndrome metabólico se redujo del 38 al 3% en el grupo de cirugía y al 24% en el de tratamiento médico |
| Dixon36 | LAP-BAND vs. controla | 60 | 30-40 | 2 | Remisión DM (HbA1c <6,2%) 73% en LAP-BAND vs. 13% control |
| Schauer37 | BGYR vs. GV vs. control | 150 | 27-43 | 1 | Remisión DM (HbA1c <6%): BGYR 42%, GV 37%, control 12% |
| Schauer38 | Extensión 3 añosb | 150 | 36 ±3,5 | 3 | Remisión DM (HbA1c <6%): BGYR 38%, GV 24%, control 5% |
| Ikramundin21 | BGYR vs. controlc | 120 | 30-40 | 1 | Control combinado* de DM, HTA, dislipemia: BGYR 49% vs. 19% control. Remisión DM (HbA1c <6%): BGYR 44%, control 9%. |
BGYR: bypass gástrico en Y de Roux; DM2: diabetes mellitas tipo 2; GV: gastrectomía vertical; HTA: hipertensión arterial; LAP-BAND: banda gástrica ajustable;
Control combinado de diabetes mellitus (HbA1c <7%), HTA (presión arterial sistólica <130mmHg) y dislipemia (c-LDL <100mg/dL).
pacientes con menos de 2 años de evolución de la diabetes y HbA1c <8%, sin tratamiento con insulina. Un 22% tenían un IMC <35kg/m2.
Por tanto, en nuestro ámbito de trabajo, la cirugía bariátrica por debajo de IMC 35kg/m2, debe plantearse en el contexto de un meticuloso análisis entre médico y paciente donde se valoren ventajas e inconvenientes, actuando en esencia de la misma manera que si el paciente tiene mayor IMC. El riesgo asociado con otras comorbilidades metabólicas es la misma en cualquier nivel de IMC y previsiblemente son estas complicaciones ligadas a la adiposidad las que decidan más sobre la actitud quirúrgica a tomar que la misma DM2 de manera aislada. Por ello, algunas sociedades científicas, incluidas las nuestras (SED, SEEN, SEEDO, SECO)25 han dado un paso adelante para posicionarse en este ámbito clínico concreto, blindando un aspecto no menos importante que es la necesidad de contar con un equipo multidisciplinar que evalúe adecuadamente al paciente; que esté ligado a un protocolo aprobado por el comité de ética y que el equipo quirúrgico tenga la solvencia requerida para realizar una cirugía metabólica con la máxima seguridad. Lo que se pretende también con esta declaración o posicionamiento es desvincular la aproximación racional y controlada de esta modalidad de tratamiento quirúrgico de aquellas prácticas comerciales poco deseables que ofrecen a sus clientes la posibilidad de «curar la diabetes» abarcando incluso a la diabetes tipo 1.
Cuestiones abiertasQuedan algunos interrogantes por contestar. El más importante y no menos comprometido es elegir el momento adecuado para realizar la cirugía metabólica. En este punto, el paciente también tiene derecho a estar informado y participar de la decisión final. Primero porque el paciente tiene obesidad grado 1 y al menos una comorbilidad mayor (DM2) y precisaría perder entre un 10-20% de su adiposidad para reducir significativamente su riesgo vascular. Los tratamientos convencionales e intensivos de pérdida de peso son infructuosos a largo plazo y las perspectivas de contar con tratamientos farmacológicos para la obesidad en Europa tampoco auguran buenas expectativas a medio plazo. Así que la cirugía bariátrica debería ser una buena alternativa de tratamiento para ese paciente. En segundo lugar, la cirugía metabólica tiene fecha de caducidad en lo que se refiere a tasas de remisión de diabetes. Habitualmente la mayoría de nuestros pacientes candidatos a cirugía con IMC <35kg/m2 suelen tener mayor edad (a menudo >60 años), mal control metabólico, resistencia a la insulina, dosis máxima de antidiabéticos orales o dosis elevadas de insulina, largo tiempo de evolución de la enfermedad y con frecuencia otras comorbilidades severas asociadas, como enfermedad coronaria. En estas circunstancias, la cirugía busca reducir el impacto de las comorbilidades en la salud global del paciente y conseguir un mejor control metabólico, pero difícilmente pueda conseguirse tasas de remisión de la DM2 comparables a si esa decisión se hubiese realizado tiempo atrás. También el riesgo quirúrgico de complicaciones se incrementa en situaciones como las referidas y si los resultados son regulares o malos, sin duda ensombrece la opinión general acerca de la utilidad de la cirugía metabólica. En diferentes estudios de cirugía bariátrica, la duración de la diabetes, la menor reserva pancreática, el tratamiento con insulina, el peor control metabólico, el menor porcentaje de pérdida de peso, se asocian a menores tasas de remisión de la DM241–43 o con mayor posibilidad de reaparición de la DM2 a medio y largo plazo44,45. Por tanto, idóneamente la cirugía debe realizarse «cuanto antes mejor».
No se conoce con exactitud el porcentaje de pacientes que vuelven a recuperar entre el 20-50% del peso perdido tras 10 años de la cirugía (mayor recuperación en técnicas restrictivas que malabsortivas) y que suele responder más bien a falta de adherencia a las normas de cambios en el estilo de vida que a un fallo en la técnica quirúrgica empleada46. En estas situaciones la hiperglucemia vuelve a aparecer y es necesario reinstaurar un tratamiento farmacológico progresivo. Aproximadamente se estima que una tercera parte de los pacientes obesos mórbidos con DM2 recaen al cabo de 5 años45. El mayor tiempo de evolución de la diabetes, el peor control metabólico inicial y un menor porcentaje de pérdida ponderal se tornan nuevamente como indicadores destacados de recidiva. Las estrategias de tratamiento farmacológico no son diferentes a las indicadas antes de la cirugía, con preferencia seleccionando fármacos que no contribuyan al incremento del peso ni favorezcan la hipoglucemia47. Si algunos fármacos, como los agonistas del receptor de GLP1, pudieran tener un efecto mayor en el control metabólico o del peso corporal con respecto a sujetos con DM2 no sometidos a cirugía bariátrica, forma parte de las incógnitas que aún están sin dilucidar.
Otra cuestión que sigue abierta es si la cirugía metabólica en este intervalo de IMC podría retrasar la progresión de las complicaciones microvasculares y macrovasculares. Claramente, con estudios que alcanzan a 3 años de duración, esta pregunta tardará un tiempo en tener contestación. En sujetos con mayor índice de IMC, sí existen evidencias en sentido positivo18, pero se necesitan algunos años más para contestar con mayor rigurosidad.
También la técnica quirúrgica forma parte del debate continuado de la cirugía metabólica. No podemos realizar un detalle pormenorizado de los estudios comparativos que analizan los resultados sobre remisión de DM2 en función de la técnica empleada. Se ha especulado mucho acerca de la técnica ideal, considerando los mecanismos fisiopatológicos implicados en la remisión de la diabetes, basadas en la exclusión duodenal y/o el mecanismo facilitador de liberación de incretinas por parte del íleo distal. Y esto ha sido fuente inspiradora de técnicas de derivación intestinal con diferentes longitudes de asas intestinales, de modalidades de anastomosis yeyunal o ileal, de transposición ileal e incluso de tratamientos endoscópicos no quirúrgicos para la implantación de un dispositivo intraluminal duodeno-yeyunal que impida el contacto de los alimentos con el duodeno y primeras asas del yeyuno28. En general podemos decir que en cuanto a tasas de remisión las derivaciones biliopancreáticas son las que ofrecen mayores garantías a largo plazo, seguidas del bypass gástrico, de la gastrectomía vertical, todas ellas claramente separadas de los resultados de la banda gástrica ajustable que es la técnica quirúrgica que menores índices de éxito presenta.
Pero a pesar de las evidencias favorables de múltiples publicaciones, en la práctica clínica diaria existe un espinoso obstáculo que son las impresiones negativas acerca de la cirugía metabólica tanto en los propios pacientes con DM2 sin obesidad mórbida como en los profesionales responsables de su tratamiento48. La falta de información y la escasa experiencia acumulada en un elevado número de centros sanitarios de España (con menos de 50 cirugías bariátricas/año, de los que una docena pueden tener DM2), es sin duda una desventaja a la hora de gestionar una oferta de cirugía metabólica con un claro respaldo de beneficio/riesgo. La mayoría de los estudios con largas series de pacientes muestran que la cirugía bariátrica y metabólica disminuye el peso, reduce las comorbilidades, mejora la calidad de vida, es segura y efectiva en manos expertas y ahorra costes al sistema sanitario. Por tanto, la cirugía bariátrica en DM2 debe ofrecerse como una alternativa cuando sea factible y no solo cuando se han agotado todas las herramientas terapéuticas.
ConclusionesLa cirugía bariátrica de la diabetes mellitus tipo 2 en individuos con IMC 30-35kg/m2 no debe plantearse como un tratamiento de último recurso. Debe formar parte como una de las estrategias de tratamiento cuando fracasen otras terapéuticas convencionales disponibles, especialmente si coexisten con otras comorbilidades metabólicas de riesgo, pero sin esperar a agotar la despensa farmacológica. La equidad no puede establecerse únicamente en función del IMC. El número de publicaciones que señalan las ventajas de la cirugía bariátrica en pacientes con DM2 por debajo de un IMC 35kg/m2 es cada día más sólida, equiparable a la de los individuos con obesidad mórbida. Pero también es un requisito imprescindible la naturaleza de un equipo cohesionado de profesionales con sólida experiencia en este terreno que pueda discutir con el paciente las mejores opciones de tratamiento. No obstante y a pesar de evidencias concretas, todavía existen suficientes escollos en numerosos profesionales para ubicar la cirugía bariátrica como tratamiento de primera línea en la DM2, pendiente aún de resultados de ensayos clínicos aleatorizados con mayor número de pacientes y seguimiento a largo plazo. Mientras tanto, desde el punto de vista clínico, parece razonable que las decisiones se basen en las mejores evidencias disponibles hasta este momento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.