Paciente de sexo femenino, de 27 años de edad, diabética tipo 1, con buen control metabólico y seguimiento de su enfermedad, que comienza bruscamente con sensación de cuerpo caliente, mialgias generalizadas a predominio de miembros inferiores de manera insidiosa que fue aumentando en intensidad y acompañada de artralgias, con marcada impotencia funcional de cintura escapular y pelviana, cefaleas fronto-occipitales, constatándose posteriormente hipertermia de 39°C de temperatura, es tratada con antibioticoterapia, antivirales y antiinflamatorios no esteroideos.
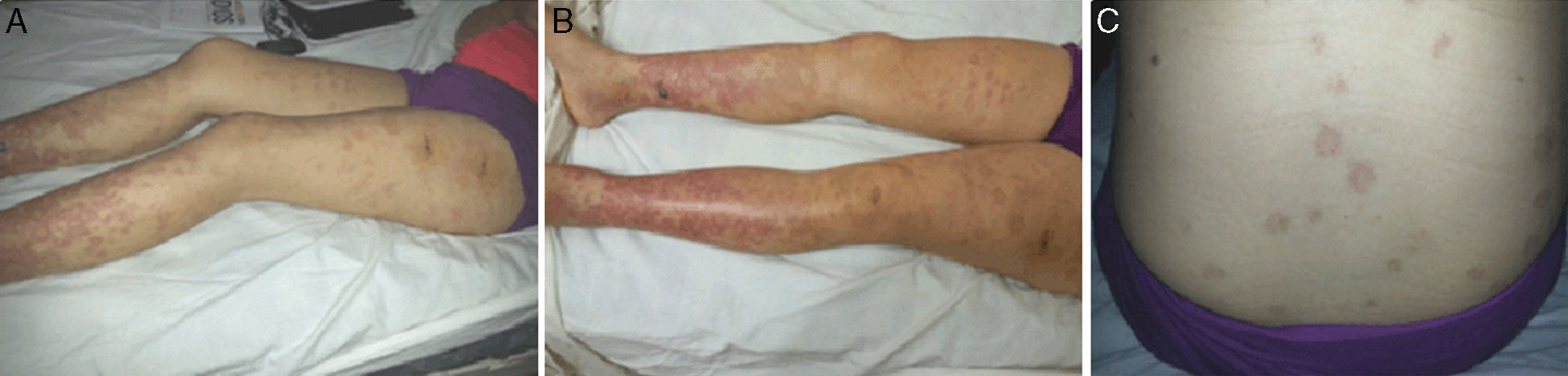
Con el correr de los días, evoluciona con la aparición de eritemas maculares en los miembros inferiores, polimorfos, de bordes difusos pruriginosos, para luego transformarse en pápulas con centros pálidos de mayor tamaño, fotosensibles y de distribución generalizada, sin respetar rostro, tronco, miembros superiores ni cuero cabelludo; concomitantemente con esta situación, persiste febril durante más de 14 días, con acentuación de las mialgias, artralgias, con aparición de artritis periférica con compromiso de grandes articulaciones y edemas duros en dichas zonas.
Laboratorio de relevancia: bicitopenia (anemia, linfopenia), eritrosedimentación elevada, función renal conservada, hepatograma sin alteración, proteína C reactiva ++ (positivo).
Laboratorios específicos: FAN + 1/2.560, anti-Ro +, anti-La +, Coombs directo +, citomegalovirus –, Paull Bunell –, hepatitis B –, virus de la inmunodeficiencia humana –, p-ANCA –, c-ANCA, triple BAAR – (negativo), biopsia de piel (infiltrado linfocitario leve, inflamación de los pequeños vasos inespecífico, hallazgos compatibles con colagenopatía), tomografía computarizada de tórax con derrame pleural bilateral leve a moderado, ganglios paraórticos de moderado tamaño y otro de menor tamaño en región axilar.
Ecocardiograma: se descartan vegetaciones valvulares.
Las enfermedades autoinmunes son un grupo clínicamente diverso de trastornos complejos tales, como diabetes mellitus tipo 1 (DM1), esclerosis múltiple (EM), enfermedad de Graves, enfermedad de Crohn, artritis reumatoide (AR), psoriasis, lupus eritematoso sistémico (LES), etc. En total, afecta a un 5-7% de la población mundial. Las enfermedades autoinmunes se producen como resultado de la pérdida de la tolerancia fisiológica a antígenos propios y se caracterizan por la activación persistente de células inmunitarias, dando lugar a daño en diferentes tejidos. Además de otras causas, estas enfermedades tienen un componente genético complejo que implica a muchos genes que regulan el alcance de la respuesta inmunitaria. El complejo mayor de histocompatibilidad (MHC), especialmente de MHC de clase ii, tiene la influencia genética más potente sobre la susceptibilidad a la enfermedad autoinmune 1.
En 1976, el notable genetista humano James Neel titulaba un capítulo del libro The genetics of diabetes mellitus, «Diabetes mellitus: pesadilla de un genetista». Sin embargo, recientemente, la disponibilidad de información detallada sobre la estructura y la variación del genoma humano y de nuevas técnicas de alto rendimiento para la explotación de estos datos permite a los genetistas soñar con desentrañar la complejidad genética que subyace a estos trastornos2.
Los estudios han reportado una sólida evidencia de vinculación entre la región HLA en el cromosoma 6 p21 con DM1, subtipo 1A. Aunque muchos estudios han mostrado certeza indicativa de vinculación locus adicionales, los hallazgos en estos locus han sido inconsistentes2.
Los genes específicos que originalmente se investigaron en esta región se denominaron como genes candidatos para la DM1, porque de las funciones de sus productos en la presentación de antígenos al sistema inmunitario celular. Estudios posteriores de genes candidatos en otros han identificado y confirmado otros locus de riesgo para la DM1, incluyendo el gen de la insulina (INS), un autoantígeno importante en la DM1, y CTLA4, que desempeña un papel en el desarrollo y el reconocimiento de antígeno de células T. Una adición relativamente reciente a la lista de asociaciones replicadas de gen candidato con la DM1 es el PTPN22, que codifica la proteína fosfatasa tirosina linfoide (LYP). En las células T, LYP actúa en un complejo con la cinasa Src C-terminal (CSK) para regular negativamente la señalización del receptor de células T. De este modo, la «ganancia de función» aparentemente estaría asociada con el PTPN22 y la variante R620W, y el supuesto efecto de dosis génica plantean la posibilidad de que no solo los inhibidores selectivos podrían dirigirse a PTPN22 como un posible enfoque terapéutico, sino también se siente alentado por los numerosos informes de que la misma variante alélica (R620W) se asocia a otras enfermedades autoinmunes comunes, como LES, AR y enfermedad de Graves2.
Esto ha sido verificado por numerosos estudios, entre ellos el realizado por Vang et al.3, quienes afirman que el descubrimiento del polimorfismo de un solo nucleótido (SNP) en LYP, codificada por el gen PTPN22, está asociado con DM1 y se ha ampliado el mismo para la AR, la AR juvenil, el LES, la enfermedad de Graves, el vitíligo generalizado y otras enfermedades humanas autoinmunes.
Frecuentemente, los pacientes lúpicos presentan otras enfermedades. Aproximadamente, el 30% de los pacientes con LES desarrollan una segunda, tercera o cuarta condición autoinmune. La DM1 es una de esas enfermedades que se asocian al LES, aunque pocos pacientes se han notificado con DM y SLE. De hecho, la última edición del libro de texto de Dubois Lupus eritematoso sistémico solo menciona la conexión en una sola tabla. Sin embargo, puede ser un reto en la gestión de estos pacientes que tienen estas condiciones: por ejemplo, ¿qué sucede en aquellos pacientes con ambas enfermedades cuya función renal se deteriora, que presentan principalmente nefritis lúpica, requiriendo más inmunosupresión intensiva o que presenten neuropatía diabética, en cuyo caso un control más estricto del nivel de insulina plasmática sería el más apropiado4?
Del mismo modo, ¿una neuropatía periférica en un paciente con ambas enfermedades es tan probable que sea debido a una enfermedad que a la otra? Además, ¿los pacientes con ambas enfermedades tienen un «doble riesgo» de desarrollar aterosclerosis4?
En nuestra cohorte, la superposición SLE-DM es poco frecuente (1,9%) y, aunque no se puede excluir la posibilidad de que algunos pacientes diabéticos podrían haber sido pasado por alto, que es poco probable. Con esta prevalencia tan baja, se abre la posibilidad de que el LES pueda de alguna manera ser protector del desarrollo de la diabetes. En nuestra revisión de la literatura, sin embargo, no hemos encontrado una prevalencia exacta de la DM en pacientes con LES4.
En los diferentes estudios, hemos observado que algunos trabajos donde se han descrito pacientes con LES-DM (por lo general, se centra en el riesgo cardiovascular) y, sorprendentemente, poco parece haber sido escrito sobre la gestión de la superposición de LES y DM4.
Nuestra paciente, de 27 años, diabética tipo 1 de larga data, a la que se le hace diagnóstico de lupus eritematoso, que presentaba con una amplia gama de patologías cutáneas (fig. 1). Las manifestaciones cutáneas son, con frecuencia, el signo de presentación del LE, y ciertos subtipos cutáneos de LE (CLE), pueden ocurrir en ausencia de la enfermedad sistémica.
El lupus eritematoso cutáneo agudo (ACLE) típicamente se presenta en la tercera década de la vida y se asocia frecuentemente a LES activo. Hay formas de ACLE localizadas y generalizadas5.
La forma generalizada del ACLE es más rara y se produce por encima y debajo del cuello y ha sido referido como un «erupción maculopapular del lupus» o «dermatitis lúpica fotosensible». Esto se presenta generalmente como una erupción pruriginosa, generalizada, en forma de máculas y pápulas simétricas, fotosensible y pueden parecerse a una erupción cutánea5-7.
Las lesiones que se asemejan eritema multiforme en pacientes con ACLE o SCLE (subagudo) se han denominado síndrome de Rowell. Histológicamente, las lesiones ACLE muestran licuefacción de la membrana basal, edema de dermis superior, infiltrado linfocítico perivascular y perianexial, todos los cuales son generalmente menos pronunciada en comparación con otros subtipos de CLE. Inmunológicamente, presentan ANA positivos; se encuentra en el 95% de los pacientes ACLE, así como una alta incidencia de anti-ADN de doble cadena (anti-dsADN) y anti-Sm. La inmunofluorescencia directa lesional (Difuso) revela depósitos inmunes granulares en la unión dermo-epidérmica y depósitos perivasculares en la dermis superior, con mayor frecuencia de inmunoglobulina M (IgM)5-7.