Las cifras del estudio Di@bet.es en España son contundentes: la diabetes afecta al 13,8% de la población española. Pero si los datos estadísticos son alarmantes, el mayor problema lo constituye el ritmo de crecimiento, y las previsiones calculan en poco tiempo proporciones pandémicas de diabetes tipo2 que pondrán en riesgo el estado de bienestar. Por ello, la diabetes no solo representa un desafío importante para los servicios de salud, sino que pasa a ser un reto para los Ministerios de Sanidad y Economía. La tecnología se ha convertido en una herramienta imprescindible en la atención de calidad del paciente con diabetes, pues facilita los procesos de atención y cuidados para obtener un buen control metabólico y prevenir las complicaciones. Las bombas de insulina, los sensores de glucosa y la automonitorización de la glucemia capilar ya han probado su eficiencia, y la telemedicina está en vías de hacerlo. Los costes indirectos de la diabetes en España son mucho más elevados que los directos, lo cual no deja de ser una paradoja que debemos invertir. La optimización de los recursos dependerá de la habilidad que tengamos los profesionales y la administración para implantar y mantener la innovación tecnológica en todos sus niveles y hacerla eficaz en la ecuación que examina los datos económicos y los beneficios. Los análisis de coste-efectividad y coste-utilidad son necesarios para establecer prioridades y permitir tomar decisiones de gestión sanitaria, que en el caso de enfermedades tan prevalentes como la diabetes tienen repercusiones directas en el gasto sanitario.
Di@bet.es study results are impressive, showing that diabetes affects 13.8% of the Spanish population. Not only the statistical facts are alarming, but the increasing incidence of this disease is a major problem, as pandemic proportions of type2 diabetes are expected. Thus, the study of diabetes represents a challenge not only for health services, but also for the Ministries of Health and Finance. Technology has become an essential tool in the quality care of patients with diabetes, as it helps in the healthcare processes to obtain an optimum metabolic balance and prevent possible complications. Insulin pumps, continuous glucose monitoring and self-monitoring blood glucose have all proved their efficiency, and telemedicine it is making good progress. The indirect costs of diabetes in Spain are much higher than the direct ones, showing the importance of inverting the paradox. The optimization of resources depends not only on the ability of the physicians, but also the administration, to implant and sustain technological innovations in our system, and with that make it effective in terms of benefits. Cost-effectiveness and cost-utility analysis are needed to prioritize and allow health management services to make the correct choices for approaching this prevalent chronic disease.
En los años noventa se presentaron resultados incuestionables en la prevención y en el retraso en la progresión de las complicaciones crónicas de la diabetes en los pacientes que realizaban terapia intensiva, tanto en diabetes tipo1 (DM1)1 como tipo2 (DM2)2. En España se ha observado que aproximadamente el 40-60%3,4 de los pacientes con DM2 y el 75,8% con DM15 no cumplen el objetivo de control glucémico, cuando se sabe que el buen control ha demostrado disminuir las complicaciones crónicas de esta patología y, por lo tanto, los costes asociados a la diabetes mellitus (DM).
Este trabajo pretende revisar los costes de la diabetes en España y sus implicaciones en el gasto sanitario, así como los principales estudios de costes de las principales tecnologías empleadas en el seguimiento y el tratamiento de la diabetes y que, en numerosas ocasiones, aún no están integradas en la atención habitual de las consultas de Endocrinología en nuestro país. Estamos convencidos de que las plataformas tecnológicas para la gestión de los datos de glucemia, las bombas de infusión de insulina, los sensores de glucosa, la monitorización ambulatoria de la glucemia capilar con glucómetros con detección de tendencias o con calculadores de bolos, la determinación de los cuerpos cetónicos en sangre capilar y una mejor comunicación médico-paciente a través de la telemedicina (TM) aportan habilidades que permiten proveer cuidados de alta calidad, facilitan la adquisición de conocimientos a profesionales y pacientes y, además, pueden resultar coste-efectivas.
Informe de evaluación de las tecnologías sanitariasEn España hay una Agencia Nacional de Tecnologías Sanitarias, el Instituto de Salud CarlosIII, y de ella dependen 7 agencias regionales que conforman la Red de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Servicio Nacional de Salud. Una de estas agencias (Avalia-t) publicó en el año 2013 una lista priorizada de las tecnologías sanitarias «nuevas y emergentes» de todas las especialidades médicas6. El objetivo de su trabajo consistió en la identificación y evaluación de las tecnologías sanitarias susceptibles de ser incorporadas al Sistema Nacional de Salud (SNS) en los 2 próximos años. La detección temprana, la adecuada priorización y la evaluación de las tecnologías de mayor impacto deberían servir para dinamizar el proceso de introducción en la cartera de servicios de aquellas tecnologías que se prevé tengan beneficios clínicos importantes o se evidencie que son más seguras o coste-efectivas.
Partiendo de la definición de EuroScan7, se estableció que una tecnología es «nueva» o «emergente» cuando se encuentra en fase previa a su autorización o adopción en el sistema sanitario o que se está utilizando en la práctica clínica, pero su uso no está extendido y se restringe a pocos centros. Se definió como tecnología «innovadora» aquella que es totalmente nueva (no hay opción terapéutica o diagnóstica disponible), presenta un mecanismo de acción o indicación muy diferente a la existente o mejora sustancialmente el tratamiento o el diagnóstico respecto a las opciones disponibles hasta el momento.
El previsible impacto de las tecnologías seleccionadas se puntuó como sigue: bajo impacto: 1-3; impacto moderado: 4-6; alto impacto: 7-9. El impacto se valoró atendiendo a los siguientes criterios: a)magnitud de la enfermedad/indicación en la que se utilizará la tecnología; b)efecto de la tecnología sobre la carga de la enfermedad (mortalidad, morbilidad, calidad de vida) en comparación a tecnologías predecesoras (de existir), y c)repercusiones económicas, organizativas u otras (éticas y legales, por ejemplo).
Las tecnologías fueron examinadas durante el periodo enero-junio 2012 aplicando una estrategia de búsqueda sistemática en Medline previamente validada. Tras una revisión preliminar, fueron agrupadas por especialidades y se remitieron a diferentes profesionales pertenecientes a las unidades médico-quirúrgicas responsables de su aplicación clínica, hasta alcanzar un mínimo de 3 por área (n=146). Se predefinieron los criterios de priorización y se diseñó un cuestionario con indicaciones explícitas sobre cómo clasificar y puntuar las tecnologías. La fiabilidad de las evaluaciones se analizó mediante el coeficiente de correlación intraclase (CCI).
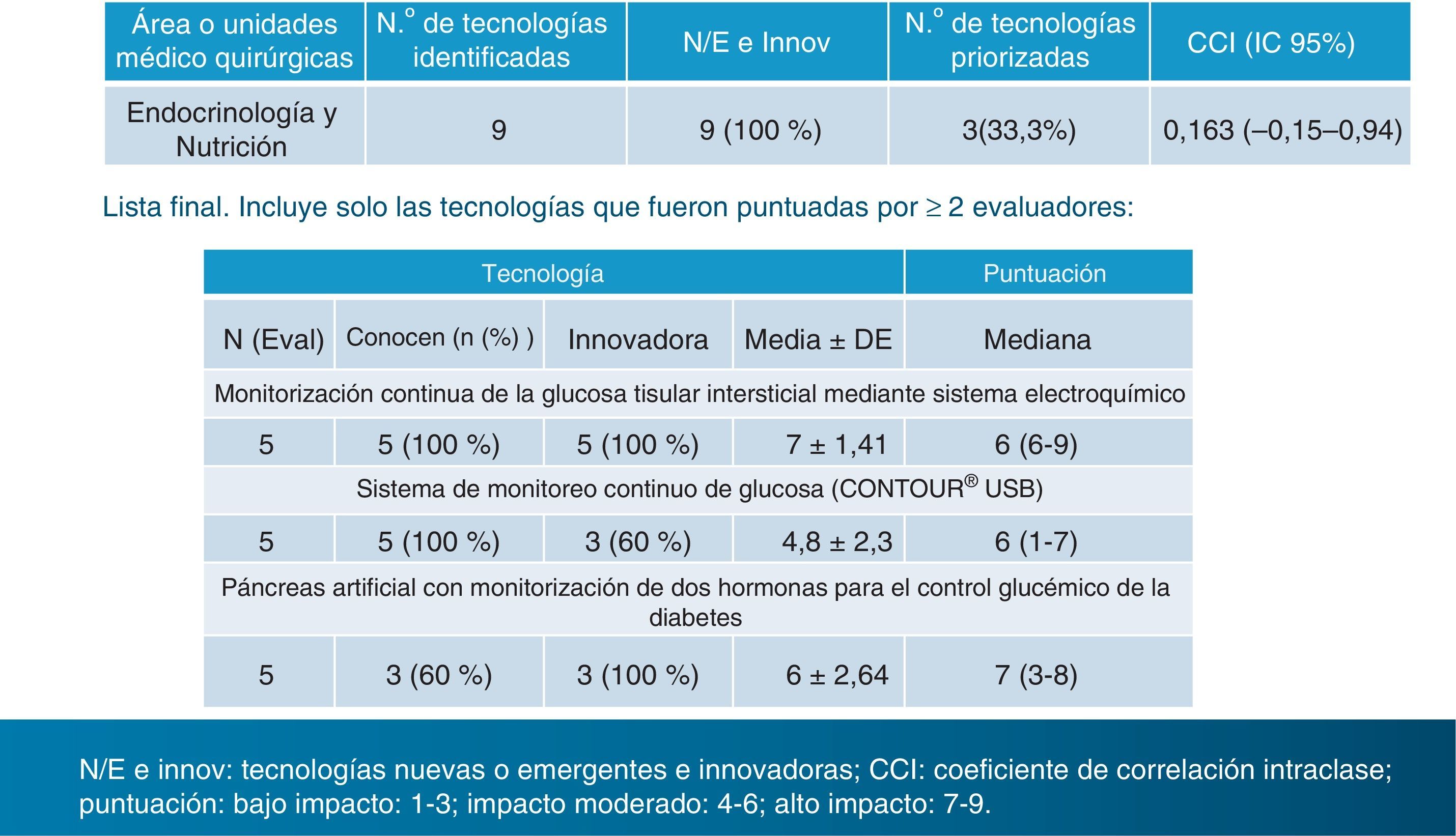
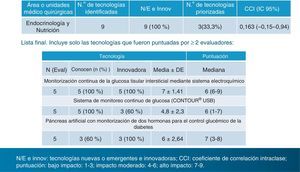
Se identificaron 246 tecnologías «innovadoras» potencialmente relevantes o de «previsible alto impacto», de las cuales 9 correspondían a la especialidad de Endocrinología y Nutrición. Ahora bien, la lista final incluyó únicamente las tecnologías puntuadas por 2 evaluadores o más, de los 5 seleccionados para nuestra especialidad. Y esa lista final quedó reducida a 3, que citamos literalmente: 1)monitorización continua de la glucosa tisular intersticial mediante sistema electroquímico; 2)sistema de monitoreo continuo de glucosa (CONTOUR® USB), y 3)páncreas artificial con monitorización de 2 hormonas para el control glucémico de la diabetes5 (fig. 1).
Tecnologías sanitarias nuevas y emergentes 2013. Lista priorizada en la especialidad de Endocrinología y Nutrición. CCI: coeficiente de correlación intraclase. Puntuación: bajo impacto: 1-3; impacto moderado: 4-6; alto impacto: 7-9.Fuente: Axencia de Avaliación de Tecnoloxías Sanitarias (avalia-t). Ministerio de Sanidad, Servicios Sociales e Igualdad6.
En nuestra especialidad, según este informe, la única tecnología innovadora de previsible alto impacto por tener una puntuación >6 resultó ser el páncreas artificial. Es cierto que es la única tecnología totalmente nueva, ya que no se está ensayando en ningún centro médico del país, pero fue votada solo por 3 de los 5 evaluadores. Las otras 2 tecnologías del ranking final obtuvieron una puntuación de 6 (impacto moderado). Llama la atención la elección de la segunda de estas opciones: el CONTOUR® USB, pues se trata de un glucómetro y en modo alguno es un «sistema de monitoreo continuo de glucosa», como figura en su enunciado. Nótese también que la palabra «monitoreo» no consta en el diccionario castellano. Los sistemas de monitorización continua de glucosa intersticial (SMCG) parece que sí cumplen los requisitos de las consideradas tecnologías «nuevas» o «emergentes» por cuanto que su uso «no está extendido» y están siendo empleados todavía en pocos servicios de endocrinología y pediatría de nuestro país, a pesar de que en algunos de estos servicios se están utilizando desde su introducción en la clínica, a partir del año 1999.
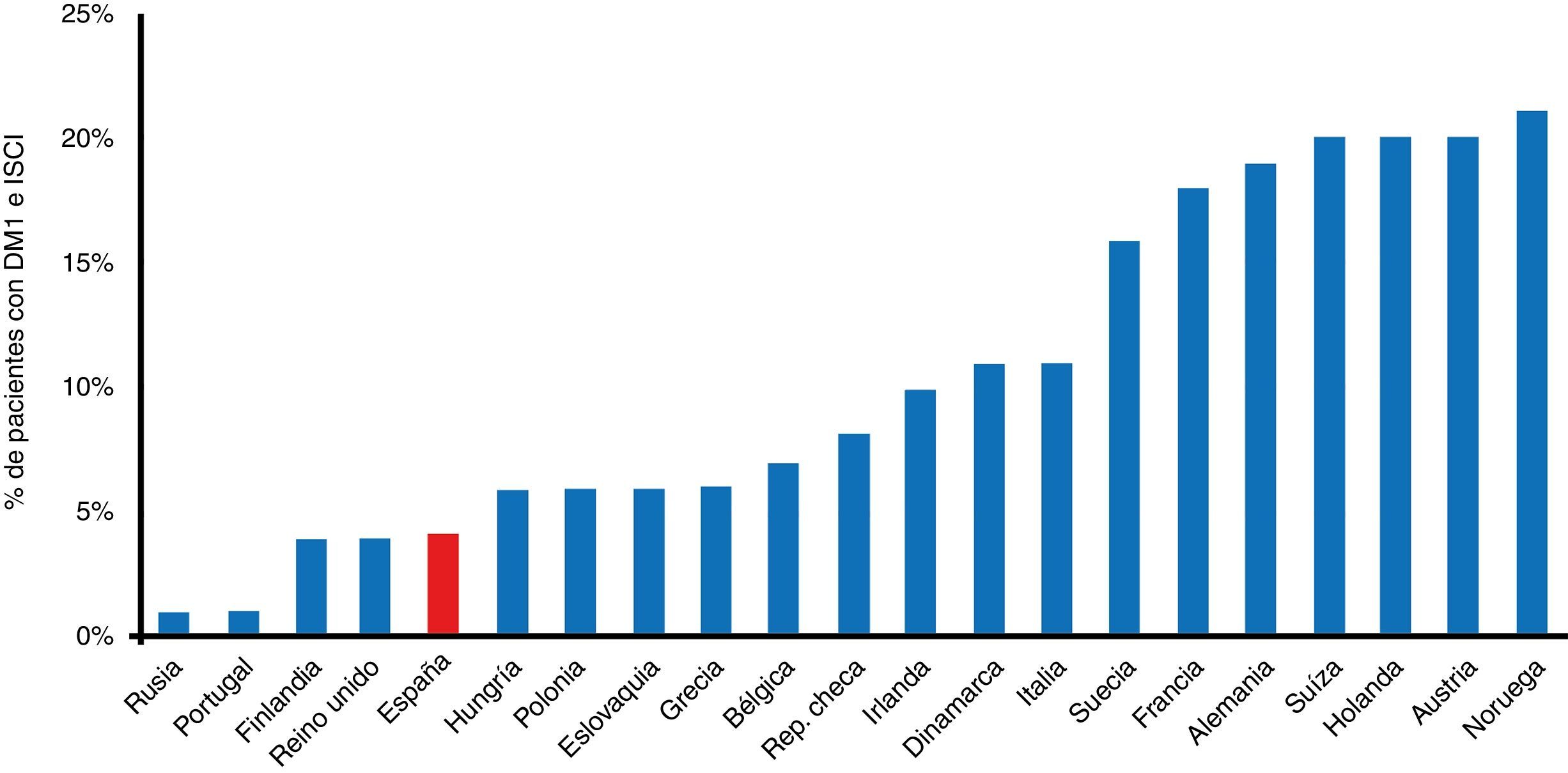
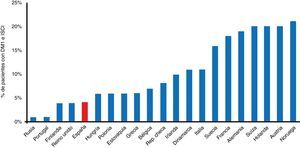
Es decir, tenemos una especialidad con tecnologías, al parecer, de poco impacto. Pero se echan de menos en este ranking final algunos sistemas que, si bien se introdujeron en la clínica hace ya muchos años, hoy día caerían perfectamente en las denominadas tecnologías «emergentes» por cuanto que su uso no está aún lo suficientemente extendido y han probado además ser coste-efectivas. Véase, por ejemplo, las bombas de infusión de insulina, cuya utilización en España es aún residual si comparamos el número de pacientes con DM1 que las llevan frente a las cifras que arrojan los países de nuestro entorno8 (fig. 2). Echamos también de menos la consideración de tecnologías «emergentes» a la atención de nuestros pacientes a través de varios servicios de TM o la utilización de sistemas de medición de glucosa innovadores, o la determinación sistemática de cuerpos cetónicos en sangre capilar, e incluso la necesidad de una educación terapéutica diabetológica estructurada con profesionales formados y reconocidos en tecnologías avanzadas.
Porcentaje de pacientes con diabetes tipo 1 portadores de sistemas de infusión continua de insulina en varios países europeos. DM1: diabetes mellitus tipo 1; ISCI: infusión subcutánea continua de insulina.
Fuente: adaptada de Renard8.
Así pues, consideramos que la lista de tecnologías presentada en la especialidad Endocrinología y Nutrición no es de gran validez ni de utilidad, pues aunque se haya considerado la valoración de 5 especialistas clínicos, no se han sabido expresar los déficit tecnológicos que aún tiene la atención diabetológica en nuestro país. Las tecnologías priorizadas han sido muy escasas, lo que reduce las posibilidades de adopción de otras tecnologías por parte de la administración en los próximos 2 años, y eso sin duda constituirá una rémora patente en nuestra especialidad.
Costes de la diabetes en EspañaEl estudio de costes directos de la diabetes en España, Spain Estimated Cost Ciberdem-Cabimer in Diabetes (SECCAID)9, se llevó a cabo porque los principales trabajos publicados sobre esta cuestión habían dado resultados muy dispares10-15. Las diferencias observadas podrían atribuirse a varias causas, pero una de las principales sería la infraestimación de la prevalencia de la diabetes, cifrada en el estudio Di@bet.es en el 13,8%16, si bien poco más de la mitad de los pacientes (7,8%) figuran como diagnosticados. La International Diabetes Federation (IDF), en su sexta edición del Atlas en Diabetes del 2013, señala una prevalencia de DM en España del 10,8% para el rango de edad de 20 a 79años; 3,78 millones de personas que originarían un gasto medio anual de 3.295dólares ($)/persona/año y una mortalidad atribuible de 25.202 personas/año17.
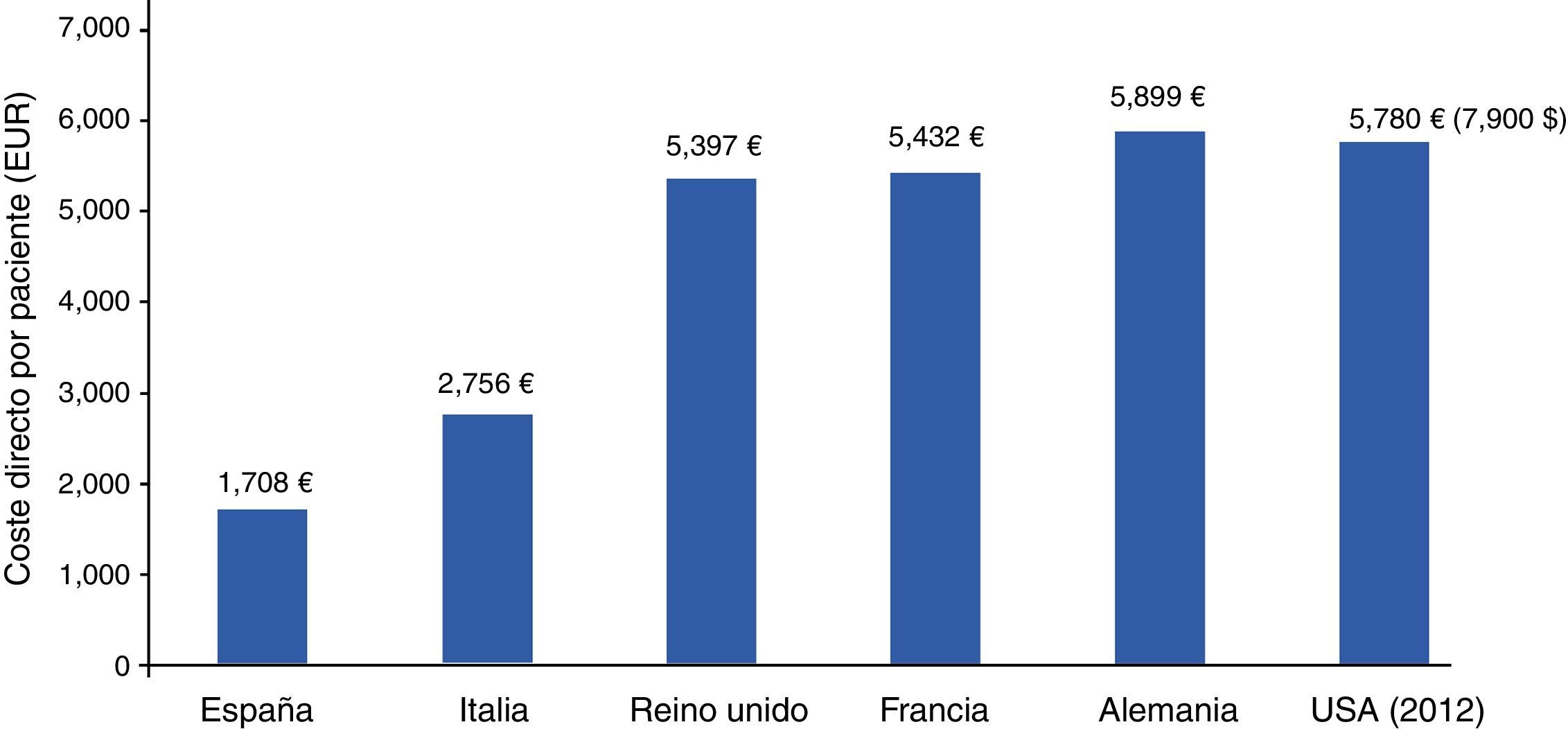
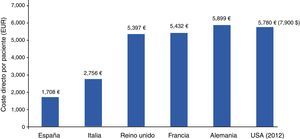
Crespo et al., en el estudio SECCAID9, estimaron en 5.809 millones de euros (€) los costes directos debidos a la diabetes en España en el año 2012; el 8,2% del gasto sanitario total. Kanavos et al.18 los habían cifrado 2 años antes en 5.447 millones de euros, mientras que los costes indirectos ascendieron a 17.630 millones de euros: más de 3 veces por encima de los directos. Estas cifras se invierten en otros países de nuestro entorno (Alemania, Francia, Reino Unido, EE.UU.), donde los costes directos ligados a los gastos de personal, servicios de salud y medicamentos son mucho mayores que los indirectos (fig. 3)18,19. El hecho diferencial tiene una implicación clara: si tenemos pocos gastos directos, no nos ha de extrañar que se disparen nuestros costes indirectos, con el significado que ello conlleva, pues están relacionados con el absentismo y las bajas laborales, las jubilaciones y las muertes anticipadas debidas a las comorbilidades de la diabetes. Deberíamos seguir el ejemplo de Estados Unidos, que en el periodo 2007-2012 incrementó los gastos directos en diabetes de 116 a 176 billones de dólares, mientras que los costes indirectos solo lo hicieron en 11 billones de dólares: de 58 a 6919,20.
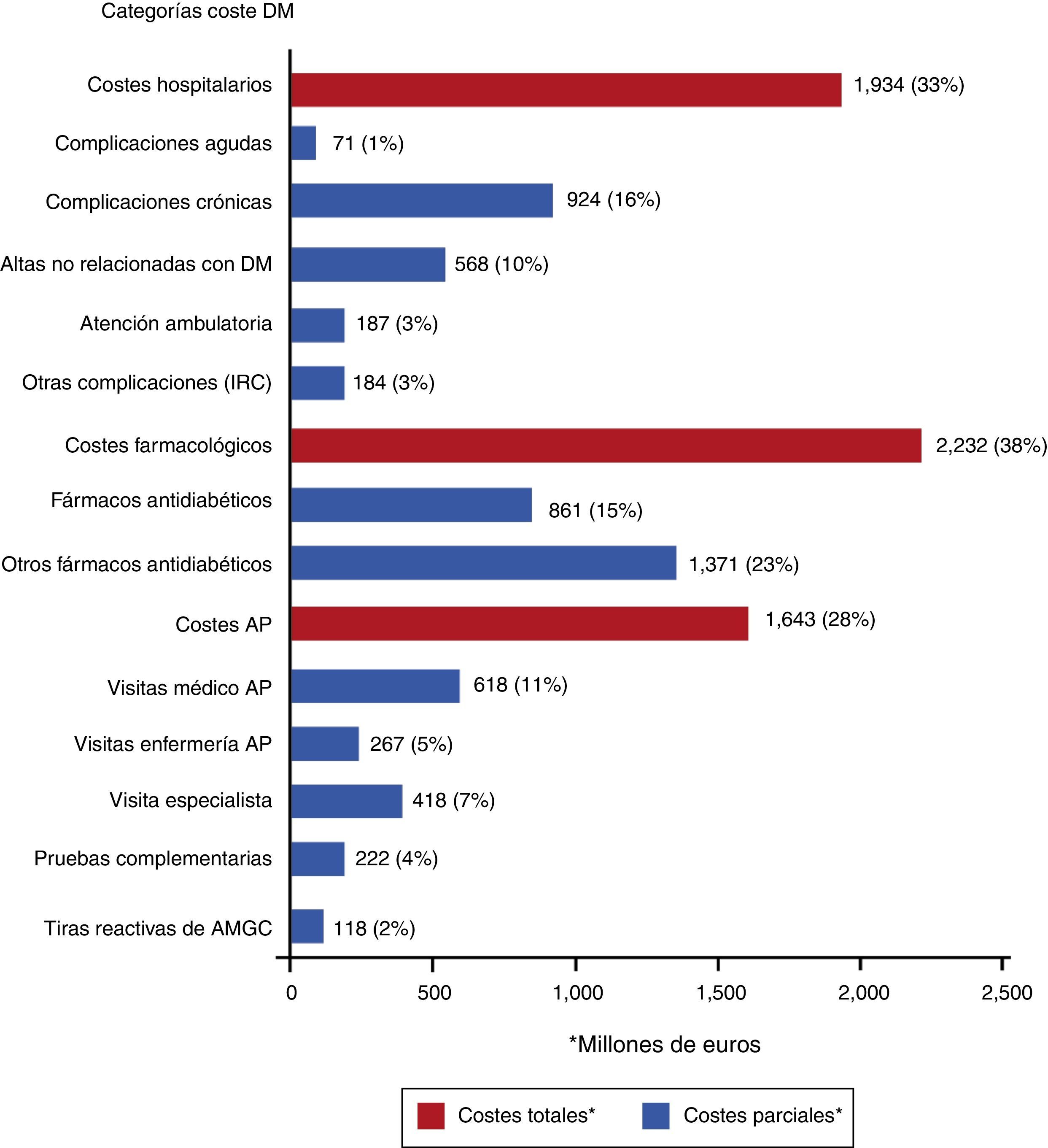
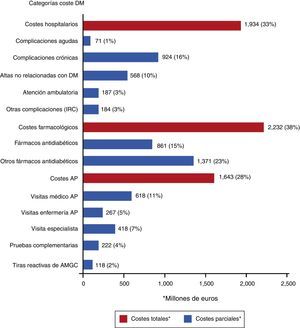
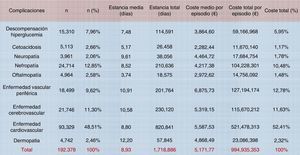
En el estudio SECCAID9 se observó que los costes farmacológicos fueron la categoría con mayor peso sobre el coste directo total: 2.232 millones de euros (38%), seguido por los costes hospitalarios (33%). Los fármacos antidiabéticos fueron los responsables del 15% del gasto (861 millones de euros), mientras que las tiras reactivas de monitorización ambulatoria de la glucemia capilar (MAGC) tan solo supusieron el 2% (118 millones de euros) (fig. 4). Estas cifras parecen muy altas, pero no lo son cuando se comparan con los elevados gastos indirectos que parece tener la diabetes en España: 9.484 y 8.400 millones de euros de 2010 en jubilaciones anticipadas y en bajas laborales, respectivamente18.
Costes directos relacionados con la diabetes mellitus y sus complicaciones en España (% sobre el total). AMGC: automonitorización de la glucemia capilar; AP: atención primaria; DM: diabetes mellitus; IRC: insuficiencia renal crónica.
Fuente: tomada de Crespo et al.9.
Vicente-Herrero et al.21 publicaron los gastos registrados por incapacidad temporal en España derivados de la diabetes y sus complicaciones en el año 2011. Para ello evaluaron los códigos CIE-9 MC relacionados con esta patología. Hubo 2.567 procesos que dieron lugar a una pérdida de 154.214 días de trabajo, lo que, traducido en costes para las administraciones públicas, ascendió a 3.297.095€ (coste estimado/paciente/año: 141€). López-Bastida et al.22 calcularon las pérdidas de productividad laboral en el año 2009, que fueron de 2.825,21 millones de euros. Ambos trabajos concluyeron que la disminución del absentismo laboral redundará en un beneficio claro para los pacientes con diabetes, la sociedad, las empresas y las instituciones públicas.
Se ha publicado recientemente el impacto económico de las complicaciones crónicas macro y microvasculares en 3.268 pacientes con DM2 de la Comunidad de Madrid (estimación total de población con DM2 de 390.944). El coste medio por paciente se ha valorado en 4.121.54€ de 2012, en un horizonte de toda la vida del paciente (66% debido a las complicaciones macrovasculares)23.
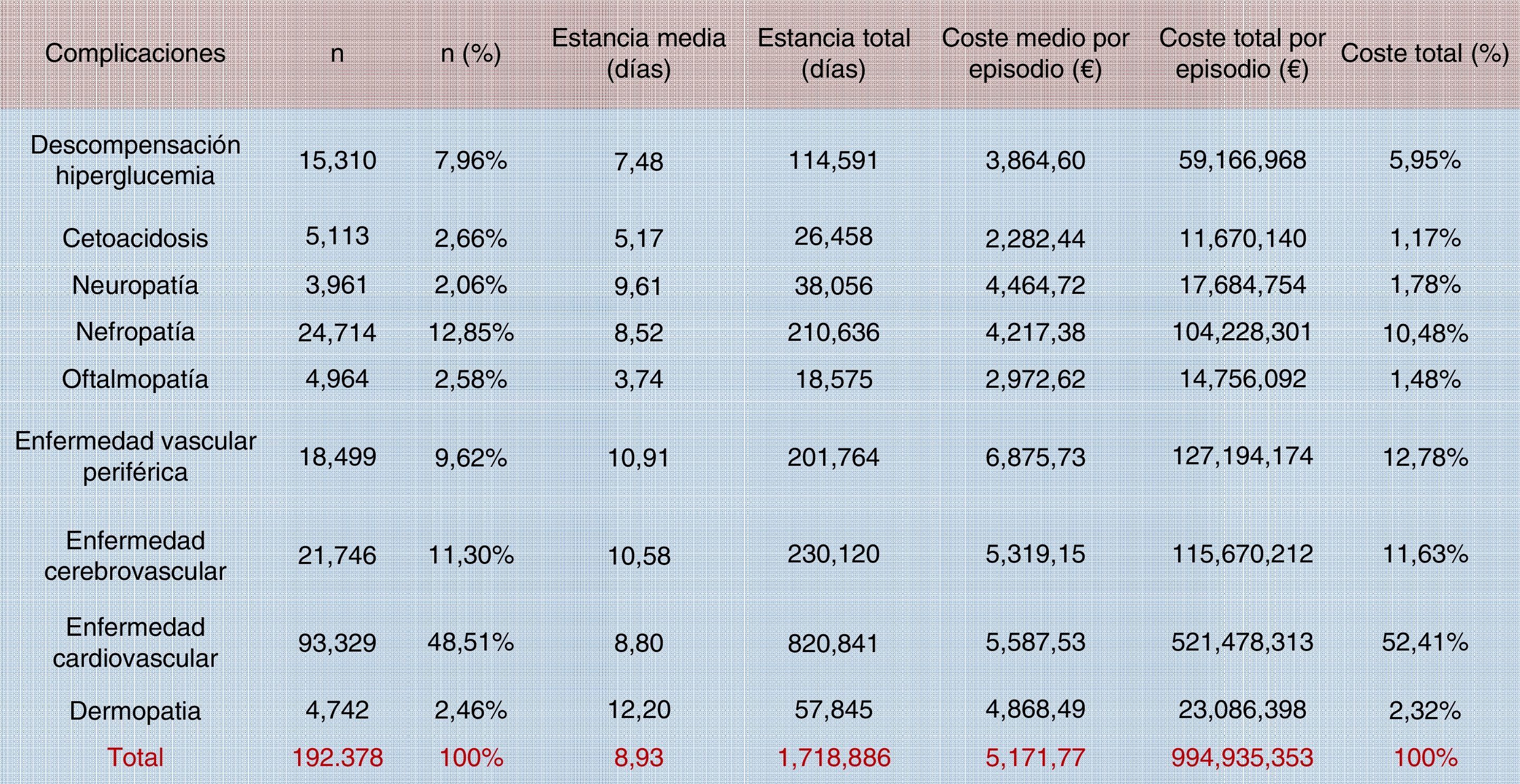
Crespo et al.9 estudiaron también el coste total relacionado con las complicaciones en general, cifrándolo en 2.143 millones de euros: el 37% del coste total anual directo generado por esta patología. La clasificación de los registros se realizó a través de los grupos relacionados con el diagnóstico (GDR), que permite imputar el consumo de recursos medio de cada patología (fig. 5). En el cómputo de complicaciones, las hipoglucemias no se incorporaron en el coste total al considerarse integradas de forma transversal en los costes ya analizados de las complicaciones agudas y crónicas, pero claramente constituyen una de las complicaciones evitables con un adecuado control diabetológico. Ahora bien, resultan muy difíciles de cuantificar porque solo se detectan los episodios graves, mientras que las hipoglucemias leves-moderadas (que no terminan en el hospital) podrían generar un coste adicional de más de 12 millones de euros24. Datos de otros países apuntan que cada ingreso por hipoglucemia grave supone un coste para los sistemas de salud de 1.25025 a 3.200€26. En España, Brito-Sanfiel et al.27 los han cifrado en 3.500€, y calcularon que el número de episodios que presentaban los pacientes era de 2 y de uno por paciente/año para aquellos con DM1 y DM2, respectivamente. Datos del mismo hospital y presentados en el Congreso Anual de Economía de la Salud (2013) ofrecen unos costes escalofriantes: 4.395,66€ por ingreso debido a hipoglucemia en DM128. No debemos olvidar que las hipoglucemias sintomáticas moderadas o graves se han asociado a un incremento del riesgo cardiovascular, a hospitalización y a mortalidad por todas las causas29.
Costes por episodio de los ingresos hospitalarios debidos a complicaciones agudas (no hipoglucemias) y crónicas en pacientes con diabetes (2010). La clasificación de los registros se realizó a través de los grupos relacionados con el diagnóstico (GDR).
Fuente: tomada de Crespo et al.9.
En resumen, teniendo en cuenta el elevado infradiagnóstico de la DM en España, su coste podría en realidad ascender a 8.787 millones de euros8 si adoptamos las cifras de prevalencia que ofrece el estudio Di@betes16, es decir, el 12,5% del gasto sanitario. Es innegable el impacto económico que tiene esta patología para el SNS. El hecho de que no todos los pacientes estén diagnosticados es muy posible que derive en un aumento de las complicaciones y hospitalizaciones futuras que podrían ser evitadas, por lo que urgen medidas de optimización del tratamiento y monitorización de la enfermedad para disminuir su impacto humano y económico.
Análisis de costesEl National Institute for Health and Clinical Excellence (NICE) ha recomendado el parámetro QALY (quality-adjusted life year) o AVAC (años de vida ganados ajustados por calidad) para su uso en los análisis de coste-efectividad de las tecnologías sanitarias. El QALY es una unidad de medida de las preferencias de los ciudadanos respecto a la calidad de vida que se ha producido o evitado, combinada con los años ganados o perdidos de vida respecto a un determinado estado de salud30. El QALY o AVAC combina 2 variables: calidad de vida y cantidad de vida: U(Q,T)=U(Q)×T. Es decir, un QALY es equivalente a: 1)un año más de vida a un nivel completo de salud: 1×1; 2)10años más de vida con una utilidad del 0,10: 10×0,1; o 3)que 10 personas ganen un año más de vida a un nivel de utilidad del 0,10: 10×1×0,1. El ratio coste utilidad incremental (RCUI) es un parámetro que se basa en la diferencia en costes y en esperanza de vida entre 2 regímenes de tratamiento. Determina si una nueva opción médica aporta valor económico. Es decir, el coste que supone conseguir una unidad de efecto adicional sobre la salud al cambiar de una alternativa médica a la siguiente para recomendar la adopción o rechazo de una intervención sanitaria. Aunque no esté bien definido, en la mayoría de estudios publicados los autores recomiendan la adopción de la intervención cuando el RCUI está por debajo de 30.000€ por QALY, y en Estados Unidos, de 50.000$. Estas cifras son fundamentalmente arbitrarias y no todos los estudios las adoptan31,32.
Para poder estimar los costes y los beneficios de las terapias comparadas a largo plazo se proyectan los resultados a través de modelos matemáticos, que son percibidos como instrumentos útiles para ayudar a la toma de decisiones en situaciones de incertidumbre33-36. Simulan los principales acontecimientos que pueden sufrir los pacientes y toman datos clínicos y económicos de diferentes estudios publicados, que relacionados entre sí remedan la evolución clínica de un paciente con una patología concreta (en nuestro caso la DM), teniendo en cuenta tanto el perfil de riesgo de la población que se va a estudiar, como la estrategia de tratamiento que sigue cada uno de los pacientes37. De otro modo sería necesario llevar a cabo ensayos con un seguimiento de muchos años, con el coste y las limitaciones que ello supondría.
Ya se ha comentado en este documento que el mejor control de la DM se asocia a menos complicaciones y, por lo tanto, a menor gasto sanitario1,2. En el United Kingdom Prospective Diabetes Study (UKPDS) se pudo observar que por cada descenso de un 1% en la hemoglobina glucosilada (HbA1c) disminuían un 37% las complicaciones microvasculares en los pacientes con DM2, un 43% las amputaciones, un 14% los infartos de miocardio, un 12% los accidentes cerebrovasculares y se cifraban en un 21% menos las muertes relacionadas con la diabetes38. El grupo de Oglesby et al.39 llegó a la conclusión de que aquellos con una HbA1c≤7% tenían un 20% menos de costes médicos directos relacionados con la DM que aquellos con HbA1c≥9%. Datos del Diabetes Control and Complications Trial (DCCT) sirvieron a Rohlfing et al.40 para definir que tan solo un descenso del 0,3% en la HbA1c conseguía un año adicional de vida, y por tanto, cualquier disminución en este parámetro por encima de 0,3% alcanza relevancia clínica en cuanto al RCUI.
El ensayo clínico aleatorizado, prospectivo y multicéntrico llevado a cabo por Slingerland et al.41 en 506 pacientes con DM2 señaló que el tratamiento intensivo resultaba claramente coste-efectivo cuando se partía de HbA1c>8,5%. Después de un año de tratamiento se conseguía un descenso de 0,83% (intervalo de confianza [IC] al 95%: 0,81-0,84) y esto presumía un RCUI de 261$ (235-288)/QALY ganado, lo que en el horizonte de toda la vida del paciente suponía 0,54 QALY (0,30-0,78), con un coste de 3.482$ (2.706-4.258) y un RCUI de 6.443$/QALY (3.199-9.686). Para aquellos con HbA1c de 7-8,5% el horizonte de beneficio descendía a 0,24 QALY (0,07-0,41), con un coste de 4.731$ (4.259-5.205) y un RCUI de 20.086$/QALY (5.979-34.193). No fue coste efectivo el tratamiento en aquellos con HbA1c<de 7%.
Análisis de costes de los sistemas de infusión subcutánea continua de insulinaEl tratamiento mediante infusión subcutánea continua de insulina (ISCI) comenzó a utilizarse en los años setenta42, pero no fue hasta finales de los noventa cuando se extendió su uso con la llegada de dispositivos más pequeños y seguros. Ya en la primera década de 2000, varias revisiones sistemáticas y metaanálisis dejaron claro que el empleo de las bombas de infusión de insulina se asociaba a un mejor control metabólico que el conseguido con las múltiples dosis de insulina (MDI), incluyendo un número menor de eventos hipoglucémicos43-52. Ahora bien, los costes iniciales y las necesidades estructurales adicionales de este tipo de terapia insulínica han propiciado la revisión exhaustiva de sus beneficios.
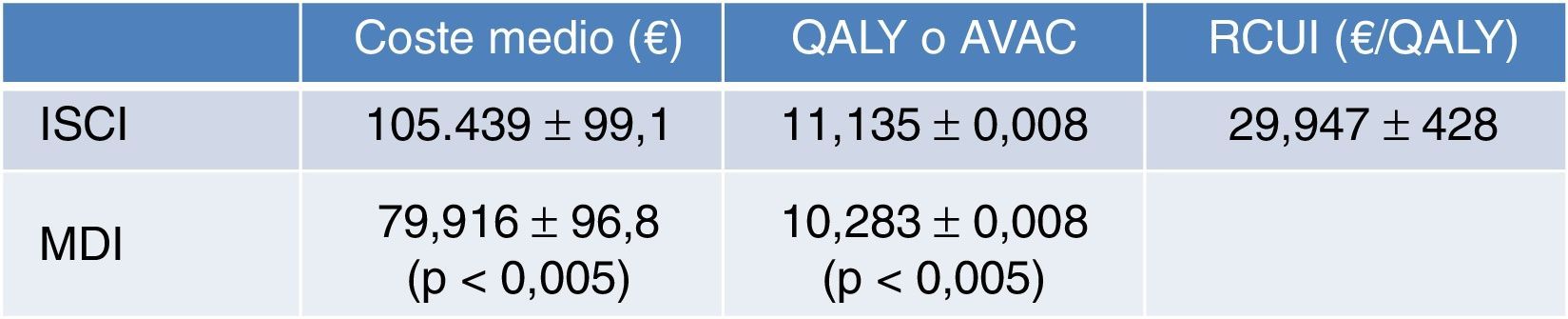
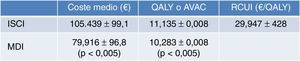
En España, Conget Donlo et al.37 publicaron en 2006 un análisis coste-utilidad de las bombas de insulina frente a las múltiples dosis diarias en 1.000 pacientes con DM1 en cada terapia. Adoptaron el modelo matemático de simulación Center for Outcomes Research (CORE)53 y emplearon datos de ámbito nacional para simular las consecuencias clínicas y económicas a largo plazo. El horizonte temporal fue el de toda la vida de los pacientes, incluyendo solo costes sanitarios directos, y actualizaron tanto costes como beneficios a una tasa del 3% anual. En los resultados observamos que con ISCI los pacientes experimentaron una ganancia de vida de 0,890años (p<0,05) y 0,852 QALY (p<0,05). El coste medio por paciente tratado con ISCI fue de 105.439±99,1€, frente a los 79.916±96,8€ en la cohorte tratada con MDI. Las bombas causaron un coste medio incremental respecto a las MDI de 25.523€ (p<0,05), lo que supuso un RCUI de 29.947€/QALY (IC95%, 29.519-30.375€) (fig. 6). Concluyeron que el tratamiento con ISCI se asociaba a una reducción del coste global de la diabetes y resultaba ser coste-efectivo respecto a la terapia con MDI. Hemos de señalar que en el modelo utilizado para el cálculo de costes solo se tuvieron en cuenta los gastos directos sanitarios y no se pudieron incluir los indirectos por falta de datos. Hoy en España ya se han publicado los costes asociados a la productividad laboral23, así como las pérdidas de días de trabajo22, por lo que es de suponer que la inclusión de este tipo de costes indirectos en los estudios de coste-beneficio debería mejorar aún más el valor del coste incremental por QALY de las bombas de infusión.
Resultados del estudio de costes en bombas de insulina en España. AVAC: años de vida ganados ajustados por calidad; ISCI: infusión subcutánea continua de insulina; MDI: múltiples dosis de insulina; QALY: quality-adjusted life years; RCUI: ratio coste utilidad incremental; €: euros.
Fuente: adaptada de Conget Donlo et al.37.
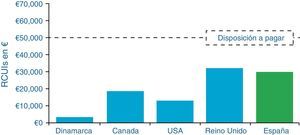
Roze et al.54 hicieron un estudio de costes de las bombas en el Reino Unido. Las premisas fueron similares a las del estudio español: mismo modelo matemático de simulación y solo evaluación de costes directos en base a los datos clínicos de sus ensayos nacionales. El tratamiento con ISCI se asoció con la mejora en la esperanza de vida en QALY ganados: 0,76±0,19 comparados con las MDI (12,03±0,15 vs. 11,27±0,14años, respectivamente). El coste medio de los pacientes tratados con ISCI fue de 19.407±1.727libras esterlinas (£) del año 2003 más elevado que en los tratados con MDI: 80.511±1.257 vs. 61.104±1.249£, respectivamente. El RCUI resultó en 25.648£/QALY ganado para los pacientes portadores de bombas de infusión, lo que hace que este tratamiento resulte coste-efectivo. La incidencia acumulada de enfermedad renal terminal fue un 22% menor y las posibilidades de infarto de miocardio de un 20% menos en los pacientes tratados con ISCI después de 10años de tratamiento.
St Charles et al.55 llevaron a cabo el estudio de costes en Estados Unidos en el año 2009 mediante el modelo matemático Markov de simulación de las complicaciones crónicas. El uso de bombas se asoció a 1,061 QALY ganados en adultos y 0,799 QALY en niños y jóvenes al comparar dicho tratamiento con el de MDI. El RCUI resultó en 16.992$ y 27.195$/QALY para los pacientes con ISCI (adultos y niños/jóvenes, respectivamente). El número de pacientes que requieren ser tratados con ISCI para evitar un caso de retinopatía proliferativa fue tan solo de 9, 19 para impedir un caso de insuficiencia renal terminal, y 41 para obviar un caso de enfermedad vascular periférica. Este análisis demostró que las bombas son una opción rentable para los pacientes con DM1 en Estados Unidos.
El estudio realizado en Canadá por St Charles al al.56 siguió también el modelo Markov de simulación de las complicaciones crónicas. Se valoró en dólares canadienses ($) del año 2006. El coste anual del tratamiento con ISCI era de 6.347,18$, y el de las MDI, de 4.649,69$. El horizonte temporal fue de 60años, y actualizaron tanto costes como beneficios a una tasa del 5% anual. El coste medio fue más elevado para el tratamiento con bomba frente al de las MDI (15.591$), pero se asoció con una mejoría en las expectativas de vida de 0,655 QALY. El RCUI resultó ser de 23.797$/QALY, y por lo tanto concluyeron que las bombas eran coste-efectivas frente al tratamiento con MDI.
En Dinamarca, Nørgaard et al.57 también realizaron un estudio de costes en bombas en sus pacientes. Adoptaron el modelo matemático de simulación de CORE y un horizonte temporal de 60años. Sus cálculos concluyeron que el tratamiento con bomba resultaba coste-efectivo.
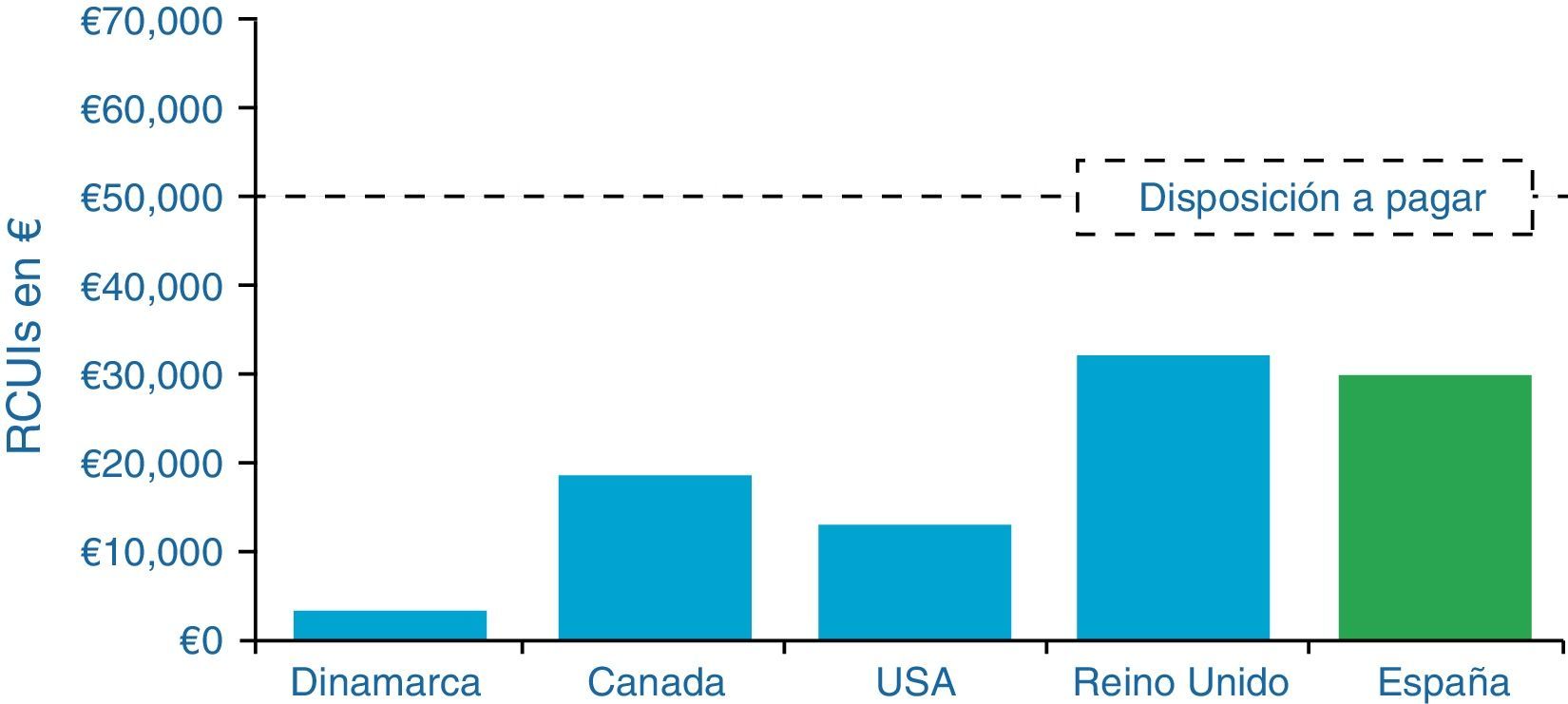
Hemos visto que la evaluación económica en 5 países (España, Reino Unido, Dinamarca, Canadá y EE.UU.) ha proyectado consistentemente que la terapia con ISCI vs. con MDI conduce a disminuir las complicaciones crónicas a largo plazo (nefropatía, retinopatía y enfermedad vascular periférica), debido a la mejora en el control glucémico. Estos estudios han demostrado que este tratamiento es coste-efectivo comparado con el de las MDI (fig. 7). Los pacientes consiguen alrededor de un año más de esperanza de vida. La revisión sistemática realizada por Cummins et al.58 llega a similares conclusiones.
El NICE realizó una revisión de las tecnologías en el año 200859, que fue actualizada en 201160. Uno de los estudios incluidos en esta revisión analiza, según el modelo CORE, el RCUI de ISCI frente a MDI en función de diferentes grados de descenso esperado de HbA1c, sobre un supuesto general de HbA1c basal de 9,4% y de reducción de tasa de hipoglucemias graves del 75%. Llegaron a la conclusión de que la terapia ISCI comparada con las MDI presentaba un RCUI de 34.330£/QALY (supuesto de descenso mínimo de HbA1c), 16.842£/QALY (descenso máximo de HbA1c), y de 22.897£/QALY (descenso medio de HbA1c), que en cualquier caso se consideraron coste-efectivos. En otro análisis incluido en la guía NICE y basado en el modelo CORE, el caso-base asumía una HbA1c de 8,8% y una tasa de hipoglucemias graves de 18,7 episodios por 100 personas-año previa a la terapia ISCI; se analizó el impacto de un descenso de HbA1c de 0,9% y una reducción del 50% en la tasa de hipoglucemias graves, sobre un horizonte de 50años. Esto daba lugar a un RCUI de 37.712£/QALY (46.009€/QALY) ganado con ISCI vs. MDI, que no cambiaba substancialmente cuando se valoraban tasas de hipoglucemia de 0% o de un 75%. Asumir además un incremento en calidad de vida de 0,01 reducía el RCUI a 29.300£/QALY (35.746 €/QALY). Disminuciones mayores de HbA1c bajo terapia ISCI mejoran la eficiencia de la terapia; así, cuando en este análisis se asume una reducción de HbA1c del 1,4%, sin descensos en la tasa de hipoglucemias graves, la RCUI baja a 24.720£/QALY (30.158€/QALY). También se analizó el impacto de la terapia sobre un segundo modelo de control metabólico aceptable (HbA1c 7,5%) y alta tasa de hipoglucemias graves (134 episodios por 100 personas-año), en el que no se asumían reducciones de HbA1c pero sí de frecuencia de hipoglucemias. El descenso del 50% en la tasa de hipoglucemias y un incremento anual de calidad de vida de 0,05, produjo en el modelo un RCUI de 28.600£/QALY (34.892€/QALY). En relación con la población pediátrica, el NICE reconoce que los modelos utilizados para el análisis de coste-efectividad no son aplicables en este rango de edad; no obstante, considera que los principales factores que favorecen la terapia ISCI frente a MDI en adultos se dan también en población pediátrica y que existen dificultades de manejo clínico con MDI, especialmente por sus bajos requerimientos.
Por todo ello, el NICE concluye que ISCI sería coste-efectivo en pacientes con HbA1c>8,5% en MDI a pesar de un elevado grado de conocimiento e implicación. Considerando el beneficio en calidad de vida que específicamente supone la reducción del miedo a las hipoglucemias, el NICE propone terapia ISCI también en aquellos pacientes con HbA1c inferiores pero que experimentan hipoglucemias frecuentes e impredecibles como resultado de la intensificación del control metabólico bajo MDI. En niños menores de 12años en los que la terapia intensiva con MDI resulta inapropiada, el NICE recomienda ISCI como una opción de tratamiento.
Posicionamiento respecto al empleo de ISCI del Grupo de Nuevas Tecnologías, Sociedad Española de Diabetes- •
La terapia con ISCI ha demostrado de forma consistente ser coste-efectiva en la optimización del control glucémico de los pacientes con DM1, tanto en población pediátrica como en adultos.
- •
La terapia ISCI es eficaz en pacientes en situación de mal control glucémico crónico y en aquellos en los que la intensificación del control viene siendo limitada por la presencia de hipoglucemias. El uso de ISCI se asocia con una mejoría significativa en la calidad de vida de los pacientes.
- •
Para asegurar su coste-efectividad, la terapia ISCI requiere programas estructurados de educación terapéutica en diabetes, formación específica de los profesionales implicados en el proceso y un alto grado de motivación e implicación por parte del paciente.
- •
El Grupo de Nuevas Tecnologías (GNT) considera que es necesario aumentar la terapia con ISCI en nuestro medio. Para ello es fundamental identificar y resolver las barreras que limitan su ejecución, como la inercia clínica, la necesidad de formación específica de profesionales y disponer de estructuras estables para su implantación. En consecuencia, se requiere el diseño de programas de educación terapéutica en diabetes específicos para su puesta en marcha, seguimiento y reciclaje en todos los servicios que vayan a ofrecer esta prestación.
Los SMCG, llamados también sensores de glucosa, miden a tiempo real la glucosa en el tejido intersticial, y su evaluación se correlaciona bien con la glucemia plasmática61. Constituyen el sostén del denominado páncreas artificial o sistemas de asa cerrada.
En el año 2008, el grupo Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group (JDRF-CGM Study Group) publicó los resultados de la utilización de los sistemas de SMCG para mejorar el control metabólico en el tratamiento intensivo de la DM1, concluyendo que en pacientes mayores de 25años permitían reducir la HbA1c 0,53% (desde 7,6 a 7,1%) comparados con los tratamientos basados en la MAGC. Sin embargo, el estudio no logró demostrar una mejoría en el control metabólico en adolescentes ni en población pediátrica, y no tuvo poder estadístico para indicar una reducción en el número de hipoglucemias graves en ninguno de los grupos62. La mayor predicción de descenso en la HbA1c en todos los sectores de edad fue la frecuencia del uso del sensor (más baja en la gente joven). Un ensayo posterior, el estudio STAR3, presentó datos de reducción significativa del valor de HbA1c también en el grupo pediátrico63, beneficios que se mantenían a los 18meses64. La mayor caída de la HbA1c en el STAR3 frente al JDRF puede atribuirse, al menos en parte, al efecto adicional del tratamiento con ISCI en todos los pacientes y a un mayor valor de HbA1c al inicio del estudio (8,3 vs. 7,6%).
El grupo JDRF llevó a cabo también un ensayo aleatorizado y controlado en 129 pacientes mayores de 8años que partían de una HbA1c<7%65. Los resultados combinados de HbA1c e hipoglucemias favorecieron a aquellos que se controlaban mediante los SMCG, lo que sugiere que la monitorización continua de glucosa es también beneficiosa en las personas que han logrado un control metabólico excelente61. En otro estudio prospectivo, aleatorizado y multicéntrico del grupo JDRF realizado en 436 niños y adultos durante 6meses se observó que los episodios graves de hipoglucemia aumentaban 8 veces cuando el 30% de los valores del sensor estaban por debajo de 70mg/dl (4,5 vs. 0,5; p<0,001), aunque se comprobó que el valor predictivo resultaba muy pequeño (<5%)66.
La Food and Drug Administration (FDA) ha aprobado el uso del sensor equipado con un dispositivo que suspende automáticamente la emisión de insulina cuando detecta valores bajos de glucosa61. El estudio ASPIRE67 demostró en 247 pacientes que llevaban bomba de insulina y el sensor portador de dicho dispositivo de bloqueo, una reducción significativa del número de hipoglucemias nocturnas sin incrementar los niveles de HbA1c. En un ensayo clínico muy reciente, Ly et al.68 llegaron a similares conclusiones. La American Diabetes Association (ADA) los recomienda para todos aquellos pacientes con historia de hipoglucemias nocturnas y no percibidas61.
Un metaanálisis de ensayos aleatorizados y controlados en DM169 comparando pacientes con ISCI y/o MDI que realizaban su control mediante MAGC frente a los que portaban SMCG, sugiere que los sensores se asocian con un descenso de la HbA1c de 0,26% (IC95%, 0,33-0,19) y que esta tecnología puede ser especialmente útil en aquellos con hipoglucemias asintomáticas y/o frecuentes episodios hipoglucémicos, aunque no se pudiera demostrar una reducción significativa de los episodios graves. La ISCI ligada al sensor consiguió mejores descensos en la HbA1c que el grupo de MDI (diferencia de cambio –0,68% [IC95%, 0,81-0,54]), sin incrementos en el riesgo de hipoglucemias. El metaanálisis llevado a cabo para estudiar específicamente la población pediátrica refleja que la SMCG no fue más efectiva que la MAGC para reducir la HbA1c en niños (diferencia media –0,13% [IC95%, –0,38 a 0,11]) y este efecto era independiente del nivel basal de HbA1c70. Sin embargo, en el subgrupo que evaluaba solo los sensores a tiempo real (SMCG-RT) sí obtuvo beneficio (diferencia media –0,18% [IC95%, –0,35 a –0,02%, p=0,02]). Este mismo grupo estudió este aspecto en pacientes con DM2, comprobando un mejor control metabólico en aquellos con SMCG (diferencia media –0,31% [IC95%, –0,6 a –0,02, p=0,04]).
La revisión sistemática realizada por The Cochrane Library71 en el año 2012 para comparar los SMCG-RT frente a la MAGC en pacientes en terapia intensiva encontró, en los 22 ensayos aleatorizados y controlados que seleccionó, una diferencia claramente significativa a favor de los pacientes que empleaban ISCI y sensores a tiempo real: HA1c –0,7% (IC95%, –0,8 a –0,5) a los 6meses de tratamiento, mientras que no era tan llamativa la diferencia en aquellos con MDI y SMCG-RT vs MAGC: HbA1c –0,2% (IC95%, –0,4 a –0,1). No había sin embargo significación en cuanto al riesgo de hipoglucemias graves ni en cetoacidosis. Tampoco las hubo en la evaluación de la calidad de vida en los 5 estudios en los que se reportaba este aspecto. No evaluaron complicaciones, muertes ni costes.
La agencia catalana de Evaluación de las Tecnologías Sanitarias, dependiente del Ministerio de Sanidad, Política Social e Igualdad, llevó a cabo una revisión sistemática de la evidencia científica sobre los SMCG-RT. La búsqueda se hizo desde 2006 hasta julio de 2010. Su informe concluye que en población adulta con control insuficiente, los SMCG-RT implican una disminución significativa del nivel de HbA1c de 0,5% a los 6meses y de 1% al cabo de un año (en este caso, combinado con el uso de ISCI). La evidencia disponible sobre la disminución de la frecuencia de las hipoglucemias e hiperglucemias es escasa, como también lo es la eficacia de estos sistemas en niños y adolescentes72.
McQueen et al.73 determinaron el coste-efectividad de los SMCG-RT en pacientes con DM1 (20años de evolución, edad media de 40años y un horizonte de vida de 33años) comparándolos con el gasto de aquellos con MAGC en terapia intensiva. El coste se expresó en dólares del año 2007, y tanto los costes como los beneficios se actualizaron a una tasa del 3% anual. El uso de los SMCG-RT resultó en un beneficio de 0,52 QALY ganados y un incremento en el coste de 23.552$, lo que viene a suponer un RCUI aproximado de 45.033$/QALY. Los sensores resultaron coste-efectivos en el 70% de las simulaciones realizadas. Los datos eran aún mejores en el estudio realizado un año antes por Huang et al.74. Los pacientes con el SMCG-RT experimentaron un beneficio inmediato en la calidad de vida (si la HbA1c era ≥7%: 0,70 QALY, p=0,49; si la HbA1c<7%: 1,39 QALY, p=0,04) y mejor control glucémico. A largo plazo, el coste-utilidad fue proyectado para reducir la probabilidad de complicaciones microvasculares y el promedio de QALY ganados en aquellos con SMCG-RT y HbA1c≥7% fue de 0,60, con un RCUI de 98.679$/QALY ganado (IC95%, –60.000 a –87.000). Si la HbA1c era <7% el promedio de QALY fue de 1,11, con un RCUI de 78.943$/QALY (IC95%, 15.000 a –291.000). Estos autores consideran que el umbral para que una intervención clínica en pacientes con DM1 resulte rentable a largo plazo está en 100.000$/QALY, aunque reconozcan que la incertidumbre rodea estas estimaciones. Heinemann et al.75 asumen que el coste diario de la monitorización continua en Europa asciende aproximadamente a 5-10€ por día, es decir, unos 3.000€ por paciente y año. Aunque no nos constan como publicados, es probable que las compañías de salud de Estados Unidos tengan suficientes datos en favor del coste-eficacia de esta terapia, pues prácticamente todas la reembolsan en pacientes con DM1 en tratamiento intensivo con ISCI o MDI.
La guía de práctica clínica de la Sociedad Europea de Endocrinología76 recomienda el uso de los SMCG-RT en niños, adolescentes y adultos con DM1 y HbA1c>7,0% (no se pronuncian sobre los niños menores de 8años). En adultos también se indican si la HbA1c es <7% para reducir las hipoglucemias, siempre que se utilicen de manera casi diaria. La ADA61 los preconiza en personas mayores de 25años en terapia intensiva (evidenciaA) y reconoce que pueden ser una herramienta útil en niños y jóvenes, sobre todo en aquellos con hipoglucemias asintomáticas y/o frecuentes episodios de hipoglucemias (evidenciaC). En estos casos recomienda el uso del sensor equipado con un dispositivo que suspende automáticamente la emisión de insulina cuando detecta valores bajos de glucosa. Los SMCG de análisis retrospectivo están indicados en niños y adultos para el diagnóstico de hipoglucemias nocturnas o asintomáticas, el estudio del fenómeno del alba y/o de las hiperglucemias posprandiales, cuando las causas de una HbA1c elevada no estén claras o ante cambios sustanciales en el tratamiento insulínico76.
Se ha señalado un nivel alto de satisfacción con el uso de los sensores, aunque no de manera significativa en todas las escalas medidas77. El éxito o el fracaso de estos dispositivos están directamente relacionados con una buena gestión de la DM1 por parte del paciente, con la motivación suficiente para utilizar esta tecnología y una frecuencia mínima del 60-70% del uso del sensor72.
Posicionamiento respecto al empleo de SMCG-RT del Grupo de Nuevas Tecnologías, Sociedad Española de Diabetes- •
Los SMCG-RT proporcionan beneficios constatados en el control glucémico no solo en pacientes en terapia con ISCI, sino también en aquellos tratados con MDI. El GNT recomienda su uso en población pediátrica (niños, adolescentes) y en adultos con DM1 y HbA1c>7,0%, siempre que se utilicen de manera casi diaria (≥60-70% del tiempo).
- •
Los SMCG-RT se recomiendan también en niños y adultos con DM1 en los que la presencia de hipoglucemias recurrentes sea un factor limitante para alcanzar o mantener el objetivo de HbA1c<7%, siempre que se empleen de manera casi diaria (≥60-70% del tiempo).
- •
Los SMCG-RT con bloqueo automático ante las hipoglucemias (low glucose suspend) pueden ser de utilidad en aquellos pacientes que presenten hipoglucemias nocturnas y/o desapercibidas (asintomáticas).
- •
Para asegurar su coste-efectividad, los SMCG-RT deben ser utilizados por profesionales con formación específica en estos sistemas y en el marco de un programa estructurado de educación terapéutica en diabetes. Además, estos dispositivos requieren un alto grado de motivación e implicación por parte del paciente.
- •
Es fundamental una elevada frecuencia del uso del sensor y la reevaluación periódica del grado de adherencia a la frecuencia en el uso del sensor para obtener los resultados esperados en la mejoría del control glucémico.
- •
Los SMCG de análisis retrospectivo son dispositivos que se utilizan como procedimiento diagnóstico y no para el tratamiento. Sin embargo, hasta la fecha no se dispone de estudios de costes de alta calidad que analicen su eficiencia como herramienta diagnóstica. Clínicamente se ha sugerido que podrían ser útiles en población pediátrica y en adultos con sospecha de hipoglucemias nocturnas o asintomáticas, en el estudio del fenómeno del alba, de las hiperglucemias posprandiales, cuando las causas de una HbA1c elevada no estén claras o ante cambios sustanciales en el tratamiento insulínico.
Los nuevos entornos económicos, organizativos, demográficos y sociales están precipitando un cambio en el modelo sanitario y la necesidad de implantar nuevas formas de atención que permitan un sistema sostenible que llegue a un mayor número de personas y facilite el tratamiento continuado a enfermos crónicos con un menor coste. En este contexto, la atención telemática (o telemedicina) se propone como una alternativa eficiente al modelo asistencial clásico. La Organización Mundial de la Salud (OMS) define la TM como los servicios de atención sanitaria en los que la distancia constituye un factor crítico y que son realizados por profesionales de la salud que utilizan las tecnologías de la comunicación para intercambiar datos, establecer diagnósticos, instaurar tratamientos, intervenir en actividades de investigación, formación y evaluación. Todo ello con el fin de prevenir enfermedades y mejorar la salud de las personas y de las comunidades en las que viven78. Una definición operativa de TM sería el uso de las telecomunicaciones para proporcionar atención sanitaria79.
Potencialmente la TM puede facilitar la consecución de objetivos de control individualizados a través de diferentes estrategias: entrenando a los pacientes en el manejo de su propia enfermedad, facilitando instrumentos para el autocuidado, proporcionando herramientas electrónicas de ayuda en la toma de decisiones del profesional sanitario y/o enviando información en base a datos clínicos individuales73. En el control del paciente con DM, como en otras enfermedades crónicas de elevada prevalencia, la aplicación de modelos de TM podría aportar un beneficio añadido en términos de efectividad y coste-efectividad79-81.
La efectividad y los costes de la TM aplicada al control de pacientes con DM1 y DM2 ha sido analizada en una revisión sistemática que incluye estudios con intervenciones diversas (atención telefónica, módem, SMS y/o conexión a Internet)81. En esta revisión se concluye, con un nivel de evidencia bueno, que la TM es al menos igual de efectiva que la atención presencial habitual en el control metabólico del paciente con diabetes e iguala los resultados obtenidos a través de programas convencionales de educación terapéutica en diabetes. Además, los sistemas de TM son valorados por parte de los usuarios con un alto grado de satisfacción. El uso de la TM ayuda a disminuir los recursos clínicos utilizados por los pacientes, como el número de consultas médicas, las visitas a urgencias, el número de hospitalizaciones y la estancia media hospitalaria, y a pesar de la inversión inicial, los autores concluyen que se consigue ahorrar costes con la provisión de servicios a través de ella. No obstante, las conclusiones derivadas de esta revisión sistemática en términos de efectividad y coste-efectividad deben ser consideradas con prudencia, ya que el tamaño de las muestras y el tiempo de seguimiento de los estudios son reducidos y es muy elevada la heterogeneidad de la población y de las técnicas y tecnologías analizadas. Por otro lado, es importante señalar que la implantación de los modelos de atención por TM no ha demostrado de forma consistente ahorro de tiempo empleado por el personal sanitario. Algunos estudios expresan incluso lo contrario, probablemente por la necesidad de reciclaje profesional en el manejo de esta actividad y la falta de planificación de la misma en el organigrama general de trabajo80. El impacto de un modelo de atención por TM en el tiempo empleado por pacientes y profesionales sanitarios ha sido analizado en un reciente estudio multicéntrico en pacientes con DM1 y control subóptimo82. En este estudio, Esmatjes et al.82 demuestran una disminución significativa del tiempo empleado por los pacientes y los profesionales en el modelo de atención telemática frente al de atención presencial y una disminución del coste global del tratamiento de aproximadamente el 50%. Es entre los pacientes donde el impacto del modelo de TM frente al presencial en el ahorro de tiempo empleado es especialmente favorable (353±222 vs. 823±645min, respectivamente; p<0,0001), resultando similares el control metabólico, la adherencia al tratamiento y la adquisición de conocimientos.
Para asegurar la viabilidad de la TM en el ámbito clínico es necesario definir la población que más puede beneficiarse de la intervención telemática y hacer una evaluación rigurosa de las nuevas y cada vez más complejas tecnologías de aplicación a la TM, incluyendo los costes derivados de su desarrollo e implementación79,83. Un ejemplo de ello es el programa IDEATel, el estudio de TM de mayor escala realizado hasta la fecha. En este trabajo se aleatorizaron 1.665 pacientes con DM de más de 55años de edad a un programa de TM o de seguimiento convencional. Los resultados, tras 5años de seguimiento, demostraron reducciones modestas de la HbA1c, presión arterial sistólica y colesterol LDL84. No obstante, el análisis de costes no señaló una reducción en el consumo de recursos sanitarios, y el gasto asociado a la implementación de la intervención en la rama de TM fue elevado, derivado sobre todo de la adquisición de hardware y el desarrollo del software85,86. Los autores concluyen que para asegurar su viabilidad y traslación al entorno clínico es necesario adoptar tecnologías menos costosas, incorporando móviles y ordenadores de uso habitual por el usuario85.
La OMS afirma que se puede conseguir una mejora en la salud y la calidad de vida a través de las tecnologías móviles. En su informe se da especial importancia al uso de información normalizada y de procesos estándares con el objetivo de mejorar la eficacia y reducir costes87. Una revisión sistemática que analiza el impacto de estas tecnologías móviles en el control metabólico de pacientes con DM1 y DM2 (mHealth) concluye que aunque constituyen una estrategia prometedora, la evidencia de su efectividad es aún débil, por lo que son necesarios estudios de alta calidad de intervenciones en movilidad88. Iniciativas como la del grupo Consolidated Standards of Reporting Trials of Electronic and Mobile HEalth Applications and onLine TeleHealth (CONSORT-EHEALTH) buscan consolidar programas de TM previamente validados en estudios piloto. El objetivo es conseguir evidencia científica de su eficacia y aplicabilidad en circunstancias clínicas comunes y a gran escala89. Además, ellos han establecido unos requisitos a cumplir para asegurar la calidad de cualquier estudio de TM.
En conclusión, para asegurar la viabilidad de la TM en el ámbito clínico es todavía necesario definir la población que más puede beneficiarse haciendo una evaluación rigurosa de las nuevas y cada vez más complejas tecnologías, incluyendo los costes derivados de su desarrollo e implementación. Son aún muchos los retos de la TM para su traslado real y eficiente al ámbito clínico de la diabetes, y es necesario el desarrollo de métodos que mejoren la gestión de datos y los sistemas informáticos de ayuda a la decisión, así como el uso de tecnologías móviles cada vez más extendidas entre los usuarios y que se proponen como estrategias para mejorar la calidad y disminuir los costes sanitarios asociados a los programas de TM. Es preciso, pues, continuar con la investigación a través de estudios de costes (minimización de costes, coste-efectividad, coste-utilidad, coste-beneficio y coste-oportunidad) para generar argumentos sólidos que favorezcan la implantación de TM en el Sistema Sanitario81.
Posicionamiento respecto al empleo de la telemedicina en la diabetes del Grupo de Nuevas Tecnologías, Sociedad Española de Diabetes- •
La TM aplicada a la DM es al menos igual de efectiva que la atención presencial en la consecución de objetivos de control metabólico y puede igualar los resultados obtenidos a través de programas convencionales de educación terapéutica en diabetes. Utilizando diferentes modelos de TM se consigue ahorrar costes en la provisión de servicios y en gastos indirectos.
- •
Las tecnologías móviles aplicadas a la TM constituyen una opción prometedora, aunque son necesarios estudios de alta calidad para evaluar su efectividad y eficiencia.
- •
Son necesarios más estudios comparativos sobre la eficiencia de los diferentes modelos de TM en la DM e identificar los grupos de pacientes que más se pueden beneficiar de esta tecnología.
Los estudios específicamente diseñados para valorar el coste-efectividad de la MAGC son muy escasos porque no resultan fáciles de llevar a cabo. Sus posibles beneficios de manera aislada en el tratamiento no pueden ser probados en un ensayo ciego, prospectivo, aleatorizado y controlado con placebo, ya que serían cuestionables desde el punto de vista ético, particularmente cuando se deben proyectar a largo plazo para poder tener datos potentes de riesgo relativo90. Así pues, el diseño de los estudios no permite cuantificar el efecto específico de la monitorización de la glucosa, sino que valoran la terapia en su globalidad.
Se considera que la MAGC es coste-efectiva en pacientes con DM1 y en los DM2 tratados con insulina en terapia intensiva, pues se ha demostrado una disminución de las complicaciones crónicas con el descenso de la HbA1c observado en los estudios de intervención, donde la MAGC formaba parte del tratamiento1,2,61,91.
Respecto a aquellos con DM2 no tratados con insulina, no está demostrado en ellos un coste-beneficio favorable92. Varios ensayos aleatorizados han intentado arrojar luz sobre esta cuestión93-95, y un reciente metaanálisis sugirió que la MAGC reducía la HbA1c un promedio de 0,25% a los 6meses96. La iniciativa Cochrane de Medicina basada en la evidencia observó en 2012 que en 9 ensayos con 2.324 participantes existía una moderada evidencia del efecto positivo de la MAGC sobre la HbA1c de –0,3% a los 6meses de seguimiento (IC95%, 0,4 a –0,1), pero a los 12meses, y con tan solo 2 ensayos evaluados (493 participantes), el beneficio descendía a –0,1% (IC95%, –0,3 a 0,04)97. No había tampoco evidencias de que la MAGC afectara a la satisfacción de los pacientes o a la calidad de vida. Ninguno de los estudios reportó datos sobre morbilidad, y solo 2 ensayos ofrecieron reseñas sobre costes. Dejando de lado uno de ellos (pues comparaba las tiras reactivas de sangre capilar con tiras de glucosa en orina), en el otro estudio no se observaron diferencias estadísticas entre los grupos de monitorización más y menos intensiva: 212€ (de 2011) en el menos intensivo frente a 203€ en el más intensivo, probablemente por la pérdida de pacientes en este último grupo. Los autores concluyeron que el supuesto beneficio de la MAGC a los 6meses se pierde a los 12meses, pero que se precisan más investigaciones para valorar el impacto psicológico sobre los pacientes, las complicaciones crónicas y las hipoglucemias.
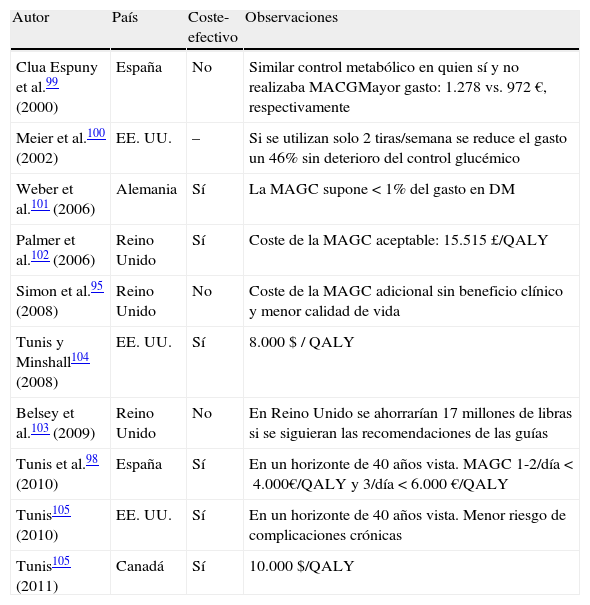
Aunque la revisión Cochrane no ofrezca buenas evidencias sobre costes, hemos creído conveniente apuntar algunos de los ensayos clínicos más señalados, y destacaremos el realizado por Tunis et al.98 en pacientes con DM2 en tratamiento con antidiabéticos orales, pues utilizaron un modelo para calcular el coste-efectividad de la MAGC en 4 países europeos, incluyendo España. En nuestro país, el RCUI para la MAGC 1-2 veces/día es menor de 4.000€/QALY, y en el caso de 3 veces/día, menor de 6.000€. Los autores concluyen que la MAGC es coste-efectiva en un horizonte de 40años, con ratio coste-efectividad en todos los países estudiados inferior a 16.000€/QALY. En la tabla 1 se resumen los estudios de coste-efectividad de la MAGC en DM299-105.
Estudios de coste-efectividad de la MAGC en la diabetes mellitus tipo 2
| Autor | País | Coste-efectivo | Observaciones |
| Clua Espuny et al.99 (2000) | España | No | Similar control metabólico en quien sí y no realizaba MACGMayor gasto: 1.278 vs. 972 €, respectivamente |
| Meier et al.100 (2002) | EE. UU. | – | Si se utilizan solo 2 tiras/semana se reduce el gasto un 46% sin deterioro del control glucémico |
| Weber et al.101 (2006) | Alemania | Sí | La MAGC supone <1% del gasto en DM |
| Palmer et al.102 (2006) | Reino Unido | Sí | Coste de la MAGC aceptable: 15.515£/QALY |
| Simon et al.95 (2008) | Reino Unido | No | Coste de la MAGC adicional sin beneficio clínico y menor calidad de vida |
| Tunis y Minshall104 (2008) | EE. UU. | Sí | 8.000 $ / QALY |
| Belsey et al.103 (2009) | Reino Unido | No | En Reino Unido se ahorrarían 17 millones de libras si se siguieran las recomendaciones de las guías |
| Tunis et al.98 (2010) | España | Sí | En un horizonte de 40 años vista. MAGC 1-2/día <4.000€/QALY y 3/día <6.000€/QALY |
| Tunis105 (2010) | EE. UU. | Sí | En un horizonte de 40 años vista. Menor riesgo de complicaciones crónicas |
| Tunis105 (2011) | Canadá | Sí | 10.000$/QALY |
DM: diabetes mellitus; MAGC: monitorización ambulatoria de la glucemia capilar; QALY: quality-adjusted life years.
En DM1, Miller et al.106, incluyendo a más de 20.555 pacientes, observaron una fuerte asociación entre los niveles de HbA1c con la mayor frecuencia de monitorización de la glucemia capilar, tanto en pacientes portadores de bomba como en los que seguían terapia con MDI, y en todos los grupos de edad (p ajustada<0,001). El uso de tiras reactivas en España para la MAGC está por debajo del umbral teórico definido por la Sociedad Española de Diabetes (SED) en más de un 30%107, lo que parece tener una repercusión en los gastos directos e indirectos de la enfermedad. Evidentemente no podemos relacionar el alto número de complicaciones de nuestros pacientes con este hecho, aunque en el capítulo de costes de la diabetes en España de este documento ya quedó bien reflejado que los costes directos en nuestro país (donde entrarían las tiras reactivas) eran muy bajos respecto a los indirectos. Así pues, creemos lícito caer en la tentación de plantear que el poco uso de tiras reactivas para el control glucémico conlleva peor control metabólico, lo que a su vez conduce a un exceso de complicaciones evitables en nuestros pacientes. En Italia ya lo han podido definir, observando que el aumento del gasto por tiras reactivas se ve compensado sobradamente por los ahorros en hospitalizaciones debidas a las complicaciones108.
Está ampliamente aceptado que la MAGC es una herramienta útil en la detección y prevención de las hipoglucemias, pero aún no hay evidencia para asegurar que el aumento de la frecuencia de autoanálisis se asocia con un descenso de las hipoglucemias graves61.
Evidentemente la MAGC por sí sola no es útil para mejorar los niveles de glucemia, y esta herramienta se debe integrar en un plan global de tratamiento. El grupo de pacientes con DM2 que no utilizan insulina consume un número de tiras reactivas que no es elevado, pero al suponer un número muy alto, se convierten en una fuente importante de gasto sanitario (en España, el 2% de los costes directos)9. En resumen, podemos convenir con McGeoch y Moore109 que la MAGC en pacientes con DM2 que no utilizan insulina resulta coste-efectiva si se dan una serie de supuestos, a saber: a)HbA1c>8%; b)pacientes adecuadamente instruidos en el uso de la MAGC y en cómo tomar medidas apropiadas basadas en sus resultados; c)en aquellos con nivel cultural suficiente para poder aprovechar las ventajas de la monitorización; d)en los receptivos y motivados para mejorar su control metabólico haciendo los cambios necesarios, y e)si concurren circunstancias especiales, como nuevo diagnóstico, iniciación o cambio de medicamentos, enfermedades intercurrentes, diabetes gestacional y/o ausencia de reconocimiento de la hipoglucemia.
Queda también por determinar el papel que tienen los nuevos glucómetros con detección de tendencias o con calculadores de bolos sobre el control metabólico y la prevención de hipoglucemias. Recientemente García-Mochón et al.110 han publicado un estudio en el que se pone de manifiesto que la detección de tendencias bajas por parte de un glucómetro podría predecir y evitar entre el 20 y el 35% de las hipoglucemias graves. Esto supondría un ahorro potencial en torno a 7,8 millones de euros por año para el SNS. Se entiende por tendencias, valores anormalmente altos o bajos de glucosa en un mismo periodo de tiempo en días consecutivos. Pero se precisan más investigaciones para valorar el impacto de estos nuevos dispositivos sobre las complicaciones crónicas, las hipoglucemias y la calidad de vida.
Posicionamiento respecto al empleo de la MAGC del Grupo de Nuevas Tecnologías, Sociedad Española de Diabetes- •
La MAGC constituye un elemento imprescindible de la terapia intensiva con MDI o ISCI en DM1 y DM2.
- •
En pacientes en tratamiento insulínico, la frecuencia óptima de autoanálisis no está bien establecida en términos de coste-efectividad. En aquellos con DM1 se demuestra una fuerte asociación entre la frecuencia de glucemias capilares y el mejor control metabólico.
- •
En pacientes con DM1 o DM2 en tratamiento con pautas de insulina basal-bolos se recomienda la MAGC al menos 4 veces al día para lograr un adecuado control glucémico. En aquellos tratados con otras pautas de insulina, la frecuencia de la MAGC debe individualizarse según el tipo de tratamiento, el riesgo de hipoglucemia y otras circunstancias particulares, como el objetivo de control, la existencia de situaciones de inestabilidad metabólica y cuando se requieran ajustes a corto plazo.
- •
En DM2 no insulinizados, la evidencia sobre el beneficio de la MACG es controvertida. En este contexto clínico su uso parece razonable en el marco de un programa de educación terapéutica en diabetes estructurado, o cuando de sus resultados se puedan derivar cambios en el tratamiento, o bien si concurren circunstancias como nuevo diagnóstico, iniciación o cambios de medicación, enfermedades intercurrentes y/o ausencia de reconocimiento de las hipoglucemias.
- •
Para que la MAGC resulte coste-efectiva es necesario un nivel de adiestramiento adecuado en su uso e interpretación y en la toma de medidas según los resultados obtenidos. Así mismo, es necesario un importante nivel de motivación e implicación por parte del paciente que asegure la realización de los cambios propuestos.
- •
Son necesarios estudios de eficacia y coste-efectividad de alta calidad para definir la eficiencia de los glucómetros con funciones de recomendación de bolo y detección de tendencias de glucemia.
La cetoacidosis diabética (CAD) es una complicación aguda, costosa y grave, pero prevenible. El coste por ingreso varía desde 5.463 a 10.109$ en Estados Unidos111, y en España se ha estimado en 2.700, 4.300 y 5.163,11€, respectivamente22,28,112.
La hipercetonemia aparece como consecuencia de un incremento en la cetogénesis hepática junto a una disminución en la cetólisis periférica en músculo estriado. La cetogénesis se ve favorecida por una mayor oferta al hígado de ácidos grasos libres a partir del tejido adiposo (lipólisis por el déficit de insulina y aumento de hormonas contrainsulares). Posteriormente, estos ácidos grasos libres, bajo la influencia del glucagón y mediante un descenso de la enzima malonil-CoA, atraviesan la membrana mitocondrial y, previa β-oxidación, se convierten en cuerpos cetónicos (β-hidroxibutirato [β-OHB], ácido acetoacético [AcAc] y acetona)113.
Desde hace unos años es posible la determinación de la cetonemia por medio de glucómetros que permiten la medición de los niveles de β-OHB a partir de una pequeña muestra de sangre capilar (10μl) y de forma rápida (segundos). Esta determinación es segura y más barata que la monitorización del equilibrio ácido-base requerida en el tratamiento de la CAD. También es más específica que la cetonuria, que mide AcAc pero no β-OHB (cetoácido predominante en la CAD). El aumento de β-OHB no se detecta en la orina por las técnicas habituales de nitroprusiato, y este hecho puede falsear valores de cuerpos cetónicos positivos en sangre y negativos en orina al inicio de una cetosis, y al revés, seguir siendo positivos en la orina cuando se ha iniciado el tratamiento insulínico y el ácido β-OHB ya se ha negativizado en sangre (desaparece en sangre 4h antes que en orina)114,115. La ADA destacaba ya en el año 2005 que la determinación semicuantitativa de cuerpos cetónicos en orina (AcAc) es poco precisa para el diagnóstico y el seguimiento de cuadros de CAD, mientras que la determinación de β-OHB es cuantitativa115 y su sensibilidad y su especificidad para determinar CAD son del 100 y del 88%, respectivamente114.
Otra de las limitaciones que presenta la medición de cetonas en orina es la posibilidad de sufrir interferencias con medicaciones dando falsos positivos, como por ejemplo con fármacos que contengan grupos sulfidrilos como el captopril, la N-acetilcisteína y la penicilamina. También se han detectado falsos negativos cuando las tiras se hallan expuestas al aire durante tiempo prolongado o en caso de orinas acidificadas por ingesta de altas cantidades de ácido ascórbico114.
Con la determinación de β-OHB en sangre capilar se lleva a cabo un seguimiento más estrecho del paciente en los primeros momentos de la cetosis hasta la resolución del cuadro clínico116-119. La determinación horaria de β-OHB es un buen marcador de si el tratamiento instaurado en una CAD es correcto. En ese caso, la cetonemia descenderá a un ritmo de 1mmol/l/h. En caso contrario, habría que reevaluar la tasa de infusión de líquidos, así como la insulinoterapia118. En niños con CAD reduce los días de estancia en las unidades de cuidados intensivos, con un ahorro promedio de 163-184$ por paciente118. Puede disminuir tanto el número de ingresos hospitalarios como los días de hospitalización, ahorrar costes y mejorar la calidad de vida de los pacientes, según se desprende de la revisión sistemática realizada por Klocker et al.120, en la que se comparaba la efectividad de los test de orina tradicionales con los de cetonemia en el manejo de la cetoacidosis diabética.
Varias sociedades científicas, como la Sociedad Española de Endocrinología Pediátrica (SEEP)121, la ADA122, la International Society for Pediatric and Adolescent Diabetes (ISPAD) y la European Society for Pediatric Endocrinology (ESPE)123, recomiendan la medición de cuerpos cetónicos en sangre (β-OHB) frente a la determinación de cetonurias (AcAc) alegando ser de gran utilidad en la práctica clínica, tanto en la CAD establecida como en la cetosis o hipercetonemia.
En pacientes ambulatorios la monitorización del β-OHB en sangre capilar permite diferenciar pacientes con cetosis de aquellos con hiperglucemia sola, y por tanto, mejorar su autocuidado en cualquier escenario. La cetosis se diagnostica precozmente, lo que puede ser verdaderamente importante en los pacientes que están con bomba de infusión de insulina para yugular situaciones que pueden terminar en ingresos por CAD116,119. Los niveles de cuerpos cetónicos circulantes pueden considerarse normales <0,5mmol/l; sospecha de cetosis 0,5-0,9mmol/l; hipercetonemia o cetosis >1mmol/l, y cetoacidosis >3mmol/l.
Posicionamiento respecto al empleo de la cetonemia capilar del Grupo de Nuevas Tecnologías, Sociedad Española de Diabetes- •
La medición de cuerpos cetónicos en sangre ofrece una interpretación sencilla y rápida a través de la valoración cuantitativa, segura, específica e inmediata del β-OHB, cetoácido predominante en la CAD.
- •
Puede considerarse un marcador sensible del déficit insulínico, y por tanto es útil para prevenir la aparición de CAD desde el comienzo de una situación de hiperglucemia con cetosis hasta su resolución.
- •
Se recomienda especialmente en la CAD establecida para evitar falsos positivos y falsos negativos con las cetonurias.
- •
Permite monitorizar al paciente cada hora, independientemente de su estado de hidratación.
- •
La normalización de la cetonemia puede utilizarse como uno de los criterios para disminuir la vigilancia intensiva y la estancia en las unidades de cuidados intensivos.
- •
Se detecta antes y desaparece antes, lo cual supone una considerable reducción de los costes y una mejor utilización de los recursos empleados en el tratamiento de la cetosis/CAD.
El desarrollo tecnológico en la diabetes ha tenido un crecimiento exponencial desde las últimas décadas del sigloxx, contribuyendo a optimizar el rendimiento de los recursos. La innovación en los conocimientos es constante, y por lo tanto tiene que serlo la innovación tecnológica, que debe constituirse como herramienta imprescindible en la atención y cuidado de calidad de las personas con diabetes por parte de los profesionales y de la gestión sanitaria para mejorar la atención clínica que ofrecen. La tecnología ha contribuido al avance en la comunicación profesional-paciente proporcionando un entendimiento más dinámico y motivador que favorece una mejor adherencia terapéutica.
En nuestra especialidad precisamos personal altamente cualificado en el tratamiento y manejo de las nuevas tecnologías en DM. De nada servirá tener bombas de infusión o sensores de glucosa si los profesionales que los atienden no están familiarizados con las nuevas tecnologías. Se deben ir abandonando los métodos de atención más clásicos, porque las nuevas generaciones así lo demandan. Nuestras consultas deberían estar preparadas para poder volcar los datos de todos los sistemas de medición de glucosa, bombas y sensores, así como emplear la TM de manera cotidiana.
Por lo expuesto en todo el documento se deduce que urgen planes de prevención y diagnóstico temprano de la diabetes y sus complicaciones. Es necesaria una mayor inversión en gastos sanitarios directos de personal, en formación y en tecnologías para así lograr disminuir el impacto humano y los enormes gastos indirectos por las complicaciones crónicas que presentan nuestros pacientes. Precisamos implementar tecnologías avanzadas, que, como los sistemas de infusión continua de insulina, tienen un nivel de efectividad y eficiencia bien establecidos. Sin embargo, a pesar de estos datos, las nuevas tecnologías tienen un grado de penetrancia en nuestro país sorprendentemente bajo. Por todo ello, se requiere la realización de más estudios de costes (minimización de costes, coste-efectividad, coste-utilidad, coste-beneficio y coste-oportunidad) para que existan argumentos sólidos ante las administraciones públicas y quede bien definido que, en la diabetes, invertir en nuevas tecnologías resulta coste-efectivo.
Conflicto de interesesP. Martín-Vaquero ha participado en actividades científicas (cursos, ponencias, reuniones científicas, ensayos clínicos y/o consultoría) patrocinados por Abbott, GSK, Lifescan, Lilly, Medtronic, MSD, Novartis, NovoNordisk, Roche, Sanofi-Aventis, Infociencia, Euromedice, Wolters Kluwer Health, Genatics Europe, Grupo ArsXXI de Comunicación y Dexcom Sweden AB.
M.A. Martínez-Brocca ha participado en actividades científicas (cursos, reuniones científicas y ensayos clínicos) patrocinados por Medtronic, Roche y Abbott.
J.M. García-López ha participado en actividades científicas (ponencias, ensayos clínicos y otros estudios) patrocinadas por Abbott, Lilly, Medtronic, MSD, Novartis, NovoNordisk, Roche, Sanofi-Aventis.
Queremos expresar nuestro agradecimiento a todos los miembros de las Sociedades Científicas que han aportado sus comentarios a este documento, pues sin duda han contribuido a mejorarlo. Asimismo, agradecemos las labores de gestión que los doctores Juan Girbés Borrás, María José Picón César, Juan Francisco Merino Torres y Raquel Barrio Castellanos han llevado a cabo en sus sociedades científicas respectivas (Sociedad Española de Diabetes, Sociedad Española de Endocrinología y Nutrición y Sociedad Española de Endocrinología Pediátrica), pues han hecho posible que este documento tenga mayor difusión y quizá con ello podamos lograr que las nuevas tecnologías en diabetes lleguen más y mejor a nuestros pacientes.
AcAc: acetoacetato
ADA: American Diabetes Association
AVAC: años de vida ganados ajustados por calidad
β-OHB: β-hidroxibutiratoCAD: cetoacidosis diabética
CCI: coeficiente de correlación intraclase
CDA: cetoacidosis diabéticaCONSORT-EHEALTH: Consolidated Standards of Reporting Trials of Electronic and Mobile HEalth Applications and onLine TeleHealth
CORE: Center for Outcomes Research
DCCT: Diabetes Control and Complications Trial
DM: diabetes mellitus
DM1: diabetes mellitus tipo 1
DM2: diabetes mellitus tipo 2ESPE: European Society for Pediatric Endocrinology
FDA: Food and Drug Administration
GDR: grupos relacionados con el diagnóstico
GNT: Grupo de Nuevas Tecnologías
HbA1c: hemoglobina glucosilada
IC: intervalo de confianza
IDF: International Diabetes Federation
ISCI: infusión subcutánea continua de insulinaISPAD: International Society for Pediatric and Adolescent Diabetes
JDRF-CGM Study Group: Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study GroupLDL: lipoproteínas de baja densidad
MAGC: monitorización ambulatoria de la glucemia capilar
MDI: múltiples dosis de insulina
NICE: National Institute for Health and Clinical Excellence
OMS: Organización Mundial de la Salud
QALY: quality-adjusted life years
RCUI: ratio coste utilidad incremental
SECCAID: Spain Estimated Cost Ciberdem-Cabimer In DiabetesSED: Sociedad Española de DiabetesSEEP: Sociedad Española de Endocrinología Pediátrica
SMCG: sistemas de monitorización continua de glucosa
SMCG-TR: sistemas de monitorización continua de glucosa a tiempo real
SNS: Sistema Nacional de Salud
TM: telemedicina
UKPDS: United Kingdom Prospective Diabetes Study
€: euro/s
£: libra/s esterlina/s
$: dólar/es
Aguilera, Eva; Ampudia, Francisco Javier; Andía, Victor; Antuña, Ramiro; Barrio, Raquel; Caballero, Águeda; Chico, Ana Isabel; Díaz-Soto, Gonzalo; Elena, Mar; Galindo, Mercedes; García-Cuartero, Beatriz; García-López, José Manuel; Giménez, Margarita; González-Blanco, Cintia; Goñi, M. José; Martín-Vaquero, Pilar; Martínez-Brocca, María Asunción; Moreno, Jesús; Merino, Juan Francisco; Picón, María José; Rigla, Mercedes; Ruiz de Adana, M. Soledad; Salgado, Yolanda; Simón, Inmaculada; Urbano, Francisca; Valverde, María Teresa; Vázquez, Federico; Vidal, Mercè; Yoldi, Carmen.
Gorgojo, Juan José; Jódar, Esteban; Mauricio, Didac; Merino, Juan Francisco; Reyes, Rebeca; Bellido, Diego; Botella, Marta; Escalada, Javier; Becerra, Antonio; Gargallo, Manuel; Gómez-Peralta, Fernando; González, Noemí; López de la Torre, Martín; Mezquita, Pedro; Moreno, Óscar; Muñoz, Manuel; Soto-González, Alfonso.
De acuerdo con los autores y editores este artículo se publica de forma íntegra en la revista Endocrinología y Nutrición. (http://dx.doi.org/10.1016/j.endonu.2014.08.003).