La diabetes mellitus tipo 2 (DM2) es una enfermedad muy frecuente a escala mundial y representa una gran causa de morbimortalidad. Su prevalencia ha aumentado enormemente en las últimas décadas y si no se toman medidas la magnitud del problema crecerá, con consecuencias para el paciente, para el sistema de salud y para los factores socioeconómicos. Está demostrado que los cambios en el estilo de vida pueden prevenir el desarrollo de DM2 siempre y cuando se optimice la prescripción de actividad física y aspectos nutricionales para este tipo de pacientes. Así, esta revisión trata del principal transportador de glucosa en el músculo esquelético, el GLUT4, y pretende conseguir un mejor entendimiento de su implicación a nivel molecular y su rol frente a distintos estímulos de nutrición y actividad física. Finalmente, se proponen aplicaciones prácticas para la prescripción de actividad física en la DM2.
Type 2 diabetes (DM2) is a very common disease worldwide and represents an important cause of morbidity and mortality. Its prevalence has increased overall in recent decades, and if action is not taken, the problem will grow with consequences for the patient, health systems and socioeconomic factors. Changes in lifestyle can prevent the development of DM2, only if the physical activity and the nutrition prescription are optimal. This review shows the main glucose uptake carrier in the skeletal muscle in order to have a better understanding of its molecular involvement, and its role in response to various stimuli, such as nutrition and physical activity. Finally, practical applications are proposed for the prescribing of physical activity in DM2.
La diabetes mellitus (DM) es un trastorno metabólico causado por una combinación variable de deficiencia de insulina e insulinorresistencia, lo cual resulta en un incremento de la glucemia con una alteración en el metabolismo de los hidratos de carbono, de los lípidos y de las proteínas1. Las estimaciones indican que para el año 2030 la prevalencia de la DM2 alcanzará proporciones epidémicas y afectará a 366 millones de personas en todo el mundo2.
Por otro lado, la resistencia a la insulina (RI) es un concepto teórico que se puede determinar mediante varios ensayos de laboratorio como la prueba de tolerancia a la glucosa o el pinzamiento normoglucémico, aunque ninguna de ellas puede aplicarse clínicamente para detectar la RI en la población general. Estas pruebas permiten el cálculo del índice insulina-glucosa como el índice HOMA que estima la RI [Índice HOMA=Insulina de suero de ayuno (μU/ml)×glucosa plasmática en ayunas (mmol/l)/22,5]3. Esta alteración podrá dar lugar a la aparición de DM tipo 2 (DM2). A nivel molecular, se asocia con un insuficiente reclutamiento de GLUT-4 a la membrana plasmática4. En ratones knockout se ha demostrado que el GLUT-4 juega un papel crucial en la RI y en la DM2 a nivel adiposo y del músculo esquelético5, por lo que resulta de gran interés la compresión del mecanismo molecular que regula el transporte de glucosa para desarrollar estrategias que mejoren la homeostasis de la glucosa en pacientes DM2 y así reducir la glucemia.
Para el tratamiento de la RI y la DM2 se puede recurrir a fármacos, principalmente biguanidas, sulfonilureas e inhibidores α-glucosidasa, dieta y actividad física6,7, y es necesario hacer mayor hincapié en estos dos últimos.
GLUT4: funciones y su funcionamientoEl principal transportador de glucosa es el GLUT, presente en numerosos tejidos, y posee varias isoformas. El GLUT1 y el GLUT3 son los principales transportadores de glucosa en estado basal y se encuentran en las células neuronales, astrocitos, tejido adiposo y muscular8. El GLUT2 se encuentra en los enterocitos, en los riñones y en las células hepáticas y pancreáticas9.
Los GLUT4 se encuentran principalmente en los tejidos sensibles a la insulina, como el músculo y los adipocitos, y son la única isoforma regulada, además de por la insulina, por la contracción muscular10. Es el mayor responsable de la captación de glucosa en el músculo esquelético, responsable de hasta un 80% de ella. El incremento de la acción de la insulina sobre los transportadores de glucosa en el músculo esquelético se asocia con un incremento de la expresión proteica del GLUT4 así como con una respuesta adaptativa de las enzimas involucradas en la oxidación y la fosforilación de la glucosa11.
La insulina y la contracción muscular tienen efectos aditivos12. La insulina aumenta el transporte de la glucosa a través de un mecanismo de señalización por transducción de señales a través del receptor de la insulina13. La contracción muscular aumenta directamente el transporte de glucosa y su metabolismo por un mecanismo insulino-independiente14,15, incrementando la utilización de glucosa en la célula muscular.
La mayor parte de los GLUT4 se encuentran en vesículas en el interior de la célula, y estas vesículas son sensibles a la insulina, al ejercicio físico y a las situaciones de hipoxia12. Las vesículas son translocadas desde la membrana plasmática celular al citoplasma, y viceversa, mediante procesos de endocitosis y exocitosis, permitiendo regular el número de transportadores presentes en la membrana para la captación de glucosa. Tanto la contracción muscular como la insulina aumentan el número de transportadores en la membrana y reducen el número presente en el citoplasma16, de modo que aumenta la captación.
La importancia de los GLUT4 en los estados fisiopatológicos reside en que la disminución de las concentraciones intracelulares de estos da como resultado un estado de RI17. Al contrario, el incremento de la sensibilidad a la insulina es mediado por el aumento en la translocación de los GLUT4 hacia la membrana plasmática18.
Relación entre el ejercicio físico y el GLUT4Los músculos con mayor cantidad de fibras tipo ST u oxidativas (fibras rojas o lentas) son los que se entrenan con deportes aeróbicos de larga duración y concentran más cantidad de GLUT4 que las fibras de tipo FT o glucolíticas (fibras blancas o rápidas)19. A través del estímulo de electroestimulación se puede observar cómo las fibras lentas captan más glucosa que las fibras rápidas20.
La práctica regular de actividad física (AF) induce una gran variedad de adaptaciones metabólicas, destacando los cambios del metabolismo basal, la mejora de la sensibilidad a la insulina y del metabolismo de la glucosa21. Tradicionalmente se creía que eran necesarias varias semanas de entrenamiento físico (EF) para conseguir las adaptaciones del músculo esquelético. Sin embargo, se ha demostrado que la respuesta de adaptación del músculo esquelético al EF ocurre en la primera semana de AF, si el estímulo del ejercicio es adecuado22. Durante la AF, el flujo sanguíneo puede llegar a aumentar hasta 20 veces, favoreciendo con ello la disponibilidad de glucosa y la captación por parte de la célula23. Durante el mismo, la permeabilidad y el transporte de glucosa al interior de la sarcómera se incrementan según la intensidad o la potencia de la contracción muscular24. Una vez se encuentra la glucosa dentro de la célula muscular y después de ser fosforilada irreversiblemente por la hexocinasa, su utilización en el músculo como sustrato energético se incrementa también con la intensidad de la AF25.
Parece ser que el aumento del glucógeno muscular está muy relacionado con el aumento y la concentración total de los GLU419. Así podemos observar que los deportistas que entrenan diariamente tienen una mayor capacidad de almacenar glucógeno muscular (además de tener más cantidad de músculo) y a la vez poseen más cantidad de GLUT4. A mayores demandas de energía que provoquen la utilización y la disminución del glucógeno muscular, mayor tendencia a la sobrecompensación, por lo que la célula aumenta la transcripción y la traducción de GLUT4, así como su translocación hacia la membrana celular, lo que llevaría a un aumento en las reservas de glucógeno26, supercompensación que suele darse en los deportistas.
Actividad físicaAl realizar AF rápidamente se producen cambios en la expresión del ARNm y de la proteína GLUT4. Una vez cesa el ejercicio disminuye la glucólisis, pero el transporte de glucosa aún permanece elevado debido a que el número de transportadores GLUT4 y el flujo sanguíneo también se encuentran elevados. Según Horton27, de 2 a 16h tras la AF (según la intensidad) la cantidad de transportadores GLUT4 vuelve a su estado basal, aunque existe gran controversia al respecto tanto en sujetos sanos como en pacientes con DM2. Esto sugiere que los transportadores GLUT4 tienen una vida media en principio corta y que su expresión puede variar rápidamente28, por lo que sería interesante realizar varios entrenamientos al día. No obstante, en otro estudio se observó que tras 60min de ejercicio en cicloergómetro al 70-75% VO2max los niveles de GLUT4 se mantenían 3h tras la AF29.
Tras todo lo citado, el incremento de la expresión de GLUT4 en el músculo esquelético es probablemente una de las adaptaciones de mayor importancia del ejercicio regular a la sensibilidad a la insulina30.
Ejercicio agudo vs crónicoEn modelos de roedores insulinorresistentes se han comprobado los siguientes efectos en el GLUT4 en el músculo esquelético: los GLUT4 aumentan en respuesta al ejercicio agudo y aumenta la translocación de los mismos31, al igual que en respuesta al entrenamiento físico32, donde además se ha observado un incremento en su expresión33. Estudios recientes han demostrado que el ejercicio agudo mejora la translocación de GLUT4 también mediado por la insulina34.
En humanos con RI, tal y como ocurre en modelos animales, tanto el ejercicio agudo como el entrenamiento crónico aumentan la cantidad de transportadores y la translocación de los mismos35. En cambio, solo se observó un incremento de su expresión en respuesta al entrenamiento36,37. Tras un único ejercicio de 30-60min en pacientes con DM2 al 60-70% VO2max no mejora la tolerancia a la glucosa; en cambio, un ejercicio prolongado en cicloergómetro al 45% VO2max disminuye la glucemia y la insulinemia38. La duración del efecto agudo sobre la sensibilidad a la insulina puede durar hasta 20h39, por lo que tal y como se ha citado anteriormente sería conveniente realizar más de un entrenamiento al día; a pesar de ello, actualmente no existe ningún consenso al respecto.
Tras una sola serie de 45-60min en bicicleta al 60-70% VO2max la translocación de GLUT4 a la membrana plasmática aumenta del 20 al 74% en individuos diabéticos, casi lo mismo que en individuos no diabéticos, en los que el incremento fue del 28 al 71%35. Por tanto, podemos decir que una sola serie de ejercicios de intensidad moderada puede aumentar el transporte de glucosa muscular a través de la inducción de la translocación de GLUT4 a la membrana plasmática.
El EF resulta ser muy beneficioso en la RI y DM240. Así, un ejercicio de resistencia aeróbica (RA) ha demostrado ser beneficioso para la tolerancia a la glucosa41. Con el EF mediante ejercicio aeróbico de larga duración parte de las fibras FT se transforman funcionalmente en más oxidativas, por el aumento de la concentración mitocondrial, lo cual resultaría beneficioso en la DM219. Además, cabe añadir que, ante una misma AF, la cantidad de GLUT4 aumenta más en músculos no entrenados que en entrenados42.
Intensidad de la actividad físicaDesde el punto de vista fisiológico, el efecto global de un tipo específico de EF depende de la intensidad y del tiempo del ejercicio, pero también de la cantidad de músculos implicados, así como de la ingesta de macronutrientes realizada antes y durante el ejercicio43, ya que metabólicamente puede tener unos efectos u otros.
En un estudio en ratas se observó que con la natación, en forma de EF intermitente de corta duración (series de 280s) de muy alta intensidad durante 8 días, se induce una masiva expresión de GLUT4 en el músculo esquelético a un nivel comparable a la observada tras un EF prolongado de baja intensidad (6h), que hasta entonces había sido considerado como el más adecuado para el aumento de la expresión del GLUT443.
En el entrenamiento de RA aumenta la cantidad de ácidos grasos libres internalizados en la célula muscular, lo que lleva a un incremento en la oxidación lipídica. Se produce un efecto inhibitorio sobre el IRS1 (insulin receptor substrate-1) asociado con la actividad de la fosfatidil-inositol 3 cinasa, que al ser activada junto con otras proteínas permite que los GLUT4 se expongan en la membrana celular. Esto produce una alteración en la utilización de la glucosa en el ejercicio y posteriormente una mejoría de la RI44.
Periodos cortos de EF de baja intensidad aumentan la cantidad de GLUT4 en las fibras lentas tipo ST. Además, en el ejercicio de baja intensidad (trabajo de RA de larga duración) de hasta un máximo de 2h se produce en primer lugar el reclutamiento de fibras de contracción lenta (tipo ST); las fibras de contracción rápida (tipo FT) son reclutadas a posteriori45, cuando se va gastando el glucógeno muscular. Esto puede darnos la idea de que el aumento del período de EF no tiene por qué dar lugar a una mayor expresión de GLUT4 en fibras tipo FT.
Parece ser más interesante un aumento de la intensidad de la AF para que se impliquen más fibras rápidas y así producir un marcado incremento en la expresión de GLUT4 de fibras FT en menos tiempo. No obstante, según esta hipótesis, para lograr un incremento máximo en el GLUT4 muscular, y para mejorar la sensibilidad a la insulina41, el EF debería incluir la contratación de todos los tipos de fibras musculares (ST y FT), ya que únicamente los músculos que son estimulados experimentan un incremento de GLUT446. Por esto parece ser esencial prescribir AF de tipo interválico con cambios de ritmo de baja-alta intensidad (como pueden ser deportes de equipo), para que se recluten fibras tanto rápidas como lentas45.
Siguiendo con lo dicho, Kraniou et al.29 observaron, en individuos jóvenes sanos no entrenados, que a una intensidad de VO2max del 80% durante 30min en cicloergómetro los niveles de ARNm y proteicos de GLUT4 eran similares a los observados al realizar el mismo ejercicio al 40% de VO2max durante 60min. Con el ejercicio de alta intensidad bajaron mucho antes los depósitos de glucógeno muscular, y esto puede ser una de las causas del aumento del GLUT4. Esto nos dice que con menos tiempo y más intensidad podemos conseguir los mismos efectos a nivel de GLUT4. Sin embargo, este estudio está realizado en sujetos sanos y solo sirve de orientación, ya que no se ha encontrado ningún estudio similar realizado en individuos con DM2. No obstante, debido al estilo de vida que llevamos podría resultar más factible el primero, ya que cada vez disponemos de menos tiempo para realizar AF.
Otro estudio observó que tras 2 semanas de entrenamiento de baja intensidad (50% VO2max) con una sola pierna, el contenido total de GLUT4 en la membrana del músculo esquelético aumentó un 26%45. Este incremento parece bajo comparado con otros estudios, probablemente debido a la baja intensidad de AF y a la corta duración de la intervención. En sujetos jóvenes no entrenados hubo un incremento del 26% en el contenido de GLUT4 después el entrenamiento con una sola pierna durante 70 días y un aumento del 166% con el EF con ejercicios de fuerza-resistencia (FR) durante 7 días, respectivamente37,47.
Holten et al.48 observaron que en pacientes con DM2 los ejercicios de FR mejoran la captación de glucosa y la señalización de insulina, e incrementan el contenido de GLUT4 del músculo esquelético hasta un 40% tras la realización de 3 sesiones semanales de 30min durante 6 semanas. Estos ejercicios no supusieron muchas repeticiones ni grandes pesos, por lo que podrían usarse en pacientes con DM2 con hipertensión, patología generalmente asociada en tales pacientes.
Actividad física en relación a la edadExiste gran polémica en cuanto a los efectos de la AF sobre la concentración de GLUT4 en el músculo esquelético a distintas edades. A una intensidad del 75% VO2max el incremento del transportador es similar en menores de 30 años y en la franja de 50-70 años49. Estos mismos resultados fueron observados por otros investigadores50, aunque algunos, como Dela et al.36, solo observaron este incremento de manera significativa en jóvenes a dicha intensidad. Se necesitan más investigaciones a diferentes edades para confirmar estos datos.
Diferentes tipos de contracción muscular e hipoxia intermitenteParadójicamente, el ejercicio excéntrico (correr cuesta abajo) disminuye la cantidad de transportadores, así como su expresión en el músculo esquelético, en comparación con el ejercicio concéntrico (andar en bici), ya que se produce daño muscular e inflamación51. La estimulación eléctrica (ejercicio isométrico) también incrementa el contenido de GLUT4 en el músculo esquelético, al igual que los ejercicios concéntricos de fuerza52.
De la misma manera, a nivel celular se observa un incremento en la expresión de la proteína GLUT4 en el músculo cardiaco de ratas expuestas a hipoxia intermitente normobárica (HIN) durante 12h al día durante 4 semanas53. En células musculares inmaduras de ratas expuestas a la HIN durante un mes se observó un incremento en el contenido de GLUT4 un 60-90% por encima del grupo control54. Estos estudios apoyan la hipótesis de que la mayor sensibilidad a la insulina en situaciones de hipoxia se debe, en parte, a un incremento en el número y en la translocación de GLUT4 en las células musculares.
Aspectos dietético-nutricionales y suplementos ergonutricionalesLa adición de hidratos de carbono (HC) tras el ejercicio en ratas produce un incremento en los niveles proteicos de GLUT4 en el músculo esquelético, que se mantiene 5h tras la suplementación y que es aún mayor de lo que se produce únicamente con el ejercicio19. En humanos, no obstante, se ha observado que la adición de 1g de HC/kg de peso corporal inmediatamente tras el ejercicio disminuye de manera significativa los niveles de ARNm55. Esta aparente controversia puede deberse a que la expresión proteica requiere insulina, que afecta a nivel transcripcional y translacional, lo que aumenta las reservas de glucógeno56.
Así, en ratas, los niveles de GLUT4 disminuyen a valores basales 42h después del ejercicio en las alimentadas con una dieta alta en HC, ya que los niveles de glucógeno muscular se recargan28. Por el contrario, en las alimentadas con una dieta baja en HC no se produce un incremento de GLUT4 y persiste durante 66h57.
En cuanto a las bebidas ricas en HC, se ha comprobado que si se ingieren en los momentos previos a la competición, aumenta la secreción de insulina, con la consiguiente translocación de GLUT4 en el músculo y en el tejido adiposo58. Su efecto inhibitorio de la glucogenólisis y de la neoglucogénesis hepática, y la disminución de glucagón, aumentan la disponibilidad periférica de glucosa y frenan su producción hepática. Simultáneamente se inhibe la lipólisis, lo que ocasiona una disminución de ácidos grasos libres en circulación susceptibles de ser utilizados por la fibra muscular59.
Por otro lado, se ha observado que la suplementación de 15g de creatina durante 3 semanas y de 5g durante otras 7 en individuos sanos, junto a la AF de FR, compensó la disminución del contenido proteico de GLUT4 en el músculo esquelético, como puede ocurrir por ejemplo tras una inmovilización, en un menor tiempo de lo que se conseguiría únicamente con ejercicio físico60.
Van Loon et al.21 observaron que la utilización de 20g/día de creatina estimuló el almacén de glucógeno en el músculo pero no afectó a la expresión del GLUT-4 en él. Así mismo, la suplementación conjunta de proteína y creatina, combinada con el entrenamiento de FR, aumenta el contenido de GLUT4 en el músculo esquelético así como la tolerancia a la glucosa en humanos, hecho que probablemente no se relacione con cambios en la expresión de dicho transportador en el músculo esquelético. Sin embargo, estas mejoras no ocurren si el EF no se lleva a cabo de manera habitual61.
Otro de los suplementos de gran interés puede ser el óxido nítrico (ON), ya sea tomado como suplemento o bien inducido por la actividad físico-deportiva de alta intensidad o entrenamientos en hipoxia intermitente. El efecto del ON sobre el tejido muscular aumenta la vasodilatación, la sensibilidad a la insulina y la captación de glucosa62, de tal manera que en los sujetos insulinorresistentes la captación de glucosa se ve disminuida, pudiendo ser así una ayuda ergonutricional interesante en pacientes con DM2.
Discusión y aplicaciones prácticasLas recomendaciones de AF para pacientes con DM2 se centran tradicionalmente en ejercicios aeróbicos como andar22. Sin embargo, este ejercicio puede no ser suficiente para el control de la glucemia. Los ejercicios interválicos (con cambios de intensidad) o de FR pueden ser una buena alternativa para estos pacientes debido al incremento de la masa muscular, y de manera independiente debido al incremento del contenido proteico de GLUT4, entre otras proteínas48. Estos últimos podrían ser de especial interés, ya que el estilo de vida sedentario que suelen llevar estos pacientes y la baja forma física en la que suelen estar podría no ser un obstáculo para la práctica de este tipo de ejercicios, ya que actividades de alta intensidad requieren menos tiempo de EF. Además 30 min de ejercicios de FR, 3 días a la semana, podrían ser suficientes, no siendo así en los ejercicios aeróbicos, en los que necesitaríamos una práctica casi diaria de ejercicio para poder conseguir adaptaciones similares63.
Por otro lado, en los pacientes que padecen hipertensión arterial no controlada no es recomendable la práctica de ejercicios isométricos, especialmente del tren superior, ya que estos aumentan la presión arterial64. No obstante, los ejercicios de fuerza-resistencia con contracciones concéntricas del tren superior e inferior pueden ser muy interesantes, ya que aumentan mucho la intensidad de la contracción muscular e incrementan la concentración del GLUT4 en los músculos activos64.
El GLUT-4 tiene una vida media corta, por lo que la frecuencia de EF es un punto a tener en cuenta cuando prescribimos AF a los pacientes con DM2. Así, sería conveniente la AF diaria, e incluso 2 sesiones. A pesar de que los niveles de GLUT4 se encuentren incrementados por corto tiempo, el incremento de la sensibilidad a la insulina se mantiene por más tiempo.
Un mayor entendimiento de los transportadores de glucosa, de GLUT4, de la contracción muscular y de los aspectos dietético-nutricionales nos ayudará a entender mejor las aplicaciones que puede tener la AF en el estado fisiopatológico de DM2 y poder prescribir AF así como optimizar aspectos dietético-nutricionales. Esto hace que a través de estos conocimientos se desarrollen programas de AF específicos, con el objetivo de aumentar el transporte de glucosa y una mejora en la utilización energética.
En algunos estudios se observa que a mayor disminución del glucógeno muscular posterior al ejercicio, ayuno o dieta baja en HC, la concentración de GLUT4 encontrada fue mayor, y por lo tanto mayor la captación de glucosa posterior a la ingesta de HC20,65.
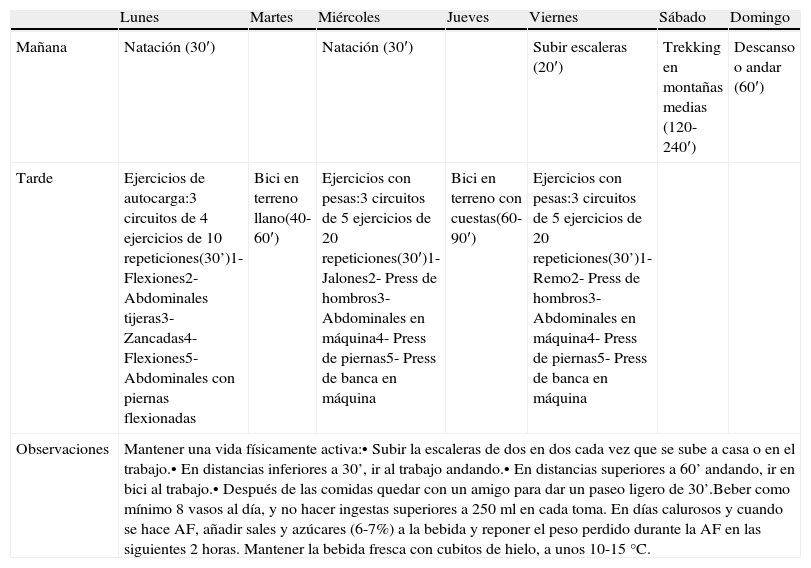
Con el objetivo de aportar aplicaciones prácticas en base a esta revisión, en la tabla 1 se presenta una propuesta de programa de EF semanal para los pacientes con DM2.
Planificación de entrenamiento semanal para individuos con diabetes mellitus tipo 2, según la revisión realizada
| Lunes | Martes | Miércoles | Jueves | Viernes | Sábado | Domingo | |
| Mañana | Natación (30′) | Natación (30′) | Subir escaleras (20′) | Trekking en montañas medias (120-240′) | Descanso o andar (60′) | ||
| Tarde | Ejercicios de autocarga:3 circuitos de 4 ejercicios de 10 repeticiones(30’)1- Flexiones2- Abdominales tijeras3- Zancadas4- Flexiones5- Abdominales con piernas flexionadas | Bici en terreno llano(40-60′) | Ejercicios con pesas:3 circuitos de 5 ejercicios de 20 repeticiones(30′)1- Jalones2- Press de hombros3- Abdominales en máquina4- Press de piernas5- Press de banca en máquina | Bici en terreno con cuestas(60-90′) | Ejercicios con pesas:3 circuitos de 5 ejercicios de 20 repeticiones(30’)1- Remo2- Press de hombros3- Abdominales en máquina4- Press de piernas5- Press de banca en máquina | ||
| Observaciones | Mantener una vida físicamente activa:• Subir la escaleras de dos en dos cada vez que se sube a casa o en el trabajo.• En distancias inferiores a 30’, ir al trabajo andando.• En distancias superiores a 60’ andando, ir en bici al trabajo.• Después de las comidas quedar con un amigo para dar un paseo ligero de 30’.Beber como mínimo 8 vasos al día, y no hacer ingestas superiores a 250ml en cada toma. En días calurosos y cuando se hace AF, añadir sales y azúcares (6-7%) a la bebida y reponer el peso perdido durante la AF en las siguientes 2 horas. Mantener la bebida fresca con cubitos de hielo, a unos 10-15°C. | ||||||
Los pacientes con DM2 necesitan controlar frecuentemente los niveles de glucemia, en los que intervienen directamente el nivel de AF así como la nutrición. En este sentido hay que adaptar la ingesta alimentaria en base a las respuestas individuales al ejercicio, por lo que es apropiado el método de ensayo y error.
Aspectos relevantes a tener en cuenta en la prescripción de actividad física en individuos con diabetesHay que evitar la AF en el pico de acción de la insulina, o bien alterar la dosis para que el pico no afecte (una posible hipoglucemia) a la realización de AF. Los individuos que realizan AF de forma regular deben disminuir las dosis de insulina previa al ejercicio (efecto beneficioso). Si la AF tiene una duración menor a 30min esta disminución no es necesaria, pero en ejercicios prolongados se precisa una reducción del 20-40%. La reducción exacta depende de la duración y de la intensidad del esfuerzo, que tendrá que valorarse de forma individual. En deportes de larga duración (alpinismo, triatlón, natación de larga distancia) la inyección de insulina de rápida acción previa al ejercicio puede omitirse. No obstante, como sucede con la hipoglucemia, es muy importante así mismo controlar la hiperglucemia, ya que en esta situación se incrementarían las pérdidas de fluidos, con posible cetosis y mayor riesgo de deshidratación, con todas sus consecuencias.
Es importante monitorizar las glucemias, ya que en los deportes de resistencia de larga duración es posible que sean similares en ocasiones futuras, y en consecuencia se podrán tomar medidas adecuadas.
La hipoglucemia es uno de los problemas habituales que se presentan en los pacientes diabéticos, y por esto es importante que el ejercicio de realice en compañía. La importancia de la hipoglucemia depende de numerosos factores, tales como: concentración de glucosa plasmática antes del ejercicio, tasa de absorción de insulina en los lugares de aplicación, tiempo transcurrido de la última ingesta y composición, así como la duración e intensidad del esfuerzo. Un control adecuado de este es importante, porque la hipoglucemia puede desarrollarse incluso 12-15h después de la AF, durante la noche.
Finalmente, tanto ante este estado fisiopatológico como ante cualquier otro, el programa de entrenamiento deportivo debe ser realizado y supervisado de manera individualizada por un profesional en la materia.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.