Evaluar la eficacia y la seguridad del cambio de insulina NPH a insulina glargina en pacientes con diabetes mellitus tipo2 (DM2) atendidos en atención primaria.
Material y métodosEstudio observacional retrospectivo. Cuarenta y seis médicos de atención primaria registraron la información clínica de pacientes tratados previamente con insulina NPH que cambiaron a glargina o siguieron con NPH a los 3-9meses después de la visita de inclusión (diseño de inclusión glargina2:NPH1).
ResultadosSe analizaron 122pacientes del grupo glargina y 57 del grupo NPH (edad 67,0 [±9,8] años, 51,4% varones). Entre la visita inicial y la final se observaron reducciones de HbA1c de 1,07 (±0,93)% vs 0,28 (±0,67)% (p<0,001), y de glucemia en ayunas de 38,4 (±37,0) vs 15,7 (±28,6)mg/dl (p<0,001), entre ambos grupos. Se observó un control inadecuado (HbA1c≥7%) en la visita final en el 61,3% vs 76,8% de los pacientes, respectivamente (p=0,044). Los porcentajes de pacientes que experimentaron alguna hipoglucemia o hipoglucemias nocturnas durante el mes previo a la visita final fueron 6,6% vs 43,9% (p<0,001) y 2,5% vs 21,1% (p<0,001), respectivamente. Las variables asociadas a un buen control glucémico fueron unos valores basales de HbA1c y glucemia en ayunas más bajos, y el cambio a insulina glargina. El principal motivo para el cambio fue la ventaja de la inyección única diaria.
ConclusionesLos pacientes con DM2 atendidos en atención primaria que cambian de insulina NPH a glargina presentan una mejora significativa del control glucémico y una menor frecuencia de hipoglucemias totales y nocturnas.
To assess the efficacy and safety of insulin Glargine in the Primary Care setting for patients with type2 diabetes mellitus (DM2) previously treated with NPH insulin.
Material and methodsThis was an observational retrospective study, with 46participating Primary Care physicians, who recorded the clinical information of patients treated with NPH insulin and who switched to insulin Glargine or continued on NPH for 3-9months (inclusion design 2Glargine:1NPH).
ResultsA total of 122patients in the Glargine group, and 57patients in the NPH insulin group were evaluated; the patients had a mean age of 67.0 (9.8) years, and 51.4% were males. A difference in HbA1c reduction was seen when comparing the Glargine and NPH groups: 1.07 (0.93)% vs. 0.28 (0.67)%, respectively (P<.001); fasting plasma glucose reductions were 38.4 (37.0)mg/dl vs. 15.7 (28.6)mg/dl, respectively (P<.001). Inadequate control (HbA1c≥7%) at final visit was noted in 61.3% vs. 76.8% of patients (P=.028), respectively. Total hypoglycemic and nocturnal hypoglycemic episodes within one month prior to final visit were 6.6% vs. 43.9%, and 2.5% vs. 21.1%, respectively (P<.0001). The variables associated with better glycemic control were lower baseline HbA1c and fasting plasma glucose values, and the switch to Glargine. The main reason for change was the advantage of one injection a day.
ConclusionPatients with DM2 who are treated with NPH insulin in Primary Care and switch to Glargine show better glycemic control and experience fewer total and nocturnal hypoglycemic episodes.
La prevalencia de diabetes mellitus tipo2 (DM2) en España se ha incrementado en los últimos años, estimándose en la actualidad en cerca del 14% de la población, lo que ha convertido la atención de estos pacientes en un importante problema de salud pública en los países industrializados y emergentes1. Uno de los objetivos fundamentales del manejo de la DM2 es el control de los niveles de glucemia, que ha demostrado reducir la tasa de complicaciones microvasculares2. Las medidas modificadoras del estilo de vida constituyen uno de los pilares fundamentales del control de las concentraciones de glucemia y hemoglobina glucosilada (HbA1c) en la DM2, pero en muchos pacientes se requiere la introducción de la terapia farmacológica. A pesar de conseguir inicialmente una reducción en las concentraciones de HbA1c con antidiabéticos orales, no se alcanza el objetivo de unos niveles inferiores al 7,0% en el 40-60% de los pacientes después de unos años de tratamiento2,3. Para mejorar el control del paciente diabético, las recomendaciones actuales consideran que el manejo del paciente se ha de efectuar en el contexto de las necesidades, preferencias y tolerabilidad de cada paciente, resaltando que la individualización del tratamiento es el punto esencial de su éxito4.
En los pacientes con DM2, la pérdida progresiva de la función de la célula β-pancreática hace necesario que a lo largo de su vida en muchas ocasiones se requiera el tratamiento con insulina5. Inicialmente se aconseja la administración única diaria de insulina de acción intermedia Neutral Protamine Hagedorn (NPH) o insulinas de acción prolongada, como la insulina glargina o la insulina detemir4. Sin embargo, la insulina glargina tiene un perfil de absorción más predecible que la insulina NPH durante las 24h y con una menor tasa de hipoglucemias diurnas y nocturnas6. El tratamiento con insulina forma parte del arsenal terapéutico que en atención primaria (AP) se dispone para el tratamiento de la diabetes, y cada vez más es utilizada por un mayor número de médicos. En un estudio aparecido recientemente efectuado en el ámbito de la AP, en donde se evalúa el control glucémico y los factores de riesgo cardiovascular en cerca de 300.000pacientes diabéticos, se aprecia que el 23,4% de los mismos están con insulinoterapia7, siendo el tratamiento basal el más utilizado en este colectivo. Por otra parte, en un reciente estudio efectuado en nuestro entorno y en Europa, se aprecia que el reporte de hipoglucemias sintomáticas por parte del paciente es importante y se asocia a una baja satisfacción con el tratamiento por parte del paciente y a una mala adherencia8. Finalmente, señalar que la insulina glargina añadida de manera temprana a metformina aporta mayores reducciones de HbA1c, con un menor incremento de peso y menos hipoglucemias diurnas y nocturnas que cuando se añade a la asociación de sulfonilurea+metformina, a pesar de recibir dosis superiores de insulina9.
El objetivo del presente estudio es evaluar en condiciones de práctica clínica habitual en el ámbito de la asistencia primaria el efecto sobre las concentraciones de HbA1c y glucemia en ayunas (GA), y la seguridad representada por el porcentaje de pacientes que presentaron algún episodio de hipoglucemia, en pacientes con DM2 atendidos en AP tratados con insulina glargina tras el cambio desde insulina NPH en comparación con un grupo control de pacientes que siguieron con el tratamiento con NPH.
Material y métodosEstudio observacional multicéntrico retrospectivo en el que se incluyeron pacientes con DM2 mayores de 18años tratados con insulina NPH. Se excluyeron pacientes tratados con otras insulinas, con diabetes gestacional y pacientes hospitalizados. El estudio se ha llevado a cabo en centros de AP españoles, y cada investigador debió registrar la información clínica de 6pacientes. Para el grupo de estudio cada investigador reclutó de manera consecutiva 4pacientes tratados un mínimo de 3meses con insulina NPH a los que el tratamiento se había cambiado a insulina glargina, y para el grupo control 2pacientes tratados un mínimo de 6meses con insulina NPH. Los investigadores recogieron información retrospectiva de los registros clínicos en 2puntos, a los que se han llamado visita basal (VB) y visita final (VF). La VB corresponde, para los pacientes del grupo insulina glargina, al momento en que los pacientes cambiaron de insulina NPH a insulina glargina, y para el grupo insulina NPH, al corte en el que se inicia la recogida de datos. La VF para ambos grupos es la información que consta entre 3 y 9meses después de la obtenida en la VB. En la VB se recogieron datos demográficos y clínicos relacionados con la DM2. En las VB y VF se recogieron las concentraciones de Hb1Ac y GA, peso y datos concernientes al tratamiento. En la VF se examinaron el número y la severidad de las hipoglucemias, el número de hipoglucemias nocturnas y el tratamiento concomitante que constaban registrados en la historia clínica en el mes anterior. Además, en el grupo insulina glargina se recogió el motivo del cambio de insulina.
Objetivos del estudioLa variable principal del estudio fue el grado de control evaluado mediante la HbA1c expresado: a)como el cambio en la concentración de la HbA1c entre las VB y VF en ambos grupos; b)como el porcentaje de pacientes controlados estableciendo como punto de corte de la HbA1c en 7,0%, y c)estableciendo el punto de corte de la HbA1c en 6,5%. Las variables secundarias fueron: a)motivo que registraron los médicos para efectuar el cambio de insulina NPH a insulina glargina; b)nivel de GA al final del tratamiento; c)grado de control de GA escogiendo como puntos de corte una GA<90mg/dl, una GA entre 90-130 y una GA>130mg/dl; d) la seguridad evaluada mediante la presencia de hipoglucemias totales y de hipoglucemias nocturnas el mes anterior a la VF, y e)qué variables se relacionan con el control glucémico del paciente, definido como una HbA1c inferior al 7,0% y como una GA entre 70-130mg/dl.
Análisis estadísticoEn la descripción de variables continuas se han utilizado la media y la desviación estándar (DE), y en las variables continuas principales se ha añadido la mediana y los cuartiles. Para la descripción de variables categóricas se han utilizado el número y el porcentaje de pacientes por categoría de respuesta. El análisis comparativo de las variables entre los grupos insulina glargina e insulina NPH se ha realizado mediante la prueba ANOVA en variables continuas, o su equivalente no paramétrico, y la prueba de chi-cuadrado de tendencia lineal (prueba de Mantel-Haenszel) al analizar variables de tipo categórico. En las comparaciones posthoc con variables de más de 2categorías se ha utilizado la prueba de Bonferroni, basada en el estadístico t de Student y que corrige el nivel de significación observado por el hecho de que se realizan comparaciones múltiples. En todas las pruebas estadísticas realizadas con las variables de resultado se ha utilizado un nivel de significación estadística (p) de 0,05. Para el cálculo del tamaño muestral se ha considerado que la diferencia mínima esperada entre insulina glargina e insulina NPH sobre el cambio de HbA1c sería 0,4% a favor de insulina glargina. Con un riesgo α (prueba bilateral) del 5%, una potencia del 90%, una DE del 1% en ambas mediciones y un ratio de 2:1 debido al menor número de hipoglucemias esperadas en el grupo insulina glargina, el número de pacientes necesarios en el estudio sería de 200 en el grupo insulina glargina y de 100 en el grupo insulina NPH.
Para el cálculo de la variable principal se han comparado las medias de HbA1c entre ambos grupos mediante la prueba t de Student para muestras independientes, y se han estratificado los niveles de HbA1c de las VB y VF según los puntos de corte 6,5 y 7,0%. Para identificar los factores relacionados con el control glucémico (HbA1c<7% y GA<130mg/dl) se han utilizado modelos de regresión logística incluyendo como variables independientes características relacionadas con la DM2, como la edad, el género, el IMC, el grado de obesidad, el tiempo desde el diagnóstico de DM2, el tiempo de insulinización, el tipo de insulina (glargina o NPH) y el grado de HbA1c basal (valor de la VB). En primer lugar se ha realizado un análisis bivariante para determinar la relación de las variables sociodemográficas y clínicas con el control glucémico. Las variables que presentaron una p<0,05, así como las que se consideraron clínicamente relevantes para determinar el control de la HbA1c, se han incluido como variables independientes en el modelo de regresión logística para el control glucémico (HbA1c y GA). El modelo de regresión logística se ha obtenido a partir de la metodología stepwise para seleccionar las variables independientes, usando el criterio del valor de p<0,01 para incluir las variables en el modelo y un valor de p>0,05 para excluirlas. El análisis de los factores que determinan el control glucémico se ha realizado con y sin ajuste según covariables como el género y el tiempo de evolución de la enfermedad, mediante modelos de regresión logística. Los resultados se han presentado con razones de posibilidades (odds ratio) ajustadas y sin ajustar. Las variables independientes del modelo de regresión logística que han sido significativas se han incluido en el modelo multivariante.
El protocolo del estudio fue aprobado por el Comitè Ètic d’Investigació Clínica (CEIC) Parc de Salut-Mar de Barcelona, con fecha 15 de noviembre de 2010.
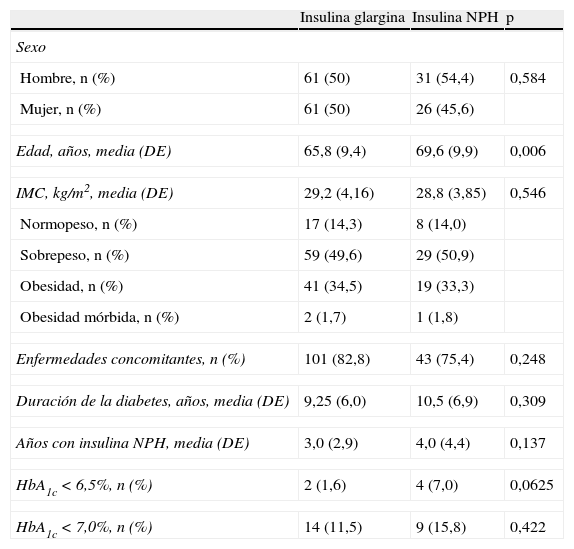
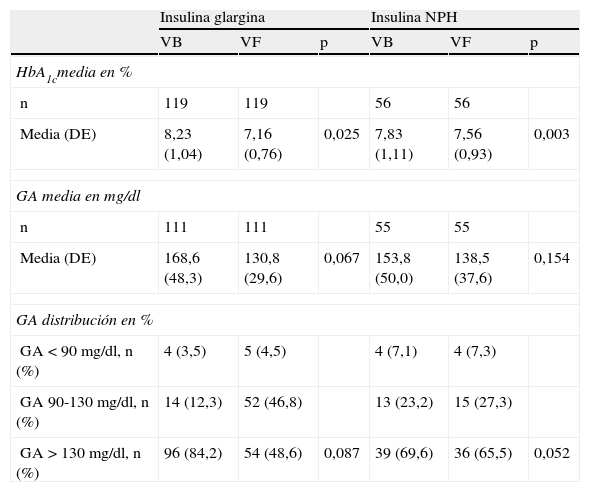
ResultadosDatos basales de los gruposParticiparon en el estudio 46médicos de AP que incluyeron un total de 274pacientes con DM2, de los cuales se excluyeron 95 por no recogerse la información de la VF en el intervalo de tiempo establecido (3-9meses) o por no cumplir los períodos mínimos de tratamiento con las insulinas estudiadas. Fueron evaluables para el estudio 179pacientes, de 67,0 (9,8) años, 51,4% varones y 48,6% mujeres. Ciento veintidós pacientes correspondieron al grupo insulina glargina (68,2%) y 57 al grupo insulina NPH (31,8%). Las características demográficas, antropomorfométricas, enfermedades concomitantes, y antecedentes de DM2 e insulinización de ambos grupos se recogen en la tabla 1, en donde no se aprecian diferencias estadísticamente significativas, a excepción de la edad, que es mayor en los pacientes asignados al grupo insulina NPH respecto al grupo insulina glargina [media (DE)]: 69,6 (9,9) años frente a 65,8 (9,4) años; p=0,006. No se encontraron diferencias en el porcentaje de pacientes con HbA1c por encima o debajo de 6,5 o 7,0% entre ambos grupos (tabla 1). La dosis de insulina total (mediana y límites) fue de 30 (8-80)UI en el grupo insulina glargina y 39 (12-80) en el grupo insulina NPH. El 68,7% de los pacientes del estudio recibían conjuntamente con la insulina tratamiento combinado con antidiabéticos orales, siendo los más frecuentes las metformina (93,5% de los pacientes con antidiabéticos orales) y la sulfonilurea (24,4%). El 80,4% de los pacientes tomaban otros fármacos (diferentes de los del control metabólico de la DM2), siendo los más frecuentes los que actúan sobre el sistema renina-angiotensina (52,5%), los hipolipemiantes (48,0%) y los antiagregantes (38,5%). Los niveles basales de HbA1c [media (DE)] fueron 8,23 (1,04)% en el grupo insulina glargina y 7,83 (1,11)% en el grupo insulina NPH (p=0,025), y los de GA fueron 168,6 (48,3)mg/dl en el grupo insulina glargina y 153,8 (50,08)mg/dl en el grupo insulina NPH (p=0,067). Se observó una tendencia a presentar glucemias mayores a 130mg/dl en el grupo insulina glargina (p=0,087) (tabla 2).
Características basales de los pacientes estudiados
| Insulina glargina | Insulina NPH | p | |
| Sexo | |||
| Hombre, n (%) | 61 (50) | 31 (54,4) | 0,584 |
| Mujer, n (%) | 61 (50) | 26 (45,6) | |
| Edad, años, media (DE) | 65,8 (9,4) | 69,6 (9,9) | 0,006 |
| IMC, kg/m2, media (DE) | 29,2 (4,16) | 28,8 (3,85) | 0,546 |
| Normopeso, n (%) | 17 (14,3) | 8 (14,0) | |
| Sobrepeso, n (%) | 59 (49,6) | 29 (50,9) | |
| Obesidad, n (%) | 41 (34,5) | 19 (33,3) | |
| Obesidad mórbida, n (%) | 2 (1,7) | 1 (1,8) | |
| Enfermedades concomitantes, n (%) | 101 (82,8) | 43 (75,4) | 0,248 |
| Duración de la diabetes, años, media (DE) | 9,25 (6,0) | 10,5 (6,9) | 0,309 |
| Años con insulina NPH, media (DE) | 3,0 (2,9) | 4,0 (4,4) | 0,137 |
| HbA1c<6,5%, n (%) | 2 (1,6) | 4 (7,0) | 0,0625 |
| HbA1c<7,0%, n (%) | 14 (11,5) | 9 (15,8) | 0,422 |
DE: desviación estándar; IMC: índice de masa corporal.
Cambios en los valores de HbA1c y de glucosa plasmática entre las visitas basal y final
| Insulina glargina | Insulina NPH | |||||
| VB | VF | p | VB | VF | p | |
| HbA1cmedia en % | ||||||
| n | 119 | 119 | 56 | 56 | ||
| Media (DE) | 8,23 (1,04) | 7,16 (0,76) | 0,025 | 7,83 (1,11) | 7,56 (0,93) | 0,003 |
| GA media en mg/dl | ||||||
| n | 111 | 111 | 55 | 55 | ||
| Media (DE) | 168,6 (48,3) | 130,8 (29,6) | 0,067 | 153,8 (50,0) | 138,5 (37,6) | 0,154 |
| GA distribución en % | ||||||
| GA <90mg/dl, n (%) | 4 (3,5) | 5 (4,5) | 4 (7,1) | 4 (7,3) | ||
| GA 90-130mg/dl, n (%) | 14 (12,3) | 52 (46,8) | 13 (23,2) | 15 (27,3) | ||
| GA >130mg/dl, n (%) | 96 (84,2) | 54 (48,6) | 0,087 | 39 (69,6) | 36 (65,5) | 0,052 |
DE: desviación estándar; GA: glucosa plasmática en ayunas; VB: visita basal; VF: visita final.
Las concentraciones de HbA1c en los 2grupos en las visitas VB y VF se recogen en la tabla 2. Los valores de HbA1c media de la VF fueron del 7,16 y del 7,56% para glargina y NPH, respectivamente; p<0,01. La diferencia de HbA1c entre las VB y VF en el grupo insulina glargina fue de 1,07 (0,93)% (IC95%: 0,9-1,2) y en el grupo insulina NPH fue de 0,28 (0,67)% (IC95%: 0,7-1,0); p<0,001 (entre ambos grupos). El porcentaje de pacientes con un control inadecuado de la HbA1c escogiendo el punto de corte en el 7,0% o superior es en la VB del 88,5% en el grupo insulina glargina y del 84,2% en el grupo insulina NPH (p=0,422), y en la VF del 61,3 y del 76,8%, respectivamente (p=0,044). Al considerar un control inadecuado de la HbA1c escogiendo como punto de corte 6,5% o superior, se encontraron en la VB el 98,4% de los pacientes en el grupo insulina glargina y el 93,0% en el grupo insulina NPH (p=0,063), y en la VF el 79,8 y el 92,9% de los pacientes, respectivamente (p=0,028). La dosis de insulina total en la VF (mediana y rango) no varió respecto a la VB: 30 (10-108)UI en el grupo insulina glargina y 39 (12-75)UI en el grupo insulina NPH. El porcentaje de pacientes en tratamiento con antidiabéticos orales no varió durante el período de estudio, el 65,4% de los pacientes continuaban con antidiabéticos orales conjuntamente con la insulina, siendo la metformina (93,2% de los pacientes) y la sulfonilurea (22,2%) los más frecuentes.
Variables secundarias- 1.
El motivo o motivos más importantes que registraron los médicos para cambiar de insulina NPH a insulina glargina fueron: requerir una sola inyección diaria en el 63,1% de los pacientes, por falta de eficacia de la insulina NPH en el 49,2%, por presentar hipoglucemias diurnas en el 32% y por presentar hipoglucemias nocturnas en el 27%.
- 2.
Los datos sobre la GA se recogen en la tabla 2, en donde se aprecian niveles significativamente más elevados en el grupo insulina glargina en la VB. La diferencia de GA entre la VB y la VF en el grupo insulina glargina fue de 38,4 (37,0)mg/dl (IC95%: 31,4-45,3), y en el grupo insulina NPH fue de 15,7 (28,6)mg/dl (IC95% 8,0-23,4); p<0,001 (entre ambos grupos).
- 3.
El porcentaje de pacientes con niveles de GA controlados según el nivel de corte <90mg/dl, entre 90-130mg/dl y >130mg, tanto en la VB como en la VF, se recoge también en la tabla 2, en donde se aprecia una mayor proporción de pacientes con una GA>130mg/dl en el grupo insulina glargina respecto al grupo insulina NPH, en la VB (p=0,087), y una mayor proporción en el grupo insulina NPH respecto al grupo insulina glargina en la VF (p=0,052), ambos en el límite de la significación estadística.
- 4.
El número (porcentaje) de pacientes que presentaron alguna hipoglucemia el mes previo a la VF fueron 8 (6,6%) en el grupo insulina glargina y 25 (43,9%) en el grupo insulina NPH (p<0,0001). Estas diferencias también fueron significativas al agruparlas en hipoglucemias sintomáticas (4,1% vs 33,3%; p<0,0001) y asintomáticas (3,3% vs 21,1%; p<0,0001), pero no para las hipoglucemias severas (0,0% vs 1,8%; p=0,142). En cuanto al número (porcentaje) de pacientes que presentaron alguna hipoglucemia nocturna en el mes previo a la VF fueron 3 (2,5%) en el grupo insulina glargina y 12 (21,1%) en el grupo NPH (p<0,0001); estas diferencias también fueron significativas al agruparlas en pacientes con alguna hipoglucemia sintomática (1,6% vs 17,5%; p<0,0001) o asintomática (0,8% vs 10,5%; p=0,002). No se presentaron hipoglucemias nocturnas severas en ninguno de los 2grupos.
- 5.
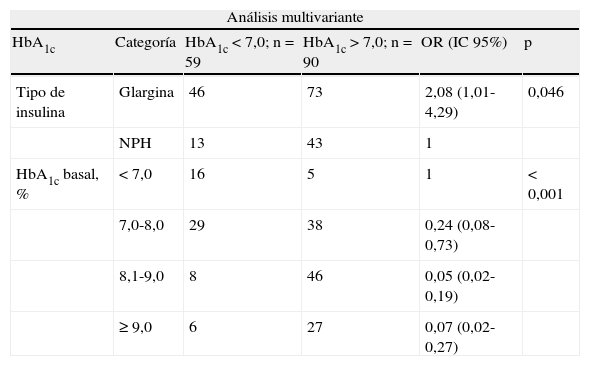
Las variables relacionadas significativamente con el control glucémico (HbA1c y GA) del paciente en el análisis multivariante se recogen en la tabla 3. El control glucémico definido como una HbA1c<7,0% solo se ha relacionado con los valores elevados de HbA1c en la VB y con el grupo insulina a la que pertenece el paciente, de manera que a medida que aumentan los niveles de HbA1c es menos probable estar controlado a los 3meses, y el cambio a insulina glargina supone una mayor probabilidad de estar controlado en la VF. En el modelo multivariante se han incluido a la HbA1c basal (OR: 0,389; IC95%: 0,25-0,60; p<0,0001) y al grupo insulina glargina (OR: 3,375; IC95%: 1,51-7,55; p=0,003). Se aprecia que por cada unidad de más de HbA1c en la VB la probabilidad de estar controlado es de 0,39 veces inferior, o visto desde otra perspectiva, por cada punto menos de HbA1c que se tiene en la VB, se aumenta la probabilidad 2,57 veces de tener una HbA1c inferior a 7%. El control glucémico definido como una GA<130mg/dl (tabla 3) se ha relacionado con un menor tiempo de evolución de la DM2, con el cambio a insulina glargina y con una concentración de glucemia en la VB no muy elevada. En el modelo multivariante se han incluido la GA en la VB (OR: 0,962; IC95%: 0,95-0,98; p<0,0001), el grupo insulina glargina (OR: 4,347; IC95%: 1,80-10,54; p=0,001) y los años de evolución de la DM2 (OR: 0,908; IC95%: 0,85-0,97; p=0,005). Por el hecho de cambiar a insulina glargina se aumenta 4,3 veces la probabilidad de presentar cifras de glucemia inferiores a 130mg/dl.
Tabla 3.Factores significativamente relacionados con un control glucémico adecuado para valores de HbA1c<7% y de glucemia en ayunas <130mg/dl
Análisis multivariante HbA1c Categoría HbA1c<7,0; n=59 HbA1c>7,0; n=90 OR (IC95%) p Tipo de insulina Glargina 46 73 2,08 (1,01-4,29) 0,046 NPH 13 43 1 HbA1c basal, % <7,0 16 5 1 <0,001 7,0-8,0 29 38 0,24 (0,08-0,73) 8,1-9,0 8 46 0,05 (0,02-0,19) ≥9,0 6 27 0,07 (0,02-0,27) Glucemia en ayunas (GA) Categoría GA <130; n=76 GA ≥130; n=90 OR (IC95%) p Duración de la diabetes (años) 0-5 17 16 2,36 (0,98-5,70) 0,021 5-10 40 33 2,69 (1,31-5,55) >10 18 40 1 Tipo de insulina Glargina 57 54 2,00 (1,03-3,90) 0,042 NPH 19 36 1 Glucemia basal, mg/dl <90 3 1 0,36 (0,03-4,66) <0,001 90-130 25 3 1 ≥130 48 86 0,07 (0,02-0,23) IC95%: intervalo de confianza del 95%; OR: odds ratio (cociente de riesgo).
Las variables escogidas en el modelo de regresión logística han sido la edad, el género, años con DM, años insulinizado, el IMC, la HbA1c y la glucemia plasmática en ayunas (GA), los antidiabéticos orales y el motivo del cambio a insulina glargina. Solo se muestran las variables estadísticamente significativas.
En el presente estudio retrospectivo efectuado en pacientes con DM2 atendidos en AP que están en tratamiento con insulina NPH, se observa que 3-6meses después de cambiar a insulina glargina se mejora el control de la HbA1c y de la GA, con un menor número de hipoglucemias totales e hipoglucemias nocturnas, sin que se modificaran significativamente las dosis totales diarias de insulina o el uso concomitante de antidiabéticos orales. Los factores que determinan un mejor control son el propio cambio a insulina glargina y valores menores de GA y de HbA1c. Así mismo, los motivos más importantes que consideran los médicos para cambiar de insulina NPH a insulina glargina fueron la ventaja de una sola inyección diaria, el control insuficiente con insulina NPH y presentar hipoglucemias. En los pacientes que cambian a insulina glargina se consigue una reducción de algo más de un punto porcentual, mientras que en los pacientes que continúan con insulina NPH el cambio apenas es de un cuarto de punto. En la mayoría de estudios controlados aleatorizados en los que se ha comparado insulina glargina frente a insulina NPH no se han detectado diferencias en la eficacia entre los 2tipos de insulina10-13. Sin embargo en un estudio observacional efectuado en consultas endocrinológicas de nuestro medio se ha podido apreciar una mejora con el cambio de NPH a glargina14. También se ha descrito en un ensayo clínico aleatorizado una mayor eficacia de insulina glargina frente a insulina NPH en los pacientes mayores de 65años15. En el presente estudio la edad de los pacientes del grupo insulina NPH es mayor que la de los pacientes del grupo insulina glargina, pero el análisis multivariante no ha detectado que la edad sea una variable determinante en el control de la HbA1c y de la GA en el grupo insulina glargina. Una posible explicación a la mejora en el control glucémico observada podría residir en la menor incidencia de hipoglucemias, pues es habitual observar en la práctica clínica que los pacientes las corrigen con un aporte excesivo de hidratos de carbono, lo que comportaría hiperglucemias reactivas y mantenidas, lo que a su vez puede contribuir a la elevación de la HbA1c. Una vez corregidas las hipoglucemias suele mejorar el control glucémico. La hipoglucemia tiene también un impacto en la calidad de vida de los pacientes. Así, el miedo a sufrir nuevos episodios es un impedimento para conseguir un control glucémico óptimo, pero también comporta una peor puntuación en los cuestionarios de calidad de vida, ansiedad y depresión, una menor satisfacción con el tratamiento y una menor adherencia al tratamiento8,16,17.
Recientemente la American Diabetes Association (ADA) y la European Association for the Study of Diabetes (EASD) han consensuado una nueva propuesta para el tratamiento escalonado farmacológico de la DM2, en donde se contempla el inicio de la insulinoterapia en el paciente diabético ya en un segundo escalón, cuando la metformina en monoterapia no es suficiente4. No obstante, varios son los obstáculos que percibe el médico para iniciar la insulinización del paciente y la subsecuente optimización, como el riesgo de hipoglucemia18, preocupación por el número de inyecciones diarias19 y la posibilidad de que empeore la calidad de vida20. De hecho, en el presente estudio el requerir más de una inyección diaria de insulina, y la posibilidad de hipoglucemias, constituyen los motivos más importantes, junto con la falta de eficacia de la insulina NPH, para que el médico de AP haya considerado el cambio a insulina glargina. Estos obstáculos que percibe el médico retarda en muchos casos el inicio de la insulinización, cuando muchos pacientes podrían beneficiarse de ella21. En el presente estudio, los pacientes que cambiaron de insulina NPH a insulina glargina presentaron casi 7veces menos hipoglucemias que los que siguieron con insulina NPH, ya fueran sintomáticas o no. En prácticamente todos los estudios controlados es constante la reducción de hipoglucemias totales con insulina glargina respecto a insulina NPH8-11. Sin embargo, cabe resaltar que la importancia de las hipoglucemias se pone de manifiesto más allá de los ensayos controlados aleatorizados en los estudios observacionales efectuados en condiciones de práctica clínica habitual. Así, en el ámbito de la asistencia endocrinológica el estudio LAUREL ha puesto de manifiesto una mejora en el control glucémico al cambiar de insulina NPH a insulina glargina13, y en el ámbito de la AP el estudio RESCUE destaca que el cambio a insulina glargina, en combinación con antidiabéticos orales, mejora el control glucémico con menos hipoglucemias22. La importancia de este hecho no solo radica en el impacto que ello supone para la calidad de vida del paciente, sino también sobre el pronóstico de la enfermedad a medio-largo plazo. Así, un control estricto de la HbA1c (<6,0%) se ha asociado a un aumento de la mortalidad total23, y una posible explicación de ello es precisamente la mayor tasa de hipoglucemias graves6. Las hipoglucemias son más frecuentes en los pacientes ancianos, pues pueden generar no solo arritmias, sino también alteraciones de la conducta o la conciencia y mareos que pueden comportar caídas, confusión o infecciones por aspiración nocturna24; de ahí que muy recientemente se matice el control estricto de la DM2, intentando individualizar el tratamiento y tomando precauciones en subpoblaciones de pacientes de riesgo elevado, como los ancianos3,25. En el presente estudio, las dos terceras partes de los pacientes recibían antidiabéticos orales concomitantemente con la insulina, siendo el más prescrito en la mayoría de los pacientes la metformina, lo cual está en consonancia con las guías actuales. Está bien documentado que la combinación de insulina con metformina reduce el posible incremento de peso que se ha descrito con la insulina en monoterapia26. Por otra parte, la adición de insulina glargina a un tratamiento con antidiabéticos orales produce menos hipoglucemias o hipoglucemias sintomáticas que cuando se introduce insulina prandial27.
Otro aspecto relevante que cabe mencionar del presente estudio es la reducción en la GA al cambiar de insulina NPH a insulina glargina, de 38,4mg/dl, mientras que en los pacientes que siguen con insulina NPH es de tan solo 15,7mg/dl. Se ha establecido recientemente que cuando las concentraciones de HbA1c son superiores al 7,0% a pesar del tratamiento, la hiperglucemia basal es la que determina la exposición a la hiperglucemia para un amplio margen de concentraciones de HbA1c28, por lo que las guías actuales consideran que el control de la hiperglucemia en ayunas con insulina basal es prioritario, y una vez conseguido este, se debe abordar el control de la hiperglucemia posprandial4. El análisis multivariante efectuado para valorar las variables relacionadas con el control metabólico de la DM2 en los pacientes del presente estudio, definido como una HbA1c<7,0%, ha señalado solo a las concentraciones de HbA1c y al hecho de cambiar a insulina glargina como los factores que van a determinar un mejor control 3-9meses después. El análisis multivariante resalta la fiabilidad de los datos al ser precisamente el control de la concentración de HbA1, definida en la variable principal, y el cambio de insulina glargina, definido como objetivo secundario en el planteamiento del estudio, las únicas variables que alcanzan significación estadística (p<0,0001 y p=0,046, respectivamente). Al estimar el control de la DM2 como el nivel de GA, se incorpora esta entre las variables significativas, definida también entre los objetivos del estudio.
El presente estudio presenta varias limitaciones tanto en su diseño como en la selección de los grupos, que conviene considerar al interpretar los resultados. La principal limitación es el propio diseño observacional, y por tanto no hubo asignación aleatoria ni tampoco se definió un protocolo a seguir para proceder al cambio de tratamiento, que se realizó en condiciones de práctica habitual. Como consecuencia de la ausencia de aleatorización, los grupos no fueron homogéneos en cuanto a edad y niveles de HbA1c iniciales y, dado que el motivo principal del cambio fue la preferencia de la dosis única, cabe esperar una disposición favorable de los pacientes en los que se produjo el cambio, con un posible sesgo a favor de las ventajas frente a los inconvenientes de la nueva pauta. Así por ejemplo, en el caso de las hipoglucemias, al ser recogidas retrospectivamente de la historia clínica no se puede garantizar que fueran interrogadas exhaustivamente y/o registradas de manera homogénea por todos los investigadores. También el tiempo hasta el primer valor de la HbA1c tras el cambio fue variable, lo que puede afectar a la comparabilidad de los resultados. Finalmente, el tamaño de la muestra evaluada fue inferior a lo previsto por incumplimiento de los criterios de inclusión. Todas estas limitaciones son comunes a los estudios observacionales y deben ser tenidas en cuenta a la hora de contextualizar los resultados.
En conclusión, en pacientes con DM2 atendidos en AP según práctica clínica habitual que están en tratamiento con insulina NPH, a los 3-9meses de efectuar el cambio a insulina glargina se aprecia una mejoría significativa en el control de la HbA1c y de la GA, y una reducción en el número de hipoglucemias totales y nocturnas. Entre los factores más importantes relacionados con un mejor control glucémico hay que resaltar el propio cambio a insulina glargina y unas concentraciones previas menos elevadas de HbA1c. Los motivos más importantes para cambiar de insulina NPH a insulina glargina fueron la ventaja de una sola inyección diaria de insulina, la falta de eficacia de insulina NPH y la presencia de hipoglucemias con esta última.
FinanciaciónEstudio financiado por Sanofi-Aventis España.
Conflicto de interesesMM-C ha recibido honorarios de Astra-Zeneca, Bayer, Boehringer Ingelheim, BMS, Esteve, GSK, Lilly, Menarini, Merck, MSD, Novartis, Novonordisk, Sanofi y Servier por cursos y conferencias sobre el tratamiento de la diabetes y ha participado en Advisory Boards de Sanofi.
A todos los médicos participantes en el estudio (grupo LAURA), sin cuya colaboración hubiera sido imposible la realización del estudio (ver anexo 1). A Gracia Romero y a Gloria Barberá, del departamento médico de Sanofi-Aventis España, por su colaboración en la discusión y la elaboración del manuscrito, y a Josep Mora por su ayuda en la redacción del manuscrito. La recogida y análisis de los datos fue realizada por IMS Health.
Alcaraz Ferrer, Enriqueta; Aliaga Ugarte, Mercedes; Aguiló Rovira, Ángel; Aguirre Rodríguez, Juan Carlos; Baillo Falo, M. Pilar; Beltrán Juana, José; Camacho de las Heras, Enrique; Carmona Carmona, Juan; Carrasco Mas, Amparo; Carrasco Martín, José Luis; Carrillo Blanchar, Manuel; Carrillo Carreño, Jerónimo; Castellanos Rodríguez, Antonio; Cereto Castro, Fernando; Comerma i Barceló, Josep; Costa Pinel, Bernardo; Del Valle Pelayo, Juan José; Gálvez Ramírez, Antonio; García Paz, Francisco Javier; Goday Arno, Alberto; Guerri Fernández, Roberto Carlos; Guzmán Jiménez, José; Huete Martos, Andrés; López Aguilar, Javier; López Simarro, Flora; Marco Segarra, Emilio; Marín Gallardo, Fernando; Mejuto Bernabé, Francisco José; Monreal Mauri, Inmaculada; Ordóñez Sánchez, Xavier; Ortega Carpio, Antonio; Pirozzo, Hernán Gerardo; Puche Manaut, Antonio; Rodríguez Moreno, M. José; Rubio Muñoz, Felisa; Salvadó Vives, Sergio; Sánchez Apresa, Juan Manuel; Santamaría Mas, Santiago; Serra Cabot, Pere; Tarragó Sala, Eduard; Tortosa Hernández, José María; Torrecillas Cabrera, Francisco Javier; Torregrosa Roig, Mireia, y Trias Vilagut, Ferran.