En pacientes con diabetes tipo 2, la cirugía bariátrica permite conseguir la remisión de la diabetes o una importante mejoría del control metabólico. Muchos endocrinólogos son reticentes a aconsejarla, incluso en los pacientes con diabetes y un IMC >35kg/m2, esgrimiendo para ello la falta de estudios de calidad, la percepción de que la cirugía no es más que un medio para motivar al paciente a modificar unos hábitos de vida poco saludables, y los riesgos inherentes a la cirugía bariátrica. Por el contrario, para el cirujano la diabetes tipo 2 es una enfermedad operable independientemente del IMC del paciente. En esta revisión discutimos los datos disponibles sobre la evolución de pacientes con un IMC por encima o por debajo de 35kg/m2. Los datos sugieren que la cirugía bariátrica podría considerarse como una opción en el algoritmo terapéutico de la diabetes tipo 2 en pacientes con un IMC >35kg/m2. Dado el carácter epidémico del aumento de la diabetes tipo 2, es muy poco probable que la cirugía se convierta en el tratamiento de elección. De todos modos, si los estudios lo demuestran, también podría ser una opción para pacientes seleccionados con un IMC entre 30 y 35kg/m2.
Remission of type 2 diabetes or a marked improvement of the metabolic control could be accomplished after bariatric surgery. Most endocrinologists are reluctant to recommend bariatric surgery to type 2 diabetic patients with a BMI >35kg/m2 based on: lack of high quality data, perception that surgery offers nothing but a motivation to change the unhealthy lifestyle habits, and inherent risks of bariatric surgery. In contrast, from the surgeon's perspective, type 2 diabetes is a surgical disease irrespective of the BMI prior to surgery. In this review, we discuss the available data on the diabetes outcomes for patients with a BMI above or below the 35kg/m2 threshold. Data would suggest that bariatric surgery should be considered as an option in the therapeutic algorithm of the type 2 diabetic patient with a BMI >35kg/m2. Given the expanding nature of the type 2 diabetes epidemics, it is very unlikely that surgery will become the treatment of choice for type 2 diabetes. Nonetheless, future studies should demonstrate if it could be also a valuable tool also for selected patients with a BMI between 30 and 35kg/m2.
diabetes tipo 2
hemoglobina glucosilada
índice de masa corporal
Swedish Obese Subjects.
¿Tratar quirúrgicamente la diabetes? La respuesta es diametralmente opuesta si se pregunta a un endocrinólogo o a un cirujano. Los algoritmos de tratamiento de la diabetes tipo 2 (DM2) de las principales sociedades científicas médicas relacionadas con la diabetes no plantean la opción quirúrgica1. Por primera vez, en la edición de 2010, la American Diabetes Association propone el tratamiento quirúrgico como una opción que considerar en los pacientes con DM2 y un índice de masa corporal (IMC) >35kg/m2, de manera especial si médicamente resultan difíciles de controlar la hiperglucemia u otras comorbilidades asociadas; aun así, no lo incluye en la figura del algoritmo terapéutico2. Por el contrario, para un cirujano la diabetes tipo 2 es una enfermedad operable. Ya desde 1991, las guías de tratamiento para la obesidad recogen que la cirugía es una opción para pacientes con un IMC >35kg/m2 si presentan comorbilidades asociadas, como la DM2, sin hacer mención expresa de las dificultades para su control3. Para el cirujano la cirugía ofrece la posibilidad de remisión de la DM2 y este efecto no se limita a los pacientes con IMC >35kg/m2. ¿A quién da la razón la evidencia científica? ¿Cuál es, si existe, el punto medio?
Cirugía bariátrica en pacientes con diabetes tipo 2 con IMC >35kg/m2El endocrinólogo considera a menudo la opción quirúrgica como el último eslabón terapéutico. La DM2 es una enfermedad crónica para la que disponemos de múltiples fármacos. Sólo después del fracaso del tratamiento médico, incluso en el paciente con IMC >35kg/m2, debería plantearse la cirugía. Genéricamente, ello corresponde a un paciente de más de 50 años, con un tiempo de evolución de su diabetes superior a 10 años y, por definición, en tratamiento con insulina, en el que no se ha conseguido una hemoglobina glucosilada (HbA1c) <7%4. En el metaanálisis de Buchwald et al., al que desde el ámbito quirúrgico se alude como demostrativo de la remisión de la DM2 tras la cirugía, la tasa de remisión de la diabetes en el conjunto de la población analizada (aproximadamente 8.000 pacientes) fue del 78,1%5. Esta tasa varió en función de la técnica quirúrgica (banda gástrica ajustable, 56,5%; bypass gástrico, 80,3%; derivación biliopancreática, 95,1%). Además, los resultados fueron similares cuando se analizó la tasa de remisión en los estudios con menos o más de 2 años de seguimiento. Aunque a primera vista estos resultados parecen espectaculares, no contestan a la pregunta que plantea el endocrinólogo. En el metaanálisis de Buchwald et al., la edad media de los pacientes fue de 40 años y no se dan datos sobre el tiempo de evolución de la DM2, el tipo de tratamiento ni el grado de control metabólico5. En una revisión sistemática, Vetter et al. concluyen que la mayor parte de los estudios que reportan resolución de la DM2 tras cirugía tienen problemas metodológicos importantes6. Muy pocos son los estudios aleatorizados y con grupo control, y en muchos de ellos hay un elevado porcentaje de pacientes perdidos durante el seguimiento.
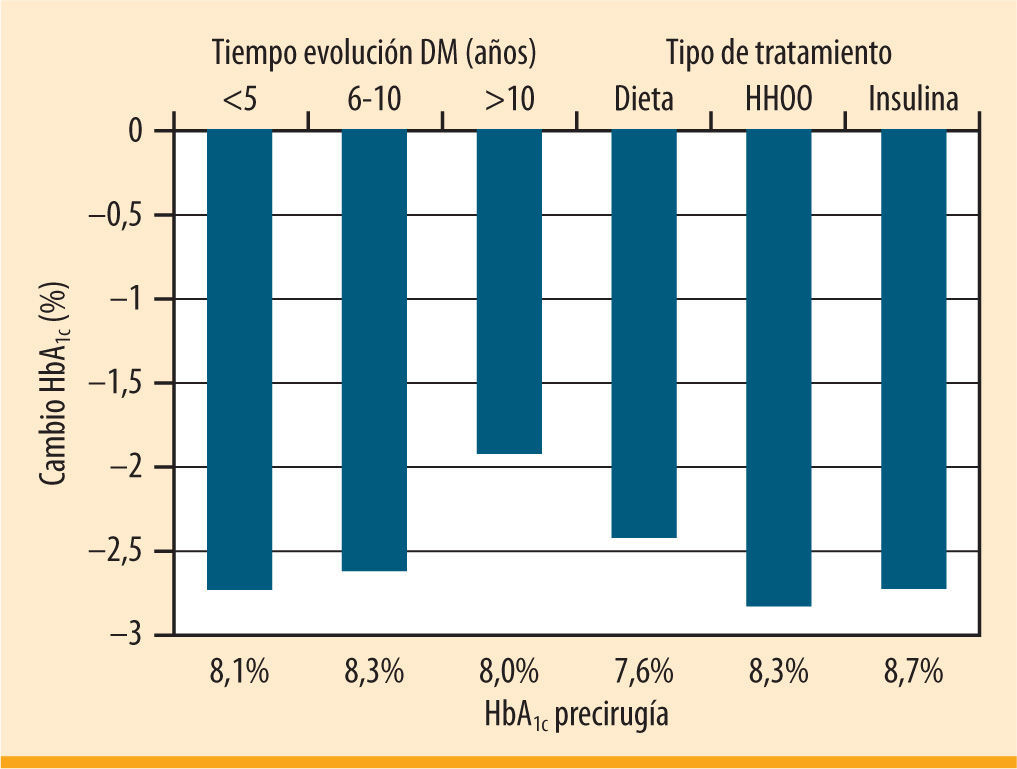
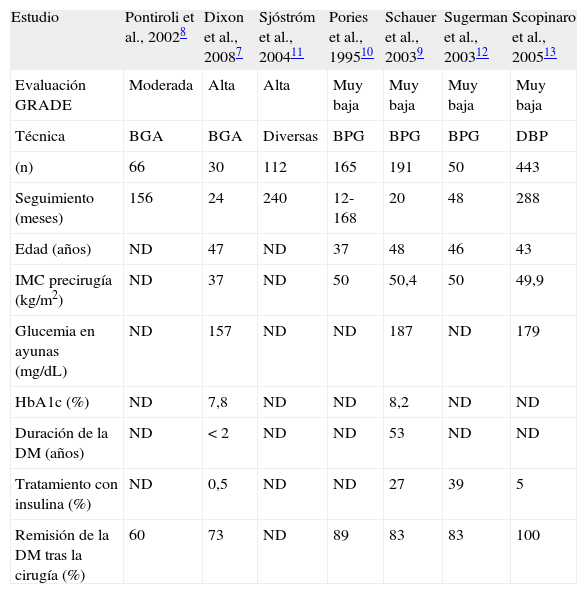
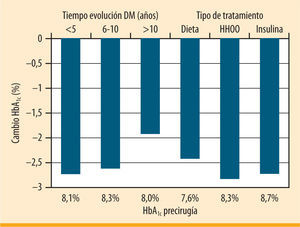
Según estándares de calidad propuestos por la Cochrane (GRADE) y una tasa de pacientes perdidos en el seguimiento inferior al 20%, Vetter et al. seleccionan una serie de estudios que describen en conjunto a un total de unos 1.500 sujetos con DM2 sometidos a cirugía bariátrica7-13. El análisis de las características de los pacientes incluidos en esos estudios demuestra que, realmente, en ninguno se aborda la población de interés (tabla 1). El estudio que recibe mejor calificación según los criterios GRADE es el estudio aleatorizado de Dixon et al. en el que se compara la evolución de la DM2 en pacientes tratados con dieta o con banda gástrica ajustable7. La tasa de resolución de la DM2 en el grupo quirúrgico fue del 73%, y en el grupo con tratamiento médico del 13%. Siendo un estudio de alta calidad, se refiere a pacientes con una DM2 de menos de 2 años de evolución, de los que únicamente el 0,5% seguía tratamiento con insulina y con una HbA1c media previa al inicio del estudio de 7,2%. De entre todas las seleccionadas, sólo en la serie de casos de Schauer et al. se describe un subgrupo de pacientes que pueden ayudarnos a resolver nuestra cuestión9. Se trata de un subgrupo de 72 pacientes (sobre un total de 191 incluidos en la serie) que tienen una evolución de la DM2 superior a 6 años, una edad media de 51 años y una duración de la enfermedad de 11,3 años, con un 60% en tratamiento con insulina, y con una HbA1c media de 8,2%. En esta serie de pacientes el descenso en la HbA1c fue del 1,9% (del 8,0 al 6,1%) para aquellos con un tiempo de evolución de la enfermedad superior a 10 años y del 2,7% (del 8,7 al 6,0%) en aquellos que recibían tratamiento con insulina (figura 1). Así pues, existe evidencia, aunque limitada, sobre el hecho de que el tratamiento quirúrgico puede ser útil en los pacientes con DM2 que fracasan con el tratamiento médico.
Características de los pacientes y tasas de remisión de la enfermedad en los principales estudios de cirugía bariátrica en sujetos con DM2 e IMC >35kg/m2
| Estudio | Pontiroli et al., 20028 | Dixon et al., 20087 | Sjóstróm et al., 200411 | Pories et al., 199510 | Schauer et al., 20039 | Sugerman et al., 200312 | Scopinaro et al., 200513 |
| Evaluación GRADE | Moderada | Alta | Alta | Muy baja | Muy baja | Muy baja | Muy baja |
| Técnica | BGA | BGA | Diversas | BPG | BPG | BPG | DBP |
| (n) | 66 | 30 | 112 | 165 | 191 | 50 | 443 |
| Seguimiento (meses) | 156 | 24 | 240 | 12-168 | 20 | 48 | 288 |
| Edad (años) | ND | 47 | ND | 37 | 48 | 46 | 43 |
| IMC precirugía (kg/m2) | ND | 37 | ND | 50 | 50,4 | 50 | 49,9 |
| Glucemia en ayunas (mg/dL) | ND | 157 | ND | ND | 187 | ND | 179 |
| HbA1c (%) | ND | 7,8 | ND | ND | 8,2 | ND | ND |
| Duración de la DM (años) | ND | <2 | ND | ND | 53 | ND | ND |
| Tratamiento con insulina (%) | ND | 0,5 | ND | ND | 27 | 39 | 5 |
| Remisión de la DM tras la cirugía (%) | 60 | 73 | ND | 89 | 83 | 83 | 100 |
BGA: banda gástrica ajustable; BPG: bypass gástrico; DBP: derivación biliopancreática; DM: diabetes mellitus; DM2: diabetes mellitus tipo 2; GRADE: Grading of Recommendations, Assessment, Development, and Evaluation; IMC: índice de masa corporal; ND: información no disponible.
Cambios en la HbA1c tras bypass gástrico en pacientes con DM2 en función del tiempo de evolución y el tipo de tratamiento (adaptada de Schauer, et al.9)
Más allá de disponer de una serie de pacientes que sean de interés para la pregunta del endocrinólogo, ¿importan las características del paciente para predecir si va a mejorar tras la cirugía? La respuesta es sí. En la serie global de Schauer et al., la tasa de remisión de la DM2 fue menor en aquellos pacientes con duración de la diabetes superior a 10 años, con peor control metabólico preoperatorio, y en aquellos que antes de la cirugía seguían tratamiento con insulina9. En la serie de Torquati et al., el tratamiento con insulina y una menor duración de la diabetes se asociaron a una evolución más favorable de la enfermedad. La cirugía de la obesidad se asocia a una importante pérdida de peso y, con ello, fundamentalmente a una mejoría en la sensibilidad a la insulina14. A la luz de los conocimientos actuales sobre la fisiopatología de la DM2, consideramos que los pacientes con mayor tiempo de evolución y en tratamiento con insulina son aquellos con una menor función beta pancreática residual15. Por tanto, no es de extrañar que en ellos sean menos evidentes los beneficios asociados a la mejoría en la acción periférica de la insulina. De todos modos, estas matizaciones centradas en la remisión de la enfermedad no deberían hacernos perder de vista el valor de la cirugía para disminuir la HbA1c en el paciente con una DM2 evolucionada, en comparación con otras alternativas terapéuticas disponibles.
Con lo expuesto hasta el momento parecería claro que la opción quirúrgica es algo que, como endocrinólogos, deberíamos considerar en aquellos pacientes con DM2 y un IMC >35kg/m2 en los que el tratamiento médico ha fracasado. Sin embargo, el endocrinólogo aún tiene otras barreras que vencer. Una de ellas es la percepción de que la cirugía no es más que una herramienta que obliga (condena) al paciente a hacer aquello (cambios en el estilo de vida) que debería ser capaz de hacer por propia voluntad. Sin duda la restricción gástrica y las modificaciones anatómicas del intestino que conlleva la cirugía son cambios mecánicos que condicionan cuantitativa y cualitativamente la ingesta del paciente. A ello el cirujano responde que, aunque los mecanismos por los que la cirugía se asocia a una pérdida importante y sostenida de peso no están todavía bien establecidos, determinados tipos de cirugía conllevan cambios en las hormonas gastrointestinales que favorecen la saciedad y la disminución del apetito (véase más adelante). Como endocrinólogos, deberíamos reconocer también que nuestra habilidad para conseguir pérdidas de peso significativas sostenidas más allá de 1 año en pacientes con DM2 es más bien limitada16. Por ello, la cirugía es una opción cuando ha fracasado el tratamiento médico dirigido a la pérdida de peso.
Otra barrera relacionada con el abordaje quirúrgico es la percepción del elevado (injustificado) riesgo que conlleva. La mortalidad global asociada al tratamiento quirúrgico en los centros de excelencia para cirugía bariátrica en Estados Unidos es del 0,3%17. En los 1.198 que fueron sometidos a banda gástrica ajustable no se produjo ningún caso de mortalidad. Para el bypass gástrico laparoscópico, fue del 0,2% (sobre 2.975 casos), y del 2,1% para el bypass laparoscópico abierto (437 pacientes). Globalmente, la tasa de complicaciones en los primeros 30 días tras la intervención fue del 4,1%. En esta serie, al igual que en la valoración de DeMaria et al.18, la DM2 no se identificó como un factor de riesgo para mortalidad o complicaciones quirúrgicas. Estas tasas de mortalidad serían comparables a las asociadas a la colecistectomía en Estados Unidos (0,3 a 0,6%)19. Ciertamente se trata de dos enfermedades y de dos indicaciones quirúrgicas distintas. Sin embargo, la mortalidad asociada a la diabetes, especialmente en el paciente en el que no se consigue un buen control metabólico, no es despreciable.
El paciente con DM2 y obesidad a menudo presenta hipertensión arterial, colesterol HDL bajo, hipertrigliceridemia, apneas del sueño y otras comorbilidades3,11. El paradigma de prevención de la enfermedad cardiovascular en el paciente con diabetes se basa en el abordaje simultáneo de factores de riesgo2. Diversos estudios han demostrado que todas estas comorbilidades mejoran con la pérdida de peso asociada a la cirugía11. Esta pérdida de peso asociada a la cirugía va a incidir positivamente además sobre la reducción de la circunferencia abdominal, otro factor de riesgo cardiovascular independiente.
En diversos estudios se ha demostrado un efecto beneficioso de la cirugía bariátrica sobre marcadores plasmáticos de riesgo cardiovascular20. Dos estudios han demostrado un efecto beneficioso de la cirugía sobre un marcador precoz de enfermedad cardiovascular como es la progresión del grosor de la íntima media carotídea21,22, aunque ninguno de los dos planteó específicamente la pregunta en una población con DM2. En el estudio de Sarmento et al., el efecto beneficioso se observó ya a los 6 meses tras la cirugía21. En el estudio de Habib et al., el tratamiento quirúrgico se asoció a una reducción del grosor de la íntima media carotídea desde 0,84 a 0,50mm a los 24 meses después de la intervención22.
Además, en el estudio Swedish Obese Subjects (SOS) se demostró una reducción significativa de la mortalidad global en el grupo de pacientes sometidos a cirugía bariátrica, en comparación con una población control23. Sin embargo, sólo un 10% de la población participante en el estudio SOS presentaba DM2. Finalmente, Adams et al. demostraron una reducción significativa de la mortalidad asociada a la diabetes (en un 92%) en comparación con un grupo control24. No sólo es el beneficio sobre el riesgo de enfermedad cardiovascular, sino que también la incidencia y la mortalidad por cáncer son menores en los pacientes sometidos a bypass gástrico, en comparación con un grupo control no operado25.
Estas razones apoyan más si cabe la indicación de cirugía de la obesidad en pacientes con DM2 y un IMC >35kg/m2. Aun en presencia de un control metabólico aceptable, la coexistencia de otras comorbilidades susceptibles de mejorar con la pérdida de peso debería llevarnos a discutir esta opción con nuestros pacientes. Como endocrinólogos, tal vez tendemos a ver al paciente como diabético con otras enfermedades asociadas, entre ellas la obesidad. Y no debemos olvidar que otra opción es ver al paciente como obeso con otras enfermedades asociadas, entre ellas la DM2.
Cirugía bariátrica en pacientes con diabetes tipo 2 con IMC <35kg/m2A los ojos de un cirujano, lo discutido hasta aquí es poco relevante, ya que el consenso para el tratamiento de la obesidad de 1991 ya recogía3 la indicación de tratamiento quirúrgico para el paciente con DM2 y un IMC >35kg/m2. Sin embargo, la discrepancia entre endocrinólogos y cirujanos queda recogida en el documento de consenso de la primera cumbre sobre el tratamiento quirúrgico de la diabetes, que tuvo lugar en Roma en 200726. Cirujanos y endocrinólogos sólo acordaron que, para este grupo de pacientes, la cirugía «debe considerarse» si el riesgo quirúrgico es aceptable. La pregunta que se debate actualmente en el ámbito quirúrgico es: ¿importa el IMC para indicar tratamiento quirúrgico en pacientes con DM2? En otras palabras, ¿debemos excluir a un paciente diabético de la opción quirúrgica basándonos en su IMC? La cuestión tiene varias derivadas.
El grupo de Pories mostró, en la década de los noventa, que la resolución de la DM2 tras el bypass gástrico ocurre prácticamente de forma inmediata tras la cirugía, mucho antes de que se produzca una pérdida significativa de peso10. Una situación similar se produce tras la derivación biliopancreática. La demostración de Rubino y Marescaux de la mejoría de la diabetes mediante bypass duodenoyeyunal en un modelo de rata diabética no obesa apoyaría estas observaciones27. El mecanismo responsable de esta situación no está bien establecido, si bien diversos estudios han sugerido que las hormonas gastrointestinales podrían desempeñar un papel fundamental28. En líneas generales, podría decirse que técnicas como el bypass gástrico o la derivación biliopancreática facilitarían el contacto precoz del alimento con las células L del intestino distal, aumentando así la secreción de GLP-1 y facilitando por tanto el efecto incretínico sobre la secreción de insulina. Asimismo, de acuerdo con la hipótesis defendida por Rubino y Marescaux, la falta de contacto del alimento con el duodeno y el yeyuno proximal evitaría la secreción de un factor no identificado con efecto antiincretínico, favoreciendo así un mejor control glucémico. La pérdida de peso tras la cirugía sería un fenómeno secundario. Participaría en la mejoría de la sensibilidad a la insulina y, por ende, de la glucosa plasmática, pero únicamente en un estadio posterior. Con estas bases, ni el punto de corte de 35kg/m2 ni probablemente ningún punto de corte tendrían sentido.
Las evidencias sobre la eficacia de las técnicas quirúrgicas actualmente aceptadas para el tratamiento de la obesidad en el grupo de pacientes con un IMC entre 30 y 35kg/m2 son escasas. Para la banda gástrica ajustable, el estudio que se usa como referencia es el de Dixon et al.7. Ciertamente, en este estudio el criterio de inclusión para el IMC fue presentar un valor entre 30 y 40kg/m2; sin embargo, sólo tres de los pacientes presentaban un IMC inferior a 35. Además, los efectos de la cirugía sobre los distintos factores hormonales no han podido ser demostrados en los pacientes sometidos a banda gástrica ajustable. Cohen et al.29 demostraron una mejoría de la glucemia plasmática en ayunas, el colesterol total, el colesterol LDL y los triglicéridos, y un aumento en el colesterol HDL, en un grupo de 37 pacientes con DM2 y un IMC <35kg/m2. Lee et al. reportaron la resolución de la DM2 en un 90% de los 44 pacientes con un IMC <35kg/m2 incluidos en su serie. Los autores no describen la duración media de la enfermedad ni el tipo de tratamiento seguido. La HbA1c media de estos pacientes antes de la cirugía era de 7,3 ± 2,2%. En un 77% de ellos, no sólo se consiguió una HbA1c <7%, sino además un colesterol LDL <100mg/dL y unos triglicéridos <150mg/dL30. Estos porcentajes fueron inferiores a los observados en pacientes con un IMC >35kg/m2 en el mismo estudio, con una remisión de la DM2 del 98%, y un cumplimento de objetivos en diversos factores de riesgo cardiovascular del 92%. Finalmente, Shah et al. describieron la remisión en el 100% de 15 pacientes con un IMC <35kg/m2, con un tiempo de evolución de la DM2 de 8,7 años, y en tratamiento con insulina en un 80% de los casos31. La raza asiática de los sujetos de los dos últimos estudios los hace poco comparables con la población caucásica, predominante en nuestro medio. La consideración de las características de los pacientes con DM2 candidatos a cirugía bariátrica es más importante si cabe que en la población con un IMC más elevado. Éste es un grupo con una menor presencia de otras enfermedades asociadas y, por tanto, éstas no justificarían la cirugía en estadios precoces de la enfermedad. Además, el menor grado de obesidad debería suponer una mayor dominancia del defecto secretor de insulina respecto al defecto en la acción periférica de la misma, en comparación con el grupo con un IMC superior.
El tercer aspecto que debe considerarse sobre el tratamiento quirúrgico en pacientes con DM2 y un IMC <35kg/m2 tiene que ver con la aparición de nuevas técnicas quirúrgicas. Desde nuestro punto de vista, ello ha acrecentado la confusión. En los últimos años se han publicado resultados sobre el bypass duodenoyeyunal, la tubulización gástrica con transposición ileal, o la tubulización gástrica con modificación del drenaje y transposición ileal32,33. La justificación para estas nuevas técnicas quirúrgicas se basa en los conocimientos del mecanismo de acción de la cirugía. En el bypass duodenoyeyunal, el estómago se mantiene intacto y se realiza una anastomosis término-terminal entre duodeno (en su primera porción) y yeyuno. El objetivo de esta cirugía sería impedir el contacto del alimento con el duodeno y el yeyuno proximal, evitándose así la secreción del factor antiincretínico propuesto por Rubino y Marescaux. En la tubulización gástrica con transposición ileal se busca, por una parte, reducir la secreción de ghrelina al resecar parte del estómago, y, por otra, facilitar la secreción de GLP-1 al interponer el segmento con más concentración de células L (el íleon distal) en una situación más proximal. Finalmente, la tercera de las técnicas busca combinar ambos objetivos. El diseño de todas ellas es buscar la máxima eficacia con el mínimo riesgo para el paciente. Desde nuestro punto de vista, estas técnicas quirúrgicas tienen hoy día poca justificación. Con las evidencias actuales, parece prematuro considerar que la DM2 se resuelve tras el tratamiento quirúrgico gracias a que las modificaciones anatómicas facilitan la secreción de GLP-1 o se evita la secreción de un factor antiincretínico. Además, parecería que en una población de pacientes con DM2, necesariamente más numerosa que la de sujetos con IMC >35kg/m2, las técnicas que aplicar deberían ser aquellas sobre las que existe un mayor conocimiento sobre su seguridad a corto y largo plazo. La posición de las sociedades científicas en relación con el tratamiento quirúrgico en pacientes diabéticos con IMC <35kg/m2 es conservadora, aunque expresada con distintos matices. La American Diabetes Association opina que no hay suficiente evidencia científica que lo justifique3. La American Society for Metabolic and Bariatric Surgery34 y la European Association for Endoscopy Surgery35 adoptan una posición similar y limitan su justificación al contexto de ensayos clínicos controlados. Desde nuestro punto de vista, estos ensayos clínicos no deberían tener como objetivo primario la mejoría de parámetros metabólicos, sino la progresión de la enfermedad cardiovascular. La DM2 es una enfermedad en expansión y con una repercusión importante sobre la morbilidad y la mortalidad. En todo el mundo hay más de 240 millones de afectados. En España, la prevalencia de DM2 en población adulta se sitúa entre el 5 y el 10%. De ellos, la mayoría tienen un IMC <35kg/m2. Aunque la cirugía permita cumplir con el paradigma actual de tratamiento de la DM2, basado en el control de la glucemia y otros factores de riesgo cardiovascular, no creemos razonable plantear la cirugía como medida generalizable para limitar el problema sociosanitario que representa esta enfermedad.
Consideraciones prácticas
- •
Las guías de tratamiento para la obesidad recogen que la cirugía es una opción para los pacientes con un IMC >35kg/m2 si presentan comorbilidades asociadas como la DM2. Sin embargo, en las guías internacionales sobre tratamiento de la DM2 aún no figura esta opción terapéutica.
- •
La cirugía de la obesidad se asocia a una importante pérdida de peso y, con ello, a una mejoría en la sensibilidad a la insulina. Además, determinados tipos de cirugía inducen cambios en las hormonas gastrointestinales que favorecen la saciedad y la disminución del apetito.
- •
La cirugía bariátrica debería ser introducida ya en el algoritmo terapéutico de la diabetes tipo 2, en pacientes con un IMC >35kg/m2 en los que fracasara el tratamiento médico dirigido a la pérdida de peso.
En resumen, aunque existen preguntas por responder, parece claro que el tratamiento quirúrgico de la obesidad debe considerarse en el paciente con DM2 y un IMC >35kg/m2. Algunos pudieran pensar que ello también es aplicable al paciente con un grado de obesidad menor (IMC 30–35kg/m2). Desde nuestro punto de vista, en el marco de nuestro sistema público de salud no hay ninguna premura para aplicar este segundo criterio. La cirugía bariátrica es un tratamiento más bien escaso en nuestro país. Los mejores resultados han sido demostrados para pacientes con grados de obesidad mayores, e incluso para ellos hay limitaciones para el acceso al tratamiento quirúrgico. Para llegar a los pacientes con obesidad de grado I hay tiempo para realizar ensayos clínicos y determinar quiénes van a beneficiarse más de este abordaje terapéutico. Sin duda la cirugía bariátrica tiene un potencial importante para inducir la remisión de la DM236, pero no creemos que sea, hoy día, la medida terapéutica principal para un problema de salud pública como es la diabetes. ¿
Declaración de potenciales conflictos de interesesLos autores no tienen ningún conflicto de intereses en relación con el contenido del presente artículo.




 HbA1c tras bypass gástrico en pacientes con
HbA1c tras bypass gástrico en pacientes con 