El descubrimiento de la etiopatogenia autoinmune de la diabetes mellitus tipo 1 (DM1) junto con la eficacia de diversas estrategias inmunoterapéuticas en modelos animales de DM1 espontánea abrieron, hace ya más de 30 años, la vía de la intervención inmunofarmacológica en esta entidad. Hoy por hoy, los estudios que evalúan la inmunoterapia al comienzo de la DM1 tienen el objetivo de modificar la historia natural de la pérdida de secreción endógena insulínica de una forma segura y aditiva a la obtenida mediante el tratamiento insulínico intensificado.
Tras las grandes expectativas levantadas a principios del presente siglo con la publicación de prometedores estudios piloto, en los últimos meses han visto la luz los resultados de ensayos clínicos fase iii con resultados insatisfactorios, lo que ha levantado nuevamente entre la comunidad científica el debate sobre los estudios de inmunointervención al comienzo de la DM1.
The discovery of type 1 diabetes mellitus’ (T1DM) autoimmune etiopathogenesis, as well as the effectiveness of diverse immunotherapeutic strategies in T1DM animal models, opened a scenario of pharmacological immuno-intervention in this disease, more than 30 years ago. The aim of current trials that are evaluating these immune therapies at T1DM onset, is to safely modify the natural history of insulin secretion loss in addition to that obtained with intensive insulin treatment.
After the great expectations arised at the beginning of the present century with the publication of promising pilot studies, the results of phase iii clinical trials have recently been published, with unsatisfactory results. This has again led to a debate on immunological therapies at T1DM onset in the scientific community.
La diabetes mellitus tipo 1 (DM1) es un rasgo genético complejo, en el que hay más de 30 loci implicados1 que condicionan diferentes cargas de riesgo para el desarrollo de la enfermedad y sobre los que actúan factores ambientales2, tanto inductores como protectores. Es probablemente a estos factores ambientales, y no a la base genética, más estable, a los que habría que atribuir, a priori, el importante incremento observado en la incidencia de DM1 principalmente en los niños de menos de 5 años de los países occidentales3.
Si bien se desconoce con exactitud las causas que determinan la pérdida de autotolerancia en las personas en riesgo de desarrollar DM1, se sabe que anomalías del proceso de presentación de la insulina a nivel tímico en fases precoces de la vida tienen un papel clave en el inicio de la respuesta autoinmune4.
Cabe destacar que en el proceso de presentación antigénica se encuentran implicados algunos de los loci genéticos más asociados con el desarrollo de la DM1: el complejo mayor de histocompatibilidad tipo ii, el gen de la insulina, el gen de la tirosinfosfatasa o el gen del CTLA-4, por citar solo algunos ejemplos1. De ellos, solo el correspondiente a un autoantígeno, el gen de la insulina, es específico de la enfermedad. Los demás están implicados en el proceso fisiológico de reconocimiento antigénico en general y son esenciales para el correcto funcionamiento del sistema inmunológico. Para acabar de complicar esta maraña, si bien clásicamente los 2 tipos celulares tradicionalmente implicados en la inmunidad celular eran los linfocitos T y las células dendríticas, estudios recientes han puesto de manifiesto que también los linfocitos B5 y las células plasmáticas tienen un papel importante como células presentadoras de antígeno, e incluso células de la inmunidad innata como los neutrófilos podrían tener un papel patogénico6.
A grandes rasgos, en la DM1 los linfocitos T autorreactivos (patogénicos) esquivan a nivel tímico los procesos de apoptosis y de transformación en linfocitos T reguladores que tienen una función inmunomoduladora4. Una vez franqueada la barrera de la inducción de autotolerancia central, el resto de los procesos patogénicos tienen lugar en los llamados tejidos linfáticos periféricos (los ganglios linfáticos pancreáticos) y en el órgano diana, el páncreas. En sendos casos, se trata obviamente de estructuras de acceso harto difícil para el estudio de la patogenia de la enfermedad. Es por ello que gran parte de los conocimientos que se tienen sobre la etiopatogenia de la DM1 han sido desvelados gracias a los estudios realizados en modelos animales de DM1 espontánea como el ratón NOD o la rata BB7. Sin embargo, el conocimiento derivado de los hallazgos en los modelos animales tiene limitaciones y no son del todo extrapolables a humanos8. Por ello, desgraciadamente, las intervenciones que se han demostrado eficaces en los modelos animales para prevenir y/o curar la DM1 no han obtenido resultados equiparables en experimentación humana8.
El hecho de que la DM1 tenga sus primeras manifestaciones clínicas cuando el daño autoinmune sobre las células β pancreáticas ya está muy evolucionado, y que este proceso se dé en individuos con un perfil genético de riesgo elevado, abre la puerta a los intentos de detener el proceso autoinmune antes de que este se produzca (estudios de prevención primaria en sujetos en riesgo) o antes de que este condicione una pérdida significativa de la secreción endógena de insulina (estudios de prevención secundaria en individuos en riesgo que ya han desarrollado marcadores de daño autoinmune, los autoanticuerpos característicos de la DM1)9,10. Si bien, probablemente, lo óptimo sería poder intervenir en estas fases más precoces de la enfermedad, centraremos esta revisión en las intervenciones inmunoterapéuticas al comienzo de la DM1, dado que es en esta situación en la que se encuentran los pacientes que atendemos en la práctica clínica diaria, más allá de programas de detección de individuos en riesgo, hoy en día justificados solo a nivel de estudios clínicos.
La inmunoterapia en el siglo xxDesde los primeros estudios en los que se ensayó la ciclosporina al comienzo de la DM1 durante los 80 se puso de manifiesto que este fármaco a altas dosis permitía conseguir un importante porcentaje de insulino-independencia11 a expensas de empeorar la función renal12. Si bien no se observaron otros efectos secundarios propios de la inmunosupresión crónica (infecciones oportunistas o aumento de la incidencia de neoplasias), lo cierto es que el efecto sobre la secreción de insulina se observó solo durante la administración del fármaco, lo que obligaba, teóricamente, a mantenerlo de forma indefinida en el tiempo si lo que se pretendía era evitar la reaparición de la diabetes. De esa época datan también estudios con azatioprina combinada con prednisona13, en los que también se observaba una disminución de los requerimientos insulínicos mientras duraba el tratamiento.
En 1993, la publicación del Diabetes Control and Complications Trial (DCCT) supuso un revulsivo en el manejo de la DM1. Este estudio puso de manifiesto varias cuestiones entre las que cabe destacar, por su trascendencia en el manejo actual de los pacientes con DM1, los siguientes mensajes clave:
- 1.
El tratamiento insulínico intensificado (TII), con todo lo que implica, más allá de la simple prescripción de múltiples dosis de insulina, se convierte en el tratamiento de elección del paciente con DM1 al demostrarse su eficacia y eficiencia para evitar/atrasar la aparición de complicaciones crónicas14.
- 2.
En un subanálisis posthoc del DCCT se establece la importancia de la función β residual, objetivada mediante la persistencia de niveles de c-péptido estimulados superiores a 0,2 nmol/L, para facilitar el manejo de la DM1. Así, en el DCCT se puso de manifiesto que un 35% de los individuos tras 1-5 años del comienzo presentaban niveles de c-péptido estimulado superiores a dicha cifra y que estos individuos tenían un mejor grado de control metabólico14. Los individuos con reserva pancreática que se asignaron a TII conservaron mejor la producción endógena de insulina, tuvieron un mejor control metabólico, con menores necesidades diarias de insulina, menos hipoglucemias y menos complicaciones crónicas que los que fueron asignados a tratamiento insulínico convencional15.
El impacto de estos hallazgos sobre los estudios de inmunointervención al comienzo de la DM1 ha sido capital. En primer lugar, el objetivo primario de los estudios de inmunointervención dejó de ser lograr la insulino-independencia del paciente, para pasar a ser tratar de conservar la función β pancreática, medida por el c-péptido16. En segundo lugar, la inmunointervención debía acompañar indefectiblemente al tratamiento de elección de la DM1, el TII, que se debía administrar tanto en el grupo de intervención como en el grupo control.
En los años siguientes, la investigación en inmunointervención estuvo marcada por los excelentes resultados obtenidos por diferentes fármacos en modelos murinos. Estas intervenciones se intentaron reproducir en individuos con reciente diagnóstico de DM1. En 2008 se publicó una revisión sistemática de los estudios aleatorizados controlados publicados sobre el tema en la que se recogen las características y los resultados de los estudios que evaluaban intervenciones diversas (ciclosporina, azatioprina, BCG, nicotinamida, inmunoglobulinas, metotrexate…)17. En esta revisión se pone básicamente en evidencia la baja protección frente a sesgos de los estudios analizados, en general de baja calidad metodológica. En el metaanálisis se objetivó que el efecto de conservación de la función β era mayor en los estudios que implicaban la administración de inmunosupresores más prolongada.
La inmunoterapia en lo que llevamos de siglo xxiEs a principios del presente siglo cuando aparecen una serie de publicaciones de estudios piloto que apuntan a la eficacia de ciertas intervenciones inmunoterapéuticas al diagnóstico de la DM1, como es el caso de los anticuerpos humanizados anti-CD3 teplizumab18 y otelixizumab19 o el autoantígeno GAD20. Más que una revisión exhaustiva de los últimos estudios publicados, de todos conocidos, intentaremos hacer un análisis global de los estudios fase ii/iii que hemos considerado más trascendentes.
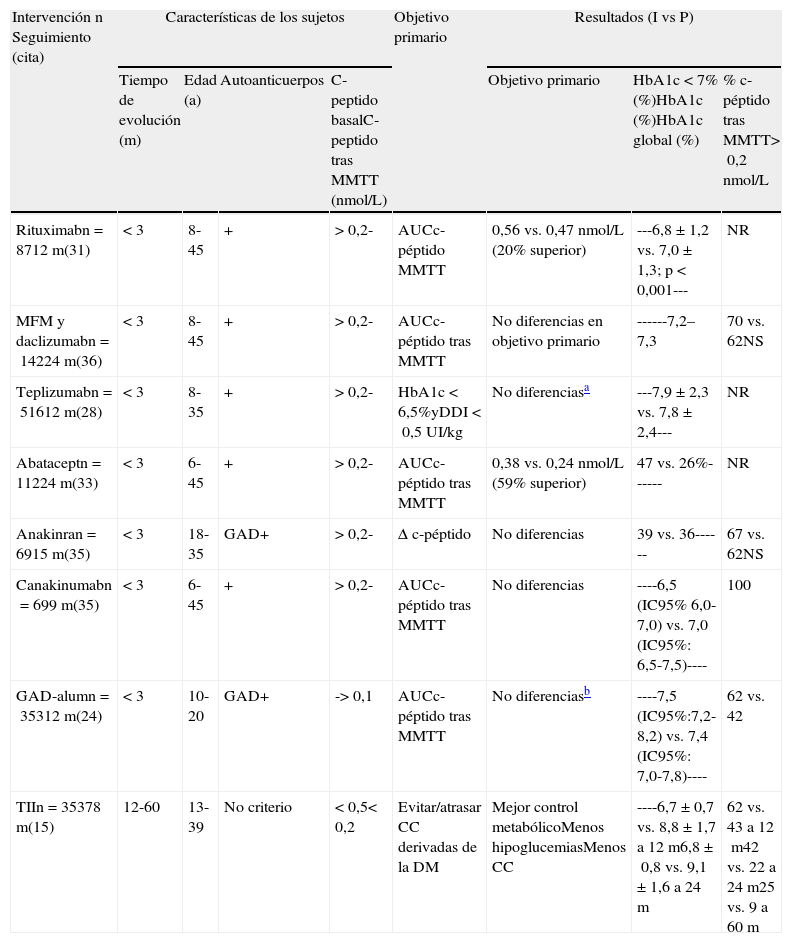
Las intervenciones inmunoterapéuticas se pueden clasificar en 2 estrategias de tratamiento diferenciadas: por una parte, la que busca la generación de tolerancia específica frente a los autoantígenos clásicos de la DM1, y por otra, la inmunoterapia no antígeno-específica, que actuaría a nivel de todo el sistema inmunitario y que suele generar algún tipo de inmunosupresión, generalmente transitoria, mientras se administra el fármaco. Las principales características y resultados de las intervenciones inmunoterapéuticas publicadas en estudios fase ii/iii en los últimos años se describen en la tabla 1.
Resumen de los estudios fase ii/iii de inmunointervención al comienzo de los últimos años y comparativa con el DCCT
| Intervención n Seguimiento (cita) | Características de los sujetos | Objetivo primario | Resultados (I vs P) | |||||
| Tiempo de evolución (m) | Edad (a) | Autoanticuerpos | C-peptido basalC-peptido tras MMTT (nmol/L) | Objetivo primario | HbA1c<7% (%)HbA1c (%)HbA1c global (%) | % c-péptido tras MMTT>0,2nmol/L | ||
| Rituximabn=8712m(31) | <3 | 8-45 | + | >0,2- | AUCc-péptido MMTT | 0,56 vs. 0,47 nmol/L (20% superior) | ---6,8±1,2 vs. 7,0±1,3; p<0,001--- | NR |
| MFM y daclizumabn=14224m(36) | <3 | 8-45 | + | >0,2- | AUCc-péptido tras MMTT | No diferencias en objetivo primario | ------7,2–7,3 | 70 vs. 62NS |
| Teplizumabn=51612m(28) | <3 | 8-35 | + | >0,2- | HbA1c<6,5%yDDI<0,5UI/kg | No diferenciasa | ---7,9±2,3 vs. 7,8±2,4--- | NR |
| Abataceptn=11224m(33) | <3 | 6-45 | + | >0,2- | AUCc-péptido tras MMTT | 0,38 vs. 0,24 nmol/L (59% superior) | 47 vs. 26%------ | NR |
| Anakinran=6915m(35) | <3 | 18-35 | GAD+ | >0,2- | Δ c-péptido | No diferencias | 39 vs. 36------ | 67 vs. 62NS |
| Canakinumabn=699m(35) | <3 | 6-45 | + | >0,2- | AUCc-péptido tras MMTT | No diferencias | ----6,5 (IC95% 6,0-7,0) vs. 7,0 (IC95%: 6,5-7,5)---- | 100 |
| GAD-alumn=35312m(24) | <3 | 10-20 | GAD+ | ->0,1 | AUCc-péptido tras MMTT | No diferenciasb | ----7,5 (IC95%:7,2-8,2) vs. 7,4 (IC95%: 7,0-7,8)---- | 62 vs. 42 |
| TIIn=35378m(15) | 12-60 | 13-39 | No criterio | <0,5<0,2 | Evitar/atrasar CC derivadas de la DM | Mejor control metabólicoMenos hipoglucemiasMenos CC | ----6,7±0,7 vs. 8,8±1,7 a 12m6,8±0,8 vs. 9,1±1,6 a 24m | 62 vs. 43 a 12m42 vs. 22 a 24m25 vs. 9 a 60m |
AUC: área bajo la curva; CC: complicaciones crónicas, I: intervención; DCCT: Diabetes Control and Complications Trial; DDI: dosis diaria de insulina; DM: diabetes mellitus; MFM: micofenolato mofetil; MMTT: mixed meal tolerance test; NR: no reportado; NS: no significativo; P: placebo; TII: tratamiento insulínico intensificado.
Las 2 últimas columnas hacen referencia al grado de control metabólico alcanzado y a la secreción máxima de c-péptido al finalizar el periodo de observación.
A diferencia de lo que ocurre en las enfermedades autoinmunes mediadas por anticuerpos, los autoanticuerpos que se generan en el curso de la historia natural de la DM1 no tienen un papel patogénico en el desarrollo de la enfermedad, si bien son útiles como marcadores de daño y de riesgo de evolución hacia la pérdida de función β pancreática. Pese a ello, la mayor parte de las intervenciones antígeno-específicas al comienzo de la DM1 han buscado su inspiración en el elenco de autoanticuerpos identificados hasta la fecha, de los cuales, solo la insulina sería un producto específico de la célula β pancreática y tendría, como ya se ha comentado, un papel central en la generación de autotolerancia a nivel tímico.
La insulina como autoantígenoPese al obvio interés de esta molécula, estudios en fases más precoces de la enfermedad, en individuos en riesgo, no han sido exitosos. En esta línea, el Diabetes Prevention Trial no obtuvo el resultado esperado21 a nivel de prevención secundaria, si bien un subanálisis posterior puso de manifiesto que la insulina oral podía ser eficaz en individuos en riesgo para retrasar la aparición de diabetes en algunos años22.
La descarboxilasa del ácido glutámico como autoantígenoComo es bien sabido, la descarboxilasa del ácido glutámico (GAD) no es un autoantígeno específico del tejido pancreático, como tampoco lo son los anticuerpos anti-GAD de la DM1, ya que se encuentran presentes en otra enfermedad de base autoinmune (stiff-person syndrome)23. Probablemente el desarrollo de Ac anti-GAD sea un epifenómeno más bien tardío del proceso autoinmune de destrucción de la célula β10. Los prometedores resultados de los estudios piloto iniciales20 no se han confirmado en el recientemente publicado estudio fase III24. Los efectos secundarios más notables de la administración de este fármaco son reacciones de irritación local en el lugar de inyección.
Pese a lo atractivo de esta estrategia de inducción de autotolerancia, vale la pena señalar que existen ejemplos, en otras enfermedades autoinmunes, en los que las intervenciones antígeno-específicas han inducido una aceleración del proceso inmunitario, lo que pone de manifiesto la importancia en la decisión del momento de administración, la dosis, la vía de administración, además de la correcta selección de los autoantígenos25.
Intervenciones inmunosupresoras/inmunomoduladoras generalizadas/«no antígeno-específicas»Estas intervenciones buscan generar autotolerancia incidiendo no sobre el autoantígeno sino sobre el resto de las células o moléculas implicadas en el proceso de presentación antigénica o en la respuesta inmunológica en general. Estas estrategias tienen el inconveniente de generar algún grado de inmunosupresión, que puede llegar a ser permanente, si bien generalmente es transitoria. Este y otros son efectos adversos cuya importancia hay que valorar con gran cuidado al aplicarlas a una enfermedad con un tratamiento eficaz y seguro como es el caso de la DM1, a diferencia de lo que ocurre con otras enfermedades autoinmunes tanto sistémicas como organoespecíficas.
Pese a que algunas de estas intervenciones han evidenciado alguna mejoría en parámetros de funcionalismo β, ninguna ha demostrado aumentar de forma significativa el porcentaje de individuos con función β pancreática clínicamente relevante en comparación con el placebo (tabla 1). Por el limitado tiempo de observación de los estudios, tampoco ha sido posible valorar si esta función β se mantiene en el tiempo más allá de lo observado en el DCCT.
Anticuerpos monoclonales humanizados anti-CD3 (teplizumab y otelixizumab)Los Ac anti-CD3 se unen a las moléculas CD3 que forman parte del complejo del receptor de la célula T y son claves en el proceso de presentación antigénica. El efecto inmunomodulador de estos fármacos tiene 2 vertientes: un efecto inmunosupresor a corto plazo que cursa con disminución de linfocitos T activados, objetivable con linfopenia importante en sangre periférica que se recupera al poco de suspender el fármaco, y un efecto a largo plazo de tipo inmunomodulador, obtenido a través de la activación de linfocitos T reguladores26.
Recientemente se ha publicado un estudio que apoyaría la hipótesis de una disminución de parámetros relacionados con la muerte de las células β en sujetos sometidos a tratamiento con teplizumab27, lo que arrojaría luz sobre el debatido tema de si la mejoría de la secreción endógena de insulina es debida a recuperación de funcionalidad de células degranuladas o a una disminución de la muerte de este tipo celular.
En el caso de teplizumab, el objetivo primario que se planteó en el estudio fase III fue un objetivo compuesto que puede resultar clínicamente atractivo (porcentaje de individuos que consiguen HbA1c<6,5% con requerimientos diarios de insulina inferiores a 0,5UI/kg)28, pero que es discutible, al tratarse de una medida indirecta de la secreción endógena de insulina, modificable por factores como el ejercicio físico o la dieta, y que no se aconseja en ninguno de los consensos publicados en los últimos 10 años16,29.
Más allá de que, en función de la no consecución del objetivo primario, se decidiera suspender los estudios en curso, el interés por la aplicabilidad de estos fármacos se ha mantenido, y se han completado estudios en individuos con mayor tiempo de evolución de la diabetes (4-12 meses)27 e incluso, en individuos prediabéticos (NCT01030861, http://www.clinicaltrials.gov). Por otra parte, en un subanálisis de los resultados se muestra que cuando el fármaco se administra de forma precoz (sin superar las 6 semanas del comienzo) o a niños de edades comprendidas entre los 8-11 años sí se obtenía una buena respuesta28. Por lo que respecta a los efectos secundarios de este fármaco a las dosis empleadas en los estudios, estos fueron bien tolerados, en general, siendo el cuadro de liberación de citocinas el efecto adverso más frecuente, si bien tenía buena respuesta a la premedicación con antiinflamatorios.
En el caso del otelixizumab es digno de mención el hecho de que las dosis de fármaco utilizadas en el estudio fase III (NCT00946257, http://www.clinicaltrials.gov) eran 15 veces inferiores a las utilizadas en el estudio piloto19, con lo que sobran otros comentarios.
Anticuerpos anti-CD20 (rituximab)Las moléculas anti-CD20 se encuentran en la superficie de los linfocitos B, y los Ac anti-CD20 provocan la opsonización de estos linfocitos y su posterior destrucción con la inducción de linfopenia de linfocitos B30. En los últimos años está cobrando interés el papel de los linfocitos B en la DM1, donde actuarían como células presentadoras de antígeno5. Este papel activo contrasta con el papel más pasivo que se les atribuía clásicamente como generadores de autoanticuerpos marcadores pero no patogénicos del proceso autoinmune. El rituximab tiene aceptada su indicación en la artritis reumatoide y la vasculitis de Wegener, entre otras enfermedades autoinmunes sistémicas (www.ema.europa.eu). En cuanto a los resultados obtenidos en estudios clínicos en DM131, los pacientes tratados con rituximab presentaron una secreción de c-péptido estimulado tras el mixed meal tolerance test un 20% superior a la que presentaban los individuos asignados al grupo de placebo(tabla 1). Los individuos asignados a rituximab tuvieron mejor grado de control metabólico que los asignados a placebo: 6,76±1,24 vs. 7,00±1,30 (p<0,001). Entre los efectos adversos de este fármaco se encuentran la linfopenia, el síndrome de liberación de citocinas, las infecciones y la leucoencefalopatía multifocal progresiva. En el estudio realizado al comienzo de la DM1 se objetivó una disminución sostenida de los niveles de linfocitos B y de inmunoglobulinas M al finalizar el periodo de observación de 12 meses, respecto del grupo asignado a placebo.
Anticuerpos anti-CTLA4 (abatacept)El abatacept se une a las moléculas CTLA4 de la membrana de los linfocitos T que constituyen la doble llave en el proceso de reconocimiento antigénico al unirse a las moléculas de superficie B7/B27 de las células presentadoras de antígeno. La activación de CTLA4 pone en marcha un proceso inhibitorio de la activación del linfocito T, de modo que el abatacept resulta ser un fármaco inmunosupresor32. Este fármaco está indicado en casos de artritis reumatoide (www.ema.europa.eu) y tiene, como efectos secundarios los propios de la inmunosupresión crónica. En cuanto a los resultados obtenidos en el estudio fase II/III, los individuos asignados a abatacept presentaron una reserva un 59% superior a la de los individuos asignados a placebo33. Un 47% de los pacientes asignados a abatacept presentaron niveles de HbA1c<7%, frente a tan solo el 26% de los individuos asignados a placebo, sin que hubiera diferencias en los requerimientos de insulina ajustados por peso. Respecto a este estudio, cabe destacar que los niveles de HbA1c iniciales fueron 4 décimas superiores en el grupo asignado a placebo. En cuanto a los efectos secundarios reportados en el estudio, los autores no informaron de diferencias estadísticamente significativas en las reacciones adversas que se observaron en ambos grupos de pacientes.
El bloqueo de la vía de la interleucina-1β (anakinra y canakinumab)La interleucina-1 (IL-1) secretada por células de la inmunidad innata tiene un efecto proinflamatorio y, al unirse a sus receptores de membrana de las células β pancreáticas, pone en marcha un proceso de disfunción secretora y de apoptosis de las mismas. Todo ello contribuye a la hiperglucemia y a la producción de más IL-134. Ello ha llevado a que se haya implicado a la IL-1 en la patogenia de la DM1 y de la DM2 y que se hayan ensayado tanto canakinumab, un anticuerpo monoclonal anti-IL1, como anakinra, un inhibidor del receptor de IL-1, en estudios de inmunointervención al comienzo de la DM1. En cuanto a su aplicación clínica en la actualidad: la utilización de anakinra está aprobada en la artritis reumatoide, mientras que canakinumab está indicado en artritis gotosa y en síndromes periódicos asociados a criopirinas/TNF-R (www.ema.europa.eu). En cuanto a sus efectos adversos, destacan la neutropenia, la mayor proclividad a infecciones y las reacciones locales en el lugar de inyección. Los resultados de ambos ensayos se han publicado recientemente de forma conjunta, sin que se objetiven diferencias estadísticamente significativas en la reserva pancreática entre los individuos asignados a dichos fármacos y los asignados a placebo35.
Inmunoterapia combinadaTambién se han publicado los resultados de un estudio aleatorizado en el que se administraron micofenolato mofetil y daclizumab36 al comienzo de la DM1. En ambos casos se trata de fármacos con claro perfil inmunosupresor: El daclizumab es un anticuerpo antirreceptor α de la interleucina-2 (CD-25), inhibe el ciclo celular de los linfocitos T activados y está indicado en el rechazo hiperagudo, mientras que el micofenolato mofetil es un citostático de los linfocitos en general, tanto T como B, y se utiliza en la inmunosupresión de los pacientes trasplantados (www.ema.europa.eu). La administración de esta combinación de fármacos no ha obtenido una mejora de la función β respecto de la administración de placebo. Más recientemente se ha publicado un estudio piloto en el que se reportaba el efecto de la combinación rapamicina e interleucina-2 en individuos recientemente diagnosticados de DM137. Este estudio se hubo de interrumpir precozmente, al objetivarse una pérdida de función β, pese a que mejoraban marcadores inmunológicos como los niveles de linfocitos T reguladores.
ConsideracionesLas siguientes consideraciones tienen el objetivo de contextualizar los resultados de los ensayos de inmunointervención respecto del «gold standard» de los estudios de intervención al comienzo y que no es otro que el DCCT14,15, tal cual se esquematiza en la tabla 1. Dichas consideraciones abarcan los siguientes aspectos:
- 1.
Población de individuos incluida en los estudios:
- a.
Los individuos incluidos en el DCCT tenían una edad que oscilaba entre los 13 y los 39 años. En la tabla 1 se muestran los criterios de inclusión de los pacientes incluidos en los diferentes estudios publicados en estos últimos meses/años, en comparación con el DCCT. En la mayor parte de los estudios se incluyen individuos con edades comprendidas entre los 8 y los 35 años. Se trata de un grupo de edad obviamente heterogéneo, ya que, por lo que conocemos de estudios de historia natural de la DM1, la evolución de la pérdida de función secretora de insulina no es equivalente en los individuos que comienzan en edad pediátrica y en los individuos que lo hacen en edad adulta9,10.
- b.
Todos los individuos incluidos en el DCCT tenían un tiempo de evolución de la DM1 superior a los 12 meses y se excluyó a los individuos que tenían un c-péptido estimulado superior a 0,5nmol/L. Si se analiza críticamente, en realidad, estas últimas puntualizaciones ponen en franca desventaja al DCCT frente a los estudios de intervención actuales, en los que los individuos se incluyen, generalmente con menos de 12 semanas de evolución desde el diagnóstico.
- a.
- 2.
Objetivos primarios de los estudios de inmunointervención. Hace ya unos años, se estableció por consenso de expertos, que la determinación del área bajo la curva de los niveles de c-péptido estimulado tras una comida estándar, sería el parámetro a utilizar para poder valorar las estrategias de mejora o conservación de la función β pancreática16. Sin embargo, como se puede observar en la tabla 1, no en todos los ensayos se ha utilizado este parámetro como objetivo primario para el diseño de los mismos. Así, si bien la mayor parte reportan de algún modo la variación del c-péptido estimulado (la medida utilizada con más frecuencia es el área bajo la curva), los objetivos primarios no son homogéneos, lo que dificulta la comparación entre los mismos. Tampoco todos los estudios reportan el porcentaje de pacientes que siguen presentando secreción endógena de insulina, que permita una comparativa de cuánto superior es la inmunointervención respecto de los resultados obtenidos con el TII en el DCCT.
Como ya se ha señalado, la fisiopatología del proceso autoinmune en la DM1 es sumamente compleja y, probablemente, a día de hoy, no se dispone del conocimiento suficiente para elaborar estrategias que puedan ser a la vez eficaces y seguras para modificar la historia natural de esta enfermedad. Una vez llegados al diagnóstico clínico de la DM1, el proceso de daño inmunológico ya está tan avanzado que probablemente no es el momento óptimo para intervenir farmacológicamente sobre la reacción autoinmune. Seguramente habría que centrar los esfuerzos en intervenciones más precoces, ya sea de prevención primaria o secundaria, una vez se conozcan mejor los factores determinantes que ponen en marcha el proceso autoinmune. En este sentido, probablemente el mejor conocimiento de los factores ambientales que condicionan el «trigger» del daño autoinmunitario, será clave para el diseño de intervenciones más eficaces y menos arriesgadas que induzcan autotolerancia específica y duradera.
Ante los resultados claramente decepcionantes de los estudios comentados, numerosas revisiones y artículos de opinión muy recientes firmados por reconocidos expertos sobre el tema38,39 coinciden en proponer unas líneas de trabajo futuras que pasan por valorar estrategias de inmunoterapia combinada y la definición de marcadores intermedios de tipo mecanicista para una mejor comprensión del proceso autoinmune y de cómo detenerlo que podrían constituir marcadores de eficacia en el proceso de inducción de autotolerancia más allá de la conservación de la secreción endógena de insulina.
Frente a esta tendencia nos atrevemos a proponer una mayor reflexión. No en vano, ya existen algunas experiencias recientes de estudios de terapia combinada que no han resultado nada prometedoras y que ya hemos comentado37. Las intervenciones inmunoterapéuticas deben ofrecer una ventaja significativa añadida sobre la obtenida por el TII sin suponer un riesgo para la salud del paciente y su elección debe ser extremadamente cautelosa. El diseño de los estudios debe ser también muy cuidadoso y con un tiempo de observación suficiente, pese a lo dificultoso de este punto por motivos obvios relacionados con el coste de los estudios. Los protocolos de los ensayos deberían seguir protocolos más estandarizados, tanto en lo que respecta a los criterios de selección de los individuos como en los objetivos primarios y secundarios a reportar. Solo así se contribuirá a generar un cuerpo de conocimiento sólido que permita extraer conclusiones y valorar la aplicabilidad de los tratamientos testados y su utilidad en la población de individuos con reciente diagnóstico de DM1.
Conflicto de interesesLos doctores Mercè Fernández-Balsells, Lidia Sojo-Vega y Wifredo Ricart-Engel han participado como investigadores en ensayos clínicos con teplizumab (Protégé y Encore) y otelixizumab (Tolerx 1)