Liraglutida es el primer análogo humano del péptido similar al glucagón tipo 1 (GLP-1) administrado una vez al día, y con el que presenta una homología del 97%. El fármaco ha sido recientemente aprobado por la European Medicines Agency y por la Food and Drug Administration para su uso en el tratamiento de la diabetes mellitus tipo 2. La aprobación inicial es para su uso una vez al día en combinación, bien con metformina o con una sulfonilurea, así como en combinación con metformina más una sulfonilurea o una tiazolidindiona. En Estados Unidos, también está indicada en monoterapia. Los resultados del programa de estudios LEAD (Liraglutide Effect and Action in Diabetes) demuestran que liraglutida disminuye de forma significativa la hemoglobina glucosilada (HbA1c) con muy bajo riesgo de hipoglucemia. El tratamiento con liraglutida también se asocia con una pérdida de peso significativa y mantenida en el tiempo, disminución de la presión arterial sistólica, mejoría de la función de las células β y reducción de otros factores de riesgo cardiovascular En este artículo se revisa la evidencia más actualizada obtenida del programa LEAD, centrándose en consideraciones prácticas sobre la manera de utilizar de forma óptima esta nueva terapia para la diabetes mellitus tipo 2.
Liraglutide is the first once daily human glucagonlike peptide-1 (GLP-1) analogue, with a 97% homology. Liraglutide has recently been approved by the European Medicines Agency and by the Food and Drug Administration to be used in the medical management of type 2 diabetes mellitus. Initial approval is for be using in combination with metformin, a sulphonylurea or a combination of metformin with a sulphonylurea or thiazolidinedione. Monotherapy with liraglutide is also approved in United States. Results from the LEAD (Liraglutide Effect and Action in Diabetes) clinical trials programme show that liraglutide significantly lowers HbA1c, with a very low risk of hypoglycemia. Liraglutide treatment was also associated with significant and sustained weight loss, decreased systolic blood pressure, improved βs-cell function, and reductions in other cardiovascular risk markers. In this article we review the most up-to-date evidence emanating from the LEAD programme, focussing on practical considerations on how to optimally use this new therapy for type 2 diabetes mellitus.
American Diabetes Association
diabetes mellitus tipo 2
: dipeptidilpeptidasa 4
European Association for the Study of Diabetes
European Medicines Agency
glucagon-like peptide 1
Homeostasis Model Assessment
Liraglutide Effect and Action in Diabetes
presión arterial sistólica
type 2 diabetes.
La diabetes tipo 2 (DM2) es una enfermedad progresiva multifactorial, que se asocia con diversos grados de disfunción de las células β pancreáticas, resistencia a la insulina y una incapacidad para suprimir la secreción de glucagón1. Está estrechamente vinculada a una serie de comorbilidades que aumentan las complicaciones microvasculares, así como el riesgo cardiovascular y cerebrovascular. El manejo óptimo de la diabetes tipo 2 requiere un tratamiento intensivo y precoz para lograr un buen control glucémico y, al mismo tiempo, evitar el riesgo de hipoglucemia y la ganancia ponderal, potencialmente asociadas al tratamiento. En este sentido, el algoritmo de tratamiento de la hiperglucemia en la diabetes tipo 2 propuesto por la European Association for the Study of Diabetes (EASD) y la American Diabetes Association (ADA) aconseja un objetivo de hemoglobina glucosilada (HbA1c) <7,0%2. El tratamiento antidiabético ideal debería reducir la hiperglucemia, mejorar la función de las células β y, si fuera posible, tener efectos beneficiosos sobre otras comorbilidades que frecuentemente acompañan a la diabetes, como la hipertensión, la dislipemia y la obesidad, ya que esto ayudaría a disminuir las complicaciones microvasculares y macrovasculares de las personas con diabetes, y a mejorar su calidad de vida.
Las terapias actualmente disponibles proporcionan beneficios a corto y medio plazo, pero no controlan adecuadamente la glucemia a largo plazo, ya que no abordan el deterioro progresivo de la función celular β1. El GLP-1 es una hormona incretina que estimula la secreción de insulina e inhibe la liberación de glucagón de forma glucosa-dependiente, además de preservar la masa y función celular β en estudios en animales. Estos efectos lo convierten en un candidato potencial para modificar la historia natural de la diabetes tipo 23. Sin embargo, el GLP-1 endógeno tiene una semivida muy corta, de 1,5-2,1 minutos, debido a la rápida degradación que sufre por la enzima dipeptidilpeptidasa 4 (DPP-4)4.
Liraglutida es un análogo del GLP-1 humano desarrollado mediante dos modificaciones en el GLP-1 nativo: la adición de un ácido graso C16 a la lisina en la posición 26, a través de un aminoácido spacer o intermedio, y el cambio de lisina en la posición 34 por arginina. La molécula resultante mantiene una homología con el GLP-1 humano del 97%5, pero con un aumento de la autoasociación, que se traduce en un retraso en la absorción desde el tejido subcutáneo y un incremento en la unión a la albúmina, lo cual se asocia con una menor susceptibilidad a la degradación por la enzima DPP-4. Gracias a estos cambios, liraglutida tiene una prolongada semivida de 13 horas, permitiendo su administración una vez al día.
Basándose en los datos que derivan de los ensayos clínicos, liraglutida ofrece una alternativa atractiva para el tratamiento precoz de la diabetes tipo 2. Liraglutida puede mejorar significativamente el control glucémico, con un bajo potencial de inducir hipoglucemia debido a su mecanismo de acción glucosa-dependiente, y al mismo tiempo preservar potencialmente la función de las células β6. Es importante destacar que liraglutida se asocia con efectos positivos sobre otros factores de riesgo cardiovascular, como la disminución sostenida del peso corporal, la disminución de la presión arterial sistólica (PAS) y otros biomarcadores de riesgo cardiovascular7.
Liraglutida ha sido aprobada por la European Medicines Agency (EMA) para el tratamiento de la diabetes tipo 2 en combinación con metformina o una sulfonilurea, así como en combinación con metformina más una sulfonilurea o una tiazolidindiona8. En Estados Unidos, también está indicada en monoterapia.
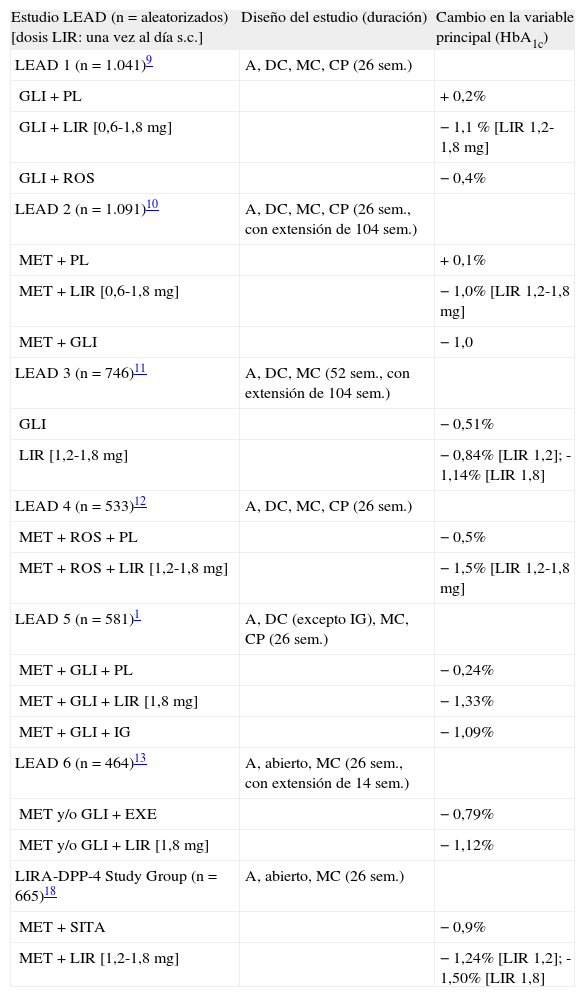
Eficacia y seguridad de liraglutida en el programa LEADLiraglutida ha sido evaluada en más de 25 ensayos clínicos con más de 5.000 individuos con diabetes tipo 2. El programa LEAD (Liraglutide Effect and Action in Diabetes)1,9–13 ha demostrado que liraglutida es eficaz y bien tolerada en los distintos estadios de la diabetes tipo 2, tanto en monoterapia como en combinación con uno o dos agentes orales (tabla 1).
| Estudio LEAD (n= aleatorizados) [dosis LIR: una vez al día s.c.] | Diseño del estudio (duración) | Cambio en la variable principal (HbA1c) |
| LEAD 1 (n= 1.041)9 | A, DC, MC, CP (26 sem.) | |
| GLI + PL | +0,2% | |
| GLI + LIR [0,6-1,8 mg] | −1,1 % [LIR 1,2-1,8 mg] | |
| GLI + ROS | −0,4% | |
| LEAD 2 (n= 1.091)10 | A, DC, MC, CP (26 sem., con extensión de 104 sem.) | |
| MET + PL | +0,1% | |
| MET + LIR [0,6-1,8 mg] | −1,0% [LIR 1,2-1,8 mg] | |
| MET + GLI | −1,0 | |
| LEAD 3 (n= 746)11 | A, DC, MC (52 sem., con extensión de 104 sem.) | |
| GLI | −0,51% | |
| LIR [1,2-1,8 mg] | −0,84% [LIR 1,2]; -1,14% [LIR 1,8] | |
| LEAD 4 (n= 533)12 | A, DC, MC, CP (26 sem.) | |
| MET + ROS + PL | −0,5% | |
| MET + ROS + LIR [1,2-1,8 mg] | −1,5% [LIR 1,2-1,8 mg] | |
| LEAD 5 (n= 581)1 | A, DC (excepto IG), MC, CP (26 sem.) | |
| MET + GLI + PL | −0,24% | |
| MET + GLI + LIR [1,8 mg] | −1,33% | |
| MET + GLI + IG | −1,09% | |
| LEAD 6 (n= 464)13 | A, abierto, MC (26 sem., con extensión de 14 sem.) | |
| MET y/o GLI + EXE | −0,79% | |
| MET y/o GLI + LIR [1,8 mg] | −1,12% | |
| LIRA-DPP-4 Study Group (n= 665)18 | A, abierto, MC (26 sem.) | |
| MET + SITA | −0,9% | |
| MET + LIR [1,2-1,8 mg] | −1,24% [LIR 1,2]; -1,50% [LIR 1,8] |
A: aleatorizado; CP: controlado con placebo; DC: doble ciego; EXE: exenatida; GLI: glimepirida; IG: insulina glargina; LIR: liraglutida; MC: multicéntrico; MET: metformina; PL: placebo; ROS: rosiglitazona; SITA: sitagliptina.
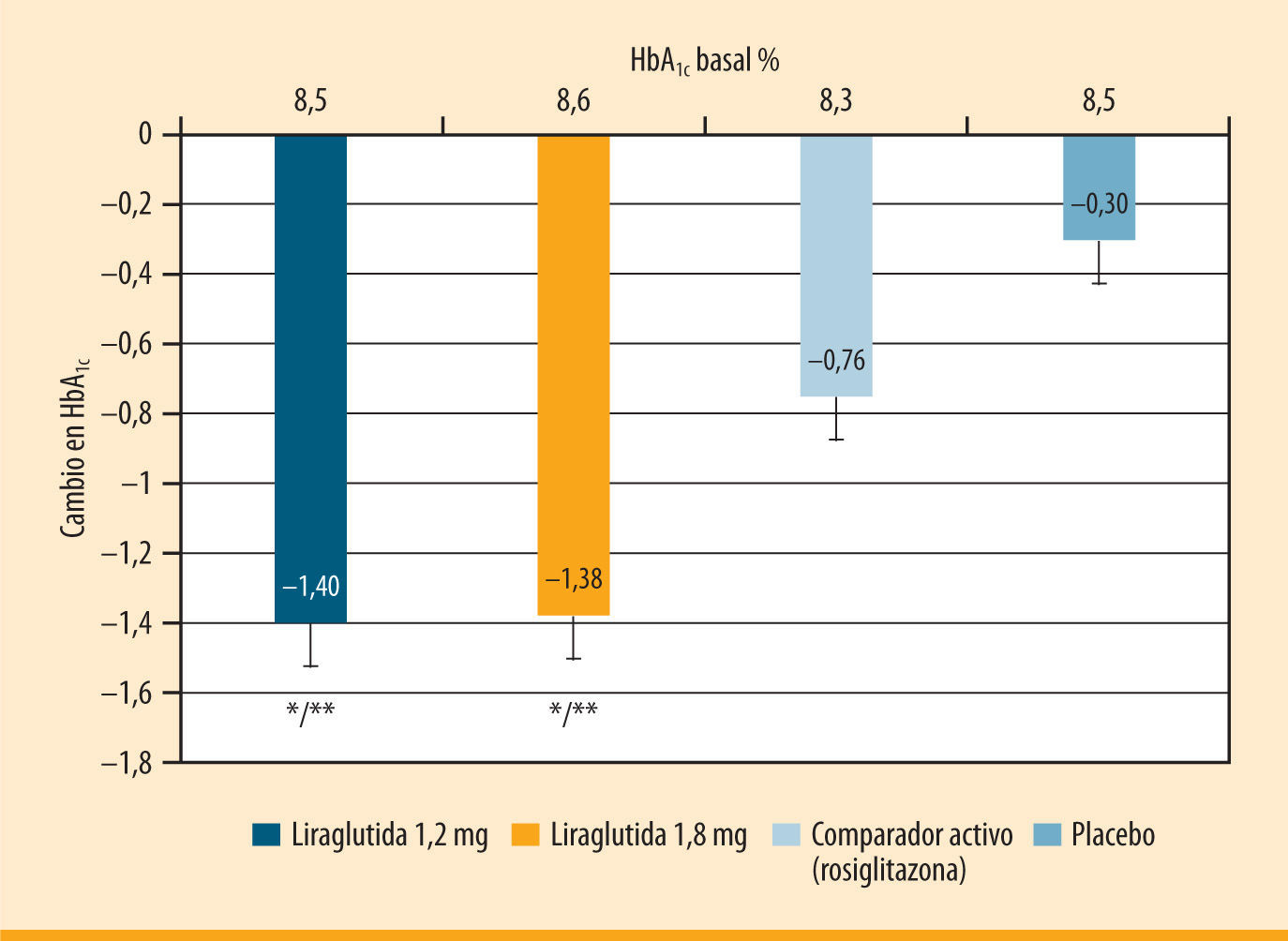
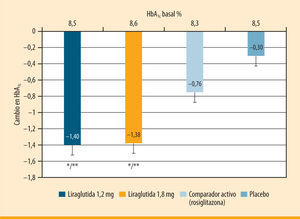
El objetivo principal en los ensayos clínicos del programa LEAD fue el descenso de la HbA1c al final del tratamiento. Los estudios LEAD 1, 2, 3 y 49–12 evaluaron diferentes dosis de liraglutida (0,6, 1,2 y 1,8 mg, una vez al día), mientras que los LEAD 5 y 61,13 evaluaron sólo la dosis de 1,8 mg una vez al día. En los estudios LEAD 1 y 29,10, el descenso de HbA1c respecto a los valores basales (en relación con placebo) fue de 1,1-1,3% y de 1,1-1,4% para liraglutida 1,2 y 1,8 mg, respectivamente. La eficacia de liraglutida 1,2 y 1,8 mg fue significativamente superior a la de rosiglitazona 4 mg en el estudio LEAD 1, cuando se añadía al tratamiento previo con glimepirida9,14 (figura 1). La reducción de la HbA1c se mantuvo hasta 2 años con liraglutida en las extensiones de los estudios LEAD 2 y 315,16. Además, liraglutida fue superior a otros dos tratamientos basados en incretinas, exenatida13,17 y sitagliptina18. En la tabla 1 se resumen los datos de eficacia de liraglutida en el programa LEAD. La reducción de la HbA1c con liraglutida fue significativamente mayor que la conseguida con glimepirida en monoterapia (LEAD 3), rosiglitazona (LEAD 1), insulina glargina (LEAD 5), exenatida (LEAD 6) y sitagliptina (en un estudio posterior al programa LEAD)18.
Eficacia de liraglutida frente a rosiglitazona (LEAD 1). Cambio en la HbA1c respecto al valor basal tras 26 semanas de tratamiento con liraglutida 1,2 o 1,8 mg una vez al día, rosiglitazona y placebo, en un estudio aleatorizado y doble ciego en 581 pacientes con inadecuado control de la diabetes tipo 2 a pesar del tratamiento previo con glimepirida en monoterapia14. *p <0,0001 frente a comparador activo (rosiglitazona); **p <0,0001 frente a placebo.
El manejo terapéutico de la DM2 requiere un tratamiento intensivo basado en la utilización de combinaciones de medicamentos con distintos mecanismos de acción, lo que puede aumentar el riesgo de sufrir hipoglucemias19. La incidencia de episodios de hipoglucemia con liraglutida ha sido, en general, muy baja, y los episodios reportados fueron casi exclusivamente de carácter leve1,9–13. En la extensión del estudio LEAD 3 a 2 años se registraron episodios de hipoglucemia leve en tasas de 0,16 y 0,28 episodios/paciente/año con liraglutida 1,2 y 1,8 mg16. Estos valores fueron 11,3 y 6,5 veces menos frecuentes que la tasa reportada para glimepirida (1,82 episodios/paciente/año). Por lo tanto, liraglutida tiene un riesgo bajo de hipoglucemia, aunque es mayor cuando se utiliza en combinación con una sulfonilurea10,11. Este fenómeno no se produce al combinar liraglutida con metformina o una glitazona.
Peso corporalLos tratamientos más utilizados para la diabetes tipo 2, particularmente la insulina, las sulfonilureas, las glinidas y las tiazolidindionas, inducen ganancia de peso en los pacientes con diabetes tipo 2. En lo que respecta a los tratamientos basados en incretinas, los inhibidores de la enzima DPP-4 son neutrales en relación con la ganancia ponderal, mientras que los agonistas del receptor del GLP-1 (exenatida y liraglutida) inducen una reducción de peso corporal debido a una disminución de la ingesta calórica19. En el estudio LEAD 2, que incluyó a 1.091 pacientes con diabetes tipo 2, liraglutida 1,2 y 1,8 mg consiguió una reducción del peso corporal de 2,6 y 2,8 kg, respectivamente, a las 26 semanas de tratamiento10, y de 3,0 y 2,9 kg después de 2 años de tratamiento15. Además, la pérdida de peso se asoció a una reducción de 1,8-2,8 cm en la circunferencia de cintura tras 2 años de seguimiento15.
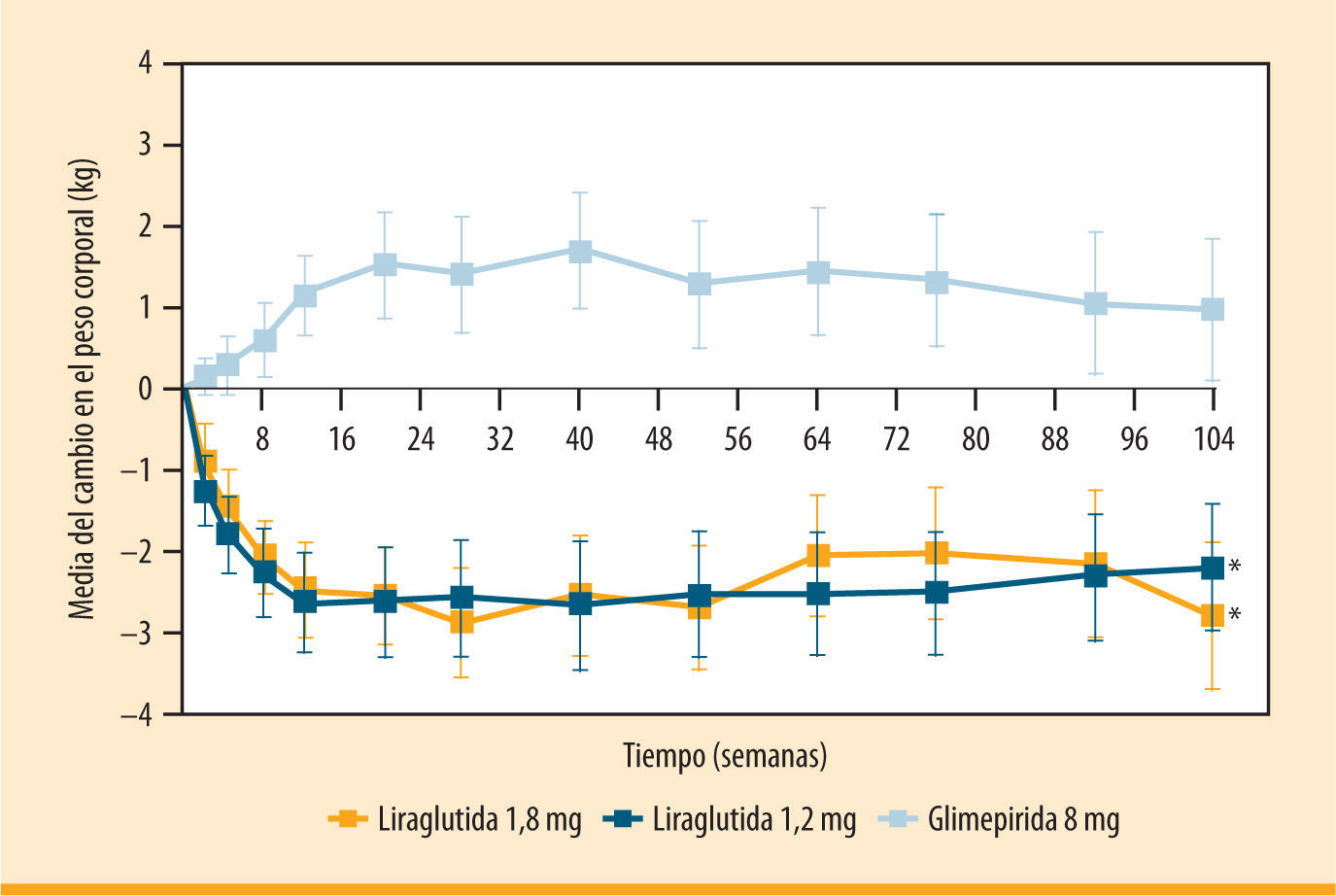
La pérdida de peso también se mantuvo a los 2 años en monoterapia con liraglutida en un estudio de extensión del LEAD 3 (figura 2)16. Es importante destacar que un metaanálisis de los seis estudios LEAD reportó que el 76% de los pacientes tratados con liraglutida perdieron peso, y el 24% perdieron >5% del peso corporal20. La reducción en el peso corporal deriva sobre todo del tejido graso, particularmente de la grasa visceral, y no de la masa magra. Este último hallazgo es importante, dado que la grasa visceral está asociada de manera importante con el aumento de los niveles de glucosa y lípidos y, en consecuencia, del riesgo cardiovascular21,22. Liraglutida también ha demostrado ser eficaz en conseguir una pérdida de peso significativa en pacientes obesos no diabéticos, de una forma dosisdependiente (1,2-1,8-2,4-3 mg) y significativamente superior a placebo y a orlistat (pérdidas de 4,8, 5,5, 6,3 y 7,2 kg con liraglutida, frente a 4,1 kg con orlistat y 2,8 kg con placebo)23.
Eficacia sostenida a largo plazo de liraglutida frente a gllmeplrlda (LEAD 3). Cambio en el peso corporal respecto al valor basal tras 2 años de tratamiento con liraglutida 1,2 mg (n= 110) o 1,8 mg (n= 114) una vez al día, frente a glimepirida (n= 97) (extensión del estudio LEAD 3)16. *p <0,0001, para valor al final de estudio, de 1,2 mg frente a glimepirida, y 1,8 mg frente a glimepirida
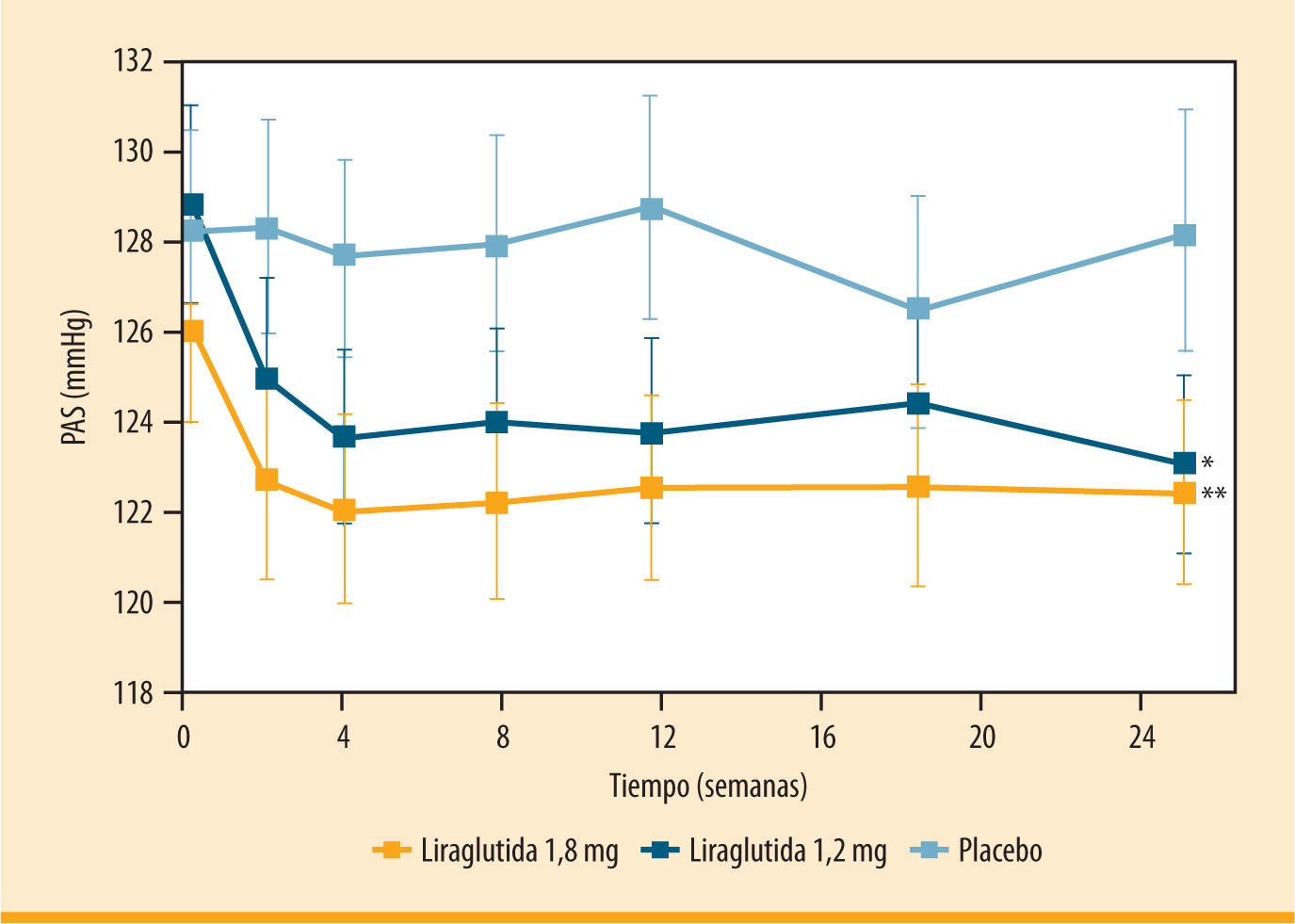
Liraglutida se asoció a un descenso rápido (en las primeras 2 semanas) y sostenido de la PAS, como demuestran los resultados obtenidos a partir de un metaanálisis de los seis estudios LEAD (figura 3)24. Los cambios en la PAS ocurrieron antes de que fuera observada una pérdida significativa de peso. Por este motivo, es poco probable que la pérdida ponderal explique los efectos a corto plazo sobre la presión arterial, aunque la reducción en el peso corporal podría contribuir parcialmente a la mejoría a largo plazo de la PAS. Una reducción todavía mayor en la PAS (−11,4 mmHg para ambas dosis, de 1,2 y 1,8 mg) se ha documentado en aquellos pacientes con una PAS en el cuartil más alto al inicio del estudio. No se ha observado una disminución significativa de la presión arterial diastólica en los estudios LEAD.
Disminución de la presión arterial sistólica (PAS) con liraglutida frente a placebo (metaanálisis de seis estudios LEAD). Cambio en la PAS respecto al valor basal en pacientes con diabetes tipo 2 tratados con liraglutida 1,2 mg (n= 896) o 1,8 mg (n= 1.363) una vez al día, o placebo (n= 524), durante 26 semanas. Resultados de un metaanálisis de los seis estudios LEAD24. *p= 0,003 para liraglutida 1,2 mg frente al nivel basal. **p= 0,0008 para liraglutida 1,8 mg frente al nivel basal
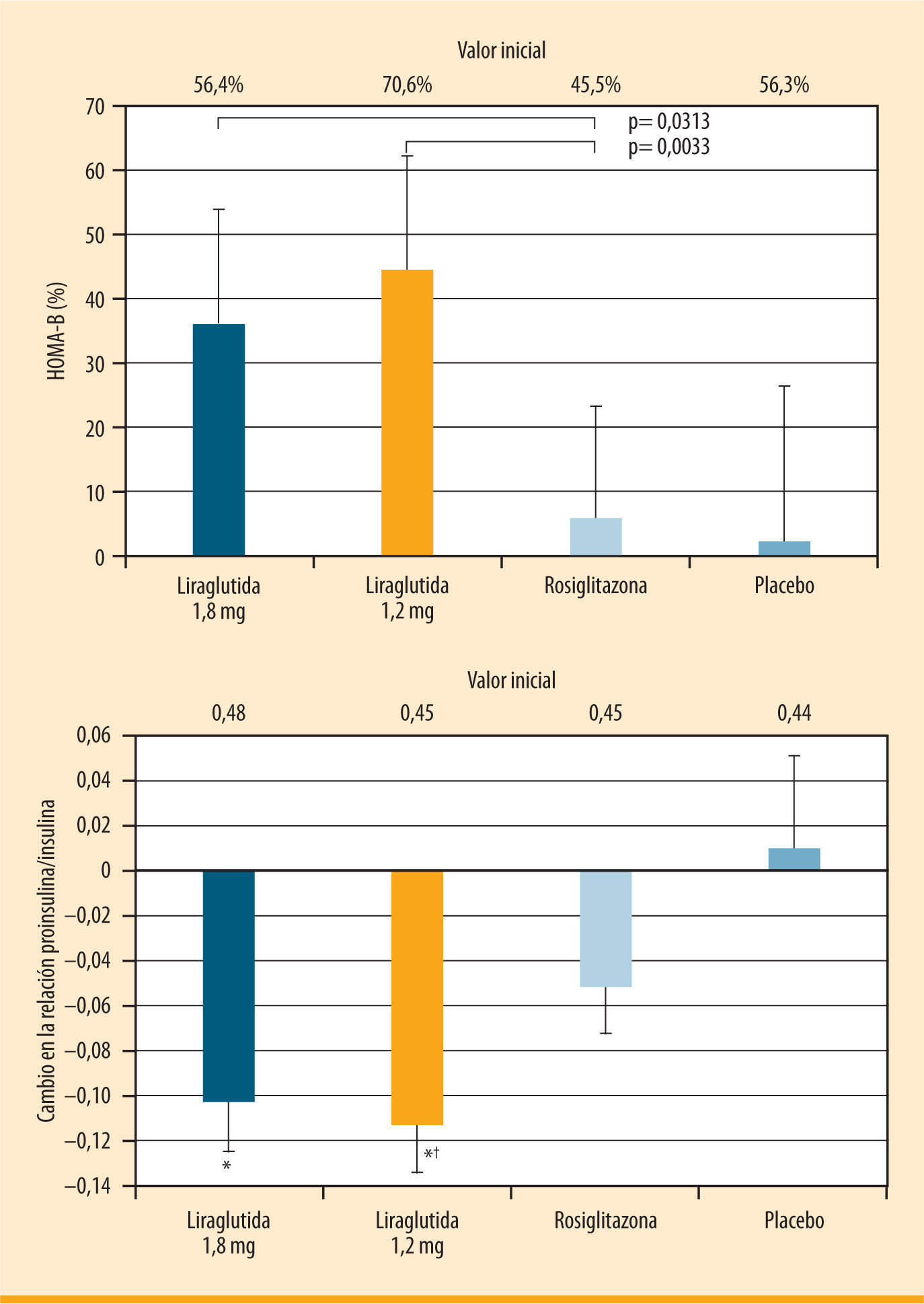
Los datos obtenidos in vitro e in vivo sugieren que el GLP-1 nativo tiene efectos beneficiosos sobre las células β pancreáticas. El GLP-1 induce un aumento de la proliferación celular β y de la neogénesis a partir de células progenitoras, además de una reducción de la apoptosis25. Efectos similares han sido reportados con liraglutida en estudios en animales, en particular con roedores, y en un experimento in vitro con células β humanas26–28. En ensayos clínicos, liraglutida mejoró de forma significativa la función de las células β, logrando mejoras tanto en el índice HOMA-B, que relaciona la secreción de insulina con los niveles de glucosa en ayunas, como en la relación proinsulina/insulina, que evalúa el grado de estrés celular β, siendo mejor el funcionamiento celular β cuanto menor es la relación proinsulina/insulina (figura 4)9. Además, contrariamente a lo que ocurre con otros medicamentos utilizados en monoterapia29, y en particular con las sulfonilureas, con liraglutida no se observa una pérdida de eficacia en el control glucémico en ensayos clínicos de hasta 2 años de duración15,16.
Efecto de liraglutida frente a rosiglitazona sobre la función de las células β (LEAD 1). Mejoría en la función celular β en pacientes con diabetes tipo 2 tras 26 semanas de tratamiento con liraglutida: HOMA-B e índice proinsulina/insulina9. *p <0,05 comparado con rosiglitazona y con placebo. fp <0,0001 comparado con placebo
Estos datos sugieren beneficios adicionales en la preservación de la función secretora y en la citoprotección de la masa celular β1,9,10. Si estas ventajas se confirman en la práctica clínica, podrían mejorar la sostenibilidad del control glucémico durante un mayor periodo de tiempo, evitando la necesaria adición de otros compuestos y, finalmente, el tratamiento con insulina. Si esto fuera así, estaríamos ante el primer tratamiento farmacológico que modificaría la historia natural de la diabetes tipo 2.
Efectos adversosLos efectos gastrointestinales, principalmente las náuseas, los vómitos y la diarrea, son los acontecimientos adversos más comunes en pacientes tratados con liraglutida1,9–13. En pacientes tratados durante 6 meses con liraglutida 1,2 o 1,8 mg en combinación con metformina, se reportó al menos un episodio de náuseas en el 16 y el 19% de los casos, respectivamente10. Sin embargo, la incidencia disminuyó con el tiempo y en la mayoría de los casos desaparecieron dentro de las 12 semanas de inicio del tratamiento. El índice de abandonos registrados debido a las náuseas fue muy bajo (2,8% de los pacientes)7, y ninguno fue reportado durante la extensión a largo plazo del estudio LEAD 3, que realizó un seguimiento a 2 años16.
Durante el programa LEAD, el 8,6% de los pacientes desarrolló anticuerpos antiliraglutida, pero no se detectaron diferencias en el control glucémico entre los pacientes anticuerpos-positivos y anticuerpos-negativos8.
Se han notificado casos aislados de pancreatitis aguda (<0,2%) durante los ensayos clínicos a largo plazo con liraglutida8, con una incidencia dentro del rango esperado o incluso inferior para los pacientes con diabetes tipo 2, que presentan un riesgo casi tres veces mayor de sufrir pancreatitis aguda que la población sin diabetes30.
Finalmente, en estudios realizados en roedores tratados con liraglutida, se ha observado en algunos casos la aparición de cáncer medular de tiroides (tumores de células C) o hiperplasia de células C, aunque no existe evidencia contrastada de este riesgo en primates o humanos31,32. Es muy posible que este fenómeno sea exclusivo de los modelos experimentales empleados en estos estudios, y muy en particular en ratones hembra, que presentan una tendencia espontánea elevada a desarrollar hiperplasia de células C de tiroides.
Liraglutida: consideraciones prácticasSelección de pacientes: ¿quién puede beneficiarse de liraglutida?La eficacia clínica de liraglutida ha sido demostrada en los diversos estadios del tratamiento de la diabetes tipo 2, tal como demuestran los resultados del programa LEAD. En este programa se incluyeron pacientes con mal control metabólico a pesar de las recomendaciones en el estilo de vida (dieta y ejercicio), y en tratamiento con metformina (con o sin una sulfonilurea) como tratamiento previo más frecuente1,9–13. En Europa, liraglutida está aprobada en combinación con metformina o una sulfonilurea, o en combinación con metformina más una sulfonilurea o con metformina y una tiazolidindiona33.
El tratamiento con análogos del GLP-1 debería iniciarse preferentemente en las fases tempranas de la diabetes, ya que los beneficios clínicos obtenidos son posiblemente más relevantes que en estadios tardíos de la enfermedad. En el caso de liraglutida, los datos que apoyan esta recomendación son:
- a.
Mayor reducción de la HbA1c en pacientes tratados previamente con un solo fármaco antidiabético que con dos o más fármacos9,10,14.
- b.
Las ventajas potenciales de liraglutida sobre la función celular β harían aconsejable su utilización preferentemente al inicio de la enfermedad y no en etapas avanzadas, cuando el grado de deterioro de la función celular β posiblemente no permita la recuperación de ésta.
- c.
Los beneficios en el perfil de riesgo cardiovascular, por la reducción del peso corporal1,9–13; la disminución del tejido adiposo visceral, con una reducción asociada de la circunferencia de cintura15,21; la reducción de la PAS1,9–13, y las mejorías modestas en el perfil de lípidos y los biomarcadores de riesgo cardiovascular34.
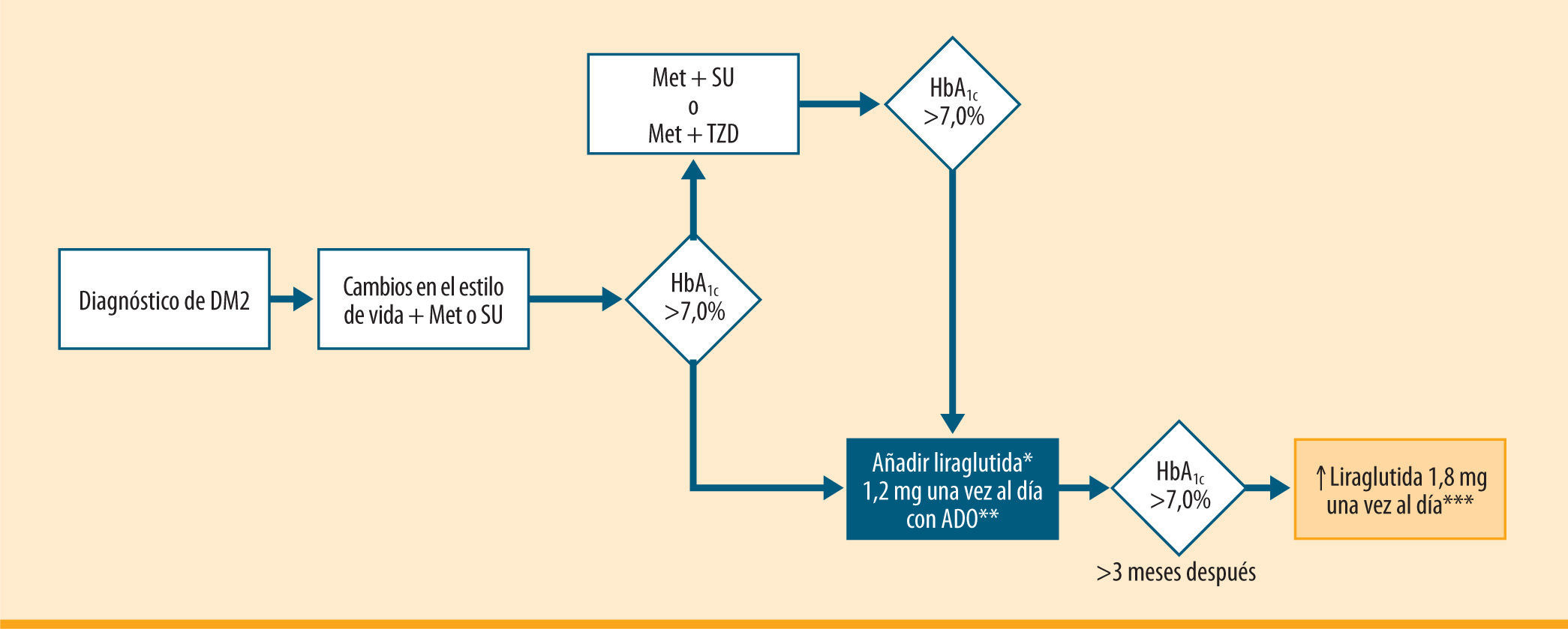
Por tanto, siguiendo las recomendaciones del consenso de la ADA/EASD para el manejo de la hiperglucemia en la diabetes tipo 22, liraglutida debería iniciarse tan pronto como fuera posible (a los 2-3 meses) en pacientes con diabetes no controlada (HbA1c >7,0%) a pesar de recibir la dosis máxima tolerada de metformina o de una sulfonilurea2. El mismo razonamiento se puede seguir cuando liraglutida es empleada como tercer fármaco en pacientes tratados con metformina en combinación con una sulfonilurea, o con metformina asociada a una tiazolidindiona (figura 5).
Algoritmo de uso de liraglutida en la diabetes tipo 2 basándose en las indicaciones del consenso de la ADA/EASD38. ADO: antidiabéticos orales; Met: metformina; SU: sulfonilurea; TZD: tiazolidindiona. Iniciar liraglutida 0,6 mg una vez al día al menos durante una semana; si es bien tolerada, incrementar a 1,2 mg una vez al día. Ésta es la dosis de mantenimiento, independientemente del IMC. No hay necesidad de autocontrol a menos que se administre con una SU. "Disminuir la dosis de la SU al 50% para evitar el riesgo de hipoglucemia. ***Mientras la dosis de 1,2 mg sea bien tolerada
Es importante señalar que liraglutida es eficaz en pacientes con diabetes tipo 2 tanto obesos como no obesos35. Además, liraglutida disminuye la HbA1c independientemente de la pérdida de peso20.
No es recomendable sustituir insulina por liraglutida en pacientes con diabetes tipo 2 avanzada, pues el grado de función celular β puede ser insuficiente para que liraglutida resulte efectiva. No existe evidencia sobre el uso de liraglutida en combinación con insulina, pero actualmente se está llevando a cabo un ensayo clínico con liraglutida coadministrada con insulina detemir33.
Liraglutida: dosificación y administraciónProporcionar información al paciente sobre los beneficios y riesgos potenciales con liraglutida es esencial para asegurar el éxito de esta terapia. Hacer hincapié en la pérdida de peso y el bajo riesgo de hipoglucemia puede ayudar a mejorar la aceptación por el hecho de ser una terapia inyectable. También es importante explicar al paciente que liraglutida no es insulina, sino una terapia indicada al inicio de la enfermedad, que no requiere a priori monitorización de la glucemia capilar (salvo en asociación con sulfonilureas) ni ajuste continuo de dosis, además de que la inyección subcutánea es fácil y prácticamente indolora.
Una ventaja importante de liraglutida sobre el otro agonista del receptor de GLP-1 disponible, exenatida, es que por su larga duración de acción se administra una vez al día, frente a las dos veces al día con exenatida. Además, liraglutida se administra independientemente del horario de las comidas, mientras que exenatida se debe administrar dentro de los 60 minutos antes de las dos comidas más importantes del día8.
La dosificación debe iniciarse con 0,6 mg por día al menos durante una semana, para mejorar la tolerabilidad gastrointestinal, y luego aumentar a 1,2 mg una vez al día. Si la HbA1c persiste >7,0% (se recomienda medir la HbA1c cada 3 meses), algunos pacientes pueden lograr un mejor control glucémico incrementando la dosis a 1,8 mg una vez al día (es la dosis máxima permitida) (figura 5).
Debido al bajo riesgo de hipoglucemia, no es necesario realizar monitorización de la glucemia capilar durante la administración de liraglutida, a menos que ésta sea utilizada en combinación con una sulfonilurea.
Cuando se utiliza liraglutida en combinación con una sulfonilurea, se recomienda que la dosis de sulfonilurea se reduzca para disminuir el riesgo de hipoglucemia. En ausencia de una recomendación específica al respecto, es aconsejable una disminución del 50% de la dosis previa de la sulfonilurea cuando un paciente comienza con liraglutida.
En relación con poblaciones especiales, existe una experiencia clínica limitada. No se requieren ajustes de dosis en pacientes de hasta 75 años de edad, o en aquellos con insuficiencia renal leve, con aclaramiento de creatinina entre 60 y 90 mL/min. En la actualidad, liraglutida no está recomendada en menores de 18 años, en mayores de 75 años, en mujeres embarazadas (o que están intentando quedar embarazadas) o en periodo de lactancia, en pacientes con disfunción hepática (ya sea leve, moderada o severa) o en aquellos con insuficiencia renal moderada a severa con un aclaramiento de creatinina <60 mL/min. Sin embargo, puesto que liraglutida no se elimina por vía renal, estudios de farmacocinética muestran que parece ser segura sin necesidad de ajuste de dosis en cualquier grado de insuficiencia renal36.
Enfoque clínico de la seguridad y la tolerabilidadLa experiencia con liraglutida en el programa LEAD1,9–13 muestra que este fármaco tiene un bajo potencial de causar hipoglucemia. Sin duda, esto representa una ventaja clínica para este medicamento a la hora de elegir una terapia complementaria en pacientes con diabetes tipo 2 no controlada. Es importante que los pacientes comprendan los potenciales efectos adversos gastrointestinales (principalmente náuseas) relacionados con liraglutida al iniciar el tratamiento, y que se lleven a cabo una serie de acciones para maximizar la tolerabilidad y el cumplimiento por parte del paciente.
La siguiente información debería ser discutida con el paciente antes de iniciar el tratamiento con liraglutida:
- a.
Aunque puedan producirse náuseas, éstas serán frecuentemente leves y en general desaparecerán en pocos días o semanas con la continuidad del tratamiento.
- b.
Si se produjeran náuseas, éstas pueden disminuir y desaparecer consumiendo comidas en pequeñas cantidades, evitando la ingesta de alimentos con elevado contenido en grasas y retrasando el aumento de la dosis de liraglutida hasta que las náuseas sean más tolerables. Si no se consigue mejoría con las citadas medidas no farmacológicas, el tratamiento antiemético (p. ej., con metoclopramida o domperidona) podría ser útil.
Debido a la baja frecuencia (<0,2%) de pancreatitis aguda en los pacientes tratados con liraglutida8, y aunque es improbable, no puede establecerse ni descartarse en estos momentos una relación de causalidad entre liraglutida y la pancreatitis. En vista de ello, al iniciar liraglutida los pacientes deben ser informados sobre los síntomas de la pancreatitis aguda, como dolor abdominal intenso y continuo, con o sin náuseas. Si se sospecha una pancreatitis, liraglutida y otros medicamentos potencialmente nocivos deben ser suspendidos8.
Por su similitud con la molécula del GLP-1 humano (97% de homología de aminoácidos), muy pocos pacientes tratados con liraglutida desarrollan anticuerpos (8,6%), y hasta ahora no hay informes de pérdida de eficacia debida a altos títulos de anticuerpos8. Esto ocurre en contraste con exenatida, que está asociada con una gran respuesta de anticuerpos (alrededor del 40% de los pacientes)6, y con una pérdida de eficacia en alrededor del 3% de los pacientes37.
En estudios in vitro con liraglutida se informó de un potencial muy bajo de interacciones medicamentosas relacionadas con los cambios en la unión a proteínas plasmáticas o a vías del citocromo P450 microsomal8. Los efectos gastrointestinales asociados con liraglutida durante las primeras semanas de tratamiento tienen el potencial de alterar la absorción de medicamentos concomitantes administrados por vía oral. Sin embargo, los estudios con fármacos como atorvastatina, digoxina, griseofulvina, lisinopril, anticonceptivos orales y paracetamol constataron pequeños cambios en la absorción, y ninguno fue considerado clínicamente relevante para requerir ajustes de dosis8.
Aunque no existe evidencia sobre riesgo de cáncer medular de tiroides en humanos, es probablemente aconsejable evitar su uso en pacientes con historia personal o familiar de cáncer medular de tiroides, y en pacientes con el síndrome de neoplasia endocrina múltiple tipo 2. Sobre la base de la evidencia disponible, no se recomienda la monitorización rutinaria con calcitonina plasmática o con estudios de imagen de tiroides.
ConclusionesLiraglutida es el primer análogo humano del GLP-1 aprobado para el tratamiento de la diabetes mellitus tipo 2. Liraglutida mejora el control glucémico, reduce el peso corporal y la presión arterial sistólica, y mejora la función de la célula β, además de asociarse a un bajo riesgo de hipoglucemia. Asimismo, este fármaco tiene una fácil dosificación (una vez al día). Junto a estas ventajas, el perfil positivo de riesgo cardiovascular hace de liraglutida una opción preferente de tratamiento frente a otros fármacos disponibles en la actualidad para la diabetes tipo 2. Por ello, es recomendable iniciar el tratamiento con liraglutida en fases tempranas de la enfermedad, con la finalidad de obtener el máximo beneficio en este tipo de pacientes.
Declaración de potenciales conflictos de interesesTodos los miembros de este grupo de trabajo recibieron soporte de Novo Nordisk para la realización de una reunión multidisciplinar presencial, que dio origen a la elaboración de este documento de consenso.




 LEAD 1). Cambio en la HbA1c respecto al valor basal tras 26 semanas de tratamiento con liraglutida 1,2 o 1,8 mg una vez al día, rosiglitazona y placebo, en un estudio aleatorizado y doble ciego en 581 pacientes con inadecuado control de la diabetes tipo 2 a pesar del tratamiento previo con glimepirida en monoterapia14. *p <0,0001 frente a comparador activo (rosiglitazona); **p <0,0001 frente a placebo.' title='Eficacia de liraglutida frente a rosiglitazona (
LEAD 1). Cambio en la HbA1c respecto al valor basal tras 26 semanas de tratamiento con liraglutida 1,2 o 1,8 mg una vez al día, rosiglitazona y placebo, en un estudio aleatorizado y doble ciego en 581 pacientes con inadecuado control de la diabetes tipo 2 a pesar del tratamiento previo con glimepirida en monoterapia14. *p <0,0001 frente a comparador activo (rosiglitazona); **p <0,0001 frente a placebo.' title='Eficacia de liraglutida frente a rosiglitazona (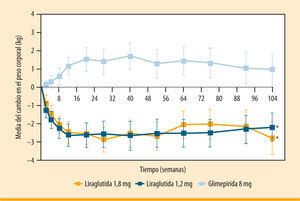 LEAD 3). Cambio en el peso corporal respecto al valor basal tras 2 años de tratamiento con liraglutida 1,2 mg (n= 110) o 1,8 mg (n= 114) una vez al día, frente a glimepirida (n= 97) (extensión del estudio
LEAD 3). Cambio en el peso corporal respecto al valor basal tras 2 años de tratamiento con liraglutida 1,2 mg (n= 110) o 1,8 mg (n= 114) una vez al día, frente a glimepirida (n= 97) (extensión del estudio 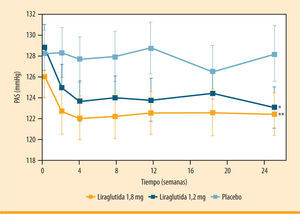 PAS) con liraglutida frente a placebo (metaanálisis de seis estudios
PAS) con liraglutida frente a placebo (metaanálisis de seis estudios 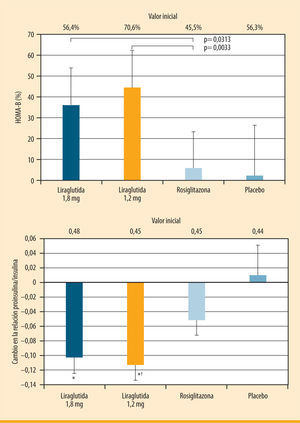 LEAD 1). Mejoría en la función celular β en pacientes con diabetes tipo 2 tras 26 semanas de tratamiento con liraglutida:
LEAD 1). Mejoría en la función celular β en pacientes con diabetes tipo 2 tras 26 semanas de tratamiento con liraglutida: 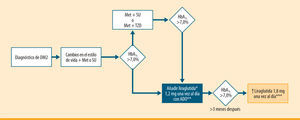 ADA/EASD38. ADO: antidiabéticos orales; Met: metformina; SU: sulfonilurea; TZD: tiazolidindiona. Iniciar liraglutida 0,6 mg una vez al día al menos durante una semana; si es bien tolerada, incrementar a 1,2 mg una vez al día. Ésta es la dosis de mantenimiento, independientemente del IMC. No hay necesidad de autocontrol a menos que se administre con una SU. "Disminuir la dosis de la SU al 50% para evitar el riesgo de hipoglucemia. ***Mientras la dosis de 1,2 mg sea bien tolerada' title='Algoritmo de uso de liraglutida en la diabetes tipo 2 basándose en las indicaciones del consenso de la
ADA/EASD38. ADO: antidiabéticos orales; Met: metformina; SU: sulfonilurea; TZD: tiazolidindiona. Iniciar liraglutida 0,6 mg una vez al día al menos durante una semana; si es bien tolerada, incrementar a 1,2 mg una vez al día. Ésta es la dosis de mantenimiento, independientemente del IMC. No hay necesidad de autocontrol a menos que se administre con una SU. "Disminuir la dosis de la SU al 50% para evitar el riesgo de hipoglucemia. ***Mientras la dosis de 1,2 mg sea bien tolerada' title='Algoritmo de uso de liraglutida en la diabetes tipo 2 basándose en las indicaciones del consenso de la 