Hasta la fecha, algunos aspectos relacionados con la variabilidad glucémica no han conseguido dilucidarse con claridad. Cuestiones tales como la implicación que pudiera tener la «variabilidad glucémica a corto plazo» en el desarrollo de las complicaciones crónicas de la diabetes continúan sin respuesta. Sin embargo, cada vez está adquiriendo mayor relevancia el papel de «la variabilidad glucémica a largo plazo», o variabilidad de la HbA1c, en el desarrollo de dichas complicaciones. Por otra parte, la variabilidad glucémica es uno de los factores pronósticos más destacados de las hipoglucemias graves e inadvertidas, y se constituye en el factor limitante para conseguir un control óptimo de la diabetes. En esta revisión se pretende abordar los aspectos más relevantes de la variabilidad glucémica, intentando clarificar en lo posible qué es lo que podríamos esperar con su control. Además se ofrecen unas directrices con las medidas óptimas a emplear para valorarla de forma adecuada.
Some aspects of glycemic variability are still not clear. Questions like the role that «short term glycemic variability» could play in the development of diabetic complications is still unanswered. On the other hand, A1C variability, or «long term glycemic variability», emerges as one of the most relevant actors in development and progression of the chronic vascular complications of diabetes. Furthermore, glycemic variability plays a central role in causing dangerous and unnoticed hypoglycemia, and it becomes the limiting factor to achieve an optimal regulation of diabetes. In this review, the most important aspects of glycemic variability are discussed, as well as clarifying, as far as is possible, what we should expect from its control. Some recommendations are also offered on how to evaluate it properly.
Aunque el concepto de variabilidad glucémica comenzó a acuñarse en los años setenta, gracias a las observaciones publicadas por Service et al.1 y Molnar et al.2, hasta la fecha no se ha conseguido una definición clara de la misma. Esto quizá sea debido a la gran cantidad de aspectos tan dispares que engloba el concepto de variabilidad.
Por ello, de entre todas las acepciones posibles, quizá la más práctica sea la esbozada por Rodbard3, quien la define de forma indirecta como «el factor limitante para alcanzar el control glucémico en términos de niveles de glucosa: no se puede reducir la glucemia media sin incurrir en una inaceptable tasa de hipoglucemias, hasta que (o simultáneamente) no se reduzca la variabilidad glucémica».
Por otra parte, aunque tenemos muy claro desde la década de los noventa el papel que juega la glucemia media (y su expresión como HbA1c) en el desarrollo de las complicaciones diabéticas4, también sabemos que la «exposición total a la glucemia» (media de los valores de HbA1c y de la duración de la diabetes) justificaría tan solo entre el 11 y el 23% de las complicaciones microvasculares5,6. Esto implica que más del 75% de dichas complicaciones se sustentarían en mecanismos etiopatogénicos y fisiopatológicos diferentes de la hiperglucemia sostenida.
Sobre esta base, Brownlee y Hirsch7, del grupo del Diabetes Control and Complications Trial (DCCT), sugirieron que, a igualdad de valores de HbA1c, la variabilidad glucémica podría explicar, al menos en parte, el hecho de que la retinopatía diabética tuviera una incidencia netamente superior en el grupo de pacientes sometidos a tratamiento convencional respecto al grupo de pacientes sometidos a tratamiento intensivo. En el mismo año, Monnier et al.8 publicaron la primera referencia de peso que ponía en relación la variabilidad glucémica y el incremento del estrés oxidativo en pacientes con diabetes mellitus tipo2 (DM2). Desde entonces, el número de publicaciones científicas relativas a variabilidad glucémica ha incrementado su número de forma exponencial.
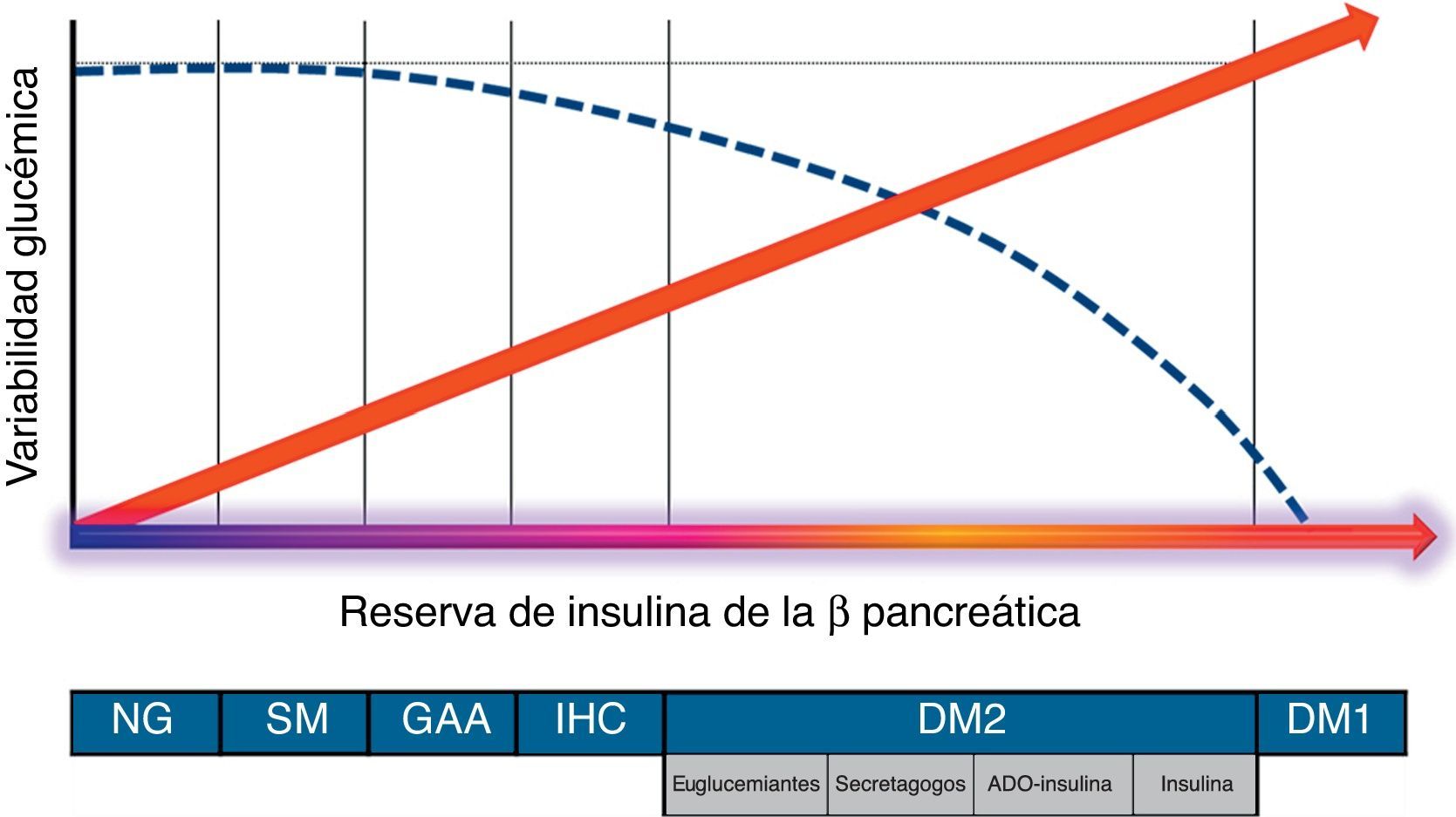
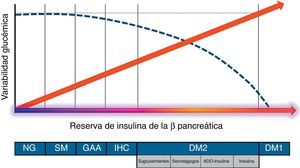
¿Desde qué momento existe la variabilidad glucémica?Son varios los trabajos que han demostrado que las cifras de glucemia fluctúan de forma significativa a lo largo del día, incluso en población no diabética. En el ADAG Study9 se evidenció que más del 90% de la población general, sin diagnóstico de alteraciones del metabolismo de los hidratos de carbono, pasa una media de 30min al día en valores de glucemia >140mg/dl. Por otra parte, se ha constatado un incremento significativo en la variabilidad glucémica entre los familiares de primer grado de pacientes con DM2, que aumenta desde las situaciones de normoglucemia hasta las de intolerancia a hidratos de carbono10. Dicha variabilidad se encuentra en estrecha relación con la funcionalidad de la célula beta pancreática en situación posprandial11, resultando máxima en situaciones de nula reserva de insulina (fig. 1).
Evolución de la variabilidad glucémica en función de la funcionalidad posprandial de la célula beta pancreática (reserva de insulina endógena).
ADO: antidiabéticos orales; DM1: diabetes mellitus tipo1; DM2: diabetes mellitus tipo2; GAA: glucemia alterada en ayunas; IHC: intolerancia a los hidratos de carbono; NG: normoglucemia; SM: síndrome metabólico-resistencia a la insulina.
La determinación de la variabilidad glucémica depende de muchos factores, entre los que cabe destacar el tipo de medición de la glucemia, el tiempo en el cual queremos determinar dicha variabilidad y el método estadístico a emplear (tabla 1). Revisar los procedimientos para evaluar la variabilidad glucémica escapa claramente del objetivo de este trabajo y, por otra parte, existen numerosas revisiones bibliográficas de gran calidad que el lector interesado puede consultar12–15. Sin embargo, merece la pena constatar que los diferentes métodos al uso determinan distintos aspectos de la variabilidad. Así, autores como Monnier et al.16 se decantan por el uso de la desviación estándar, Mean Amplitude of Glucose Excursions (MAGE) y Mean Of Daily Differences (MODD), argumentando que son los métodos más ampliamente utilizados en la mayor parte de los trabajos y que, entre los 3, consiguen evaluar de forma consistente los aspectos más relevantes de la variabilidad glucémica. En cambio, autores como Rodbard15,17 abogan por centralizar todas las mediciones en la desviación estándar y en el coeficiente de variación (medida subrogada de la desviación estándar), dado que todos los demás métodos se correlacionan de forma significativa con estos índices. De forma más reciente, el consenso «The Ambulatory Glucose Profile» (AGP) aboga por el uso de estas 2 medidas, asociadas al rango intercuartílico, para expresar los datos de la variabilidad glucémica cuando se emplea la monitorización ambulatoria de glucosa18.
Componentes de la medida de la variabilidad glucémica
| Tipo de determinación de la glucemia |
| Capilar (automonitorización de glucemia) |
| Intersticial (monitorización continua de glucemia) |
| Tiempo en el que deseamos valorar la variabilidad de la glucemia |
| Intradía |
| Interdía (48 h) |
| Periodos mayores de tiempo |
| Método estadístico empleado |
| Medidas basadas en la desviación estándar |
| Medidas diferentes de la desviación estándar |
Los métodos empleados para determinar la variabilidad glucémica están condicionados, en la mayor parte de las ocasiones, por la muestra con la que se trabaja. Por ejemplo, en grandes series, como la del DCCT, solo se tiene acceso a perfiles de glucemia capilar de 7 puntos, ya que el tamaño muestral hubiera hecho inviable el uso de monitorización continua de glucosa. Otros estudios, por el contrario, se basan en el uso de monitorización continua de glucosa intersticial. La gran ventaja de estos últimos es que son capaces de determinar las fluctuaciones de glucemia que ocurren a lo largo del día con mayor precisión, mientras que estudios como el DCCT aportan un gran volumen de pacientes seguidos durante mucho tiempo. Los estudios con monitorización continua de glucosa adolecen, en cambio, de que el número de pacientes suele ser discreto y el tiempo de seguimiento, en general, corto. En todo caso, las diferencias existentes en cuanto a la metodología, tanto en la manera de determinación de la glucemia como en el método estadístico empleado para el cálculo de la variabilidad, hacen necesario que se tenga que extremar la prudencia a la hora de comparar los resultados entre los estudios que emplean diferentes metodologías.
¿Influye la variabilidad glucémica en los valores de HbA1c?La glucemia media plasmática se correlaciona fuertemente con los valores de HbA1c, de tal forma que esta última determinación se considera, en realidad, una medida «subrogada» de la glucemia media19.
Sin embargo, resulta mucho más polémica la influencia que pueda tener la variabilidad glucémica sobre los valores de HbA1c. De los estudios realizados sobre la base de datos del DCCT, 2 de ellos no evidenciaron relación entre la variabilidad glucémica y los valores de HbA1c20,21, mientras que un tercero, más reciente, encontró que las asociaciones de la glucemia posprandial y de la variabilidad glucémica con la HbA1c resultaron relativamente débiles y se atenuaron aún más cuando la glucemia media se incluyó en el análisis multivariado22. Entre los pacientes con DM2, tanto los resultados objetivados por Kohnert et al.23 como los extraídos del ADAG Study24 no encuentran asociaciones claramente significativas entre variabilidad glucémica y HbA1c. Los últimos autores encuentran una relación muy débil de la variabilidad glucémica con la glucemia media plasmática, pero tan solo en pacientes con diabetes tipo1 (DM1) y solamente en aquellos casos en los que los niveles de HbA1c eran marcadamente elevados. Estos resultados ponen de manifiesto, por tanto, que la variabilidad glucémica es mayor en los pacientes que presentan niveles superiores de glucemia media plasmática (y, por tanto, de HbA1c), es decir, en los pacientes peor controlados.
Variabilidad glucémica y estrés oxidativo en humanosAunque existen gran cantidad de trabajos realizados in vitro y en experimentación animal que relacionan las fluctuaciones agudas de las concentraciones de glucosa con la activación del estrés oxidativo y la lesión endotelial, los resultados de los ensayos clínicos aleatorizados realizados en humanos son mucho más inconsistentes a este respecto.
Entre las evidencias a favor, cabe destacar el trabajo realizado por Monnier et al.8 en pacientes con DM2. En este ensayo encontraron una relación muy significativa entre la variabilidad glucémica, determinada por monitorización continua de glucosa y calculada mediante MAGE, con la excreción urinaria de 15(S)-8-iso-PGF2α, un marcador de activación del estrés oxidativo. En pacientes con DM1, Ceriello et al.25 encuentran que la hiperglucemia aguda parece empeorar la función endotelial e incrementa la respuesta inflamatoria y el estrés oxidativo, independientemente de la duración de la enfermedad y del control glucémico previo.
Sin embargo, también existen numerosas evidencias en contra de esta asociación, ya que los resultados obtenidos por Monnier y Ceriello no han podido ser reproducidos por otros autores, ni en pacientes con DM126, ni en pacientes con DM227, ni en voluntarios sanos28. Posteriormente, el propio Monnier29 confirmó que los hallazgos iniciales que relacionaban las fluctuaciones de glucemia con el estrés oxidativo solo eran válidos para los pacientes con DM2 tratados de forma exclusiva con antidiabéticos orales, no encontrando esta asociación en los pacientes tratados con insulina, tanto con DM1 como con DM2. Además, el estrés oxidativo (determinado nuevamente por la excreción urinaria de 15(S)-8-iso-PGF2α) era más evidente en los pacientes mal controlados, con mayores niveles de HbA1c, resultados que son concordantes con las observaciones de otros autores, los cuales no encuentran un exceso de estrés oxidativo relacionado con las fluctuaciones de glucemia en pacientes con DM2 bien controlados30. Aunque Monnier et al.29 especulan con la posibilidad de que la propia insulina ejerza un papel «antiinflamatorio», lo que realmente inducen a pensar estos resultados es que el mal control glucémico sostenido podría ser el origen per se del exceso del estrés oxidativo observado en estos pacientes, mientras que la variabilidad aguda de la glucemia tendría menor relevancia26.
Además de lo anterior, la ausencia de reproducibilidad en los resultados referentes a la activación del estrés oxidativo por las fluctuaciones agudas de glucemia podría tener otras explicaciones. En primer lugar, la metodología empleada para la determinación del marcador del estrés oxidativo (15(S)-8-iso-PGF2α) en los estudios de Monnier y de Wentholt es diferente. Este último autor26 apunta a que el método empleado por su grupo es mucho más específico para la medida de este componente que el empleado por otros autores, lo que daría lugar a una posible sobreestimación de las cantidades de este marcador de estrés oxidativo en otros trabajos. Por otra parte, la duración de los estados de hiperglucemia inducidos en los diferentes trabajos también podría jugar un papel relevante en la etiopatogenia del estrés oxidativo. En el ensayo de Ceriello et al.25 los participantes eran sometidos a clamps hiperglucémicos durante 6h, mientras que en el estudio de Wakil et al.28 la duración máxima fue de 180min. En tercer lugar, dado que los niveles de 15(S)-8-iso-PGF2α son netamente superiores en pacientes con DM1 que en los controles, independientemente de la variabilidad glucémica que puedan expresar25,26, se podría especular con la hipótesis de que en la DM1 existirían otras vías relacionadas con la activación del estrés oxidativo, diferentes de la variabilidad glucémica30.
Variabilidad glucémica y riesgo de hipoglucemiasSon múltiples los trabajos que recogen el riesgo añadido de hipoglucemias cuando incrementa la variabilidad glucémica, tanto en pacientes con DM1 como en pacientes con DM2.
En pacientes con DM1, la variabilidad glucémica ha demostrado ser un predictor más potente de hipoglucemia grave que la HbA1c o que la glucemia media31, y muy especialmente para las hipoglucemias nocturnas32. En este sentido, para cada mmol/l (18mg/dl) de incremento en la variabilidad glucémica el riesgo de hipoglucemia aumentaría en casi un 10%32.
En pacientes con DM2, la variabilidad glucémica también ha demostrado ser mejor predictor de hipoglucemias severas que la HbA1c33, e incluso se correlaciona mejor con el riesgo de hipoglucemias inadvertidas que los niveles bajos de glucemia media. Dicho de otra manera, un paciente tendría mayor riesgo de hipoglucemia si expresase un elevado grado de variabilidad aunque mantuviera glucemias medias en el rango alto de la normalidad, que otro que tuviera glucemias medias en el rango bajo de la normalidad pero que expresase poca variabilidad en sus cifras34.
Por otra parte, el uso de algunos índices de variabilidad glucémica, tales como el Low Blood Glucose Index (LBGI), centrado en los valores de hipoglucemia y basado en la automonitorización de glucemia capilar, permite predecir entre un 60 y un 75% de los episodios de hipoglucemias graves en las 24h siguientes, tanto en pacientes con DM1 como en pacientes con DM2 sometidos a tratamiento con insulina35.
Variabilidad glucémica y riesgo de complicaciones crónicasUno de los aspectos más interesantes, y que ha generado más controversias en la literatura, es el de la posible contribución de la variabilidad glucémica al desarrollo de complicaciones crónicas en los pacientes con diabetes. Como hemos visto anteriormente, esta hipótesis se apoyaría sobre la base de que las fluctuaciones agudas de las concentraciones de glucosa podrían incrementar el estrés oxidativo, la respuesta inflamatoria y el daño endotelial en experimentos in vitro, en modelos animales y en algunos ensayos clínicos llevados a cabo en humanos8,25.
Complicaciones microvasculares y neuropatíaYa hemos comentado anteriormente que Brownlee y Hirsch7, en la primera década del 2000, establecieron una asociación positiva entre la incidencia de retinopatía diabética y el incremento de la variabilidad glucémica en los pacientes del DCCT sometidos a tratamiento convencional. Sin embargo, el mismo año, Kilpatrick et al.36, utilizando la misma base de datos del DCCT pero con un procedimiento estadístico diferente, intentaron rebatir las afirmaciones de Brownlee, al no encontrar asociación significativa entre el desarrollo de retinopatía o de nefropatía, ni con la variabilidad glucémica intradía ni con la interdía. Poco tiempo después, el propio grupo del DCCT/EDIC corroboró las afirmaciones de Kilpatrick, constatando que los resultados iniciales obtenidos por Brownlee eran consecuencia de un artefacto estadístico. Al estratificar adecuadamente a los pacientes por grupos ajustados en relación con los niveles de HbA1c, comprobaron que no existían diferencias significativas en cuanto al desarrollo de retinopatía en relación con la variabilidad glucémica. Esto les permitió afirmar que, virtualmente, todo el beneficio (96%) del tratamiento intensivo frente al convencional sobre la progresión de la retinopatía podía ser explicado por las diferencias en la reducción neta de los niveles medios de la HbA1c entre ambos grupos5. En un trabajo reciente, sobre una muestra parcial de la base de datos del DCCT, los autores encuentran de nuevo que solo los valores de la HbA1c (y de la albúmina glucosilada) correlacionan con el desarrollo de retinopatía y nefropatía, mientras que la influencia tanto de la variabilidad glucémica como de la glucemia posprandial es muy débil y se atenúa aún más cuando se incluye la glucemia media plasmática en los análisis multivariados22.
En lo referente al desarrollo de neuropatía diabética entre los pacientes con DM1, unicamente un trabajo encuentra una mayor incidencia de la misma en relación con un incremento de la variabilidad glucémica, medida como desviación estándar, aunque la correlación fue muy débil. Al no encontrar asociación con otras complicaciones microvasculares, los autores especulan con que el sistema nervioso periférico podría ser más sensible que el árbol vascular a las fluctuaciones agudas de la glucemia37. Sin embargo, poco después Siegelaar et al.38, utilizando la base de datos más amplia del DCCT, no encontraron asociación estadísticamente significativa ente la variabilidad glucémica y el desarrollo de polineuropatía periférica en pacientes con DM1.
En cuanto a la DM2, solamente existe un estudio con cierta relevancia en el que se asocia un exceso de aparición de retinopatía a un incremento de la variabilidad glucémica a largo plazo. No obstante, hay que tener en cuenta que se trata de un estudio retrospectivo en el que, además, exclusivamente se estima la variabilidad de las glucemias basales39.
Complicaciones macrovascularesExisten muy pocos trabajos que reflejen la influencia que la variabilidad glucémica pueda tener en el desarrollo de complicaciones macrovasculares en los pacientes con diabetes. Además, la mayor parte de ellos hacen referencia no a la variabilidad en sí misma, sino más bien al efecto que pudiera ejercer la hiperglucemia posprandial sobre el desarrollo de dichas complicaciones. Por otro lado, gran parte de estos trabajos se sustentan en revisiones retrospectivas de estudios epidemiológicos y son muy escasos los ensayos clínicos aleatorizados y prospectivos en los que se haya estimado la influencia de la variabilidad glucémica40,41.
Dejando aparte la influencia de la hiperglucemia posprandial y centrándonos en la variabilidad glucémica, el grupo de Di Flaviani42 encuentra una relación significativa en el análisis univariado entre la variabilidad glucémica y el incremento de masa ventricular izquierda, en un pequeño grupo de pacientes con DM2 de corta evolución y bien controlados. Sin embargo, esta asociación no se mantuvo en el análisis multivariado, en el que solo existió correlación de la hipertrofia ventricular izquierda con la excreción urinaria de 15(S)-8-iso-PGF2α. No obstante, esta excreción de marcadores urinarios de estrés oxidativo sí se correlacionaba con la variabilidad glucémica, por lo que se podría intuir una relación indirecta entre dicha variabilidad glucémica y el daño de órgano. En un estudio observacional realizado en China sobre más de 200 pacientes con diabetes ingresados de forma consecutiva por infarto agudo de miocardio se comprobó que los niveles elevados de MAGE al ingreso se asociaban significativamente con la incidencia de eventos cardiovasculares mayores en el año siguiente al alta, mientras que ni la glucemia basal ni los niveles de HbA1c lo hicieron de forma significativa43.
Por el contrario, son muchas más las referencias bibliográficas que no obtienen relación significativa entre variabilidad glucémica y enfermedad macrovascular. Entre otros, Nathan et al.22 encuentran que solo la HbA1c se asocia a enfermedad cardiovascular en el análisis multivariado, cuando recientemente revisó una muestra de pacientes del DCCT. Lipska et al.44, por su parte, tras analizar una serie de casi 20.000 pacientes con infarto agudo de miocardio, concluyen que la variabilidad glucémica, determinada por 5 métodos diferentes y tras realizar un ajuste multivariable, no se relaciona de forma significativa con la mortalidad cardiovascular. En el estudio HEART2D, la reducción de las excursiones glucémicas posprandiales mediante insulina rápida preprandial no demostró una reducción de eventos cardiovasculares, cuando los niveles de HbA1c eran similares, en pacientes con DM2 que habían sufrido un infarto agudo de miocardio reciente, a pesar de conseguir una reducción en la variabilidad glucémica en el grupo de pacientes tratados con insulina prandial sobre el grupo de pacientes tratados con insulina basal45. Como último ejemplo, el ADAG-Study46 también evidenció que tanto los valores de glucemia media como los de HbA1c tenían asociaciones mucho más fuertes con el riesgo cardiovascular que los valores de glucemia posprandial o las diferentes medidas empleadas para determinar la variabilidad glucémica, tanto en pacientes con DM1 como en pacientes con DM2.
Variabilidad de la HbA1c… ¿variabilidad glucémica a «largo plazo»?A diferencia de los estudios sobre las fluctuaciones de la glucemia a «corto plazo» (intradía, interdía…), que aparentan llevar a un callejón sin salida sobre su relación con el desarrollo de complicaciones en la diabetes, la variabilidad glucémica «a largo plazo» o variabilidad de la HbA1c parece correlacionar de forma intensa con el desarrollo de complicaciones micro y macrovasculares, tanto en pacientes con DM1 como en pacientes con DM2.
El trabajo que probablemente dio la pista sobre la influencia de la variabilidad de la HbA1c en el desarrollo de complicaciones vasculares en la DM fue el Pittsburg Epidemiology of Diabetes Complications Study (EDC), estudio prospectivo de 16años de duración realizado sobre pacientes con DM1, en el que se evidenció que cada descenso del 1% en la desviación estándar de la HbA1c se asociaba a una reducción del 23% en el riesgo relativo de enfermedad cardiovascular47. Posteriormente, Kilpatrick et al.48, estudiando la base de datos del DCCT, pudieron comprobar que la variabilidad de la HbA1c añadía un mayor riesgo de desarrollo de complicaciones microvasculares al predicho de forma exclusiva por los valores medios de HbA1c. Y esto resultaba mucho más evidente entre los pacientes del grupo de tratamiento convencional que se encontraban en los percentiles más elevados de variabilidad. Desde entonces se ha incrementado el número de publicaciones que avalan tanto una mayor incidencia como un riesgo incrementado de desarrollo de complicaciones macrovasculares y microvasculares (retinopatía y nefropatía fundamentalmente) en pacientes con DM1, en relación con la variabilidad de la HbA1c49,50.
Respecto a la DM2, la variabilidad de la HbA1c se ha mostrado como un predictor significativo de la aparición de microalbuminuria, independientemente de los valores medios de HbA1c51, y se asocia con la aparición de macroalbuminuria en la enfermedad renal crónica de los pacientes con diabetes52.
Variabilidad glucémica y pacientes críticosVarios estudios han puesto de manifiesto que el incremento en la variabilidad glucémica implica mal pronóstico, de forma independiente de las cifras de glucemia, en los pacientes no diabéticos, en población tanto adulta como infantil. De entre todos ellos cabe reseñar el publicado por Krinsley et al.53, un estudio multicéntrico con más de 40.000 pacientes seleccionados en el que se pudo objetivar que un incremento en la variabilidad glucémica (estimada como un coeficiente de variación >20%) se asociaba de forma independiente con mayor riesgo de mortalidad entre los pacientes no diabéticos. Sin embargo, esta variabilidad glucémica no incrementó el riesgo de mortalidad entre los pacientes con diabetes, e incluso la diabetes se comportó como factor protector frente a dicha variabilidad, ya que se asoció de forma independiente a un descenso en el riesgo de mortalidad. Estos resultados, aparentemente paradójicos pero concordantes con los de otros investigadores, trata de explicarlos el autor como una posible influencia positiva de la diabetes en un potencial «preacondicionamiento» en dichos pacientes ante la influencia de la variabilidad glucémica.
Si bien parece claro que la variabilidad glucémica es un marcador pronóstico negativo de primera magnitud entre los pacientes no diabéticos, no está tan claro qué es lo que podemos esperar del control de dicha variabilidad, o, dicho de otro modo, del control riguroso de las glucemias, en los pacientes críticos. Por un lado, en el ensayo clínico de Van den Berghe et al.54, se encontró una reducción del 42% de la mortalidad, cuando los pacientes eran sometidos a un control estricto de las glucemias. Sin embargo, en el estudio NICE-SUGAR55 se obtuvieron resultados absolutamente contrapuestos, dado que apareció un incremento en la mortalidad entre los pacientes críticos cuando fueron sometidos a un control riguroso de las glucemias. Hay que comentar, no obstante, 2 matices que hacen diferentes a ambos estudios y que probablemente puedan tener cierta relevancia a la hora de tratar de explicar resultados tan contradictorios. Por una parte, la población del ensayo de Van den Berghe era exclusivamente quirúrgica, mientras que en el NICE-SUGAR los pacientes estudiados se encontraban en unidades de pacientes críticos polivalentes, con lo cual podríamos pensar que los pacientes del primer estudio pudieran estar menos afectados, en general, desde el punto de vista cardiovascular. En segundo lugar, en el NICE-SUGAR no existieron diferencias significativas entre la variabilidad glucémica entre los grupos sometidos a un control estricto de las glucemias y los sometidos a un control más convencional, mientras que en el estudio de Van den Berghe sí se objetivó una reducción neta en la variabilidad glucémica en el grupo sometido a tratamiento intensivo.
¿Se comportan de manera diferente la diabetes mellitus tipo1 y la diabetes mellitus tipo2 desde el punto de vista de la variabilidad glucémica?En primer lugar, ya hemos comentado que la DM1 y la DM2 parecen comportarse de forma diferente en lo referente a la respuesta del estrés oxidativo en relación con el incremento de la variabilidad glucémica, esté mediada o no, dicha respuesta, por el posible papel antiinflamatorio atribuido a la administración de insulina exógena8,25–30.
En un trabajo de revisión sistemático exhaustivo, Nalysnyk et al.41 encuentran algunas diferencias entre la asociación de variabilidad glucémica y el desarrollo de complicaciones diabéticas entre los pacientes con DM1 y los pacientes con DM2. Los autores llegan a la conclusión de que podría existir un vínculo débil entre variabilidad glucémica y riesgo de complicaciones micro y macrovasculares en la DM2, así como que los picos de glucemia posprandial podrían ejercer una influencia deletérea en el desarrollo de enfermedad cardiovascular entre los pacientes con DM2. Sin embargo, estas asociaciones no han podido objetivarse entre los pacientes con DM1, en los cuales, a diferencia de los pacientes con DM2, tanto los valores de glucemia basales como los valores de glucemia posprandiales parecen mostrarse igualmente predictivos para el desarrollo de complicaciones microvasculares.
En lo que respecta a la relación de la variabilidad de la HbA1c y el desarrollo de complicaciones crónicas, también parecen existir diferencias entre los pacientes con DM1 y con DM2. Entre los pacientes con DM1 parece existir un vínculo más claro entre la existencia de valores fluctuantes de HbA1c, con el desarrollo de complicaciones tanto macrovasculares como con la aparición o el empeoramiento tanto de nefropatía como de retinopatía49,50. En cambio, y hasta la fecha, en los pacientes con DM2 la variabilidad de la HbA1c parece estar relacionada de forma casi exclusiva con el desarrollo y empeoramiento de enfermedad renal. Los resultados obtenidos en el estudio RIACE permiten objetivar que el desarrollo de retinopatía en los pacientes con DM2 es más dependiente de los valores absolutos de HbA1c que de su variabilidad, quizá como consecuencia de que dicha variabilidad resulta netamente inferior entre los pacientes con DM2 que entre los pacientes con DM152.
Reflexiones y conclusionesAunque del adecuado control de la variabilidad glucémica a corto plazo no pueda inferirse de forma tajante que vaya a disminuir la incidencia de complicaciones en los pacientes con diabetes, sí existen datos de peso suficientes que avalan que dicho control pueda aportar beneficios incuestionables a los pacientes con diabetes.
Aún no disponemos de evidencia científica adecuada para poder trasladar los resultados obtenidos in vitro y en animales de experimentación a los seres humanos25. Por una parte, resulta complicado ligar de forma estadísticamente significativa el estrés oxidativo (origen etiopatogénico fundamental de las complicaciones diabéticas) tanto con la variabilidad glucémica como con el daño de órgano diana42. Esto podría explicarse por diferentes razones que pueden coexistir en los mismos individuos. En primer lugar, los pacientes con mayor variabilidad glucémica suelen ser aquellos que exhiben peor control metabólico en general, es decir, niveles más elevados tanto de glucemias medias como de HbA1c. En estos pacientes el estrés oxidativo se encuentra muy elevado y puede resultar complicado desligar de forma matemática la contribución que pueda tener la variabilidad glucémica al montante total de dicho estrés oxidativo26,30 y, por ende, a la lesión vascular. En segundo lugar, es posible que sea realmente muy difícil poder llegar a conocer alguna vez la relevancia que la contribución que la variabilidad glucémica estimada en cortos espacios de tiempo (desde pocas horas a pocos días) pueda tener sobre las complicaciones crónicas de la diabetes. Dichas complicaciones se van fraguando a lo largo de los años, por lo que las fluctuaciones de la glucemia recogidas en pequeños periodos de tiempo28, aunque sean muy intensas, podrían no afectar de forma significativa ni al estrés oxidativo ni a los órganos diana. En cambio, la medida de la variabilidad de la HbA1c, como marcador de variabilidad glucémica a largo plazo, sí parece relacionarse de forma más contundente con la aparición o la exacerbación de complicaciones crónicas en los pacientes con diabetes47-52. En tercer lugar, la existencia de una variabilidad glucémica progresiva, desde las situaciones de prediabetes hasta las etapas de diabetes franca9-11, unida a la evidencia de un exceso de estrés oxidativo en los pacientes con diabetes26,29,30, podría servir en gran medida de sustento a la hipótesis fisiopatológica del «preacondicionamiento» que sufren los pacientes con diabetes ante el estrés oxidativo incrementado que suponen las situaciones críticas, y explicar, al menos en parte, el mejor pronóstico que tienen ante situaciones de variabilidad glucémica extrema frente a los pacientes críticos no diabéticos53.
Lo que parece indudable es que, si no conseguimos una reducción de la variabilidad glucémica, nunca podremos alcanzar un control metabólico adecuado en los pacientes con diabetes, al menos sin incurrir en una tasa inaceptablemente elevada de hipoglucemias3. Y enlazando con lo anterior, algo para lo que sí ha demostrado su utilidad el control de la variabilidad glucémica es, precisamente, para evitar situaciones de hipoglucemia, fundamentalmente las más peligrosas (graves, nocturnas, inadvertidas…)32–35. Desde el punto de vista del autor, conseguir un mejor control glucémico a largo plazo (reducción de las glucemias medias y de la HbA1c) sin incurrir en tasas elevadas de hipoglucemia justificaría más que sobradamente el intentar reducir la variabilidad glucémica. Por otra parte, la variabilidad glucémica elevada parece que se puede asociar a peor calidad de vida y a afectación del estado de ánimo56, una razón más para tener en cuenta a la hora de intentar explorar cuál pueda ser el origen de dicha variabilidad en los pacientes con diabetes, e intentar controlarla en la medida de lo posible.
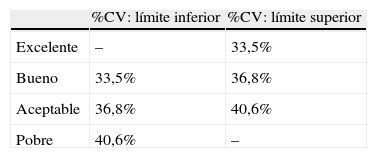
Esto nos llevaría a preguntarnos qué método utilizar para determinar la existencia de variabilidad glucémica y cómo cuantificarla. Dado que no existe un gold standard para la medida de la variabilidad glucémica, resulta muy complicado recomendar un solo método para la práctica clínica diaria. Como ocurre en tantos aspectos relacionados con la diabetes, lo mejor, sin duda, es la individualización de cada caso particular que lo requiera12-15, valorando si precisa o no monitorización continua de glucosa y el espacio de tiempo que debemos considerar más adecuado para estimar dicha variabilidad. En cuanto al método estadístico a emplear, dado que todas las fórmulas empleadas se correlacionan de forma más o menos intensa con la desviación estándar, y que esta medida de dispersión depende fundamentalmente de los valores de la media, quizá lo más práctico sea la utilización del coeficiente de variación, al menos como aproximación inicial15,17,18. Resulta sencillo estimarlo en la práctica clínica, tanto por su sencillez de cálculo (%CV=100×desviación estándar/glucemia media) como porque varios de los glucómetros que actualmente existen en el mercado realizan su cálculo de forma automática a través del software informático que tienen incorporado. Un acercamiento a la interpretación de los valores de este coeficiente nos lo ofrece Rodbard17, quien estima que medidas del coeficiente de variación con valores de hasta el 33,5% pueden considerarlas como adecuadas, mientras que serían inapropiadas cuando el valor superara el 40,6% (tabla 2).
Rangos de referencia para la valoración del coeficiente de variación glucémica (%CV)
| %CV: límite inferior | %CV: límite superior | |
| Excelente | – | 33,5% |
| Bueno | 33,5% | 36,8% |
| Aceptable | 36,8% | 40,6% |
| Pobre | 40,6% | – |
Basada en Rodbard17.
El autor declara no tener ningún conflicto de intereses en relación con el artículo publicado.