La diabetes neonatal (DN) es una enfermedad poco frecuente (1/160.000-260.000 recién nacidos)1–3, caracterizada por diabetes de inicio antes de los 6 meses de vida con autoinmunidad negativa. Existen 2 entidades que difieren en algunas características: la diabetes neonatal permanente (DNP) y la diabetes neonatal transitoria (DNT). Representan un 40-50% y 50-60% respectivamente y ambas aparecen antes de los 6 meses de vida. La DNT presenta una remisión al año de vida y en un 50% de los casos recidiva generalmente en la pubertad1, mientras que la DNP no presenta remisión4. Un gran porcentaje de estas diabetes pueden ser tratadas exitosamente con sulfonilureas (SU) debido a que la mutación más frecuentemente implicada en su etiología (KCNJ11/ABCC8) causa una activación del mismo canal de potasio que es bloqueado por las SU.
Presentaremos un caso de transferencia de insulina a SU en un paciente de 53 años diagnosticado de DNT con mutación en KCNJ11 tras 15 años de insulinoterapia.
Hombre de 53 años con antecedentes de dislipidemia y diabetes diagnosticada a los 18 años en hiperglucemia simple como hallazgo en un examen rutinario. Recibió tratamiento con antidiabéticos orales (ADO) durante 18-20 años (desconocemos esquema). A los 37 años de edad, debido al mal control metabólico con ADO (HbA1c 11%), se decidió insulinizar al paciente con múltiples dosis de insulina, tratamiento con el que presentó un excelente control glucémico posterior (HbA1c alrededor de 6% hasta la fecha). En los últimos meses su esquema de tratamiento ha sido: insulina rápida regular 6 UI en desayuno e insulina premezclada 50% 15 UI en la comida y 20 en la cena (0,5 UI/kg/día). Hasta la fecha el paciente no ha presentado complicaciones crónicas. Pesa 77 kg, mide 1,76m, IMC 24,9. A la exploración neurológica no presenta alteraciones motoras, sensitivas ni cognitivas.
Entre sus antecedentes familiares destacan: padres con diabetes de diagnóstico tardío, un hermano sin diabetes y 2 hijos: uno de 23 años sin diabetes y el otro de 18 años que presentó DNT de inicio a los 2 meses de edad con remisión a los 9 meses. A los 16 años, su hijo pequeño presentó una recidiva de la diabetes por lo que se realizó el estudio genético, encontrándose una mutación en heterocigosis del gen KCNJ11 (cambio del nucleótido c.149G>A -p. Arg50Gln-) con lo que inició tratamiento con SU, consiguiendo un perfecto control metabólico con gliclazida 30mg/día.
A raíz del diagnóstico del hijo se realizó el estudio genético al padre, confirmándose la presencia de la misma mutación.
Por esta razón y dado el buen control del hijo con SU, se decidió realizar el cambio de tratamiento en el padre.
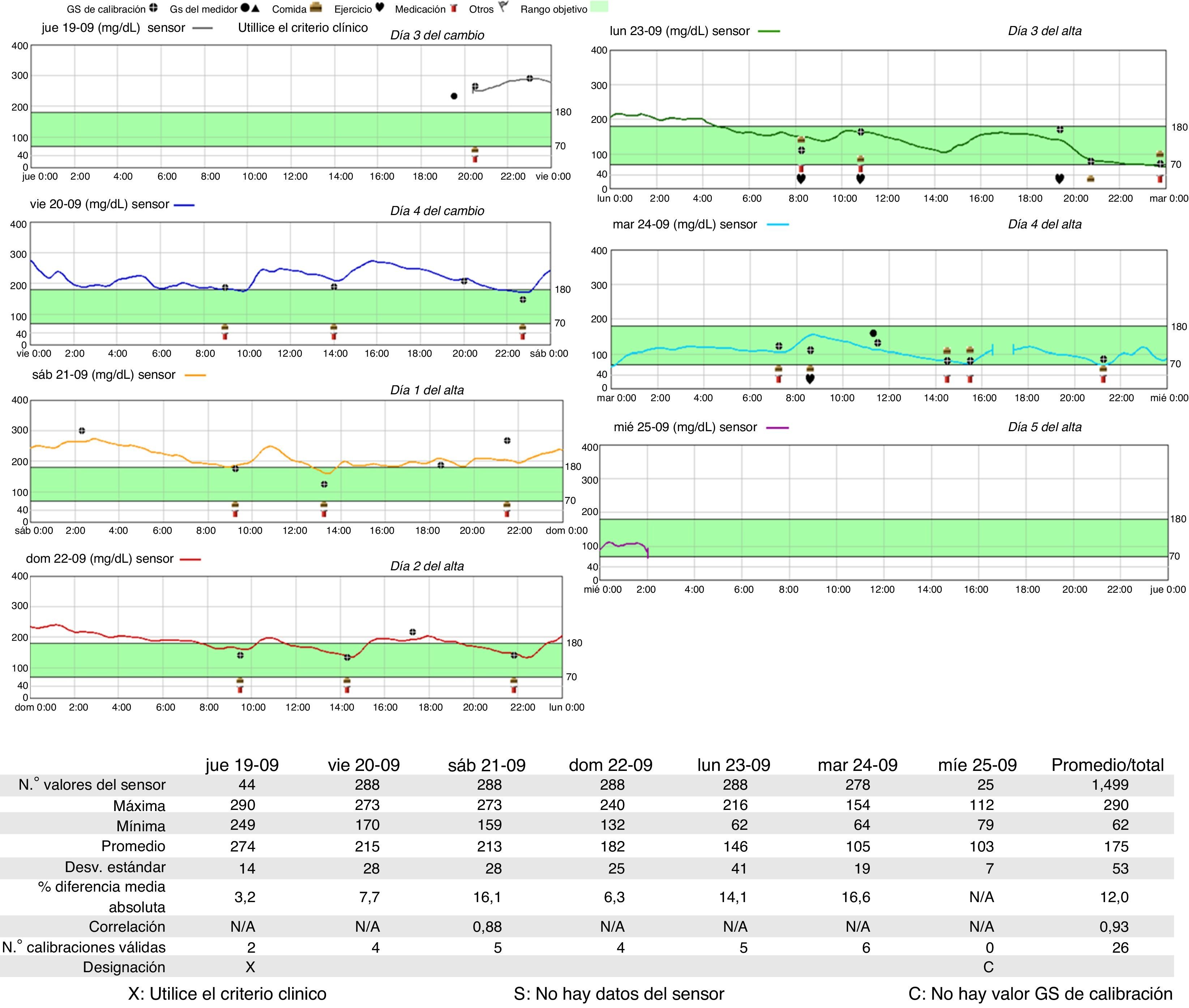
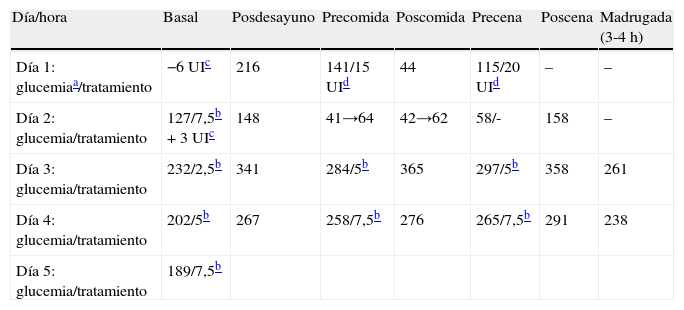
El paciente es ingresado para iniciar el cambio de insulina a SU según el protocolo del grupo internacional de colaboración para la DN para pacientes hospitalizados5. El día 1 se instala un sensor subcutáneo de glucosa (modelo iPRO-2 de Medtronic) para realizar el registro de todo el proceso y se mantiene con su dosis habitual de insulina. El día 2 se inicia el tratamiento con glibenclamida 7,5mg (0,1mg/kg/día) más 3UI de insulina rápida regular en el desayuno (50% de su dosis habitual) con lo que presenta repetidas hipoglucemias (40-55mg/dl) durante las siguientes 12 h, suspendiéndose totalmente la insulina. En los días siguientes se van titulando las dosis de glibenclamida con mejoría progresiva del control glucémico (tabla 1) hasta llegar a una dosis de 7,5mg en cada comida (0,3mg/kg/día) con controles correctos, dosis con la que es dado de alta tras 5 días de ingreso hospitalario.
Controles de glucemia capilar y dosis de glibenclamida administrada durante la transferencia de insulina a SU
| Día/hora | Basal | Posdesayuno | Precomida | Poscomida | Precena | Poscena | Madrugada (3-4h) |
| Día 1: glucemiaa/tratamiento | −6UIc | 216 | 141/15UId | 44 | 115/20UId | – | – |
| Día 2: glucemia/tratamiento | 127/7,5b+3 UIc | 148 | 41→64 | 42→62 | 58/- | 158 | – |
| Día 3: glucemia/tratamiento | 232/2,5b | 341 | 284/5b | 365 | 297/5b | 358 | 261 |
| Día 4: glucemia/tratamiento | 202/5b | 267 | 258/7,5b | 276 | 265/7,5b | 291 | 238 |
| Día 5: glucemia/tratamiento | 189/7,5b |
En los días siguientes al alta, los niveles de glucemia van descendiendo, primero normalizándose y luego presentando hipoglucemias, por lo que se disminuye la dosis de glibenclamida a 5mg en cada comida (0,2mg/kg/día) y posteriormente a las 2 semanas a 2,5mg en cada comida (0,1mg/kg/día), manteniéndose buen control glucémico y HbA1c 6,5% a los 4 meses del cambio de tratamiento.
Antes de comenzar el tratamiento con glibenclamida se midió el péptido C que fue de 0,16ng/ml y al cuarto día de tratamiento se incrementó hasta 1,9ng/ml.
Todo el proceso ha sido monitorizado por un sensor subcutáneo de glucosa que mostró la progresión del control glucémico durante los días del cambio a glibenclamida y en los 5 días posteriores al alta (fig. 1).
El 30-58% de las DNP presentan una mutación del gen KCNJ11 que codifica para la subunidad Kir6.2 del canal de potasio ATP sensible de la célula beta pancreática6. En la DNT en cambio, lo más frecuente (70-80%) es una anomalía en el brazo largo del cromosoma 6 (6q24)1,7, aunque existe un porcentaje importante con la misma mutación activadora del gen KCNJ11 o ABCC8 que en la DNP3,6. Cabe destacar que el 80% de estas mutaciones son esporádicas3,6,8.
En condiciones normales, el aumento de glucosa plasmática produce un aumento en la entrada de glucosa a la célula y su glucosilación desencadena un cambio en la relación ATP/ADP intracelular, inhibiendo el canal ATP sensible de la célula beta pancreática. Esto produce una despolarización en la célula que desencadena la secreción de insulina2,3,5,8.
La mutación del gen KCNJ11 que codifica para la subunidad Kir6.2, una de las subunidades implicadas en el cierre del canal de potasio, conlleva una menor sensibilidad de este canal al aumento de ATP intracelular, manteniéndose abierto, por lo que no se genera despolarización celular y, consiguientemente, se produce una menor secreción de insulina5,8. La relevancia clínica de este hecho radica en que las SU generan el cierre de este canal de potasio ATP sensible por una vía alternativa a la subunidad Kir6.2 por lo que son eficaces en el tratamiento de las DN que presentan esta mutación1,7.
Hasta la fecha, el estudio más amplio publicado en que se realizó la transferencia de insulina a SU6 incluyó a 49 pacientes con DN por mutación del gen KCNJ11 y se logró el éxito, definido como posibilidad de suspender la insulina con dosis adecuada de SU, en el 90% de los casos.
Se utilizó glibenclamida en el 87% de los casos, pero también fueron utilizadas gliclazida, tolbutamida, glipizida y glimepirida sin diferencias en la eficacia, por lo que se cree que se trata de un efecto de clase. El rango de edad de los pacientes de este estudio fue entre 3 meses y 36 años, el control metabólico previo era deficiente (HbA1c promedio de 8,1%) y la dosis promedio utilizada de 0,45mg/kg/día de glibenclamida. Por último, el péptido C presentó un importante aumento posterior al tratamiento con SU.
A diferencia de los incluidos en el estudio previo, nuestro paciente tenía un excelente control previo con insulina (HbA1c en torno a 6%) y la dosis de glibenclamida que ha requerido ha sido mucho menor (0,1mg/kg/día), además de que la transición se realizó en menor tiempo que otros casos descritos (4-5 días vs. 4 o más semanas)8. La edad del paciente en el momento de la transición es superior (53 años) a la de los pacientes del estudio y curiosamente no había presentado DN conocida (cabría pensar la posibilidad de que el paciente presentara una forma de diabetes leve que pasó desapercibida en los primeros meses de vida). Los niveles de péptido C previos y posteriores al inicio de SU, en cambio, no difieren de los observados en el estudio previamente citado. El tipo de mutación, la forma de diagnóstico y el buen control glucémico mantenido podrían haber jugado un papel importante en el éxito de la transferencia a SU.
El caso más similar descrito es el de un hombre de 32 años al momento de la transferencia a SU, que fue exitosa, y con buen control hasta los 57 meses de seguimiento9. El paciente requirió mayor dosis de SU que en nuestro caso (0,8 vs. 0,1mg/kg/día)9. Aunque algunos estudios describen que la transferencia en la edad adulta tendría menos eficacia, nuestro caso y el citado en este último estudio no lo confirman.
Existe un caso publicado de una familia en que se realizó la transferencia de insulina a SU en la madre y la hija (la madre con DNP y la hija con DNP y retraso mental moderado), en el que, a diferencia de nuestro caso, la madre, que fue tratada en la edad adulta, presentó resistencia a las SU y la hija respondió exitosamente10.
Por último, en nuestro caso la transferencia se ha realizado inicialmente en una unidad de hospitalización y después en hospital de día, si bien es cierto que se ha demostrado previamente que es posible realizar esta transferencia de forma ambulatoria en su totalidad con éxito11.
Este caso pone de manifiesto la importancia de evaluar los antecedentes familiares en los pacientes con diabetes de cara a clasificar el diagnóstico correctamente, puesto que, incluso en aquellos pacientes adultos con más de 15 años de tratamiento con insulina y portadores de una mutación en KCNJ11, la transferencia a SU podría ser efectiva.