dipeptidilpeptidasa IV
glucagon-like peptide 1
hemoglobina glucosilada
hipertensión arterial
tomografía axial computarizada con tomografía de emisión de positrones
Se trata de una paciente con una diabetes avanzada, de 9 años de evolución, con sobrepeso (IMC 27,3kg/m2) y un control metabólico fuera de los objetivos (hemoglobina glucosilada [HbA1c] >7%, glucemia basal 168mg/dL) a pesar del tratamiento combinado con dos fármacos orales (metformina y vildagliptina) en dosis adecuadas. Podemos suponer que la elección de un inhibidor de la dipeptidilpeptidasa IV (DPP-IV) como segundo fármaco debe derivar del intento de su médico por limitar las hipoglucemias y la ganancia de peso, ya que la mayoría de las guías clínicas considerarían como tratamiento estándar el uso de una sulfonilurea o de insulina basal tras el fracaso de la monoterapia con metformina, por la limitada experiencia a largo plazo con el uso de estos fármacos1-3. Ese intento de limitar las hipoglucemias parece razonable a la vista de los factores de riesgo cardiovascular presentes (mujer posmenopáusica, con hipertensión arterial [HTA], hiperlipidemia y diabetes) y el riesgo de fractura osteoporótica (baja densidad mineral ósea, diabetes).
Se plantean, por tanto, varias posibilidades terapéuticas: la triple terapia oral asociando un secretagogo o una glitazona, o bien la insulinización con una insulina basal o el uso de un análogo del GLP-1 (glucagon-like peptide 1)1-3.
La triple terapia oral, aunque recogida en la mayoría de las guías de práctica clínica más actuales, sigue teniendo aún escasas evidencias que avalen su uso a largo plazo, y se suele recomendar sólo en los casos en los que la insulinización es inaceptable o imposible. Además, la elección de una glitazona en una mujer menopáusica con osteoporosis, una HTA de larga evolución (lo que aumenta el riesgo de insuficiencia cardiaca) y otros factores de riesgo cardiovascular, no parece la mejor elección por sus posibles efectos deletéreos, duplicando tanto el riesgo de fractura osteoporótica como los ingresos por insuficiencia cardiaca. La adición de una sulfonilurea tendría el riesgo de inducir hipoglucemias y ganancia de peso, además de sus posibles repercusiones sobre el agotamiento de la célula beta. La posibilidad de cambiar el inhibidor de DPP-IV por un secretagogo en dosis máximas, junto a dosis máximas de metformina, probablemente no aporte la potencia suficiente para conseguir el control metabólico deseado (HbA1c <7%).
El único análogo del GLP-1 disponible en nuestro país por el momento, exenatida, sólo se reembolsa en pacientes obesos (no es nuestro caso), aunque sería una aproximación atractiva en un paciente en el que nos preocupara limitar tanto la ganancia de peso como la posibilidad de hipoglucemias, que podrían causar una caída con riesgo de fractura o desencadenar un episodio cardiovascular.
Por lo tanto, me inclinaría por recomendar el inicio de una insulina basal nocturna (al acostarse) en principio, sin modificar el resto del tratamiento. El objetivo sería una glucemia predesayuno en el rango 80–120mg/dL, lo que se podría lograr con una NPH (insulina protamina neutra de Hagedorn), aunque el deseo de limitar tanto las hipoglucemias graves como la ganancia de peso podría aconsejar el inicio de un análogo basal como detemir.
¿Qué perfiles glucémicos deberían realizarse con el cambio de terapia que propone?Los estudios más recientes disponibles4, 5 no muestran ningún beneficio de la automonitorización de la glucemia capilar en pacientes con diabetes tipo 2 no tratados con insulina. No obstante, pueden ser útiles en algún subgrupo de pacientes en los que el valor obtenido resulte importante para mantener o iniciar modificaciones del estilo de vida.
Una vez iniciada la insulinoterapia, sólo serían precisos los valores de glucemia capilar predesayuno para que la paciente siguiera un esquema de autoajuste de dosis entre los diversos que han sido publicados. Por ejemplo, el esquema −3, 0, +3 (para una media de tres glucemias capilares basales menores de 80, entre 80 y 120, y por encima de 120mg/dL, respectivamente) ha probado ser tan efectivo sobre la reducción de la HbA1c como el ajuste por un profesional médico6. Por supuesto que, tanto en caso de enfermedad intercurrente como de clínica sugerente de hiperglucemia o hipoglucemia, la paciente debería vigilar más de cerca sus cifras glucémicas.
¿Qué exploraciones, analíticas y pruebas complementarias deberían realizarse?Hay algún aspecto llamativo en esta paciente, como la ausencia de retinopatía o nefropatía en presencia de un diagnóstico de neuropatía por electromiografía, junto a una astenia (al parecer) clínicamente significativa. Además, presenta una artrosis que precisa una potente terapia antiinflamatoria y que, junto con la astenia, limita su movilidad y favorece la ganancia de peso. Parece por lo tanto razonable valorar la necesidad de una terapia que no ha sido efectiva (gabapentina). También deberíamos descartar un efecto adverso de algunos de los fármacos que toma (tanto atorvastatina como risedronato se han asociado a molestias y síndromes dolorosos osteoarticulares de diferente intensidad).
Aunque resulta poco probable, se han descrito algunos casos de fracturas subtrocantéreas, incluso bilaterales, de difícil diagnóstico clínico (se manifiestan por dolor e impotencia funcional sin otros signos típicos de las fracturas de cadera) en sujetos tratados durante largo tiempo con aminobisfosfonatos. El examen detenido de una radiografía de las extremidades proximales de ambos fémures puede descartar el problema.
Por otra parte, la debilidad de miembros inferiores, que no parece deberse a un problema endocrinológico (no hay síntomas sugerentes de insuficiencia suprarrenal o alteración tiroidea relevantes), vascular (los pulsos son normales) o neurológico (no hay alteraciones de la sensibilidad o los reflejos, ni alteraciones del trofismo), obliga a descartar, en un paciente con un nivel de antígeno CA 19.9 elevado, la presencia de diversas patologías, tanto benignas como tumorales.
El CA 19.9 es un antígeno glucoconjugado, definido por un anticuerpo monoclonal IgG1, generado contra la línea celular del carcinoma cólico humano. El 80-90% de pacientes con cáncer de páncreas avanzado presentan niveles elevados del antígeno, con una sensibilidad del 86% y una especificidad del 87%, cuando se considera un valor de corte de 37 UI/mL. También aparece elevado en el 55-89% de los cánceres gástricos, el 65% de los colorrectales, el 22-51% de los hepatocarcinomas y colangiocarcinomas, y de forma ocasional en el cáncer de ovario, útero y pulmón. En este sentido, debe recordarse que diversos cánceres, especialmente el de páncreas, el de mama y el de colon y recto, son más comunes entre los sujetos con diabetes. Puede asimismo estar elevado en procesos benignos como la pancreatitis aguda, el seudoquiste pancreático, la colangitis, la colecistitis, la hepatitis y la cirrosis; en procesos respiratorios como las bronquiectasias, la tuberculosis, la asbestosis, el asma bronquial, la fibrosis pulmonar y la neumonía intersticial idiopática, y en enfermedades reumatológicas (síndrome de Sjogren, artritis reumatoide, lupus, dermatopolimiositis, etc.), aunque en concentraciones más bajas.
Por tanto, la repetición del sedimento urinario con un urocultivo, y una revisión ginecológica con citología y ultrasonografía endovaginal, junto con una prueba de imagen abdominopélvica de alta resolución, podrían ser los siguientes pasos que dar antes de pensar en medidas más extremas como una PET-TAC.
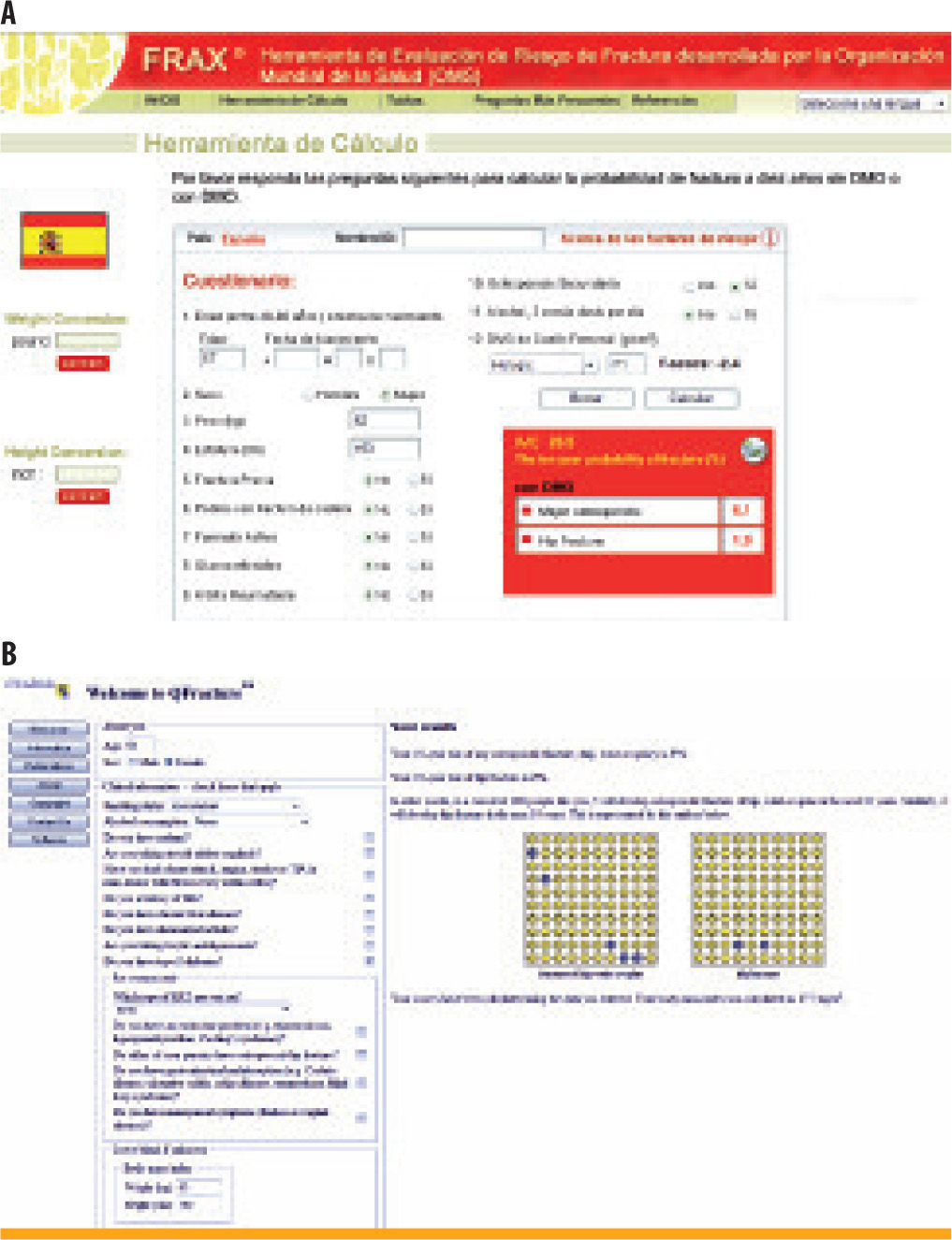
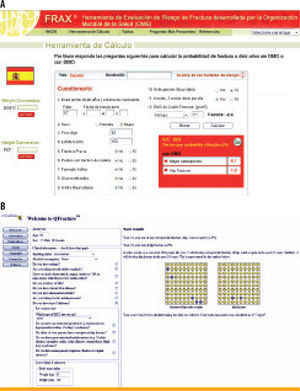
¿Qué otros cambios realizaría en el resto de la terapia de esta paciente?Resulta también llamativa la osteoporosis de larga evolución que presenta la paciente y que parece haber sido tratada con bisfosfonatos durante quizá hasta 12 años. El uso de alguno de los motores de cálculo del riesgo de fractura, como el índice FRAX® (de la Organización Mundial de la Salud y calibrado según el riesgo de fractura de la población española; disponible en: http://www.shef.ac.uk/FRAX/tool_SP.jsp?locationValue=4) (figura 4A), o el más reciente QFracture™ (que no utiliza los valores de densidad mineral ósea y sí considera el antecedente de diabetes; disponible en: http://www.clinrisk.co.uk/qfracture/index.php) (figura 4B), estima un riesgo de fractura en los próximos 10 años entre bajo y medio (entre 6,1 y 5% para cualquier fractura osteoporótica mayor, y entre 1,9 y 2% para la fractura de cadera). Este riesgo, además, debe haberse visto modificado sustancialmente por los más de 10 años de tratamiento con alguno de los fármacos más potentes para el tratamiento de la osteoporosis (un aminobisfosfonato), sin haber aparecido ninguna fractura en este tiempo. Por otro lado, los pacientes sin cambios de masa ósea relevantes, o incluso con pérdida de esta última, siguen obteniendo el beneficio de la reducción de las fracturas osteoporóticas con fármacos de esta clase.
En la figura se muestran dos de los más recientes modelos de cálculo del riesgo absoluto de fractura o del riesgo porcentual de sufrir fractura en los siguientes 10 años. A. En el modelo FRAX®, desarrollado bajo el auspicio de la Organización Mundial de la Salud (disponible en: http://www.shef.ac.uk/FRAX/tooLSRjsp?locationValue=4), la densidad mineral ósea no es necesaria, aunque puede incluirse su información si está disponible. El resto de datos necesarios, como el peso, la talla, el sexo o la edad, así como algunos antecedentes personales y familiares relevantes, se pueden obtener fácilmente. Algunos autores han sugerido que, en nuestro medio y a pesar de estar ajustado para la tasa de fracturas de la población española, el FRAX® podría infraestimar hasta en un 50% el riesgo real. B. El modelo □Fracture™, desarrollado en el Reino Unido y aún pendiente de publicar ajustado para población española (disponible en: http://www.clinrisk.co.uk/qfracture/index.php), posee el atractivo de no emplear la medida de la masa ósea y usar un mayor número de antecedentes y enfermedades crónicas concomitantes, y para nosotros, como diabetólogos o endocrinólogos, incluir específicamente el antecedente de diabetes o de enfermedades endocrinas como el síndrome de Cushing o el hipertiroidismo
Comoquiera que el efecto de los aminobisfosfonatos sobre el hueso puede prolongarse durante años tras la retirada del fármaco, no parecería descabellado ofrecerle a la paciente unas «vacaciones terapéuticas» de su tratamiento antiosteoporótico, con vigilancia densitométrica en 1 o 2 años. En caso de pérdida de masa ósea significativa y, sobre todo, en caso de fractura, probablemente me inclinaría por recomendarle un tratamiento anabólico, con bastante probabilidad teriparatida, tras lustros de tratamientos anticatabólicos potentes.
Por otra parte, no puedo compartir la retirada de los suplementos de calcio y vitamina D ni en ésta ni en ninguna otra paciente, salvo efectos secundarios no tolerables del calcio (náuseas, estreñimiento) o toxicidad por vitamina D, lo que resulta prácticamente imposible con los compuestos de calcio y vitamina D disponibles en un único comprimido. ¿
Declaración de potenciales conflictos de intereses
Ninguno relevante para esta actividad. En el periodo 2009–2010: fondos para la investigación clínica relacionada con la diabetes: Janssen, Lilly, MSD, Novo Nordisk, Roche y sanofi-aventis. Participación en Bureau de Ponentes: Almirall, Lilly, MSD, Novo Nordisk.