American Diabetes Association
American Heart Association
Adult Treatment Panel III
diabetes tipo 2
enfermedad cardiovascular
hemoglobina glucosilada
hipertensión arterial
hipertrofia ventricular izquierda
International Diabetes Federation
inhibidor de la enzima conversora de la angiotensina
Michigan Neuropathy Screening Instrument
presión arterial
polineuropatía diabética
riesgo cardiovascular
Se trata de un varón de 68 años con diabetes tipo 2 (DM2), clínica de polineuropatía (PND) sensitivomotora distal grave, mal control glucémico (HbA1c 9,8%) y dislipemia diabética, con hipertrigliceridemia (TG 210mg/dL), aumento del colesterol LDL (colesterol LDL calculado 145mg/dL) y disminución del colesterol HDL (38mg/dL), a pesar del tratamiento con estatinas. Padece una hipertensión arterial (HTA) en tratamiento con tres fármacos sin conseguir un adecuado control, obesidad de grado I (IMC 30,5kg/m2) y perímetro abdominal de riesgo cardiometabólico alto. Además, nuestro paciente presenta una microalbuminuria secundaria a una nefropatía de doble etiología, tanto hipertensiva como diabética. Asimismo, podemos observar que tiene antecedentes familiares de HTA, obesidad, diabetes y nefrolitiasis. El paciente cumpliría los criterios diagnósticos de síndrome metabólico definidos por la Organización Mundial de la Salud (OMS)1, la International Diabetes Federation (IDF)2, el Adult Treatment Panel III (ATP III)3 o la American Heart Association (AHA)4.
Las evidencias clínicas actuales y las recomendaciones de consenso apoyan que la diabetes debe considerarse de muy alto riesgo cardiovascular en las siguientes situaciones: enfermedad cardiovascular clínica o subclínica, resistencia a la insulina y síndrome metabólico con 4 o 5 componentes, presencia de múltiples factores de riesgo como dislipemia, HTA y tabaquismo, o bien existencia de insuficiencia renal o de albuminuria. Estaríamos ante un paciente con riesgo cardiometabólico muy alto.
¿Qué otras pruebas diagnósticas estarían indicadas en el paciente que nos ocupa?La información sobre el paciente es limitada. Entre las pruebas complementarias solicitaría las siguientes:
- •
Examen de fondo de ojo y presión intraocular. Recomendada su realización anual en pacientes con DM2 desde el momento del diagnóstico. El diagnóstico de retinopatía diabética es muy probable en un paciente con otra manifestación de microangiopatía como es la microalbuminuria5.
- •
Valoración del índice tobillo-brazo. Los pacientes con PND deben evaluarse para descartar la presencia de enfermedad vascular periférica, que constituye un factor de riesgo determinante en la evolución de las lesiones del pie. La palpación de pulsos periféricos muy débiles nos hace sospechar la existencia de afectación arterial periférica. Un índice <0,9 confirmaría este diagnóstico5.
- •
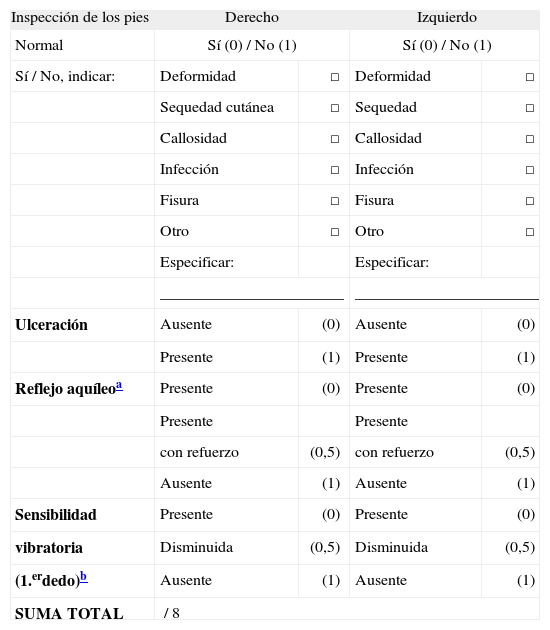
Estudio de la neuropatía diabética. El Michigan Neuropathy Screening Instrument (MNSI) se basa en datos obtenidos de la inspección, la valoración de la sensibilidad vibratoria con diapasón estándar y de los reflejos aquíleos (tabla 2). Un valor superior a 2-2,5 sobre un máximo de 8 aumenta el riesgo de desarrollar úlceras plantares. En nuestro paciente el riesgo es elevado, ya que la puntuación es de 7 en el pie derecho y de 5 en el izquierdo. La exploración más objetiva de la sensibilidad vibratoria se consigue con el neurotensiómetro. Se puede explorar a cualquier nivel, pero generalmente se utiliza la punta del primer dedo del pie. Podemos calcular el umbral de percepción vibratoria. Se ha demostrado que cuando es superior a 20mV, incrementa el riesgo de desarrollar úlceras plantares. También se puede utilizar el diapasón graduado de Rydel, considerando que existe alteración si se pierde la percepción de la sensibilidad al nivel ≤4 octanos. Para valorar la sensibilidad superficial, se utiliza el monofilamento de Semmes-Weinstein de 10g. También deberemos excluir otras posibles causas de neuropatía, como el hipotiroidismo, el déficit de vitamina B12, la uremia, etc. Con la exploración clínica completa no es necesaria la realización de electromiografía.
Tabla 2.Michigan Neuropathy Screening Instrument para el cribado de la neuropatía26
Inspección de los pies Derecho Izquierdo Normal Sí (0) / No (1) Sí (0) / No (1) Sí / No, indicar: Deformidad □ Deformidad □ Sequedad cutánea □ Sequedad □ Callosidad □ Callosidad □ Infección □ Infección □ Fisura □ Fisura □ Otro □ Otro □ Especificar: Especificar: _______________________ _______________________ Ulceración Ausente (0) Ausente (0) Presente (1) Presente (1) Reflejo aquíleoa Presente (0) Presente (0) Presente Presente con refuerzo (0,5) con refuerzo (0,5) Ausente (1) Ausente (1) Sensibilidad Presente (0) Presente (0) vibratoria Disminuida (0,5) Disminuida (0,5) (1.erdedo)b Ausente (1) Ausente (1) SUMA TOTAL / 8 - •
Sería aconsejable descartar la coexistencia de neuropatía autónoma cardiovascular mediante la respuesta de la presión arterial (PA) al ortostatismo y la respuesta de la frecuencia cardiaca a las maniobras de Valsalva, la respiración profunda y el ortostatismo. La presencia de neuropatía autonómica cardiovascular confiere un mayor riesgo de isquemia miocárdica silente6,7.
- •
Electrocardiograma y ecocardiografía. Nos informará de la existencia de cardiopatía isquémica, hipertrofia ventricular izquierda (HVI) o bloqueo de rama. En pacientes hipertensos con HVI en el electrocardiograma, el bloqueo de rama izquierda del haz identifica a los individuos con un mayor riesgo de mortalidad cardiovascular8. La realización de ecografía cardiaca es más sensible y específica en estos pacientes.
- •
Otros:
- –
Automonitorización de la PA o monitorización ambulatoria de la PA (MAPA).
- –
Resulta controvertido si se recomienda un cribado sistemático de cardiopatía isquémica en pacientes con DM asintomáticos. Se establece que si el riesgo cardiovascular (RCV) es muy elevado, debería someterse a evaluación cardiológica.
- –
Una ecografía carotídea y renal completarían el estudio.
- –
Las recomendaciones dietéticas están presentes en todas las guías de práctica clínica sobre HTA y DM25,9.
La presencia de diabetes, HTA, obesidad e hiperlipemia aconseja una dieta hipocalórica pobre en sal (<3g /día), grasas (especialmente saturadas) e hidratos de carbono de rápida absorción. El objetivo sería una reducción de 8kg (10% del peso basal) en 6 meses. Esta reducción tiene un efecto favorable sobre la DM, la HTA y la dislipemia. Prescribiría una dieta de 1.200kcal/día, con un aporte de hidratos de carbono de 50-55% y 20-30g de fibra, un aporte de proteínas de 0,8g/kg de peso ideal (el 50-75% de ellas de alto valor biológico) y un porcentaje de grasa total del 30% (grasas saturadas <7%, grasas poliinsaturadas <7%, grasas trans <2% y grasas monoinsaturadas 15-20%).
El paciente presenta hiperuricemia. El aumento de ácido úrico se reconoce como un hallazgo común en sujetos con síndrome metabólico. Los niveles de urato sódico pueden ser considerados como un marcador de inflamación, isquemia y estrés oxidativo en pacientes con obesidad, HTA o diabetes con elevado RCV10. Así pues, la dieta será pobre en purinas y la ingestión de alcohol estará prohibida. Aunque se necesitan ensayos clínicos aleatorizados para aclarar si los pacientes con alto RCV e hiperuricemia se benefician o no del tratamiento con inhibidores de la xantinaoxidasa, en nuestro caso estaría indicado el tratamiento por la presencia de litiasis renal, ya que existen estudios que demuestran que alopurinol disminuye la probabilidad de recurrencia de cálculos de oxalato cálcico en pacientes con hiperuricemia11.
La restricción calórica debe acompañarse de un incremento de la actividad física cotidiana y de la realización de ejercicio físico programado de forma regular para evitar la pérdida de masa muscular. Teniendo en cuenta la existencia de PND sensitivomotora grave, la programación de ejercicio debe ser muy gradual y basarse en ejercicios en los que el apoyo en los pies sea menor (para minimizar el riesgo de úlceras), como la natación, la bicicleta estática o los ejercicios de brazos y tronco. Se debe instruir al paciente para el aseo y cuidado de los pies y la inspección diaria para evitar las lesiones o descubrirlas precozmente.
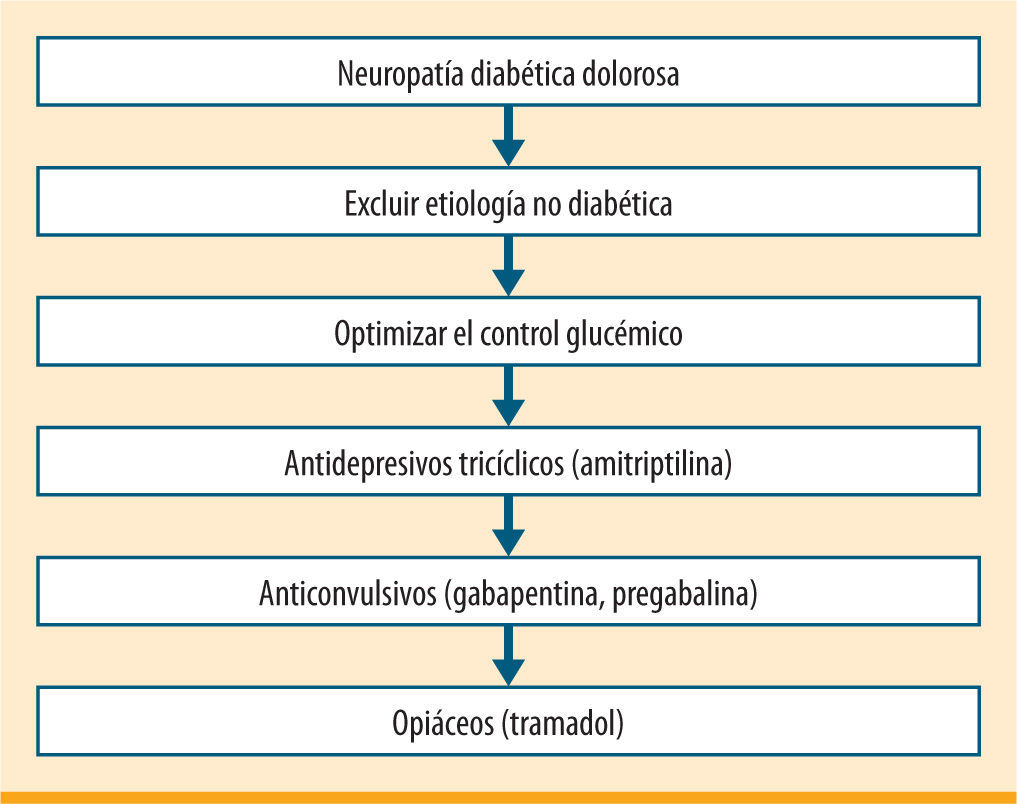
Tratamiento farmacológicoNeuropatíaEl dolor neuropático es el resultado de una lesión con alteración de la transmisión de la información nociceptiva en el sistema nervioso central o periférico. Una de sus principales características es la alodinia, es decir, la aparición de dolor en respuesta a estímulos que habitualmente no son dolorosos. Los antidepresivos tricíclicos constituyen el primer escalón terapéutico en el tratamiento farmacológico de la neuropatía diabética dolorosa5 (figura 1). La mayor evidencia disponible en cuanto a eficacia se refiere a amitriptilina. Como inconveniente, este fármaco presenta un estrecho margen terapéutico y una elevada incidencia de efectos secundarios, como estreñimiento, mareos, sequedad oral, aumento de peso, retención urinaria, hipotensión ortostática, trastornos de la conducción cardiaca, etc. La dosis de inicio es 25mg/día administrados en el momento de acostarse, y se aumentará progresivamente según la tolerancia y eficacia hasta 75-125mg/día.
Algoritmo de tratamiento de la neuropatía diabética propuesto por la American Diabetes Association (ADA)5
El siguiente escalón terapéutico está ocupado por los anticonvulsivos análogos del GABA (ácido gammaaminobutírico). Entre ellos contamos con gabapentina, 300-400mg administrados inicialmente antes de acostarse y aumentando la frecuencia hasta 3 veces al día. También con pregabalina12, que ofrece como ventajas sobre la anterior el presentar una menor variabilidad interpersonal y que su administración es 2 veces al día. Finalmente, duloxetina es un inhibidor de la recaptación de serotonina y noradrenalina que muestra una buena tolerancia; se administra una vez al día.
Podemos añadir al tratamiento analgésicos convencionales como ibuprofeno, AAS (ácido acetilsalicílico) o tramadol. La aplicación tópica de capsaicina al 0,075%, 4-5 veces al día durante 4-6 semanas, puede ser útil.
La electroterapia puede asimismo beneficiar a algunos pacientes que no toleran o no responden adecuadamente al tratamiento farmacológico.
Hipertensión arterialEl objetivo diana de las cifras de presión arterial en pacientes con DM se establece en cifras inferiores a 130/80 mmHg13. Dado que el paciente mantiene cifras de PA por encima del límite recomendado y además tiene microalbuminuria, necesitaríamos optimizar el tratamiento. El tratamiento con inhibidores de la enzima conversora de la angiotensina (IECA) es el más apropiado en este caso, y las dosis utilizadas no son las máximas, pero no estaría indicado aumentar la dosis por la hiperpotasenia5. Deberíamos suspender el tratamiento con indapamida por la hiperuricemia. El antagonista del calcio se puede mantener si los edemas en miembros inferiores son leves-moderados. Como alternativa podemos considerar el tratamiento con betabloqueadores, pues han demostrado reducir la morbimortalidad en pacientes con DM214. Presentan problemas como el enmascaramiento de los síntomas hipoglucémicos y la posible exacerbación de la enfermedad vascular periférica. Sería interesante conocer el resultado del índice tobillo-brazo. Los más utilizados son atenolol, bisoprolol, nebivolol y carvedilol. Este último combina un efecto bloqueador beta no selectivo y antagonista alfaadrenérgico, con algunas ventajas sobre los bloqueadores betaadrenérgicos clásicos, especialmente en cuanto a tolerancia y ausencia de efectos perjudiciales en el metabolismo hidrocarbonado. Otro fármaco que considerar es doxazosina, un alfabloqueador con un excelente perfil metabólico; sin embargo, su principal efecto secundario, que es la hipotensión ortostática, puede limitar su uso, ya que es especialmente poco tolerada en pacientes con neuropatía autonómica cardiovascular. Otros fármacos que pueden utilizarse son los agentes de acción central como monoxidina, que actúa sobre los receptores imidazólicos que modulan la actividad del sistema simpático.
DislipemiaEl colesterol ligado a las lipoproteínas de baja densidad (colesterol LDL) calculado mediante la fórmula de Friedewald nos da un valor de 145mg/dL, que es superior al valor de referencia aconsejado (<100mg/dL). El colesterol ligado a las lipoproteínas de alta densidad (colesterol HDL) es de 38mg/dL, inferior al recomendado (>45mg/dL), y la cifra de triglicéridos (TG), 210mg/dL, superior a la recomendada (<150mg/dL)15. El objetivo fundamental del tratamiento se debe centrar en reducir los valores de colesterol LDL, ya que es el predictor más importante de RCV en el paciente diabético. Un aumento de 1mmol (38,7mg/dL) de colesterol LDL eleva un 57% el riesgo de episodios cardiovasculares. Por tanto, los hipolipemiantes de primera elección son las estatinas. La intensificación del tratamiento hipolipemiante en nuestro paciente consistiría en cambiar a atorvastatina 80mg/día16. En caso de mantener los triglicéridos elevados y el colesterol HDL bajo, añadiríamos fenofibrato o ácido nicotínico al tratamiento. Los hipolipemiantes más potentes para reducir la trigliceridemia son los fibratos, que además aumentan el colesterol HDL, aunque su utilidad para prevenir la enfermedad cardiovascular (ECV) no está bien establecida17. El ácido nicotínico es el fármaco más eficaz para elevar el colesterol HDL, y las nuevas formulaciones de liberación retardada no empeoran el control glucémico y mejoran la tolerabilidad18.
Control glucémicoEl paciente presenta una DM2 de larga evolución con mal control metabólico (HbA1c 9,7%). Actualmente recibe tratamiento con antidiabéticos orales (ADO), metformina en dosis máximas y sulfonilureas.
Cuando los ADO no logran mantener los objetivos de HbA1c es necesario iniciar la insulinoterapia19. Se ha demostrado que el porcentaje de contribución a la HbA1c es diferente según la cifra de HbA1c20. En nuestro paciente, con una HbA1c de 9,7%, la contribución de las glucemias basales y posprandriales sería del 60 y el 40%, respectivamente. Nuestro primer objetivo sería tratar la glucemia en ayunas, añadiendo insulina basal a la metformina y sustituyendo glimepirida por repaglinida por su duración de acción más corta y su menor riesgo de hipoglucemias. Como insulina basal podríamos utilizar glargina o detemir en administración nocturna por su menor riesgo de hipoglucemias frente a la insulina NPH, en dosis de 16 UI (0,2 UI/kg/día). Sería conveniente disponer de automonitorización diaria de la glucemia, enseñando al paciente un algoritmo sencillo para titular dosis de insulina, aumentando 2 UI cada 3 días hasta conseguir los objetivos de glucemia en ayunas (70-130mg/dL). Si no conseguimos el objetivo metabólico, el paciente realizará automonitorización de las glucemias posprandriales y se administrará un análogo rápido de insulina antes de una o de varias comidas, a razón de 0,05-0,15 UI/kg en cada dosis prandial21.
AntiplaquetariosSe recomienda utilizar AAS (75-162mg/día), ya que estamos ante un paciente con alto riesgo cardiovascular22. En la mayoría de ensayos clínicos las dosis oscilan entre 75 y 325mg/día. Aunque no hay datos que apoyen el uso de una dosis concreta, si se utiliza la dosis más baja posible puede ayudar a reducir los efectos secundarios. Por el contrario, un ensayo aleatorizado de AAS 100mg/día mostró un escaso efecto en un subgrupo de pacientes diabéticos23,24.
¿Qué pronóstico le augura a este paciente?Por el hecho de tratarse de un paciente con DM2, ya es un paciente con alto riesgo cardiovascular. Para realizar un cálculo más preciso podemos utilizar modelos como el SCORE, el REGIDOR, el Framingham o el derivado del UKPDS (Risk Engine). Este último pondera dos factores que tienen gran importancia a la hora de predecir episodios cardiovasculares, como son la duración de la diabetes y el grado de control metabólico medido por la HbA1c. Además, también calcula el riesgo de padecer enfermedad cerebrovascular. Nuestro paciente tendrá un riesgo, en los próximos 10 años, del 54% de padecer un episodio coronario, del 43,4% de un episodio coronario mortal, del 19% de ictus y del 2,9% de ictus mortal. Presenta asimismo un alto riesgo de úlceras en los pies al obtener una puntuación elevada en la escala MNSI, y un riesgo 20 veces superior de desarrollar insuficiencia renal terminal por la presencia de microalbuminuria25,26. ¿
Declaración de potenciales conflictos de interesesLa autora declara no tener conflictos de intereses.




 ADA)5' title='Algoritmo de tratamiento de la neuropatía diabética propuesto por la American Diabetes Association (
ADA)5' title='Algoritmo de tratamiento de la neuropatía diabética propuesto por la American Diabetes Association (