Se sabe que la vitamina D (25(OH) D) tiene un efecto directo sobre la salud del hueso y músculo. Se ha relacionado también con enfermedades reumatológicas de origen autoinmune. Los estudios en niños con este tipo de enfermedades son escasos, sobre todo en artritis idiopática juvenil. El objetivo de este trabajo fue determinar las concentraciones de 25(OH) D en pacientes con lupus eritematoso sistémico (LES) y artritis idiopática juvenil (AIJ), y compararlas con las concentraciones en individuos sanos.
MétodosSe determinaron las concentraciones de 25(OH) D por medio de espectrometría de masas con cromatografía liquida por tándem (ID-LC-MS/MS), las concentraciones de la hormona paratiroidea por análisis inmunorradiométrico (IRMA), y las concentraciones de calcio, fósforo y fosfatasa alcalina por métodos colorimétricos en 37 pacientes con LES, 37 pacientes con AIJ y 79 controles sanos.
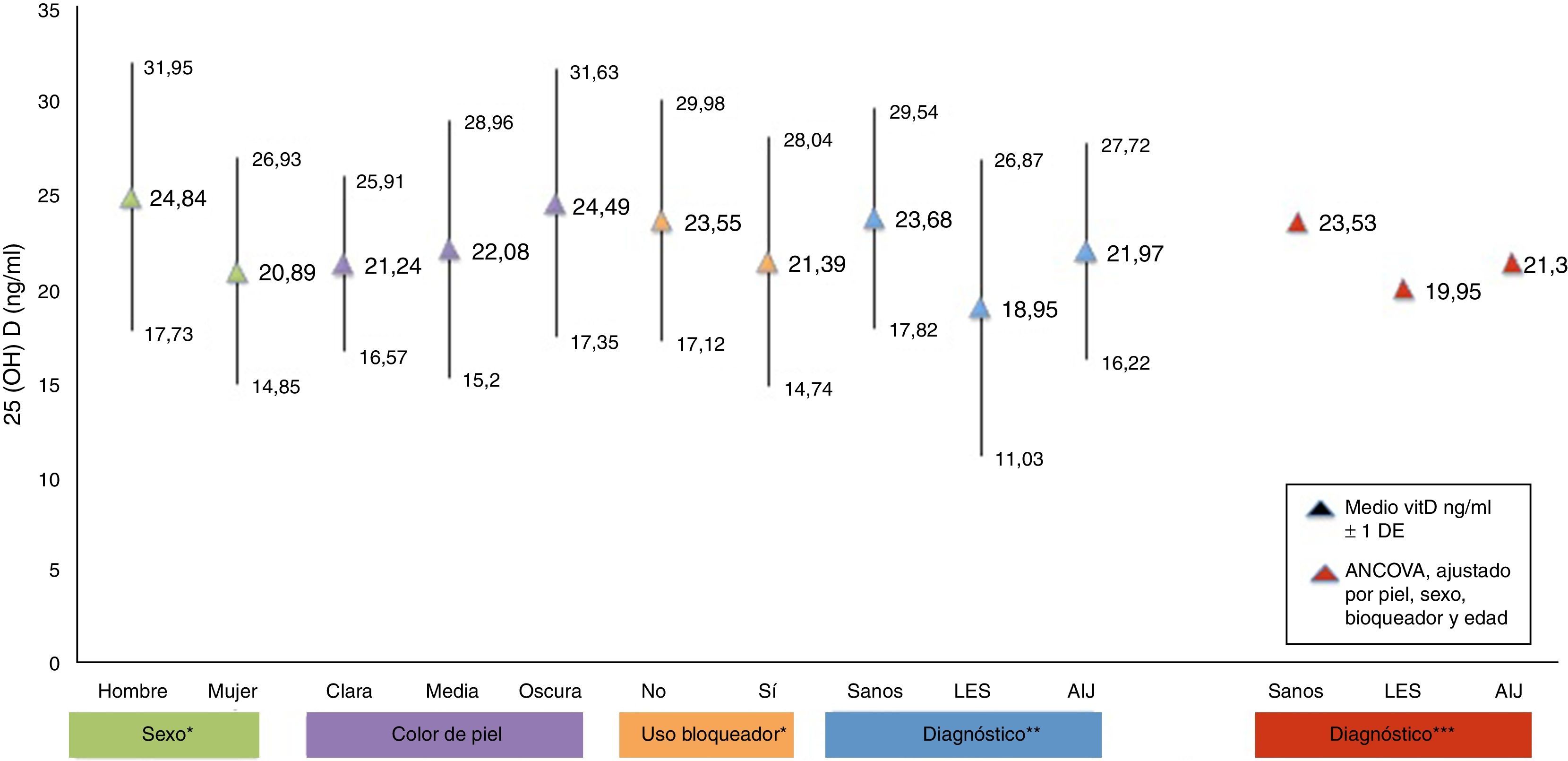
ResultadosLas concentraciones séricas de 25(OH) D fueron de 18.9 ±7.92ng/ml en LES, 21.97±5.55ng/ml en AIJ y 23.6±3.07ng/ml en controles sanos. Hubo una diferencia significativa al comparar las concentraciones de 25 (OH) D entre los pacientes con LES y los controles sanos (p <0.05). El 29.7% de pacientes con LES, el 35.1% con AIJ y el 31.6% de sujetos sanos cursaron con niveles deficientes de vitamina D en este estudio.
ConclusionesUna tercera parte de los niños estudiados en los tres grupos mostraron deficiencias de vitamina D. La más severa fue en los niños con LES.
It is well recognized that vitamin D has a direct effect in bone and muscle and has been associated as well with some rheumatologic diseases. Reports in children are scarce. The aim of this study was to determine the concentration level of 25(OH)D in a group of patients with systemic lupus erythematosus (SLE) and juvenile idiopathic arthritis (JIA) and compare them with healthy controls.
MethodsVitamin D (25(OH)D) was measured with isotope-dilution liquid chromatography-tandem mass spectrometry (ID-LC-MS/MS), PTH with immunoradiometric assay (IRMA), calcium, phosphorus and alkaline phosphatase by colorimetric assay in 37 patients with SLE, 37 patients with JIA and 79 healthy controls.
ResultsMean 25(OH)D concentration levels were as follows: SLE 18.9±7.92ng/ml, JIA 21.97±5.55ng/ml and 23.6±3.07ng/ml in healthy controls. There was a significant difference between SLE patients vs. healthy controls (p <0.05); 29.7% of SLE patients, 35.1% of JIA patients and 31.6% of healthy controls had deficient levels of vitamin D.
ConclusionsOne third of the total sample of children in this study had deficient levels of vitamin D. Patients with SLE presented a significant difference compared with healthy controls.
La vitamina D (25(OH) D) desempeña un rol en la fisiopatología del hueso y su deficiencia tiene efectos importantes en el sistema esquelético. Al día de hoy se le atribuyen también funciones en el sistema inmune debido a que se le ha reconocido una participación en el crecimiento y diferenciación de múltiples tipos de células (macrófagos, células dendríticas y células B y T)1–4. Aunado a las pocas fuentes alimentarias ricas en esta vitamina, se han demostrado varios factores de riesgo relacionados con las bajas concentraciones de vitamina D, como la latitud y poca exposición al sol, el color de piel, la edad, la temporada estacional, el tipo de vestimenta, el diagnóstico de obesidad, la contaminación ambiental, el uso de corticoides, así como el uso de bloqueador solar5–7. Se ha identificado que la hipovitaminosis D se encuentra presente en diversas enfermedades crónico degenerativas, como la diabetes mellitus tipo 1, enfermedad cardiovascular, algunos tipos de cáncer, así como algunas enfermedades autoinmunes como esclerosis múltiple4,8–14. El lupus eritematoso sistémico (LES) y la artritis idiopática juvenil (AIJ) son dos enfermedades dentro del campo de la reumatología consideradas de riesgo para la presencia de hipovitaminosis D. Especialmente los niños con LES presentan un mayor riesgo de deficiencia debido al tratamiento médico con esteroides, el uso de bloqueador solar y la recomendación estricta de no exponerse al sol15–17. La AIJ es también una enfermedad de origen autoinmune en la cual, además del proceso inflamatorio, también se indica el uso de esteroides18,19. La información del estatus de la vitamina D en pacientes pediátricos con LES es escasa. Con relación a la AIJ, los reportes acerca del estatus son aún más limitados. Por ello, los objetivos del presente estudio fueron determinar las concentraciones de 25(OH) D en un grupo de pacientes con LES, en uno con AIJ y compararlos con controles sanos, y conocer la relación entre las concentraciones de vitamina D con la hormona paratiroidea (PTH), calcio (Ca), fósforo (P) y fosfatasa alcalina (FA).
2MétodosSe incluyeron niños y adolescentes menores de 18 años con diagnóstico de LES o AIJ de los servicios de Reumatología del Hospital Infantil de México Federico Gómez (HIMFG) y del Instituto Nacional de Rehabilitación, en la Ciudad de México. El diagnóstico de LES se realizó de acuerdo con los criterios del American College of Rheumatology20,21 y el de AIJ de acuerdo con los criterios del Comité de Reumatología Pediátrica de la Liga Internacional contra el Reumatismo (ILAR)22. El grupo control de niños y adolescentes sanos fue pareado por edad y sexo con los sujetos enfermos y reclutados de la zona centro del país. Se excluyeron los sujetos que se encontraban tomando algún suplemento de vitamina D. Para los controles, se excluyeron aquellos con antecedentes familiares de enfermedades como LES y AIJ.
2.1CuestionarioEn cada caso se aplicó un cuestionario para recabar información sobre variables demográficas, historial de la enfermedad, tiempo de exposición al sol (cuantificado en horas a la semana en un horario de 10-16h), uso de esteroides, color de piel (por medio de una escala de color) y uso de bloqueador solar.
La actividad de la enfermedad en los sujetos con LES fue valorada mediante el Systemic Lupus Erythematosus Disease Activity Index (SLEDAI)23,24. En el caso de los sujetos con AIJ se aplicó un cuestionario de capacidad funcional (CHAQ)25–27 y se determinó la clase funcional mediante la escala de Steinbrocker28.
2.2AntropometríaPara medir el peso y la talla se utilizó una báscula con estadímetro (Modelo Seca 700 con capacidad de 220kg y 200cm de estatura). Se calculó el índice de masa corporal (IMC) con los datos del Center for Disease Control Prevention 2000 Growth Chart (CDC 2000).
2.3Vitamina D, hormona paratiroidea, calcio, fósforo y fosfatasa alcalinaLas concentraciones de 25(OH) D se analizaron mediante el método de isotope-dilution liquid chromatography-tandem mass spectrometry (ID-LC-MS/MS) en el Laboratorio de Metabolismo de la Universidad de TUFTS, en Boston, Estados Unidos. La PTH fue medida en el Laboratorio de Metabolismo Mineral Óseo del HIMFG utilizando la técnica de ensayo inmunorradiométrico (IRMA). Las concentraciones de Ca, P y la FA fueron determinadas por métodos colorimétricos en el Laboratorio Central del mismo hospital.
2.4Análisis estadísticoEl análisis estadístico se realizó utilizando el paquete estadístico SPSS versión 17.0. Se consideró como valor significativo cuando p <0.05. La diferencia de medias entre los tres grupos fue valorada utilizando ANOVA. Las diferencias entre las proporciones se evaluaron con χ2. Se utilizó la correlación de Pearson entre las concentraciones séricas de 25(OH) D y los niveles de Ca, P, FA y PTH. Se realizó un análisis de regresión logística múltiple y de covarianza (ANCOVA) para ajustar los niveles de 25(OH) D con las variables de diagnóstico, sexo, edad, exposición al sol y uso de bloqueador solar.
El protocolo fue aprobado por el Comité de Ética del HIMFG. Se obtuvo el consentimiento informado de los padres o tutores de todos los sujetos y el asentimiento informado de los niños mayores de 8 años.
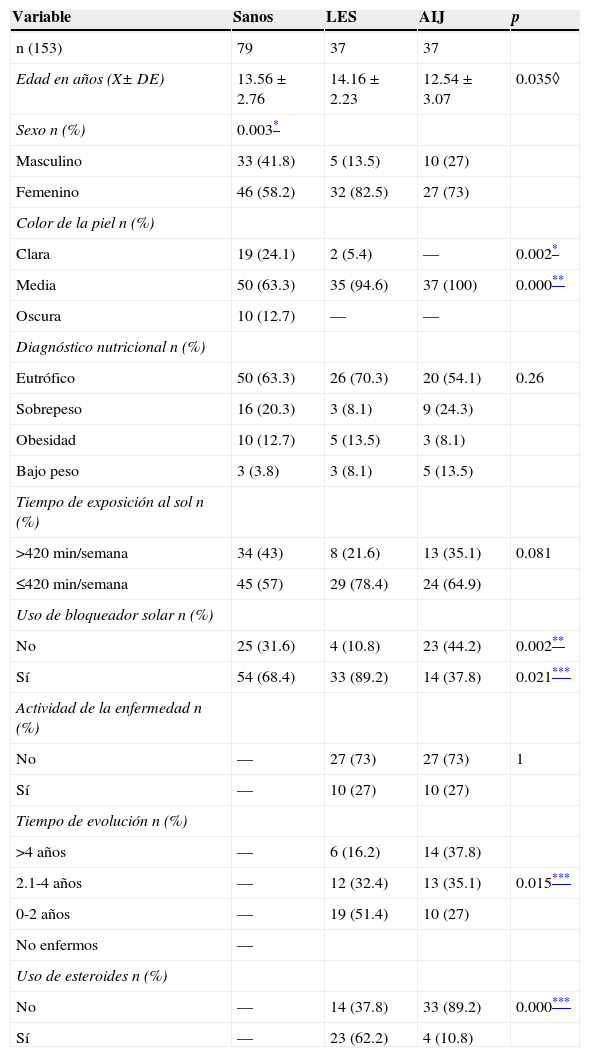
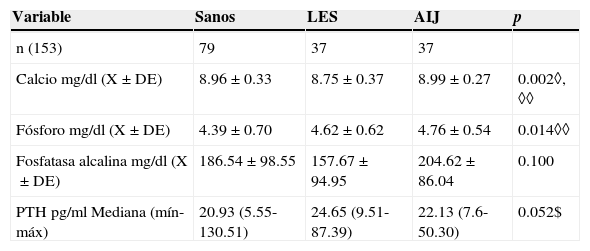
3ResultadosSe incluyeron un total de 153 sujetos, 37 con LES, 37 con AIJ y 79 controles sanos. No hubo diferencias significativas en el diagnóstico nutricional y tiempo de exposición al sol entre los tres grupos (tabla 1). En el grupo de sujetos enfermos no se presentaron diferencias en cuanto a la actividad de la enfermedad (el 73% se encontraban activos). En la tabla 2 se observan las medias de concentración de Ca, P, FA y los valores de medianas de PTH de los tres grupos. Los valores de Ca mostraron diferencias entre el grupo de controles sanos vs grupos de enfermos; el P presentó diferencias significativas entre el grupo de sanos vs. AIJ. Los valores de PTH y FA no presentaron diferencias significativas.
Análisis bivariado de las características de los sujetos por grupo de estudio
| Variable | Sanos | LES | AIJ | p |
|---|---|---|---|---|
| n (153) | 79 | 37 | 37 | |
| Edad en años (X± DE) | 13.56±2.76 | 14.16±2.23 | 12.54±3.07 | 0.035◊ |
| Sexo n (%) | 0.003* | |||
| Masculino | 33 (41.8) | 5 (13.5) | 10 (27) | |
| Femenino | 46 (58.2) | 32 (82.5) | 27 (73) | |
| Color de la piel n (%) | ||||
| Clara | 19 (24.1) | 2 (5.4) | — | 0.002* |
| Media | 50 (63.3) | 35 (94.6) | 37 (100) | 0.000** |
| Oscura | 10 (12.7) | — | — | |
| Diagnóstico nutricional n (%) | ||||
| Eutrófico | 50 (63.3) | 26 (70.3) | 20 (54.1) | 0.26 |
| Sobrepeso | 16 (20.3) | 3 (8.1) | 9 (24.3) | |
| Obesidad | 10 (12.7) | 5 (13.5) | 3 (8.1) | |
| Bajo peso | 3 (3.8) | 3 (8.1) | 5 (13.5) | |
| Tiempo de exposición al sol n (%) | ||||
| >420min/semana | 34 (43) | 8 (21.6) | 13 (35.1) | 0.081 |
| ≤420min/semana | 45 (57) | 29 (78.4) | 24 (64.9) | |
| Uso de bloqueador solar n (%) | ||||
| No | 25 (31.6) | 4 (10.8) | 23 (44.2) | 0.002** |
| Sí | 54 (68.4) | 33 (89.2) | 14 (37.8) | 0.021*** |
| Actividad de la enfermedad n (%) | ||||
| No | — | 27 (73) | 27 (73) | 1 |
| Sí | — | 10 (27) | 10 (27) | |
| Tiempo de evolución n (%) | ||||
| >4 años | — | 6 (16.2) | 14 (37.8) | |
| 2.1-4 años | — | 12 (32.4) | 13 (35.1) | 0.015*** |
| 0-2 años | — | 19 (51.4) | 10 (27) | |
| No enfermos | — | |||
| Uso de esteroides n (%) | ||||
| No | — | 14 (37.8) | 33 (89.2) | 0.000*** |
| Sí | — | 23 (62.2) | 4 (10.8) |
◊ ANOVA post hoc LES vs. AIJ.
Análisis bivariado de las características bioquímicas de calcio, fósforo, fosfatasa alcalina y PTH de los sujetos por grupo de estudio
| Variable | Sanos | LES | AIJ | p |
|---|---|---|---|---|
| n (153) | 79 | 37 | 37 | |
| Calcio mg/dl (X±DE) | 8.96±0.33 | 8.75±0.37 | 8.99±0.27 | 0.002◊, ◊◊ |
| Fósforo mg/dl (X±DE) | 4.39±0.70 | 4.62±0.62 | 4.76±0.54 | 0.014◊◊ |
| Fosfatasa alcalina mg/dl (X±DE) | 186.54±98.55 | 157.67±94.95 | 204.62±86.04 | 0.100 |
| PTH pg/ml Mediana (mín-máx) | 20.93 (5.55-130.51) | 24.65 (9.51-87.39) | 22.13 (7.6-50.30) | 0.052$ |
◊ ANOVA post hoc sanos vs. LES.
◊◊ ANOVA post hoc sanos vs. AIJ
$ Kruskal-Wallis
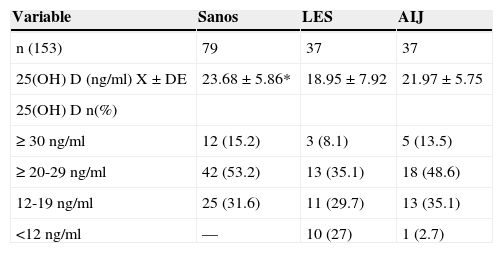
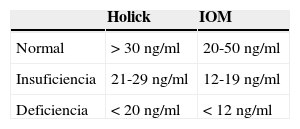
Los resultados de las concentraciones medias de 25(OH) D por grupo de estudio se observan en la tabla 3. En LES, la media de las concentraciones séricas de 25(OH) D fueron significativamente más bajas (18.9 vs 23.6ng/ml, p <0.05), comparadas con los controles, pero sin diferencias significativas al ser comparados con AIJ (21.9ng/ml). Al comparar los diferentes puntos de corte, se encontró que el 31.6% de los sujetos sanos cursaron con deficiencia de acuerdo con los parámetros establecidos por Holick29 (<20ng/ml) y el mismo porcentaje para insuficiencia con parámetros del Institute of Medicine (IOM)30 (≥12-19ng/ml). En cuanto al grupo de sujetos enfermos, el 29.7% de pacientes con LES y el 35.1% con AIJ cursaron con niveles dentro de un rango de ≥12-19ng/ml. En la tabla 4 se observan los puntos de corte establecidos por Holick y por el IOM.
Análisis bivariado de 25(OH) D de los sujetos por grupo de estudio
| Variable | Sanos | LES | AIJ |
|---|---|---|---|
| n (153) | 79 | 37 | 37 |
| 25(OH) D (ng/ml) X±DE | 23.68±5.86* | 18.95±7.92 | 21.97±5.75 |
| 25(OH) D n(%) | |||
| ≥ 30ng/ml | 12 (15.2) | 3 (8.1) | 5 (13.5) |
| ≥ 20-29ng/ml | 42 (53.2) | 13 (35.1) | 18 (48.6) |
| 12-19ng/ml | 25 (31.6) | 11 (29.7) | 13 (35.1) |
| <12ng/ml | — | 10 (27) | 1 (2.7) |
◊ ANOVA post hoc sanos vs. LES
*Sanos vs. LES p< 0.05.
No se encontraron diferencias al analizar las medias±DE entre los sujetos enfermos con esteroides y los enfermos sin esteroides (19.23±7.99ng/ml vs 21.17±6.41ng/ml, p=0.25). Los sujetos enfermos con actividad de la enfermedad presentaron concentraciones menores comparados con los sujetos enfermos sin actividad (20.12±8.79ng/ml vs 20.59±6.36ng/ml, p=0.8).
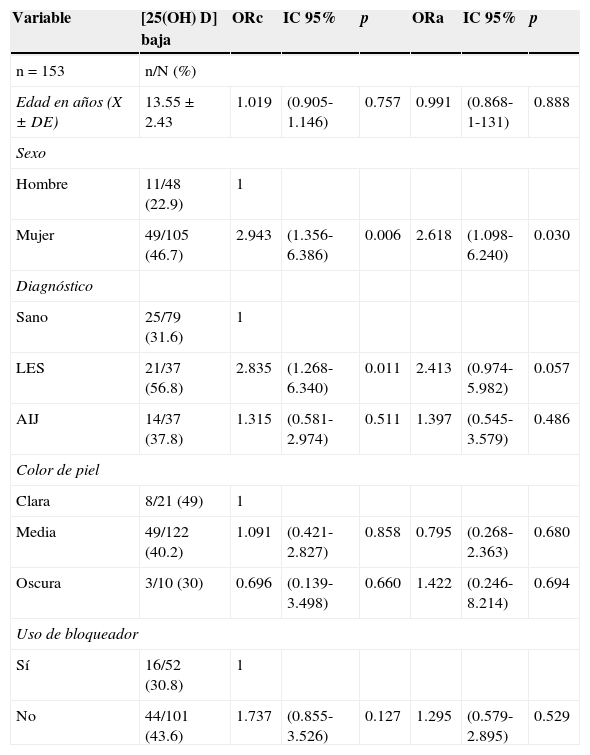
A los sujetos con AIJ se les aplicó el CHAQ. El 54% cursó con la categoría leve-moderado y la categoría moderado, y las medianas de vitamina D fueron de 21.6 y 24.2ng/ml, respectivamente. En cuanto a la clase funcional Steinbrocker, el 97.3% de la población se encontró entre las clases I y II, que corresponden al paciente capaz de realizar actividades de la vida diaria (cuidado personal profesional y entretenimiento), con medianas de concentración de vitamina D de 21.3 y 20.8ng/ml, respectivamente. Al realizar la correlación de las concentraciones de 25(OH) D con el log de PTH, se observó una correlación negativa, estadísticamente significativa (-0.210, p=0.009), a diferencia de las correlaciones con los niveles de Ca, FA y P, las cuales resultaron positivas. La correlaciones de Ca y FA resultaron estadísticamente significativas (p<0.05), pero no así con P (p=0.441). Al realizar la regresión logística por factores de riesgo (diagnóstico, edad, sexo, color de piel y uso de bloqueador) para hipovitaminosis, se observó que los sujetos con diagnóstico de LES presentaron un mayor OR para la presencia de hipovitaminosis, 2.41 (IC 95%: 0.97-5.98; p=0.057) y el OR para mujeres fue de 2.61 (IC 95%: 1.09-6.42; p<0.05). No se observaron diferencias significativas entre los niveles de la vitamina D y el color de piel y uso de bloqueador solar (tabla 5).
Concentraciones séricas de 25(OH) D por factores de riesgo con regresión logística ajustados por diagnóstico, sexo, edad, color de piel y uso de bloqueador solar
| Variable | [25(OH) D] baja | ORc | IC 95% | p | ORa | IC 95% | p |
|---|---|---|---|---|---|---|---|
| n=153 | n/N (%) | ||||||
| Edad en años (X±DE) | 13.55±2.43 | 1.019 | (0.905-1.146) | 0.757 | 0.991 | (0.868-1-131) | 0.888 |
| Sexo | |||||||
| Hombre | 11/48 (22.9) | 1 | |||||
| Mujer | 49/105 (46.7) | 2.943 | (1.356-6.386) | 0.006 | 2.618 | (1.098-6.240) | 0.030 |
| Diagnóstico | |||||||
| Sano | 25/79 (31.6) | 1 | |||||
| LES | 21/37 (56.8) | 2.835 | (1.268-6.340) | 0.011 | 2.413 | (0.974-5.982) | 0.057 |
| AIJ | 14/37 (37.8) | 1.315 | (0.581-2.974) | 0.511 | 1.397 | (0.545-3.579) | 0.486 |
| Color de piel | |||||||
| Clara | 8/21 (49) | 1 | |||||
| Media | 49/122 (40.2) | 1.091 | (0.421-2.827) | 0.858 | 0.795 | (0.268-2.363) | 0.680 |
| Oscura | 3/10 (30) | 0.696 | (0.139-3.498) | 0.660 | 1.422 | (0.246-8.214) | 0.694 |
| Uso de bloqueador | |||||||
| Sí | 16/52 (30.8) | 1 | |||||
| No | 44/101 (43.6) | 1.737 | (0.855-3.526) | 0.127 | 1.295 | (0.579-2.895) | 0.529 |
En la figura 1 se muestran las concentraciones medias de 25(OH) D divididas por factores de riesgo. Se observan diferencias significativas en las variables de sexo, uso de bloqueador solar y diagnóstico (p <0.05). Después de realizar el análisis de covarianza ajustado por los factores de riesgo, se observó que los valores medios de 25(OH) D en el grupo de LES permanecieron bajos (19.95ng/ml) al ser comparados con el grupo control de sanos (p<0.05).
4DiscusiónLos resultados obtenidos en este trabajo muestran una diferencia entre las concentraciones medias de vitamina D de los pacientes con LES comparada con los sujetos sanos (18.95 vs. 23.68ng/ml), que resultó ser significativa (p <0.05). Este hallazgo es consistente con lo publicado en el estudio realizado por Wright y colaboradores en pacientes pediátricos con lupus (n=38) y sujetos sanos (n=207). Al comparar los resultados, se reportaron concentraciones de vitamina D menores en los sujetos enfermos (18ng/ml) que en los sujetos sanos (22.3ng/ml), con una diferencia p =0.004.16
La literatura muestra que la deficiencia de vitamina D, con concentraciones por debajo de 20ng/ml, es un problema prevalente en la población pediátrica31–36. De acuerdo con los puntos establecidos por la IOM con respecto a las concentraciones de 25(OH) D (normal 20-50ng/ml, insuficiencia 12-19ng/ml y deficiencia<12ng/ml),30 el presente estudio reporta concentraciones medias de vitamina D en rangos de normalidad para los grupos de AIJ (21.97ng/ml) y controles sanos (23.68ng/ml), a diferencia del grupo de LES, los cuales se encuentran en rangos de insuficiencia (12-19ng/ml). Con respecto a los valores establecidos por Holick (normalidad>30ng/ml, insuficiencia 20-29ng/ml y deficiencia<20ng/ml),29 las concentraciones medias del grupo de LES se encuentran en deficiencia, y en los grupos de AIJ y controles sanos en insuficiencia.
Los factores de riesgo para presentar concentraciones bajas de vitamina D en este tipo de enfermedades son múltiples, dentro de las cuales se encuentran el color de piel, el uso de bloqueador solar, la exposición al sol, el uso de glucocorticoides y la actividad de la enfermedad. Se ha descrito que el color de piel juega un papel importante en las concentraciones de vitamina D. Específicamente, un color de pigmentación mayor inhibe la síntesis y la biodisponibilidad cutánea de la vitamina D2,6,16,17. En este estudio se encontró que los sujetos con un color de pigmentación mayor corresponden al 6.5%, y se encontraron concentraciones menores de 25(OH) D en los sujetos con piel clara y media, que correspondieron al 93.5% de la población. Estos resultados difieren del estudio realizado por Wright y colaboradores, en el cual la población de sujetos con un color de pigmentación mayor corresponde al 47%, y sí se observan valores menores de vitamina D16.
Los pacientes con LES presentan fotosensibilidad, uno de los criterios diagnósticos de la enfermedad, lo que promueve la producción de autoanticuerpos y que la inflamación empeore. Por tal motivo está indicado el uso de bloqueador solar, el cual reduce la síntesis de vitamina D cutánea hasta en el 99%6. En este estudio se observó que el 89.2% de los sujetos con LES usan bloqueador, y que el 78% tiene una menor exposición al sol (≤420min/semana). En contraste, en los sujetos con AIJ la exposición al sol se dio en el 65%, y en los sujetos sanos en el 57%. Al evaluar las concentraciones de vitamina D se encontró que los sujetos que usan bloqueador solar presentan concentraciones más bajas comparados con aquellos que no lo usan (p=0.05). En el estudio realizado por Robinson y colaboradores, en el cual evaluaron a 37 sujetos de 4 a 21 años de edad con diagnóstico de LES, reportaron el uso de bloqueador solar en el 57%, que estuvo asociado con un incremento de 6ng/ml en las concentraciones de 25(OH) D. Cabe mencionar que los usuarios de bloqueador solar fueron los sujetos con ingesta de suplementos de vitamina D, a diferencia de este estudio en el cual los sujetos no tomaron estos suplementos37.
Se ha descrito en la literatura que el uso de esteroides puede contribuir de forma adversa con el metabolismo y la biodisponibilidad de la vitamina D6,29. En la población aquí estudiada, el 62.2% de los sujetos con LES y el 10.8% de los sujetos con AIJ se encontraban medicados con esteroides. Sin embargo, no se encontraron diferencias significativas entre la medicación y las concentraciones de vitamina D. En el estudio ya mencionado de Robinson y colaboradores, el 66% de su población con LES tomaba algún tipo de glucocorticoide, y tampoco encontraron alguna asociación entre el medicamento y las concentraciones de la vitamina37.
La actividad de la enfermedad al parecer juega un papel importante en las concentraciones de la vitamina D. Se observó que los sujetos enfermos con actividad de la enfermedad presentaron concentraciones más bajas de vitamina D, aunque sin mostrar diferencias significativas. En el estudio de Wright y colaboradores se reportó que los pacientes con actividad de la enfermedad mostraron concentraciones<20ng/ml16. Por su parte, Robinson y colaboradores encontraron que los sujetos con LES también presentaban concentraciones bajas de vitamina D asociadas significativamente con la actividad de la enfermedad37.
Así mismo, al igual que en la literatura, se encontró una correlación negativa estadísticamente significativa entre las concentraciones de 25(OH) D y PTH. Esto significa que a medida que disminuyen las concentraciones de vitamina D incrementa la actividad de la PTH para mantener el metabolismo del calcio38.
Es importante mencionar que los puntos de corte con mayor validez son los establecidos por el IOM, ya que la técnica con la cual se definieron es hasta ahora el estándar de oro39. Es primordial contar con puntos de corte establecidos mundialmente, ya que las diferencias con los autores son objeto de crítica al momento de tomar decisiones acerca de la suplementación cuando se cuenta con rangos tan amplios.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes.
Fuente de financiaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.