La notificación espontánea depende de la capacidad de los médicos de detectar las reacciones adversas a medicamentos (RAM) y del hábito de reportarlas. En 2008 y 2009, la frecuencia de reportes de RAM al Programa Electrónico de Farmacovigilancia (SISFAR) del total de egresos del Hospital Infantil de México Federico Gómez fueron bajas (0.44 y 0.20%, respectivamente). Por esta razón, en el 2010 se decidió evaluar la capacidad de los médicos de identificar las RAM utilizando como estrategia la revisión de los expedientes clínicos.
MétodosSe llevó a cabo un estudio observacional, descriptivo, transversal y retrospectivo en el Departamento de Urgencias (DU), del 1 de marzo al 31 de agosto del 2010. Se clasificaron y cuantificaron como RAM identificadas por los médicos cuando existió evidencia por escrito en el expediente clínico de que ellos habían asociado una manifestación clínica con una RAM, incluyendo además la evaluación del número de reportes al SISFAR. Se realizó el análisis descriptivo con SPSS versión 18.
ResultadosLa frecuencia de RAM de los pacientes que ingresaron al DU fue del 21.8%. El 86% de ellas fueron identificadas por los médicos en el expediente clínico y el 14% por el farmacéutico. Se reportó solamente el 6.1% al SISFAR.
ConclusionesAunque fue elevada la identificación de las RAM en el expediente clínico, es posible que existan algunas que no se hayan detectado. Por otra parte, se confirmó el elevado grado de subreporte al SISFAR, por lo que se requieren acciones para fomentar el hábito del reporte.
Spontaneous notification depends on the ability of pediatricians to identify adverse drug reactions (ADRs) along with their habit of reporting these incidents. During the years 2008 and 2009, the frequency of reports of ADRs to the Electronic Program of Pharmacovigilance (SISFAR) in the Hospital Infantil of Mexico Federico Gomez (HIMFG) was low (0.44% and 0.20%, respectively). Because of the above, the ability of pediatricians from the Emergency Department (ED) to identify ADRs using the clinical chart review was evaluated in 2010 in this study.
MethodsA descriptive, observational, cross-sectional retrospective study was conducted in the ED from March 1 to August 31. ADRs were classified and quantified as “ADRs identified by pediatricians” when there was evidence in the clinical chart that pediatricians associated a clinical sign, symptom and laboratory value with an ADR. The numbers of notifications reported in SISFAR were quantified. Descriptive analysis was done using SPSS v.18.
ResultsConsidering patients who were admitted to the ED, the frequency of ADRs was 21.8%. The frequency of ADRs identified by physicians in clinical charts was 86%. The pharmacist detected 14% of ADRs. The frequency of ADRs reported by physicians was 6.1%.
ConclusionsAlthough identification of ADRs in the clinical charts by pediatricians was high, it is possible that some ADRs were undetected. Because underreporting was very high, it is necessary to take actions to improve the reporting process.
El Programa Internacional de Monitoreo de los Medicamentos de la Organización Mundial de la Salud (OMS) define a la Farmacovigilancia como la ciencia y las actividades relacionadas con la detección, medición, entendimiento y prevención de efectos adversos o cualquier otro problema asociado con fármacos1. De acuerdo con la metodología empleada para su búsqueda, las reacciones adversas a medicamentos (RAM) se presentan con una frecuencia del 0.14% al 36.6% en los niños2–4. Presentan un gran impacto en la morbilidad, en la mortalidad5,6 y en los costos7. Dentro de las metodologías existentes, cabe destacar que la recomendada por el Programa Internacional de Monitoreo de los Medicamentos para el desarrollo de las actividades de farmacovigilancia es la notificación espontánea (NE), que debe realizarse voluntariamente por los profesionales de la salud y la industria farmacéutica a la autoridad sanitaria1.
La NE permite la detección temprana de nuevas señales, así como de las RAM graves y de poca frecuencia8. De acuerdo con lo publicado por el Centro Internacional de Monitoreo de los Medicamentos, localizado en Uppsala, Suecia9, los médicos son los profesionales de la salud que más participan en ese programa auspiciado por la OMS, con el 55% de las notificaciones en los pacientes de 0 a 17 años y el 49% en mayores de 18 años. A pesar de lo anterior, existen causas atribuidas a los médicos que potencialmente disminuyen la eficacia de la NE, como una baja capacidad para identificar las RAM, o el hábito de no reportar a los organismos regulatorios las que han detectado10. Con respecto a la identificación de las RAM, en primer término es indispensable que se sospeche que un signo, síntoma o anormalidades de los exámenes de laboratorio en un paciente puedan ser causados por un medicamento. Para ello, el médico tiene que desarrollar una habilidad que debe convertirse en un hábito para detectar, en todo paciente que esté recibiendo uno o varios medicamentos, signos y síntomas que no están directamente relacionados con la enfermedad. Pero también puede suceder que los médicos, habiendo identificado una RAM, no la reporten a los organismos regulatorios correspondientes, por lo que se originan cifras de subreporte que oscilan entre el 6-100%10. Hay diversos estudios que han tratado de identificar las características personales y profesionales, así como las actitudes, en los médicos asociadas con el subreporte11. Sin embargo, existen escasas publicaciones en las que se haya evaluado la capacidad de los médicos para identificar las RAM en pacientes pediátricos12–14.
El Sistema de Farmacovigilancia (SISFAR) del Hospital Infantil de México Federico Gómez (HIMFG), que es un hospital de tercer nivel de atención, está basado en la NE. Inicialmente, se realizaba con el llenado manual de los formatos de reportes. Sin embargo, se sustituyó por un programa electrónico denominado SISFAR, el cual fue desarrollado por el Centro Institucional de Farmacovigilancia (CIF) del propio HIMFG, sustentado en la Norma Oficial Mexicana de Farmacovigilancia (NOM-220-SSA1-2012)15. Este fue instalado en 10 áreas de hospitalización, incluyendo el Departamento de Urgencias (DU)16. El SISFAR tiene la ventaja de ser de fácil acceso y llenado, por lo que la captura consume menos tiempo comparado con el método manual. Al recibir la notificación electrónica, un farmacéutico la analiza de acuerdo con los lineamientos de la NOM-220-SSA1-2012,15 y la envía al Centro Nacional de Farmacovigilancia (CNF) de la Secretaría de Salud de México.
A pesar de contar con este sistema en el HIMFG, durante 2008 y 2009 la frecuencia de reportes de RAM al SISFAR del total de egresos fue baja (0.44 y 0.20%, respectivamente)17,18. Con la finalidad de encontrar una explicación para el bajo reporte de las RAM al SISFAR, se decidió investigar si este fenómeno podía atribuirse a que los médicos no identificaban las RAM, o si las identificaban y optaban por no reportarlas al SISFAR.
2MétodosEl estudio se realizó en el DU del HIMFG. El diseño fue observacional, descriptivo, transversal y retrospectivo. Inició el 1 de marzo del 2010 y concluyó el 31 de agosto del mismo año. La definición de una RAM se basó en la emitida por la OMS: una respuesta a fármacos que es nociva, no intencionada y ocurre a dosis normalmente utilizadas en el hombre para la profilaxis, diagnóstico, terapéutica o la modificación de una función fisiológica1.
Antes de iniciar el presente estudio, y como parte de las actividades de rutina del Centro Institucional de Farmacovigilancia, se efectuó una capacitación dirigida exclusivamente al personal médico del DU, que incluyó un adiestramiento para el llenado electrónico del SISFAR. Se aclararon las dudas que el personal tuvo al respecto del programa y se incluyeron pláticas relacionadas con la importancia de la Farmacovigilancia en adultos y en niños. Una vez concluido lo anterior, se cuantificaron las notificaciones que los médicos enviaron al CIF durante el periodo del estudio. Los médicos adscritos, miembros permanentes del personal, fueron cuatro, además de cinco residentes de la subespecialidad de Urgencias Pediátricas (dos de primer año, dos de segundo y un jefe de residentes) que permanecieron durante todo el periodo del estudio, y cinco residentes más de la especialidad de Pediatría (dos de primer año, uno de segundo y uno de tercero), que en promedio tuvieron una permanencia de un mes y eran sustituidos por otros nuevos, que también eran capacitados.
Los pacientes se clasificaron con una “RAM identificada por los médicos” cuando, de acuerdo con un farmacéutico capacitado en Farmacovigilancia, se encontraba evidencia por escrito de que los médicos habían asociado una manifestación clínica con una RAM. Para realizar lo anterior, se revisaron los expedientes clínicos de cada paciente internado en el DU buscando en las notas clínicas de los médicos, en la hoja de indicaciones de enfermería y en los exámenes de laboratorio y gabinete, evidencias de una posible RAM, incluyendo la búsqueda de términos y acciones tales como “debido a fármacos”, “relacionado con fármacos”, “asociado con la administración de fármacos”, “reacción adversa a fármacos”, “diagnósticos del paciente”, “si el médico retiró el medicamento sospechoso” y “si el médico administró algún fármaco para tratar una RAM”. Las RAM se clasificaron con respecto a la severidad, la gravedad y la causalidad, conforme a la Norma Oficial Mexicana de Farmacovigilancia (NOM-220-SSA1-2012)15. El farmacéutico consultó las manifestaciones clínicas de las RAM de cada uno de los medicamentos administrados a los pacientes en MICROMEDEX 2.019.
Cuando existía cierta duda sobre una posible relación causa-efecto del medicamento con las manifestaciones clínicas, esta fue discutida con un médico pediatra experto en Farmacovigilancia. Para la colección de la información de los expedientes clínicos se diseñó, en Microsoft Office Excel 2007, una base de datos que incluyó la captura de aspectos demográficos de los pacientes (número de expediente, nombre, fecha de nacimiento, edad, sexo, peso, talla), diagnósticos de ingreso, fecha de ingreso, resultados de laboratorio, datos relevantes de la historia clínica y de los medicamentos administrados antes de su ingreso o durante el mismo, así como la fecha de egreso del DU.
2.1Análisis estadísticoEl tamaño de la muestra del estudio fue por conveniencia. Se calculó la frecuencia de las RAM en el DU, así como la frecuencia de las RAM identificadas por los médicos en el expediente clínico y las que fueron notificadas al SISFAR. La edad de los pacientes se categorizó de acuerdo a la guía de la Conferencia Internacional de Armonización sobre la Investigación Clínica de Productos Médicos en la Población Pediátrica20 y el puntaje Z de índice de masa corporal se calculó con el programa WHO AnthroPlus21. El análisis descriptivo incluyó medidas de tendencia central y de dispersión como el número de casos (%), media (IC 95%) y mediana (percentiles 25-75). El análisis estadístico se realizó con SPSS versión 18.
2.2Consideraciones éticasEl protocolo de investigación fue aprobado por la Comisión de Investigación y los comités de Ética y Bioseguridad del Hospital Infantil de México Federico Gómez.
3ResultadosDurante el periodo de estudio, las primeras 10 causas de internamiento en el DU clasificadas de acuerdo con la ICD-1022 fueron neumonía (J18.9) (8.97%), agranulocitosis (D70) (5.42%), convulsiones (R56.8) (4.73%), hemartrosis por hemofilia (M25.0) (4.26%), gastroenteritis (A09) (3.17%), septicemia (A41.9) (3.05%), traumatismo intracraneano (S06.9) (2.98%), epistaxis (R04.0) (2.89%), estado asmático (J46) (2.11%) y leucemia linfoblástica aguda (C91.0) (1.79%).
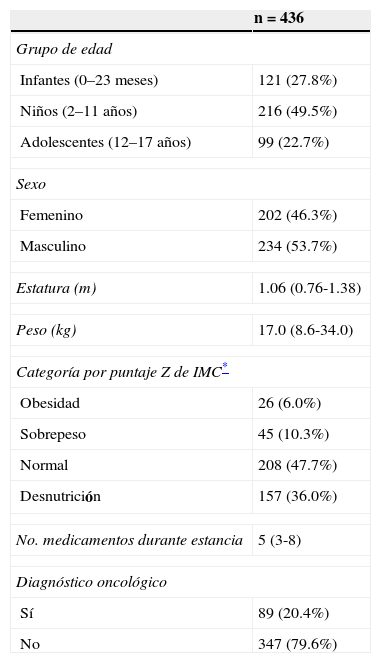
De un total de 436 casos que ingresaron al DU del 1 de marzo al 31 de agosto del 2010, en 95 pacientes se documentó una RAM (21.8%). De estas, 82 fueron identificadas y consignadas en el expediente clínico por los médicos (86%) y las 13 restantes fueron identificadas solamente por el farmacéutico (14%). De las 82 identificadas y consignadas por los médicos, solo cinco fueron también reportadas al SISFAR (6.1%). Con la finalidad de describir las características demográficas de los pacientes que se incluyeron en el estudio, se generó la tabla 1, en la que puede observarse que el 49.5% de los niños tenía de 2 a 11 años de edad, el 6% presentaba obesidad y el 36.0% desnutrición, y que el número promedio de medicamentos recibidos durante su estancia fue de cinco. Además, el 20.4% presentó una enfermedad oncológica.
Datos sociodemográficos de los niños
| n = 436 | |
|---|---|
| Grupo de edad | |
| Infantes (0–23 meses) | 121 (27.8%) |
| Niños (2–11 años) | 216 (49.5%) |
| Adolescentes (12–17 años) | 99 (22.7%) |
| Sexo | |
| Femenino | 202 (46.3%) |
| Masculino | 234 (53.7%) |
| Estatura (m) | 1.06 (0.76-1.38) |
| Peso (kg) | 17.0 (8.6-34.0) |
| Categoría por puntaje Z de IMC* | |
| Obesidad | 26 (6.0%) |
| Sobrepeso | 45 (10.3%) |
| Normal | 208 (47.7%) |
| Desnutrición | 157 (36.0%) |
| No. medicamentos durante estancia | 5 (3-8) |
| Diagnóstico oncológico | |
| Sí | 89 (20.4%) |
| No | 347 (79.6%) |
Un hallazgo relevante e inesperado en el presente estudio fue que los médicos identificaron y anotaron en el expediente clínico un porcentaje elevado de las RAM que se presentaron en los niños, aun cuando la gran mayoría de ellos no enviaron la notificación electrónica al CIF. Cabe resaltar que a pesar de que la identificación de las RAM por los médicos en el total de los 95 pacientes fue del 86%, la falta de reporte al CIF fue muy elevada (93.9%). Otro hallazgo también inesperado fue que se realizaron acciones con los pacientes en los que el médico identificó una RAM, como la suspensión del medicamento sospechoso, o en algunos casos el inicio de un tratamiento específico para controlar los efectos adversos, acciones que no fueron cuantificadas en el estudio. Cabe destacar que la identificación del 14% de los casos de RAM adicionales encontrados en el presente estudio fue realizada por el farmacéutico, lo que propició una identificación más eficaz. Este hallazgo concuerda con otros estudios que incluyen a los farmacéuticos como revisores de expedientes, ya que ellos detectan tasas más elevadas de eventos adversos a medicamentos que otros profesionales de la salud23.
Con respecto a la identificación de las RAM, existen otros hallazgos parecidos a los del presente estudio. Tal es el caso de una unidad de cuidados intensivos de adultos en la que los médicos identificaron y anotaron en el expediente el 70% de las RAM que presentaron sus pacientes24. En el caso de pacientes pediátricos, Neubert y colaboradores realizaron un estudio en el que se revisó el expediente clínico por un equipo de expertos (Farmacólogo Clínico, Farmacéutico y Pediatra) como estándar de oro, y encontraron que los médicos reconocieron el 50% de las RAM que se presentaron en los niños internados en ese hospital pediátrico12. Por otro lado, Oehme y colaboradores, en 1999, encontraron que los médicos identificaron en el expediente clínico el 45.7% de las RAM. Esta cifra se elevó al 96.2% para el año 2008, lo que fue atribuido a una mayor sensibilización por parte del personal médico. En otro estudio realizado en niños, en el que también se utilizó el expediente clínico para la búsqueda de las RAM, se encontró que el 91.1% de ellas habían sido identificadas por el médico14. En México, en un estudio realizado en adultos hospitalizados, los médicos identificaron y anotaron en el expediente clínico el 76% de las RAM25. Como se mencionó en los resultados, la frecuencia de las RAM en el DU fue del 21.8%, que puede considerarse como una de las más altas reportadas en pacientes pediátricos hospitalizados2,3, y puede explicarse, en buena medida, por la metodología utilizada o por las características de un departamento de urgencias pediátrico.
Cabe destacar que algunos autores13,26 han reportado que la revisión del expediente clínico puede considerarse como el estándar de oro. Sin embargo, también hacen notar que es un método que consume tiempo, recursos humanos y, por lo tanto, resulta más costoso, con una condicionante más: que si se aplica en unidades médicas donde el expediente clínico tiene deficiencias, los resultados pueden ser poco confiables. Por otra parte, también se señala con respecto a los métodos computarizados14,26–28 que estos permiten analizar la posibilidad de una relación causal a través de la generación de algoritmos, y son considerados como herramientas prácticas, de bajo costo de implementación, que consumen menos recursos e incrementan las tasas de detección de las RAM, comparadas con la NE y la revisión manual de los expedientes clínicos. Sin embargo, una limitante de los métodos computarizados es que existen hospitales que no cuentan con un registro electrónico completo de los expedientes clínicos que incluya la historia clínica, las notas de los médicos y de enfermería, y los exámenes de laboratorio y gabinete. Un procedimiento que tal vez podría incrementar el número de reportes y mejorar la identificación de las RAM sería la obligatoriedad del reporte de las mismas en vez del reporte voluntario, como recientemente fue implementado en la Norma Oficial de Farmacovigilancia en México15. Sin embargo, como se demostró en una revisión sistemática11, no necesariamente la medida anterior resulta útil en la práctica, ya que de todas formas existen factores profesionales y personales que frecuentemente participan en el subreporte de las RAM, como la especialidad médica, la edad, el lugar y carga de trabajo, la capacitación específica en Farmacovigilancia, el desconocimiento de los requerimientos, el miedo al ridículo, la falta de interés, la indiferencia, la inseguridad, la complacencia y el temor de problemas legales.
En futuros estudios relacionados con las RAM deberá especificarse cuál es la definición de una RAM, ya sea la recomendada desde hace años por la OMS o la nueva, que en diciembre del 201029 fue acuñada por el Parlamento y el Consejo Europeo y que se encuentra vigente desde julio de 2012 en la regulación de medicamentos humanos en la Unión Europea. Esta define una RAM como “una respuesta a un medicamento la cual es dañina y no intencionada”. Este cambio tuvo como finalidad garantizar que se cubrieran los efectos nocivos y no intencionados, resultados no solo del uso autorizado de un medicamento a dosis normales, sino también como consecuencia de los errores de medicación y aplicaciones fuera de los términos de autorización, incluyendo el mal uso y abuso de los medicamentos.
Dentro de las limitaciones del presente estudio pueden plantearse las siguientes:
- •
Los hallazgos solamente reflejan lo sucedido en el DU, por lo que no pueden ser extrapolados a los otros departamentos clínicos y quirúrgicos del hospital en estudio.
- •
A pesar de la capacitación del personal del DU, puede considerarse que esta no resultó efectiva ya sea porque no tuvo un impacto en los médicos o porque no fue lo suficientemente didáctica, como se infiere por el bajo porcentaje de reportes espontáneos de las RAM al CIF.
- •
No se exploraron los motivos de no realizar el reporte de una RAM identificada por el médico al CIF a través de un cuestionario estructurado, como varias de las causas que se mencionaron previamente11.
- •
A veces, en el expediente clínico, no se identificaban con toda claridad las notas clínicas de los médicos, ya fuera porque estaban escritas a mano, en otras ocasiones porque se encontraban en desorden, o porque faltaban algunos exámenes de laboratorio o datos de algún tratamiento.
- •
No se puede descartar que, en cierto número de casos, el médico haya pensado en la presencia de una RAM, pero optó por no anotarlo en el expediente.
- •
Los casos en los que el médico no pensó en la asociación de un medicamento ante la presencia de ciertos signos, síntomas y alteraciones de los exámenes de laboratorio no fueron investigados.
En conclusión, en el presente estudio se demuestra que los médicos de este hospital identifican las RAM que se presentan en los niños hospitalizados en el DU. Sin embargo, el principal problema es que no se reportan, para lo cual es necesario implementar estrategias que mejoren sustantivamente el reporte de las RAM al CIF, con lo que el subreporte podría minimizarse. Es recomendable incorporar más intencionadamente a los farmacéuticos en la vigilancia de las actividades de Farmacovigilancia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Fuente de financiamientoNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.