Salmonella enterica es una especie de bacterias anaeróbicas facultativas que han sido empleadas con gran éxito como vector bacteriano vivo atenuado con fines vacunales. Recientemente se ha documentado que S. enterica tiene propiedades importantes para ser considerada como agente terapéutico contra el cáncer. Estudios preclínicos y clínicos han demostrado que S. enterica coloniza tumores sólidos, semisólidos y metástasis, además de que contribuye a disminuir la resistencia a los tratamientos. En esta revisión se aborda la capacidad de S. enterica atenuada para eliminar células tumorales y su empleo como vector bacteriano vivo acarreador de moléculas heterólogas contra el cáncer.
Salmonella enterica, a species of facultative anaerobic bacteria, has demonstrated success as a live-attenuated bacterial vector for vaccination. S. enterica has also demonstrated promise as a therapeutic agent against cancer. Pre-clinical and clinical trials have shown that S. enterica is localized in both solid and semi-solid tumors as well as in metastatic tumors. Moreover, S. enterica reduces resistance to treatment with other agents. In this review we present the novel therapeutic anti-cancer approaches that use S. enterica both for its ability as a delivery system for heterologous moieties against cancer and for its direct anti-cancer properties.
El cáncer constituye uno de los principales retos de salud pública en el mundo, y aunque se han realizado grandes progresos con los tratamientos, los problemas relacionados con la eliminación de metástasis, los efectos adversos y la resistencia a los tratamientos hacen necesaria la búsqueda de alternativas terapéuticas con mayor efectividad y selectividad por las células alteradas o el microambiente tumoral1–5. Una alternativa para la solución a estos problemas es el empleo de vectores bacterianos vivos atenuados como agentes antitumorales o acarreadores de moléculas con actividad antitumoral6–8.
1.1Vectores bacterianos en la terapia antitumoralLa propuesta de emplear bacterias como agentes antitumorales fue documentada desde 1868 por W. Busch, al observar que el sarcoma de una paciente disminuyó al adquirir un proceso de erisipela9. Esta observación fue retomada 30 años después por William B. Coley10 y Friedrich Fehleisen. Este último describió que el agente causante de la erisipela era el Streptococcus pyogenes9. Las observaciones de W. Coley sobre la recuperación de pacientes con cáncer después de una infección por erisipela lo llevaron a desarrollar una vacuna denominada toxina de Coley, compuesta por Streptococcus pyogenes y Serratia marcescens, para tratar pacientes con sarcomas, carcinomas, linfomas, melanomas y mielomas9–11. Esta toxina perdió importancia debido a los avances de la radioterapia y la quimioterapia.
El principio antitumoral de las bacterias fue retomado en 1935 por Holmgren, quien reportó que la cepa atenuada de Mycobacterium bovis, el Bacillus Calmette-Guérin (BCG), tenía actividad antitumoral12. Esta actividad antitumoral podría explicar la observación de Rosenthal sobre la baja incidencia de leucemia en los neonatos inmunizados con BCG13. Estudios posteriores permitieron que, desde 1976, BCG sea aplicada vía intravesical como inmunoterapia para reducir la recurrencia y la progresión del carcinoma de vejiga de células transicionales superficiales5,13,14.
Recientemente se han propuesto tres grupos distintos de bacterias con actividad antitumoral como resultado de su habilidad de tolerar el oxígeno, el cual se encuentra en concentraciones muy bajas en el microambiente tumoral. En el grupo I se encuentran bacterias estrictamente anaeróbicas del género Bifidobacterium (que producen ácido láctico); en el grupo II se encuentran bacterias intracelulares de los géneros Salmonella y Listeria (que son anaeróbicas facultativas); por último, en el grupo III se encuentran bacterias estrictamente anaeróbicas del género Clostridium (formadoras de esporas).3
Dentro de estos grupos de bacterias, Salmonella enterica serovar Typhi (S. Typhi), que infecta al humano, y Salmonella enterica serovar Typhimurium (S. Typhimurium), que infecta al ratón y al humano, han llamado la atención por la disponibilidad de cepas atenuadas con baja toxicidad15 y por su alta especificidad por el tejido tumoral,16,17 incluyendo las metástasis18.
2Salmonella enterica y su selectividad por el microambiente tumoralActualmente, S. enterica es el vector bacteriano más utilizado como agente terapéutico en modelos preclínicos de cáncer. Sin embargo, los mecanismos que explican la selectividad de esta bacteria hacia los tejidos tumorales no son muy claros. Se ha descrito que el microambiente generado por la fisiopatología del tumor, caracterizado por hipoxia (a concentraciones de oxígeno ≤10mmHg comparadas con el tejido normal de 50-60 mmHg)3, acidez (originada como consecuencia del ácido láctico, producto del metabolismo anaeróbico inducido por la disminución de oxígeno) y necrosis (resultado de la muerte de células tumorales por falta de nutrientes y crecimiento descontrolado), podrían contribuir a la proliferación bacteriana en el microambiente tumoral6.
Estudios in vitro realizados por Kasinskas y Forbes, donde se mimetizó el microambiente tumoral de células de carcinoma de colon y el gradiente de metabolitos en los tumores humanos, han demostrado que S. enterica migra al tejido tumoral por la atracción de moléculas que estarían actuando como agentes quimiotácticos al unirse a sus respectivos receptores en la bacteria, favoreciendo la colonización del tumor19. De esta manera, el receptor de aspartato en S. enterica inicia la quimiotaxis de la bacteria hacia la zona tumoral, el receptor de serina inicia la penetración y el receptor de ribosa/galactosa dirige a S. enterica hacia la zona de necrosis tumoral20. En este proceso, la motilidad de la bacteria mediada por moléculas como CheA/CheY es indispensable para la distribución efectiva y para el reclutamiento de la bacteria en el tejido tumoral20–22. Sin embargo, estos hallazgos han sido confrontados recientemente con los estudios in vivo realizados por Crull y colaboradores en un modelo murino de carcinoma de colon. Estos demuestran que la invasión y la colonización del tumor por S. Typhimurium es independiente de las islas de patogenicidad tipo I y tipo II, e incluso independiente de la motilidad y de la respuesta quimiotáctica. Sus resultados también sugieren que la colonización y la actividad antitumoral se ven afectadas por la vía de administración, resultando la vía intravenosa y la vía intraperitoneal las más eficaces23. Este estudio también confirmó que las cepas de S. Typhimurium mutadas en las vías metabólicas de la síntesis de aminoácidos aromáticos disminuyeron ligeramente la colonización del tejido tumoral en comparación con las bacterias de la cepa silvestre21.
Se ha propuesto que, una vez que S. enterica llega al microambiente tumoral, los mecanismos que permiten su permanencia están asociados con la poca actividad de los macrófagos y neutrófilos24 debido a la hipoxia dentro del tumor, a la supresión de la respuesta inmune mediada por la presencia de citocinas (como TGF-β) y al difícil acceso de los anticuerpos anti-Salmonella y de los factores de complemento por el crecimiento irregular de los vasos sanguíneos dentro del tumor25.
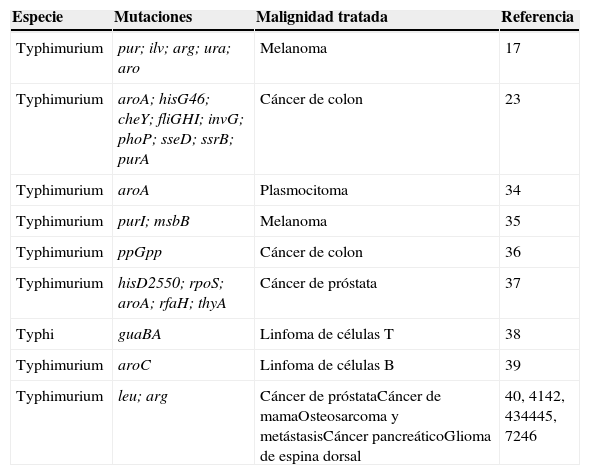
3Salmonella enterica y su actividad intrínseca antitumoralS. enterica es una bacteria anaeróbica facultativa que ha sido empleada con gran éxito como vector bacteriano vivo atenuado con fines vacunales en función de su afinidad por células presentadoras de antígenos8,26,27. Esta característica está asociada con los mecanismos de inducción o activación de la respuesta inmune innata28,29 o específica30,31, que explican parte de la actividad inmunoterapéutica antitumoral que posee esta bacteria. La actividad intrínseca antitumoral de S. enterica se complementa con la competencia entre la célula tumoral y la bacteria por los nutrientes o por la liberación de componentes bacterianos antitumorales debido a la lisis de las bacterias adheridas a la célula tumoral15. Diversos estudios han documentado la actividad intrínseca antitumoral per se que S. enterica posee (Tabla 1).
Salmonella enterica y su actividad intrínseca antitumoral
| Especie | Mutaciones | Malignidad tratada | Referencia |
|---|---|---|---|
| Typhimurium | pur; ilv; arg; ura; aro | Melanoma | 17 |
| Typhimurium | aroA; hisG46; cheY; fliGHI; invG; phoP; sseD; ssrB; purA | Cáncer de colon | 23 |
| Typhimurium | aroA | Plasmocitoma | 34 |
| Typhimurium | purI; msbB | Melanoma | 35 |
| Typhimurium | ppGpp | Cáncer de colon | 36 |
| Typhimurium | hisD2550; rpoS; aroA; rfaH; thyA | Cáncer de próstata | 37 |
| Typhi | guaBA | Linfoma de células T | 38 |
| Typhimurium | aroC | Linfoma de células B | 39 |
| Typhimurium | leu; arg | Cáncer de próstataCáncer de mamaOsteosarcoma y metástasisCáncer pancreáticoGlioma de espina dorsal | 40, 4142, 434445, 7246 |
Desde 1982, Kurashige y Mitsuhashi documentaron la inducción de la respuesta inmune con actividad antitumoral por el empleo de minicélulas (vesículas sin ADN genómico) obtenidas de S. Typhimurium en un modelo murino de sarcoma32, así como de linfoma de células T33. En estos modelos, las minicélulas restauraron la actividad de los macrófagos en el microambiente tumoral. Posteriormente, los estudios de Eisenstein y colaboradores, en 1995, empleando mutantes en vías metabólicas (mutantes en aroA) de S. Typhimurium SL3235 demostraron que estas cepas atenuadas fueron efectivas para inhibir el crecimiento y reducir el tamaño tumoral en un modelo murino de plasmocitoma34. La capacidad de las cepas atenuadas de S. enterica para colonizar y replicar dentro de los tumores fue demostrada por Pawelek y colaboradores desde 1997, empleando un modelo de melanoma murino. Los resultados mostraron una relación de colonización de 1,000:1 con respecto al tejido normal, y se confirmó su utilidad como acarreador de proteínas terapéuticas hacia las células tumorales in vivo17. Desde entonces han surgido diversos reportes demostrando que las cepas atenuadas de S. enterica tienen la capacidad de reducir el tamaño del tumor, de retrasar el desarrollo de metástasis y prolongar la sobrevida en diversos modelos murinos de cáncer, como en el caso de carcinoma de pulmón,35 carcinoma de colon,23,36 cáncer de próstata,37 linfoma metastásico de células T38 y linfoma de células B,39 entre otros.
Estos estudios han sido consistentes con las observaciones realizadas en modelos murinos de xenotrasplantes con líneas celulares humanas, entre ellas cáncer de mama y próstata,40–42 donde se han empleado cepas atenuadas de S. Typhimurium que inducen menor toxicidad en el hospedero y que mantienen su actividad antitumoral. Ejemplo de ello son los trabajos descritos con las cepas auxotróficas A1 (deficientes en la síntesis de leucina y arginina) y A1-R (deficiente en la síntesis de leucina y arginina, con mayor capacidad de eliminar células tumorales), que se han empleado en modelos murinos de xenotrasplantes de cáncer de próstata humano40 y sus metástasis41, así como cáncer de mama humano42. Los resultados en este último modelo demuestran que las cepas colonizan el tumor, y que aproximadamente el 40% de los animales tratados erradicaron completamente el tumor y permanecieron aparentemente sanos las veinte semanas que duró el experimento42. Estudios recientes demuestran que esta cepa A1-R inhibe la metástasis a hueso que induce el cáncer de mama43. Otros trabajos han documentado la actividad antitumoral y antimetastásica de S. Typhimurium A1-R en osteosarcoma,44 cáncer pancreático45 y en gliomas de la espina dorsal46.
Diversos esfuerzos se han realizado para obtener cepas atenuadas de S. enterica que reduzcan los efectos secundarios en el hospedero. Con esta finalidad fue desarrollada la cepa VNP20009 de S. Typhimurium con mutaciones en los genes msbB (que afectan la formación de lípido A, reduciendo la toxicidad asociada al lipopolisacárido) y purI (que la hace dependiente de una fuente externa de adenina). Esta cepa se ha empleado en estudios clínicos de fase I en 24 pacientes con melanoma metastásico y un paciente con carcinoma renal metastásico. Los pacientes que recibieron dosis intravenosas de 3x108 UFC/m2 de la cepa VNP20009 no presentaron reacciones adversas severas. Sin embargo, la colonización del tejido tumoral fue moderada y el efecto antitumoral no fue significativo47.
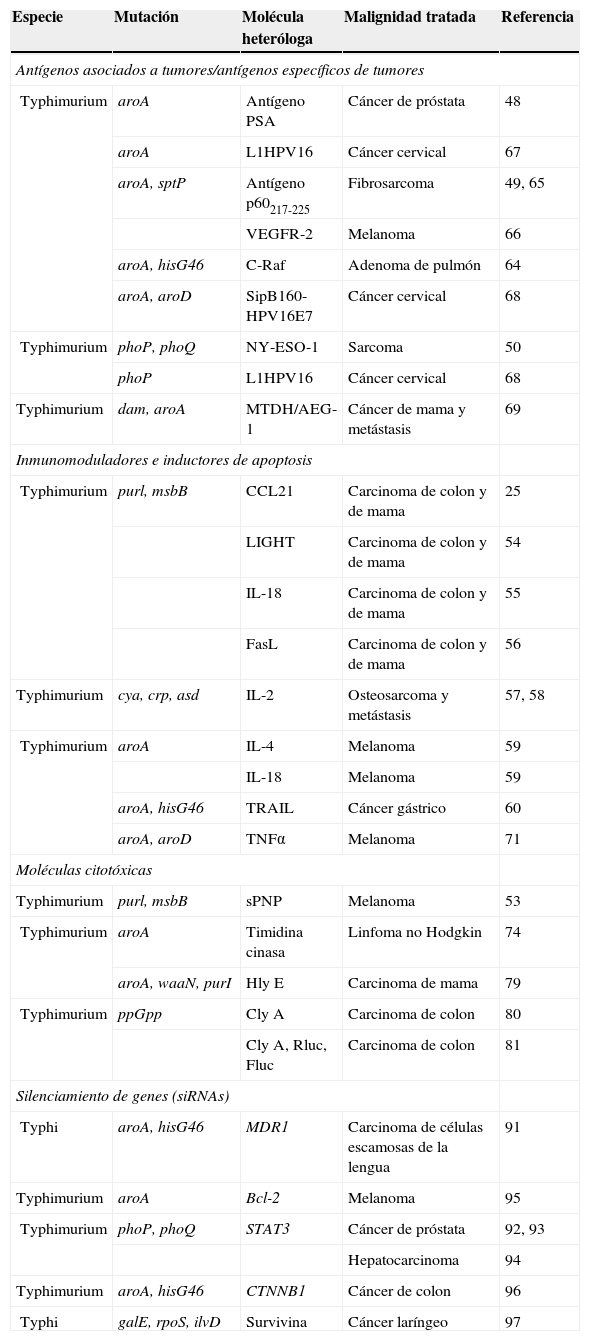
4Salmonella enterica como acarreador de moléculas heterólogas antitumoralesLa modesta actividad antitumoral inducida por S. enterica en los estudios clínicos47 pone de manifiesto la necesidad de mecanismos alternativos para potenciar y asegurar la reversión del tumor. Para el caso de tumores inmunogénicos, se han expresado en S. enterica antígenos asociados con tumores y antígenos específicos de tumores que se sobreexpresan en la célula tumoral, con la finalidad de inducir o potenciar la respuesta inmune específica en contra del tumor48–50. Para el caso de los tumores no inmunogénicos, se han expresado en S. enterica proteínas que activan moléculas citotóxicas51–53 o inmunomoduladoras que potencian la respuesta inmune o que inducen a la célula tumoral a morir por apoptosis25,54–60. Esta estrategia también ha sido útil en los tumores inmunogénicos (Tabla 2).
Salmonella entérica como acarreador de moléculas heterólogas antitumorales
| Especie | Mutación | Molécula heteróloga | Malignidad tratada | Referencia |
|---|---|---|---|---|
| Antígenos asociados a tumores/antígenos específicos de tumores | ||||
| Typhimurium | aroA | Antígeno PSA | Cáncer de próstata | 48 |
| aroA | L1HPV16 | Cáncer cervical | 67 | |
| aroA, sptP | Antígeno p60217-225 | Fibrosarcoma | 49, 65 | |
| VEGFR-2 | Melanoma | 66 | ||
| aroA, hisG46 | C-Raf | Adenoma de pulmón | 64 | |
| aroA, aroD | SipB160-HPV16E7 | Cáncer cervical | 68 | |
| Typhimurium | phoP, phoQ | NY-ESO-1 | Sarcoma | 50 |
| phoP | L1HPV16 | Cáncer cervical | 68 | |
| Typhimurium | dam, aroA | MTDH/AEG-1 | Cáncer de mama y metástasis | 69 |
| Inmunomoduladores e inductores de apoptosis | ||||
| Typhimurium | purl, msbB | CCL21 | Carcinoma de colon y de mama | 25 |
| LIGHT | Carcinoma de colon y de mama | 54 | ||
| IL-18 | Carcinoma de colon y de mama | 55 | ||
| FasL | Carcinoma de colon y de mama | 56 | ||
| Typhimurium | cya, crp, asd | IL-2 | Osteosarcoma y metástasis | 57, 58 |
| Typhimurium | aroA | IL-4 | Melanoma | 59 |
| IL-18 | Melanoma | 59 | ||
| aroA, hisG46 | TRAIL | Cáncer gástrico | 60 | |
| aroA, aroD | TNFα | Melanoma | 71 | |
| Moléculas citotóxicas | ||||
| Typhimurium | purl, msbB | sPNP | Melanoma | 53 |
| Typhimurium | aroA | Timidina cinasa | Linfoma no Hodgkin | 74 |
| aroA, waaN, purI | Hly E | Carcinoma de mama | 79 | |
| Typhimurium | ppGpp | Cly A | Carcinoma de colon | 80 |
| Cly A, Rluc, Fluc | Carcinoma de colon | 81 | ||
| Silenciamiento de genes (siRNAs) | ||||
| Typhi | aroA, hisG46 | MDR1 | Carcinoma de células escamosas de la lengua | 91 |
| Typhimurium | aroA | Bcl-2 | Melanoma | 95 |
| Typhimurium | phoP, phoQ | STAT3 | Cáncer de próstata | 92, 93 |
| Hepatocarcinoma | 94 | |||
| Typhimurium | aroA, hisG46 | CTNNB1 | Cáncer de colon | 96 |
| Typhi | galE, rpoS, ilvD | Survivina | Cáncer laríngeo | 97 |
AEG-1: astrocyte elevated gene-1; Bcl-2: B-cell lymphoma 2 gene; CCL21: chemokine (C-C motif) ligand 21; CTNNB1: catenin beta-1 gene; C-Raf1: serine-threonine kinases of the Raf family; Cly A: cytolysin A; FasL: Fas ligand; Fluc: firefly luciferase; Hly E: hemolysin E; IL-2: interleukin-2; IL-4: interleukin-4; IL-18: interleukin-4; LIGHT: a member of TNF cytokine family; L1HPV16: capsid protein L1HPV16; MTDH: Metadherin; MDR1: multidrug resistance protein 1 gene; NY-ESO-1: testis antigen; sPNP: Salmonella purine nucleoside phosphorylase; Rluc: Renilla luciferase; STAT3: signal transducer and activator of transcription 3 gene; HPV16E7: human papilloma virus protein E7; TRAIL: TNF-related apoptosis-inducing ligand; TNF-α: tumor necrosis factor α; VEGFR-2: vascular endothelial growth factor receptor-2.
La presencia y sobreexpresión de proteínas que promueven la transformación y la tumorigénesis en las células tumorales, actualmente clasificadas como “antígenos asociados a tumores” (TAA) o “antígenos específicos de tumores” (TSA)61, han dado pauta para el empleo de S. enterica como acarreador de estos antígenos con fines profilácticos y terapéuticos8.
Una vez que S. enterica ha llegado al microambiente tumoral, las células tumorales infectadas presentan antígenos de Salmonella y son eliminadas por células T específicas contra esta bacteria62. En este proceso, un evento importante es la presentación cruzada de los antígenos tumorales. Esta vía alterna de presentación de antígenos se ve favorecida por la sobreexpresión de proteínas como conexina 43, que induce la formación de uniones adherentes entre las células tumorales y las células dendríticas. Este evento permite a las células tumorales transferir péptidos pre-procesados hacia la célula dendrítica para su adecuada presentación por el complejo mayor de histocompatibilidad (MHC) clase I63 y la consecuente inducción de una respuesta de linfocitos T CD8+ antígeno-específicos. Una vez en el microambiente tumoral, S. enterica induce la expresión intratumoral de óxido nítrico sintetasa inducible (iNOS) e interferón-γ (IFN-γ), inhibe la expresión de arginasa-1, interluecina-4 (IL-4), factor de crecimiento transformante-β (TGF-β), factor de crecimiento del endotelio vascular (VEGF), y reduce la capacidad supresora de las células mieloides intratumorales, aumentando la respuesta antitumoral del huésped29. Diversos reportes han documentado la importancia de las células NK (natural killers), neutrófilos,28 macrófagos,29 linfocitos T30 y linfocitos B31 en la actividad antitumoral.
Sin embargo, toda esta maquinaria inmunológica inducida por la presencia de S. enterica en el microambiente tumoral no fue suficiente para permitir la regresión del tumor en los estudios clínicos47. Una alternativa para potenciar la respuesta inmune antitumoral es la expresión o liberación de antígenos tumorales de la superficie de S. enterica, aprovechando su afinidad por células presentadoras de antígenos8. Al respecto, se ha evaluado la liberación de TAA/TSA por S. enterica con fines vacunales utilizando los sistemas de secreción I y III. El sistema de secreción tipo I (SSTI) fue empleado por Fensterle y colaboradores para liberar el antígeno específico de próstata (PSA) a través del sistema de HlyA. Sus resultados mostraron que, en los ratones inmunizados con S. Typhimurium que expresaban el antígeno PSA, se activó una respuesta inmune mediada por linfocitos T CD8+ que inhibió el desarrollo del tumor48. Otro de los antígenos que ha sido acoplado a este sistema es la proteína C-Raf, molécula que juega un papel central en la transducción de señales, y que al sobreexpresarse o mutarse induce carcinogénesis. La inmunización de un modelo murino de adenoma pulmonar con S. Typhimurium que sobreexpresa C-Raf indujo anticuerpos contra C-Raf, respuesta de células T, e inhibió el crecimiento tumoral64.
El sistema de secreción tipo III (SSTT) fue empleado por Panthel y colaboradores utilizando un modelo murino de fibrosarcoma que sobreexpresa el péptido 217-225 de la proteína p60 de Listeria monocytogenes, que simula un antígeno tumoral49. Los estudios in vivo demostraron que el 80% de los ratones inmunizados con S. Typhimurium que expresaron el antígeno p60 a través del SSTT fueron protegidos ante el reto de células tumorales de fibrosarcoma que expresaban el péptido p60217-225. En los ratones que resistieron el reto de fibrosarcoma se observó una respuesta de linfocitos T CD8+ específicos de antígeno que inhibió el desarrollo del tumor49,65. El antígeno tumoral NY-ESO-1 (proteína de células germinales que se encuentra sobreexpresada en cáncer de pulmón, melanoma, esófago, ovario, vejiga y próstata) también ha sido liberado a través del SSTT en S. enterica. La administración oral de esta cepa atenuada que expresa la proteína NY-ESO-1 indujo la regresión del tumor en un modelo murino de fibrosarcoma previamente establecido, y la regresión tumoral fue mediada por linfocitos CD8+ antígeno-específicos50. Estudios realizados en un modelo murino de melanoma reportaron que la inmunización orogástrica con S. Typhimurium que trasloca el epítopo inmunogénico de la proteína del receptor 2 del factor de crecimiento endotelial (VEGFR-2) murino a través del SSTT, indujo una respuesta de linfocitos T CD8+ antígeno-específicos y redujo las metástasis hasta en el 60%66. Recientemente se ha demostrado que la administración oral de S. Typhimurium que libera la fusión de la proteína E7 del virus de papiloma humano tipo 16 (HPV16) acoplado a la proteína SipB del SSTT de S. enterica, inhibió el crecimiento del tumor en el 45% y promovió la supervivencia hasta en el 70% en un modelo murino de cáncer cervical67.
S. enterica también ha sido empleada para acarrear plásmidos que contienen la secuencia de antígenos tumorales. Ejemplo de ello es el gen de L1HPV16 que codifica para la proteína de la cápside del HPV16, donde la inmunización de los ratones con S. Typhimurium que acarreó este plásmido indujo la regresión del tumor y aumentó la sobrevida en un modelo murino de cáncer cervical68. Estudios similares fueron realizados con el gen que codifica para la proteína MTDH/AEG1-1, un oncogén asociado con angiogénesis que se encuentra sobreexpresado en el 40% de los pacientes con cáncer de mama. El transporte de este gen por S. Typhimurium indujo la regresión del tumor y aumentó la sobrevida en un modelo murino de cáncer de mama69.
Los resultados prometedores de la actividad profiláctica que induce la inmunización con S. enterica que transporta secuencias de antígenos asociados con tumores ha permitido escalar este sistema a estudios clínicos de fase I en pacientes con estadio IV de cáncer pancreático. En este estudio, que actualmente se encuentra en curso, se administrarán por vía oral cuatro dosis de 106 UFC de S. Typhi Ty21a (cepa segura aprobada para su uso en humanos como vacuna contra la fiebre tifoidea) que acarrea un plásmido que contiene la secuencia VEGFR-2 humano, proteína que está sobreexpresada en el endotelio del microambiente tumoral. El objetivo de este estudio es inducir actividad antiangiogénica y generar una respuesta de memoria contra las células endoteliales para eliminar la vascularización del tumor70.
6Salmonella enterica y proteínas inmunomoduladoras e inductoras de apoptosis en cáncerEl éxito de S. enterica como acarreador de antígenos tumorales para la activación de linfocitos T CD4+ y CD8+ antitumorales se limita a aquellos tumores que expresan antígenos asociados o específicos del tumor16.
Para superar este problema, se ha utilizado a S. enterica como un vehículo para transportar moléculas que modulan la respuesta inmune en el huésped, facilitando el proceso de eliminación del tumor.
Loeffler y colaboradores expresaron diversas moléculas inmunomoduladoras, como la citocina LIGHT54, la interleucina IL-1855, la quimiocina CCL2125, en S. Typhimurium, y observaron la reversión del crecimiento de los tumores primarios y sus metástasis de pulmón en modelos murinos de carcinoma de mama y carcinoma de colon. En estos trabajos, las proteínas fueron acopladas a un péptido señal para garantizar la secreción de la molécula; una vez en el microambiente tumoral, indujeron la quimioatracción de células de la respuesta inmune, como células dendríticas, macrófagos, neutrófilos, células NK y linfocitos. Sorenson y colaboradores describieron que una dosis oral de S. Typhimurium que expresa a la Interleucina-2 humana evitó la formación de metástasis pulmonares en un modelo murino de osteosarcoma; en este proceso, las células NK fueron las probables responsables de la regresión tumoral57,58. Agorio y colaboradores demostraron que la dosis única de la cepa de S. enterica con un plásmido que codifica para IL-4 o IL-18 fue suficiente para retardar el crecimiento tumoral y prolongar la sobrevida de ratones con melanoma. En cualquiera de los casos, el efecto antitumoral estuvo acompañado con un aumento sistémico de interferón gamma (IFN-γ)59.
Otros trabajos han explorado la inducción de apoptosis de la célula tumoral mediada por moléculas que se expresan y secretan de S. enterica. Tal es el caso del ligando de Fas56 o del TNF-α71 en modelos murinos de carcinoma de colon y melanoma, respectivamente. S. enterica también se ha empleado para transportar el gen que codifica el ligando de muerte TRAIL (tumor necrosis factor-related apoptosis-inducing ligand), induciendo una regresión significativa del tumor en un modelo murino de cáncer gástrico60.
7Salmonella enterica y moléculas citotóxicas antitumoralesUno de los principales problemas en la terapia antitumoral es la resistencia que presentan las células tumorales a los agentes quimioterapéuticos. S. enterica ofrece una alternativa viable para resolver este problema, según lo documentan los resultados de Hiroshima y colaboradores en un modelo murino de xenotransplante de cáncer pancreático humano resistente a la quimioterapia, donde la comparación de la actividad antitumoral de esta bacteria con agentes quimioterapéuticos demostró que la cepa atenuada de S. Typhimurium A1-R presentó mayor actividad antitumoral que los agentes quimioterapéuticos 5-fluorouracilo (5-FU), cisplatino (CDDP) y gemcitabina (GEM). También se observó un efecto sinérgico antitumoral al combinar S. enterica con 5-FU, sugiriendo que el tratamiento con S. enterica induce quimiosensibilidad en las células resistentes a la quimioterapia72. Estos resultados son consistentes con los estudios realizados por Chang y colaboradores en modelos murinos de melanoma y cáncer de mama, en los que S. enterica sensibilizó la célula tumoral a la acción del agente quimioterapéutico CDDP, y se observó un efecto terapéutico aditivo para retardar el tumor y prolongar la sobrevida de los ratones con tumores. La quimiosensibilidad inducida por S. enterica fue asociada con la sobreexpresión de la proteína conexina 43, molécula que favorece las uniones adherentes entre las células tumorales permitiendo una mejor comunicación y una distribución homogénea del agente quimioterapéutico73.
No obstante que los resultados del efecto sinérgico mediado por la administración de S. enterica y el agente quimioterapéutico son alentadores, aún es necesaria la implementación de mejores estrategias que permitan la destrucción selectiva del tejido tumoral sin dañar los tejidos sanos. Una alternativa a esta disyuntiva es el uso de enzimas que, una vez localizadas en el microambiente tumoral, activan compuestos citotóxicos (pro-fármacos) que eliminan la célula tumoral52. Esta estrategia ha sido explorada empleando como acarreadores las cepas atenuadas de S. enterica. Se ha descrito que para su efectividad se requieren, al menos, dos etapas: la primera es la administración de la bacteria atenuada que acarreará a la enzima de interés al microambiente tumoral, y la segunda es la administración del compuesto citotóxico inactivo (pro-fármaco) el cual se activará estrictamente en el microambiente tumoral en presencia de la enzima52. Ejemplos de esta estrategia son los trabajos de Chen y colaboradores, donde la expresión del gen que codifica para la enzima fosforilasa del nucleósido de purina (sPNP) en S. Typhimurium cepa VNP20009 activó el compuesto no tóxico 6-metilpurina-2’-desoxirribósido (6MePdR) en un potente fármaco antitumoral, la 6-metilpurina (6MeP), retardando el crecimiento del tumor e incrementando la infiltración de linfocitos T CD8+ en un modelo murino de melanoma53. Massa y colaboradores documentaron la actividad antitumoral de S. Typhimurium SL3262, que expresa un anticuerpo de un solo dominio contra el antígeno CD20 y, al mismo tiempo, expresa la enzima timidina cinasa, activadora de fármacos como el ganciclovir. Esta bacteria recombinante aumentó la especificidad por el microambiente tumoral en un modelo xenográfico de linfoma no Hodgkin humano debido a la presencia del anticuerpo anti-CD20, e indujo una actividad antitumoral que aumentó la sobrevida en ratones deficientes de respuesta inmune específica74.
Con la finalidad de mejorar la actividad antitumoral mediada por S. Typhimurium VNP20009 en ensayos clínicos de fase I, Nemunaitis y colaboradores expresaron en esta cepa el gen de la enzima citosina desaminasa de Escherichia coli. Esta enzima se encarga de convertir a la 5-fluorocitosina en 5-fluorouracilo, un metabolito citotóxico que se emplea en los tratamientos de cáncer gástrico, cáncer de mama, cáncer de próstata y cáncer de cabeza y cuello75. Con esta nueva cepa recombinante se realizó un ensayo clínico piloto que incluyó tres pacientes con cáncer refractario (uno con carcinoma de células escamosas de cabeza y cuello y dos con adenocarcinoma de esófago). Los resultados demostraron que la cepa VNP20009 colonizó el tejido tumoral en dos de los pacientes; además, se observó la actividad de la enzima citosina desaminasa al medir la concentración del 5 fluorouracilo en el tejido tumoral75. Este trabajo confirma la capacidad de S. enterica de colonizar tejido tumoral en humanos y su utilidad como acarreador de moléculas que activan compuestos citotóxicos con actividad antitumoral.
La búsqueda de mejores alternativas terapéuticas antitumorales ha permitido la evaluación de una nueva generación de moléculas entre las que se encuentran proteínas bacterianas con actividad citotóxica. Ejemplo de ello son la toxina diftérica de Corynebacterium diphtheria, la exotoxina A de Pseudomonas aeruginosa, la α-hemolisina de Staphylococcus aureus, la parasporina-4 de Bacillus thuringiensis, la listeriolisina O de Listeria monocytogenes, la aerolisina de Aeromonas hydrophila, la citolisina A de Escherichia coli, entre otras76–78. El transporte selectivo de estas proteínas citotóxicas hacia la célula tumoral, sin que dañen a las células normales, se ha resuelto al acoplarlas con anticuerpos específicos contra antígenos tumorales generando los compuestos denominados “inmunotoxinas”, o acoplándolos con alguna molécula que tenga un ligando sobreexpresado en la célula tumoral. Tal es el caso de ciertos factores de crecimiento o citocinas. A estas proteínas se le denomina “toxinas específicas”78. Sin embargo, el mayor reto es transportar estos compuestos a las zonas hipóxicas y con poca vascularidad en el tumor. Para superar este obstáculo, algunas proteínas citotóxicas han sido expresadas en cepas atenuadas de S. enterica, y de esta manera son transportadas al microambiente tumoral de manera efectiva y selectiva. Los trabajos de Ryan y colaboradores, empleando un modelo murino de cáncer de mama, demuestran que la administración intravenosa de una S. Typhimurium que expresa la hemolisina E (Hly E), proteína de Escherichia coli que forma poros en la membrana celular bajo un promotor que se induce en anaerobiosis, permitió la colonización del tumor, indujo necrosis y disminuyó la masa tumoral79.
Otra proteína de Escherichia coli que ha sido evaluada por su actividad antitumoral es la citolisina A (ClyA), que también forma poros en la membrana y que recientemente ha sido expresada en S. Typhimurium bajo un sistema inducible de tetraciclina para evitar el daño a las células normales. La administración de esta Salmonella recombinante como terapia antitumoral en un modelo murino de carcinoma de colon, permitió la regresión del tumor, disminuyó las metástasis a pulmón y promovió la sobrevivencia el ratón77,80,81. Los resultados alentadores en los modelos preclínicos empleando proteínas bacterianas citotóxicas expresadas en S. enterica constituyen una alternativa prometedora que debiera explorarse en detalle.
8Salmonella enterica y el silenciamiento génico antitumoralS. enterica tiene una gran capacidad de transportar y transferir DNA plasmídico al interior de células eucariotas82–84, induciendo actividad antitumoral en modelos murinos de melanoma, cáncer de vejiga y adenocarcinoma de pulmón85–88. Con base en estas observaciones, S. enterica atenuada se ha convertido en el candidato ideal para transportar y liberar en el microambiente tumoral a los RNA pequeños de interferencia (siRNA) para el silenciamiento de genes implicados en cáncer89,90. Ejemplo de ello es el silenciamiento de proteínas implicadas en la resistencia a la quimioterapia, como gp-170 codificada por el gen MDR (multidrug resistance) realizado en un modelo murino de carcinoma de células escamosas de lengua91. También se ha silenciado la expresión del factor de transcripción STAT-3, una molécula asociada con la supervivencia de las células tumorales en modelos murinos de cáncer de próstata92,93 y carcinoma hepatocelular94, y se ha documentado el silenciamiento génico de proteínas antiapoptóticas, como Bcl-2, en un modelo murino de melanoma95. Los oncogenes, como el gen CTNNB1 que codifica para β-catenina, también han sido silenciados en modelos murinos de cáncer de colon96. Estudios recientes en un modelo murino de cáncer laríngeo han descrito el silenciamiento del gen que codifica para survivina, una proteína implicada en la supresión de apoptosis97. En todos los casos descritos, la liberación de los siRNA mediada a través de S. enterica en los diferentes modelos murinos de cáncer indujo la regresión de los tumores.
9PerspectivasHa pasado más de siglo y medio desde la primera vez que se describió la actividad antitumoral de las bacterias2, y aunque los avances en este campo han sido lentos uno de los logros más importantes a la fecha es el empleo de la cepa atenuada de Mycobacterium bovis, el BCG, como inmunoterapéutico eficaz para el carcinoma de vejiga de células transicionales superficiales en humanos13.
Los estudios descritos en esta revisión han demostrado el uso potencial de cepas atenuadas de S. enterica serovar Typhi y Typhimurium como una alternativa prometedora para resolver problemas inherentes a la terapia con agentes quimioterapéuticos, debido a que estos vectores vivos atenuados presentan una gran selectividad por el tejido tumoral y metástasis, y sensibilizan a las células tumorales a la quimioterapia6,8,98. Estas propiedades son potenciadas por la actividad citolítica que S. enterica tiene per se, por la capacidad de inducir respuesta innata y adaptativa en el microambiente tumoral y por la indiscutible habilidad de transportar moléculas heterólogas al microambiente tumoral, como antígenos asociados o específicos de tumores, moléculas inmunomoduladoras e inductoras de apoptosis, proteínas activadoras de moléculas citotóxicas y transporte de siRNA, que silencian genes implicados en la tumorigénesis y resistencia a la apoptosis8 (Tabla 2).
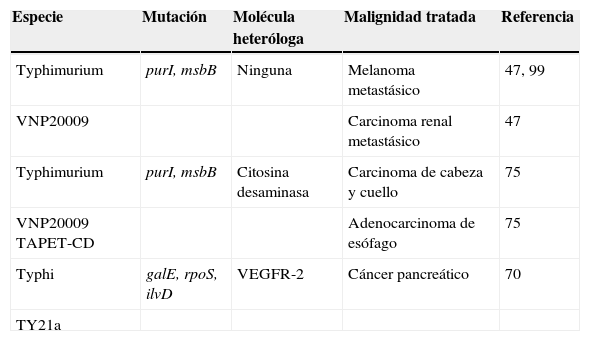
No obstante que se han documentado ensayos clínicos de fase I empleando a S. enterica para eliminar tumores (Tabla 3), aún son necesarios mayores esfuerzos enfocados en lo siguiente:
Ensayos clínicos empleando a Salmonella entérica como agente antitumoral
| Especie | Mutación | Molécula heteróloga | Malignidad tratada | Referencia |
|---|---|---|---|---|
| Typhimurium | purI, msbB | Ninguna | Melanoma metastásico | 47, 99 |
| VNP20009 | Carcinoma renal metastásico | 47 | ||
| Typhimurium | purI, msbB | Citosina desaminasa | Carcinoma de cabeza y cuello | 75 |
| VNP20009 TAPET-CD | Adenocarcinoma de esófago | 75 | ||
| Typhi | galE, rpoS, ilvD | VEGFR-2 | Cáncer pancreático | 70 |
| TY21a |
VEFGR-2: vascular endothelial growth factor receptor-2.
- Desarrollar cepas atenuadas seguras. Es importante mencionar que los resultados de estudios clínicos fase I con S. Typhimurium cepa VNP20009 mostraron que la bacteria no indujo efectos adversos severos, y fue bien tolerada por los pacientes con melanoma metastásico, carcinoma renal metastásico, carcinoma de cabeza y cuello y adenocarcinoma de esófago47,75,99. A la fecha se encuentra en curso un ensayo clínico fase I con pacientes de cáncer pancreático empleando S. Typhi cepa Ty21a. Esta cepa es segura y está aprobada para su uso en humanos con fines vacunales70. Otras opciones que debieran evaluarse en la terapia antitumoral en fase clínica son las cepas de S. Typhi CVD908, CVD908-htrA y Ty800, las cuales también han demostrado ser seguras en ensayos clínicos con fines vacunales, incluso en niños27,100.
- Desarrollar mejores mecanismos de transporte de moléculas antitumorales al interior de la célula o al microambiente celular. Una estrategia interesante a evaluar es el empleo de los sistemas de secreción bacterianos, como el tipo V, o de autotransportadores, para liberar moléculas antitumorales acopladas a péptidos fusogénicos que desestabilizan membranas. Esta estrategia permitiría a la molécula antitumoral alcanzar su blanco dentro de la célula, independientemente de que S. enterica se encuentre dentro o fuera de la célula tumoral8,101.
- Mejorar la selectividad de la bacteria por la célula o el tejido tumoral. Una estrategia que se ha evaluado por el grupo de Massa y colaboradores es la expresión de un anticuerpo de un solo dominio contra el antígeno CD20 en la superficie de S. Typhimurium SL3262 para aumentar la especificidad de la bacteria por el microambiente tumoral en un modelo xenográfico de linfoma no Hodgkin74. Sin embargo, aún existen diversas alternativas que pueden ayudar a incrementar esta selectividad. Una propuesta interesante son las adhesinas sintéticas fusionadas a dominios variables de la cadena pesada de los anticuerpos comúnmente denominados como nanoanticuerpos, los cuales, al ser expresados en Escherichia coli, han demostrado ser eficientes para colonizar tumores que expresan algún antígeno reconocido por la adhesina sintética fusionada al nanoanticuerpo102.
- Establecer estudios clínicos donde se evalúe el uso potencial de S. enterica en combinación con agentes quimioterapéuticos52.
Finalmente, acorde con los estudios preclínicos y clínicos expuestos en esta revisión, las cepas atenuadas de Salmonella enterica pueden considerarse excelentes aliados en la lucha contra el cáncer.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
FinanciamientoEl presente trabajo recibió financiamiento de Fondos Federales HIM-2013-028(GAA) y HIM-2014-032(RLP). HCN, AVE y DCBP obtuvieron beca PROBEI.