La infección de la glándula salivar submandibular es poco común, por lo que la sialadenitis submandibular supurativa aguda neonatal no coincidente con parotiditis se considera una entidad de rara presentación. El objetivo de esta revisión fue verificar si ha habido cambios en los aspectos clínicos y microbiológicos de esta infección desde sus primeras descripciones.
MétodosSe realizó una revisión de la literatura internacional en distintas fuentes de información desde los primeros reportes y hasta abril del 2016, para tratar de recopilar todos los casos publicados con esta infección hasta la fecha actual.
ResultadosEl total de pacientes reportados en esta revisión fue de 39 neonatos en 30 artículos. Las publicaciones provinieron fundamentalmente de los Estados Unidos y Europa, mientras que en América Latina solo ha sido declarado un caso en Cuba. Se describen distintos aspectos clínicos de presentación y evolución de esta infección en los pacientes reportados.
ConclusionesLa sialadenitis submandibular supurada aguda neonatal es una infección poco común que presenta características clínicas similares a través de los años. Como característica microbiológica, esta infección es habitualmente ocasionada por Staphylococcus aureus aunque en los últimos 16 años involucra algunos Staphylococcus aureus resistentes a meticilina. Por lo general, evoluciona de manera favorable con tratamiento temprano y apropiado.
Submandibular salivary gland infections are uncommon. For this reason, neonatal acute suppurative submandibular sialadenitis non-coincident with parotitis is considered as a rare entity. The aim of this work was to verify if there have been changes in the clinical and microbiological aspects of this infection from its first descriptions.
MethodsA review of the international literature from different sources was performed from the earliest reports until April, 2016, in order to collect all the cases reported with this infection up to the present date.
ResultsWe found 39 neonate patients reported in 30 articles for this review. Most articles came from the United States of America and Europe, whereas in Latin America there was only one case declared in Cuba. Some of the clinical aspects of the presentation and evolution of this infection in the reported patients are described.
ConclusionsNeonatal acute suppurative submandibular sialadenitis is an uncommon infection that presents similar clinical features through the years. As microbiological feature, this infection is usually caused by Staphylococcus aureus, although some methicillin-resistant Staphylococcus aureus have been implicated during the last 16 years. In general, it presents a satisfactory evolution with an early and appropriate antibiotic treatment.
Se designan sialadenitis a todos los procesos inflamatorios de las glándulas salivares, independientemente del agente que lo origine. La inflamación de las glándulas salivares puede ser causada por agentes bacterianos; en tal caso, se produce una sialadenitis supurada. Por lo general es unilateral y la glándula parótida resulta más frecuentemente afectada respecto a las glándulas submandibulares. La infección exclusiva de la glándula submandibular es poco común, por lo que la sialadenitis submandibular supurativa aguda neonatal no coincidente con parotiditis se considera una entidad de rara presentación1,2. Se asocia comúnmente con prematuridad, deshidratación y con alimentación por sonda nasogástrica u orogástrica3,4. En los casos reportados ha sido habitual encontrar Staphylococcus aureus como microorganismo causal de la infección. Como vía más común, se sugiere que la infección es ascendente, desde la cavidad oral hasta la glándula salivar afectada. El diagnóstico y tratamiento antibiótico temprano de la sialadenitis submandibular supurada puede prevenir complicaciones, como la formación de abscesos y septicemia3,4.
A propósito de lo anterior, se realizó una revisión de la literatura internacional para tratar de recopilar los casos publicados con estas infecciones de escasa presentación en el periodo neonatal hasta la fecha actual, con el objetivo de verificar si hay cambios en los aspectos clínicos y microbiológicos de esta infección desde sus primeras descripciones.
2MétodosSe realizó un estudio descriptivo y retrospectivo de reportes de casos de pacientes neonatales con el diagnóstico de sialadenitis submandibular supurada aguda a partir de la publicación más antigua que se pudo encontrar y hasta abril del 2016.
Se realizó una revisión de la literatura escrita en revistas médicas conservadas en bibliotecas institucionales y en la biblioteca particular del autor de correspondencia; además, se realizó una búsqueda en línea de bases de datos médicas y otros sitios para abarcar la literatura gris (actas de congresos, informes de investigación, memorias). Se utilizaron las siguientes palabras clave: [“suppurative submandibular sialadenitis” OR “bacterial submandibular sialadenitis” OR “purulent submandibular sialadenitis”] AND [neonatal OR newborn OR “recién nacido”] para todos los años. Las bases de datos consultadas fueron PubMed-Medline (http://www.ncbi.nlm.nih.gov/pubmed/), Embase (http://www.embase.com), Scielo (http://www.scielo.org), Worldcat (http://www. Worldcat.org), LILACS (http://regional.bvsalud.org), ClinicalKey (https://www.clinicalkey.com), Google (http://www.google.com), OpenGrey (http://www.opengrey.eu/).
Una vez reconocidos los artículos, y después de la revisión de estos, se obtuvieron distintos aspectos clínicos y de exámenes de laboratorio que mostraban las características particulares de los pacientes y se conformó una tabla expresiva del conjunto de casos identificados. Cuando no se pudo obtener el artículo completo, se tomó el resumen de la publicación para ofrecer la información factible de extraerse.
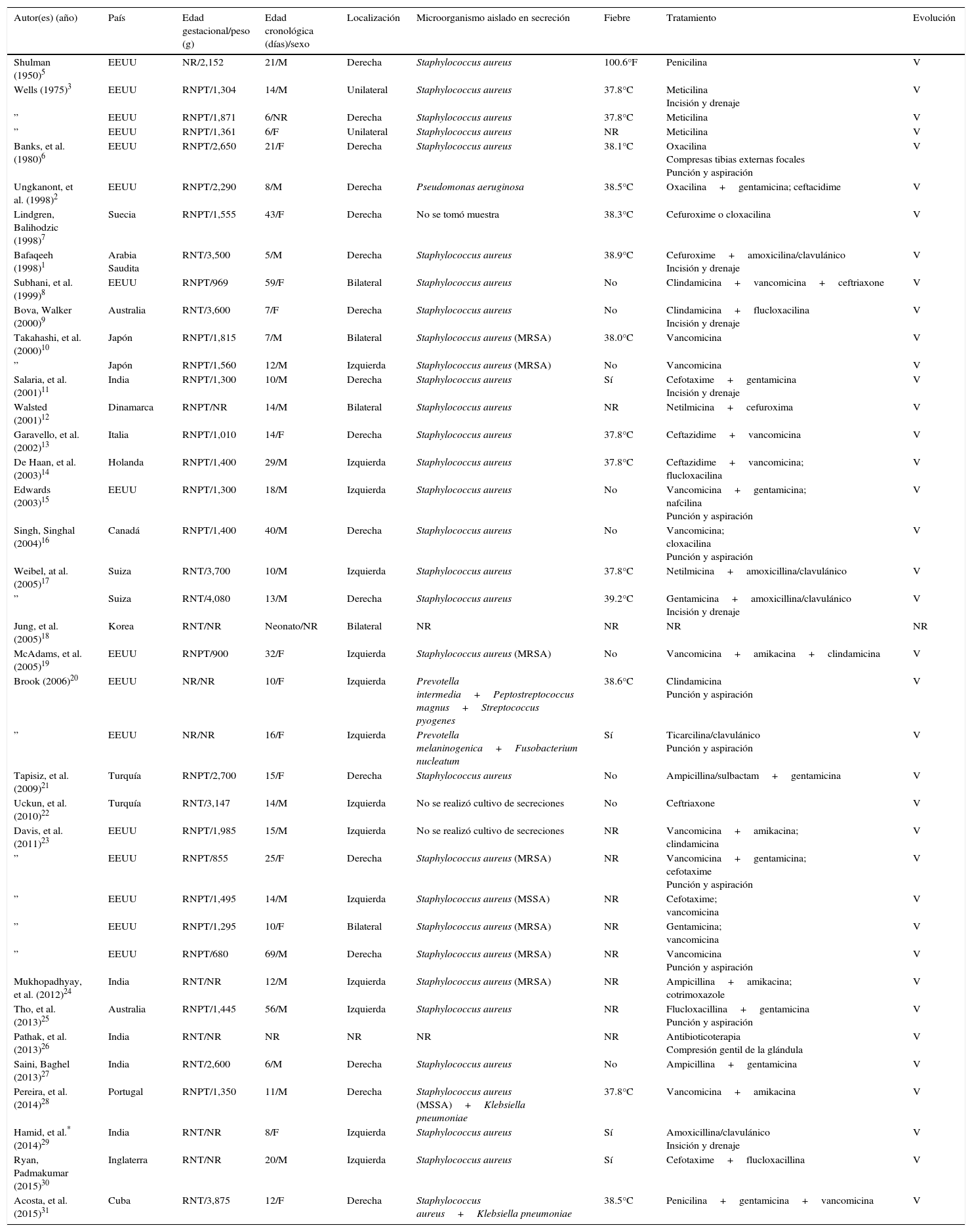
3ResultadosSe encontraron un total de 30 artículos con reportes de pacientes neonatales con sialadenitis submandibular supurada aguda provenientes de diversos países (39 casos en total). Los reportes bien documentados comenzaron desde 1950 por B. H. Shulman, en los Estados Unidos5, hasta el más reciente en el 2015 por el mismo equipo de autores que realiza esta revisión, en La Habana, Cuba. Se describen distintos de aspectos clínicos de presentación de esta infección (Tabla 1).
Casos reportados en la literatura de sialadenitis submandibular supurada aguda neonatal (1950-2015)
| Autor(es) (año) | País | Edad gestacional/peso (g) | Edad cronológica (días)/sexo | Localización | Microorganismo aislado en secreción | Fiebre | Tratamiento | Evolución |
|---|---|---|---|---|---|---|---|---|
| Shulman (1950)5 | EEUU | NR/2,152 | 21/M | Derecha | Staphylococcus aureus | 100.6°F | Penicilina | V |
| Wells (1975)3 | EEUU | RNPT/1,304 | 14/M | Unilateral | Staphylococcus aureus | 37.8°C | Meticilina Incisión y drenaje | V |
| ” | EEUU | RNPT/1,871 | 6/NR | Derecha | Staphylococcus aureus | 37.8°C | Meticilina | V |
| ” | EEUU | RNPT/1,361 | 6/F | Unilateral | Staphylococcus aureus | NR | Meticilina | V |
| Banks, et al. (1980)6 | EEUU | RNPT/2,650 | 21/F | Derecha | Staphylococcus aureus | 38.1°C | Oxacilina Compresas tibias externas focales Punción y aspiración | V |
| Ungkanont, et al. (1998)2 | EEUU | RNPT/2,290 | 8/M | Derecha | Pseudomonas aeruginosa | 38.5°C | Oxacilina+gentamicina; ceftacidime | V |
| Lindgren, Balihodzic (1998)7 | Suecia | RNPT/1,555 | 43/F | Derecha | No se tomó muestra | 38.3°C | Cefuroxime o cloxacilina | V |
| Bafaqeeh (1998)1 | Arabia Saudita | RNT/3,500 | 5/M | Derecha | Staphylococcus aureus | 38.9°C | Cefuroxime+amoxicilina/clavulánico Incisión y drenaje | V |
| Subhani, et al. (1999)8 | EEUU | RNPT/969 | 59/F | Bilateral | Staphylococcus aureus | No | Clindamicina+vancomicina+ceftriaxone | V |
| Bova, Walker (2000)9 | Australia | RNT/3,600 | 7/F | Derecha | Staphylococcus aureus | No | Clindamicina+flucloxacilina Incisión y drenaje | V |
| Takahashi, et al. (2000)10 | Japón | RNPT/1,815 | 7/M | Bilateral | Staphylococcus aureus (MRSA) | 38.0°C | Vancomicina | V |
| ” | Japón | RNPT/1,560 | 12/M | Izquierda | Staphylococcus aureus (MRSA) | No | Vancomicina | V |
| Salaria, et al. (2001)11 | India | RNPT/1,300 | 10/M | Derecha | Staphylococcus aureus | Sí | Cefotaxime+gentamicina Incisión y drenaje | V |
| Walsted (2001)12 | Dinamarca | RNPT/NR | 14/M | Bilateral | Staphylococcus aureus | NR | Netilmicina+cefuroxima | V |
| Garavello, et al. (2002)13 | Italia | RNPT/1,010 | 14/F | Derecha | Staphylococcus aureus | 37.8°C | Ceftazidime+vancomicina | V |
| De Haan, et al. (2003)14 | Holanda | RNPT/1,400 | 29/M | Izquierda | Staphylococcus aureus | 37.8°C | Ceftazidime+vancomicina; flucloxacilina | V |
| Edwards (2003)15 | EEUU | RNPT/1,300 | 18/M | Izquierda | Staphylococcus aureus | No | Vancomicina+gentamicina; nafcilina Punción y aspiración | V |
| Singh, Singhal (2004)16 | Canadá | RNPT/1,400 | 40/M | Derecha | Staphylococcus aureus | No | Vancomicina; cloxacilina Punción y aspiración | V |
| Weibel, at al. (2005)17 | Suiza | RNT/3,700 | 10/M | Izquierda | Staphylococcus aureus | 37.8°C | Netilmicina+amoxicillina/clavulánico | V |
| ” | Suiza | RNT/4,080 | 13/M | Derecha | Staphylococcus aureus | 39.2°C | Gentamicina+amoxicillina/clavulánico Incisión y drenaje | V |
| Jung, et al. (2005)18 | Korea | RNT/NR | Neonato/NR | Bilateral | NR | NR | NR | NR |
| McAdams, et al. (2005)19 | EEUU | RNPT/900 | 32/F | Izquierda | Staphylococcus aureus (MRSA) | No | Vancomicina+amikacina+clindamicina | V |
| Brook (2006)20 | EEUU | NR/NR | 10/F | Izquierda | Prevotella intermedia+Peptostreptococcus magnus+Streptococcus pyogenes | 38.6°C | Clindamicina Punción y aspiración | V |
| ” | EEUU | NR/NR | 16/F | Izquierda | Prevotella melaninogenica+Fusobacterium nucleatum | Sí | Ticarcilina/clavulánico Punción y aspiración | V |
| Tapisiz, et al. (2009)21 | Turquía | RNPT/2,700 | 15/F | Derecha | Staphylococcus aureus | No | Ampicillina/sulbactam+gentamicina | V |
| Uckun, et al. (2010)22 | Turquía | RNT/3,147 | 14/M | Izquierda | No se realizó cultivo de secreciones | No | Ceftriaxone | V |
| Davis, et al. (2011)23 | EEUU | RNPT/1,985 | 15/M | Izquierda | No se realizó cultivo de secreciones | NR | Vancomicina+amikacina; clindamicina | V |
| ” | EEUU | RNPT/855 | 25/F | Derecha | Staphylococcus aureus (MRSA) | NR | Vancomicina+gentamicina; cefotaxime Punción y aspiración | V |
| ” | EEUU | RNPT/1,495 | 14/M | Izquierda | Staphylococcus aureus (MSSA) | NR | Cefotaxime; vancomicina | V |
| ” | EEUU | RNPT/1,295 | 10/F | Bilateral | Staphylococcus aureus (MRSA) | NR | Gentamicina; vancomicina | V |
| ” | EEUU | RNPT/680 | 69/M | Derecha | Staphylococcus aureus (MRSA) | NR | Vancomicina Punción y aspiración | V |
| Mukhopadhyay, et al. (2012)24 | India | RNT/NR | 12/M | Izquierda | Staphylococcus aureus (MRSA) | NR | Ampicillina+amikacina; cotrimoxazole | V |
| Tho, et al. (2013)25 | Australia | RNPT/1,445 | 56/M | Izquierda | Staphylococcus aureus | NR | Flucloxacillina+gentamicina Punción y aspiración | V |
| Pathak, et al. (2013)26 | India | RNT/NR | NR | NR | NR | NR | Antibioticoterapia Compresión gentil de la glándula | V |
| Saini, Baghel (2013)27 | India | RNT/2,600 | 6/M | Derecha | Staphylococcus aureus | No | Ampicillina+gentamicina | V |
| Pereira, et al. (2014)28 | Portugal | RNPT/1,350 | 11/M | Derecha | Staphylococcus aureus (MSSA)+Klebsiella pneumoniae | 37.8°C | Vancomicina+amikacina | V |
| Hamid, et al.* (2014)29 | India | RNT/NR | 8/F | Izquierda | Staphylococcus aureus | Sí | Amoxicillina/clavulánico Insición y drenaje | V |
| Ryan, Padmakumar (2015)30 | Inglaterra | RNT/NR | 20/M | Izquierda | Staphylococcus aureus | Sí | Cefotaxime+flucloxacillina | V |
| Acosta, et al. (2015)31 | Cuba | RNT/3,875 | 12/F | Derecha | Staphylococcus aureus+Klebsiella pneumoniae | 38.5°C | Penicilina+gentamicina+vancomicina | V |
EEUU: Estados Unidos; MSSA: S. aureus sensible a meticilina; MRSA: S. aureus resistente a meticilina; RNT: recién nacido de término; RNPT: recién nacido pre-término; M: masculino; F: femenino; V: vivo; NR: no reportado.
Los 39 pacientes reportados en esta revisión provienen fundamentalmente de los Estados Unidos (16 casos) y de Europa (10 pacientes), mientras que en América Latina solamente se describe el reporte de Cuba, previamente mencionado.
Esta infección se presentó en 24/36 recién nacidos pre-término (66.6%), en 12 de los neonatos a término, y no se pudo precisar la edad gestacional en tres casos.
Según lo revisado, fueron 22 pacientes de sexo masculino y 14 de sexo femenino. Aunque el dato no pudo precisarse en otros tres neonatos, se aprecia que la balanza se inclina al predominio de presentación en el sexo masculino. La edad de presentación fue variable: desde tan temprano como a los 5 días de vida, hasta el término del periodo neonatal. En seis pacientes se presentó después de los primeros 30 días de vida; estos resultaron ser recién nacidos de muy bajo peso (< 1,500g), por lo que se infiere que tuvieron probablemente alrededor de 30 a 32 semanas de edad gestacional y no habrían sobrepasado el periodo neonatal por edad postconcepcional.
La sialadenitis submandibular supurada fue bilateral en cinco pacientes, tuvo una localización unilateral en 33 pacientes y solamente en un caso no se pudo determinar la localización. Cuando la infección fue de un solo lado, se presentó en la glándula submandibular derecha en 17 pacientes, del lado izquierdo en 14 casos y se calificó como unilateral sin más precisión en otros dos neonatos. De aquí se observó que lo más habitual es la presentación unilateral, aunque puede ocurrir la afectación de ambas glándulas submandibulares a la vez.
El microorganismo causal en la mayor parte de los casos resultó ser Staphylococcus aureus, el cual se presentó en 31/35 (88.5%) de los pacientes (en dos casos en conjunto con Klebsiella pneumoniae y en el resto como aislamiento simple). Los primeros casos reportados de infección por Staphylococcus aureus resistente a meticilina datan del año 2000. En tres recién nacidos no se obtuvo muestra para cultivo bacteriológico de las secreciones, y en un paciente no se pudo precisar el resultado en la información del artículo publicado. Otros microorganismos tuvieron menos relevancia por la frecuencia, aunque se consideraron microorganismos propios de la flora bucal.
En esta casuística, 19 neonatos cursaron con fiebre, en 9 no estuvo entre las manifestaciones clínicas y no se pudo precisar en el resto al revisar la publicaciones correspondientes.
Sin contar un neonato en quien no se especificó el tratamiento recibido, todos los pacientes recibieron tratamiento antibiótico parenteral, variable en tipos de antibióticos ya que se debe considerar la época de los reportes, así como los protocolos de tratamiento de cada institución, entre otros aspectos.
Cabe destacar que todos los pacientes descritos en esta revisión, sobrevivieron.
4DiscusiónEn esta revisión se pudieron analizar las características clínicas y microbiológicas de 39 casos1–3,5–31. Algunos autores han reconocido que el primero en describir la sialadenitis submandibular supurativa aguda neonatal aislada fue D. H. Wells, en 19751,2,6. Sin embargo, otros autores más recientes21,28 han dado el crédito de ser el primero a B. H. Shulman, quien en 1950 describió un neonato con esta infección de la glándula submandibular derecha, sin afectación de las glándulas parótidas5. Desde entonces se puede encontrar en la literatura la descripción de algunos casos puntuales, una serie de casos de cinco pacientes23, y la más reciente, un neonato en La Habana, Cuba31.
La sialadenitis submandibular supurada aguda es más frecuente en los neonatos de pretérmino en contraste con lo que se señala para la parotiditis supurada aguda, la cual se presenta principalmente en los recién nacidos a término32. La prematuridad es una condición inequívoca de mayor probabilidad de infección en el periodo neonatal, incluso hasta para los primeros meses de vida13; sin embargo, para esta condición, influye también la necesidad frecuente de los neonatos prematuros de acudir a la alimentación por sonda nasogástrica u orogástrica. La alimentación con sonda, a largo plazo, puede disminuir la secreción de saliva al eludir la estimulación de la cavidad orofaríngea por los alimentos, produciendo un enlentecimiento u obstrucción ductal funcional al aclaramiento de saliva; por estasis se facilita la colonización bacteriana y la subsecuente infección de la glándula7,13. De manera similar, la deshidratación puede disminuir la secreción de saliva por espesamiento y enlentecimiento del flujo de saliva por el conducto de Wharton, posibilitando igualmente lo planteado13. Aunque las glándulas salivares, parótida y submandibulares, desembocan por sus conductos respectivos en la boca, la calidad de las secreciones de estas difiere desde el punto de vista etiopatogénico. Así, en las glándulas parótidas, los ácinos son primariamente serosos mientras que en las submandibulares y sublinguales los ácinos son serosos y mucinosos4. Las secreciones mucinosas contienen mayor cantidad de IgA y otras enzimas que tienden a proteger las glándulas submandibulares de infecciones, razón por la cual es posible que las glándulas parótidas sean más comúnmente afectadas4.
No existe una explicación clara de por qué Staphylococcus aureus sea el agente causal casi universal, ya que no es flora habitual de la boca en el recién nacido; por lo general, está constituida por Streptococcus, lactobacilos y anaerobios33. Por ello, es comprensible que el uso de biberones o mala higiene de las mamas en la alimentación del neonato, la utilización de dispositivos orogástricos y nasogástricos, la intubación endotraqueal, entre otras, puedan transportar este microorganismo a la cavidad oral del recién nacido.
La sialadenitis submandibular supurada neonatal tiene como característica el comienzo agudo, con signos de inflamación de la región submentoniana que a veces se prolongan por debajo hasta el cuello. Es fácilmente palpable, presenta una consistencia firme, dolorosa a la manipulación y presión; la piel suprayacente se encuentra eritematosa, caliente y algo empastada34. La presencia de estas manifestaciones fue universal, y así la exhibieron todos los casos detallados. La fiebre es un síntoma frecuente, la cual, en ocasiones, puede ser elevada.
El signo clínico característico de la sialadenitis submandibular supurativa aguda, y para algunos el más específico para el diagnóstico, es la salida de secreción purulenta por el orificio de desembocadura del conducto de Wharton en el suelo de la boca, por debajo de la lengua, más evidente al ejercer presión sobre la glándula inflamada13,34. La desembocadura del conducto excretorio puede estar enrojecida o, en algunos casos, dilatada. La infección puede diseminarse y provocar una bacteriemia, por lo que algunos pacientes pueden presentar un cuadro de respuesta inflamatoria sistémica, alcanzando también un estadio de sepsis19,34.
La evolución a la formación de un absceso en la glándula submandibular también puede presentarse en el neonato1,9,25,27, y se identifica por la sensación de renitencia-fluctuación a la palpación que no estaba presente al comienzo de la infección, lo cual puede corroborarse con estudios de imagen, como los estudios ultrasonográficos1,9.
Esta infección debe diferenciarse de la adenitis supurada, que puede tener una localización submentoniana pero se caracteriza por ser una tumoración firme, dolorosa, móvil, asociada con la inflamación del mentón, o intraoral que a la compresión no evidencia salida de pus por el conducto de Wharton. Otras afecciones fácilmente descartables serían linfangioma, teratoma, quiste dermoide o higroma quístico, por las características a la palpación y por no exhibir signos inflamatorios.
En la actualidad, es común la infección por Staphylococcus aureus resistente a meticilina. En esta revisión se evidenció que en algunos casos el aislamiento correspondió con Staphylococcus aureus resistente a meticilina, y en otros se determinó que eran sensibles a meticilina. Debido a estos aspectos epidemiológicos, en tales casos se recomienda el uso de antibióticos del tipo anti-estafilocóccico resistente a meticilina19,21,24,28. Además, se sugiere la combinación con otros antibióticos que cubran el espectro de los Gram negativos, ya que también estos microorganismos se encuentran entre los agentes causales de la sialadenitis submandibular supurada neonatal19,21,28. De esta manera, la terapia empírica debe iniciarse con penicilina antiestafilocóccica más un aminoglucósido, o penicilina antiestafilocóccica más una cefalosporina.
La duración de la terapia con antibióticos no se ha determinado con exactitud, pero se ha consensuado que es necesario un mínimo de 7 a 10 días, o al menos hasta que se compruebe que la afectación se ha resuelto19,34. También es factible considerar un esquema de tratamiento secuencial parenteral-oral, para no prolongar mucho tiempo el tratamiento por vía parenteral.
Algunos pacientes con abscedación pueden requerir de cirugía, con incisión y drenaje del absceso1,9. La compresión externa de la glándula para facilitar drenaje de pus, además de orientar en el diagnóstico, puede ayudar a la más rápida resolución de la infección, pero debe hacerse mediante una manipulación gentil para prevenir la diseminación hematógena de la infección26.
En la actualidad, la evolución de esta infección es favorable con un adecuado tratamiento antibiótico.
Se concluye que la sialadenitis submandibular supurada aguda neonatal es una infección poco común que ha mantenido características clínicas y microbiológicas similares a través de los años: afecta principalmente a los recién nacidos pretérmino, presenta manifestaciones inflamatorias locales en la región submandibular, habitualmente es unilateral, con secreciones purulentas por el orificio de salida del conducto de Wharton en el suelo de la boca como signo característico; por lo general, es ocasionada por Staphylococcus aureus, aunque en los últimos años se han identificado algunas cepas resistentes a meticilina. En general, esta infección evoluciona de manera favorable con el tratamiento antibiótico parenteral de amplio espectro, aunque a veces es necesario realizar la incisión y el drenaje del absceso en caso de que se presente.
FinanciamientoNo se ha recibido financiación alguna de institución u organización. El trabajo se realizó a costo de los propios autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.