En el síndrome nefrótico cortico-sensible (SNCS), la corticoterapia prolongada podría reducir la frecuencia de recaídas. El objetivo de este trabajo fue la comparación de un esquema corticoide prolongado frente al tratamiento habitual del SNCS primario, evaluando los siguientes parámetros: el número de pacientes con recaídas, el número total de recaídas, el tiempo medio transcurrido al iniciar el tratamiento, hasta la remisión y hasta la primera recaída, la dosis acumulada de corticosteroides y la toxicidad esteroide.
MétodosLa población se dividió en dos grupos: el grupo A (27 pacientes) recibió 16-β-metilprednisona durante 12 semanas, reduciendo la dosis hasta la semana 24; y el grupo B (29 pacientes) recibió 16-β-metilprednisona durante 12 semanas, y placebo hasta la semana 24.
ResultadosLa tasa de incidencia acumulada de recaídas (persona/año) fue en el grupo A 36/100, y en el grupo B 66/100 (p=0.04). El tiempo medio transcurrido (días) hasta la primera recaída fue de 114 en el grupo A y 75 en el grupo B (p=0.01). Las diferencias de tiempo transcurrido al iniciar tratamiento y hasta la remisión entre ambos grupos no fueron significativas. El total acumulado de recaídas fue de 9 en el grupo A y 17 en el grupo B (p=0.04), y el total de pacientes con recaídas fue de 3 (grupo A) y 7 (grupo B) (p=0.17). La dosis media acumulada (mg/m2) por paciente fue de 5,243 en el grupo A y de 4,306 en el grupo B (p=0.3), y el cortisol sérico (μg/dl) final fue de 14 en el grupo A y 16 en el grupo B (p=0.4). La toxicidad esteroide fue similar entre ambos grupos.
ConclusionesLa duración del tratamiento disminuyó el número de recaídas, sin incrementar la toxicidad esteroide.
In the steroid-sensitive nephrotic syndrome (SSNS) the prolonged treatment with steroids could decrease the frequency of relapses. We conducted a comparative study of prolonged steroid scheme and the usual treatment of primary SSNS to assess: the number of patients with relapses, mean time to treatment initiation, to remission and to first relapse, total number of relapses, total cumulative dose of steroids, and the steroid toxicity.
MethodsPatients were divided into two groups: group A (27 patients) received 16-β-methylprednisolone for 12 weeks, reducing the steroid until week 24. Group B (29 patients) received 16-β-methylprednisolone for 12 weeks and placebo until week 24.
ResultsCumulative incidence rate of relapse (person/years) for group A was of 36/100 and 66/100 for group B (p=0.04). Average elapsed time to first relapse was of 114 days for group A and of 75 days to for group B (p=0.01). The difference in time for initial response to treatment and up to achieve remission between both groups was not significant. Total cumulative relapses were 9 for group A and 17 for group B (p=0.04). Total patients with relapses were 3 for group A and 7 for group B (p=0.17). Cumulative average dose per patient was 5,243mg/m2 for group A and 4,306mg/m2 for group B (p=0.3), and serum cortisol was 14μg/dl for group A and 16μg/dl for group B (p=0.4). There were no steroid toxicity differences between groups.
ConclusionsThe duration of the treatment had an impact on the number of relapses without increasing steroid toxicity.
El síndrome nefrótico se define por la presencia de proteinuria>40mg/m2/h y albúmina sérica<2.5g/ml; la hipercolesterolemia y la presencia de edemas son hallazgos frecuentes, pero no son requisitos diagnósticos. La incidencia de la forma primaria en pediatría es de 2/100,000 niños1.
Inicialmente, el International Study of Kidney Disease in Children (ISKDC) estableció un régimen diario de corticoterapia de 8 semanas. Recomendaciones posteriores prolongaron el tratamiento a 12 semanas2,3. Con estos esquemas, hasta el 53% de los pacientes sufrirán recurrencias de la enfermedad en algún momento de su evolución4,5, por lo que deberán reiniciar la administración de glucocorticoides con el riesgo eventual de desarrollar efectos adversos asociados6,7. Por tal motivo, se describen terapéuticas esteroides de 6 meses de duración8–10.
En el presente trabajo se realizó un estudio comparativo entre un esquema corticoide prolongado y el tratamiento esteroide habitual del síndrome nefrótico cortico-sensible (SNCS) primario. Los objetivos generales fueron evaluar los siguientes parámetros:
- 1.
El número de pacientes con recaídas dentro de los 12, 24 y 36 meses de finalizados ambos tratamientos.
- 2.
El número de recaídas durante el tiempo total de duración del estudio.
- 3.
El tiempo medio transcurrido desde el diagnóstico hasta el inicio terapéutico, desde el inicio terapéutico hasta la remisión inicial y desde esta remisión hasta la primera recaída.
- 4.
La dosis acumulada de corticosteroides.
El objetivo específico a evaluar fue la aparición de la siguiente toxicidad esteroide:
- •
Aspecto cushingoide
- •
Índice HOMA aumentado (> 3)
- •
Reducción de la velocidad de crecimiento
- •
Hipertensión arterial
- •
Acné, estrías
- •
Cataratas/presión intraocular aumentada
- •
Osteoporosis/osteopenia
Se implementó un ensayo clínico, controlado, aleatorizado, doble ciego (médicos y pacientes), de no inferioridad clínica en pacientes con SNCS primario inicial.
2.1Criterios para pacientes2.1.1Inclusión- •
Pacientes desde 1 año y hasta 11 años de edad, eutróficos y normotensos.
- •
Creatininemias en rangos normales de acuerdo con la edad y sexo.
- •
Sedimentos urinarios sin hematuria.
- •
Ecografía renal normal.
- •
Consentimiento médico aprobado. En el caso de los adolescentes se requirió de su asentimiento, de acuerdo con los principios básicos de la Declaración de Helsinki.
- •
Intolerancia a la medicación corticoide.
- •
Contraindicación al uso de esteroides (por ejemplo, infecciones agudas o crónicas presentes)
- •
Se separaron del estudio a los pacientes quienes desarrollaron durante el protocolo un síndrome nefrótico cortico-dependiente (SNCD) o cortico-resistente (SNCR), aquellos que no cumplieron con las indicaciones y/o no concurrieron, por lo menos, al 80% de las citas establecidas, y aquellos que presentaron toxicidad esteroide no controlada.
La población total se dividió aleatoriamente en dos grupos. En el grupo A se administró un tratamiento prolongado con 16-β-metilprednisona a una dosis de 48mg/m2/día durante 6 semanas; posteriormente se continuó con una dosis de 33mg/m2/día en días alternos por otras 6 semanas. A partir de la semana 13, se redujo la dosis a 24mg/m2/día en días alternos hasta cumplida la semana 16; después a 18mg/m2/día en días alternos hasta cumplida la semana 20; y finalmente a 8mg/m2/día en días alternos hasta cumplir la semana 24.
En el grupo B se dio el tratamiento habitual, que consistió en la administración de 16-β-metilprednisona a una dosis de 48mg/m2/día durante 6 semanas; posteriormente se continuó en días alternos con una dosis de 33mg/m2/día hasta la semana 12; y finalmente se suministró un placebo en los días alternos hasta cumplir 24 semanas de tratamiento.
Las propiedades del placebo en cuanto a sabor, aspecto externo y presentación fueron similares a los comprimidos de 16-β-metilprednisona.
La dosis de corticoides se indicó una vez por día, durante la mañana, en ayunas y que no superara los 60mg/día. La adherencia al tratamiento se controló mediante el recuento de la medicación en cada consulta, excluyéndose del estudio a los pacientes que no cumplieran con las indicaciones.
La dosis de 48mg/m2/día de 16-β-metilprednisona equivale a 60mg/m2 de meprednisona, y la dosis de 33mg/m2 de 16-β-metilprednisona equivale a 40mg/m2 de meprednisona.
En ambos grupos se prescribió vitamina D a 1,500 UI/día, carbonato de calcio a 50mg/kg/día (dosis máxima 2g/día) y dieta hiposódica durante las 24 semanas del tratamiento.
2.3Forma de cegamiento y aleatorizaciónToda la medicación, tanto la corticoide como el placebo, se administró como comprimidos en presentaciones indistinguibles. El contenido de los mismos fue conocido solamente por un profesional médico externo al grupo de investigadores (con esta función específica delegada previamente), quien dio el comprimido a cada paciente, de acuerdo con su número asignado con la secuencia de aleatorización. Por su parte, la aleatorización se obtuvo con el programa estadístico GraphPad InStat.
2.4Controles2.4.1Al ingreso- •
Registros de peso y talla con cálculo de la velocidad de crecimiento, control de la tensión arterial (método oscilométrico, auscultatorio), registro del estadio de desarrollo puberal (Tanner), evaluación de edad ósea (radiografía de mano izquierda) y control oftalmológico (fondo de ojo, tonometría).
- •
Ecografía renal y reacción de Mantoux-PPD.
- •
Los controles en sangre fueron VDRL, serología para VIH, hepatitis A, B, C, toxoplasmosis y chagas, dosaje de complemento sérico (C3 y C4).
- •
Uremia, estado ácido-base venoso, proteinograma electroforético, colesterol total, LDL-C, HDL-C, trigliceridemia, creatinina, ionograma, calcemia, fosfatemia, fosfatasa alcalina (FAL), ácido úrico, glucemia, insulinemia basal.
- •
Dosaje de 25-OH vitamina D (colecalciferol)
- •
En orina se midió proteína de 24h (expresada en mg/m2/h) o la relación proteinuria-creatininuria en muestra única (valor normal<0.2). Para fines operativos, a los responsables de los pacientes se les entregaron tiras reactivas para medir la presencia de proteína en orina y se los instruyó para su comunicación con el investigador.
- •
Se realizó el cálculo del filtrado glomerular estimado, expresado como el índice creatinina/talla y la constante de Barrat correspondiente al sexo y edad.
- •
Cálculo de la velocidad de crecimiento. Se realizó a partir de las medidas de la talla en cm. Por razones operativas, la primera medida correspondió al primer control nefrológico, y las siguientes medidas a la talla anual hasta el final del estudio. Para calcular la velocidad de crecimiento, los resultados se expresaron en cm/año.
- •
En materia fecal se realizó estudio parasitológico completo (estudio directo, seriado y test de Graham).
- •
Control clínico incluyendo el registro de la tensión arterial.
- •
En sangre, proteinograma electroforético, colesterol total, LDL-C, HDL-C, trigliceridemia, creatinina, ionograma, calcemia, fosfatemia, fosfatasa alcalina, glucemia e insulinemia basal.
- •
Percentil de la velocidad de crecimiento, evaluación cardiológica, control oftalmológico.
- •
Evaluación de edad ósea. En los pacientes mayores de 6 años se solicitó absorciometría radiográfica de fotón doble (densitometría mineral ósea de columna lumbar), midiendo el contenido mineral óseo (g/cm2) y el puntaje Z. Para calcularlo se emplearon los valores registrados para esta población proporcionados por estudios realizados en controles locales. La interpretación de los datos se basó en la comparación de los resultados con valores normales ajustados por sexo, edad y etapa de pubertad11.
- •
Al finalizar el estudio, se determinó el dosaje de cortisol sérico matinal (8:00 AM).
- •
Se realizó una biopsia renal en los pacientes que desarrollaron SNCD y SNCR.
La duración del protocolo fue de 36 meses.
Las variables independientes evaluadas fueron las siguientes:
Sexo
Edad del inicio del síndrome nefrótico (años)
El tiempo transcurrido hasta comenzar el tratamiento, desde el inicio terapéutico hasta presentar la remisión y desde la remisión hasta la primera recaída.
Las variables dependientes evaluadas fueron las siguientes:
Dosis acumulativa del esteroide
Número de recaídas diagnosticadas
Adherencia al tratamiento
Dosaje final de cortisol sérico
Toxicidad esteroide
- 1)
Síndrome nefrótico primario inicial o de debut. Primer episodio con proteinuria mayor a 40mg/m2/h, albúmina sérica menor a 2.5g/ml y, eventualmente, hipercolesterolemia superior al percentil 95, sin patología infecciosa ni inmunológica concurrente.
- 2)
Recaída. Proteinuria>40mg/m2/h durante 3 días consecutivos (ISKDC)
- 3)
Tratamiento de la recaída. Con 16-β-metilprednisona 48mg/m2/diarios hasta alcanzar la remisión durante 3 o más días continuos, seguido de cuatro semanas de 16-β-metilprednisona a 33mg/m2 en días alternos
- 4)
Recaídas frecuentes. Dos o más recaídas en 6 meses o cuatro en 12 meses (ISKDC)
- 5)
Remisión parcial. Proteinuria<2+, proporción de proteína-creatinina en la orina>0.2 y<3.5g/mg o>4mg/m2/h y<40mg/m2/h e incremento de los niveles de albúmina sérica>2.5g/ml (ISKDC)
- 6)
Remisión completa. Ausencia de edema y proteinuria<1+en la tira reactiva, proteína-creatinina en la orina<0.2g/mg o<4mg/m2/h durante ≥ 3 días consecutivos (ISKDC)
- 7)
Síndrome nefrótico cortico-dependiente. Reaparición de la proteinuria>40mg/m2/h al reducir la dosis de esteroides intra-tratamiento o en un tiempo menor a 20 días de finalizado el mismo
- 8)
Síndrome nefrótico cortico-resistente. Persistencia de la proteinuria>40 mg/m2/h o>3.5g/mg luego de dos series de tratamiento corticoide de 12 semanas de duración cada uno o luego de 4 semanas de tratamiento diario con metilprednisona más tres pulsos consecutivos de metilprednisolona
- 9)
Toxicidad esteroide. Diabetes, sangrado digestivo, edema cerebral, glaucoma, hipertensión, retención hidrosalina, obesidad, insulino-resistencia, retraso del crecimiento, aumento de la presión intra-ocular, cataratas, cambios psicológicos y de la conducta, hábito cushingoide (giba dorsal, estrías abdominales, afinamiento de la piel, equimosis, hirsutismo, acné)
- a)
Aleatorización simple. Se utilizó el programa estadístico EPIDAT 3.0 para la asignación de los sujetos al tratamiento (dos grupos), aleatorización 1:1.
- b)
Tamaño de la muestra. Para evaluar el número de recaídas en el síndrome nefrótico se asumió que el porcentaje de las mismas varía del 30% al 50% durante los primeros 3 años. El cálculo del tamaño muestral, con una potencia deseada del 80% para un alfa a dos colas=0.05 (un valor de confianza Z de 1.65) y un ES estimado de 10% fue de 22 pacientes. Esperando una pérdida del 20% se buscó ingresar una población de 27 pacientes.
- c)
Para evitar sesgos de selección, la población de ambos grupos fue arbitrariamente estratificada por edades: de 1 año a 6 años, 11 meses y 29 días, y de 7 años a 11 años, 11 meses y 29 días.
- d)
Tasa de incidencia acumulada (TIA). Para evaluar la proporción de individuos que sufrieron el evento (recaída) durante todo el periodo de seguimiento (persona-tiempo).
- e)
La heterogeneidad de la dosis acumulada final se analizó mediante una prueba t no pareada con corrección de Welch.
- f)
Se empleo el riesgo relativo (RR) para evaluar la aparición de toxicidad esteroide relacionada con los dos tratamientos.
- g)
Considerando el tamaño muestral y el número de eventos, se utilizó el test exacto de Fisher para evaluar si la cohorte total se comportaba como dos poblaciones distintas con respecto al total acumulado de recaídas y al número total de pacientes con recaídas.
- h)
Se realizó el cálculo de la estadística ordinal logarítmica (log-rank) para comparar la distribución de supervivencia actuarial entre los pacientes del grupo A y los del grupo B.
Se estableció como nivel de significación estadística un valor de p<0.05.
La evaluación de los resultados se realizó por intención de tratar.
Los resultados se presentaron como medias±DE y se emplearon los programas estadísticos GraphPad InStat y EPIDAT 3.0.
El protocolo fue aprobado por el Comité de Ética e Investigación del Hospital General de Niños Ricardo Gutiérrez.
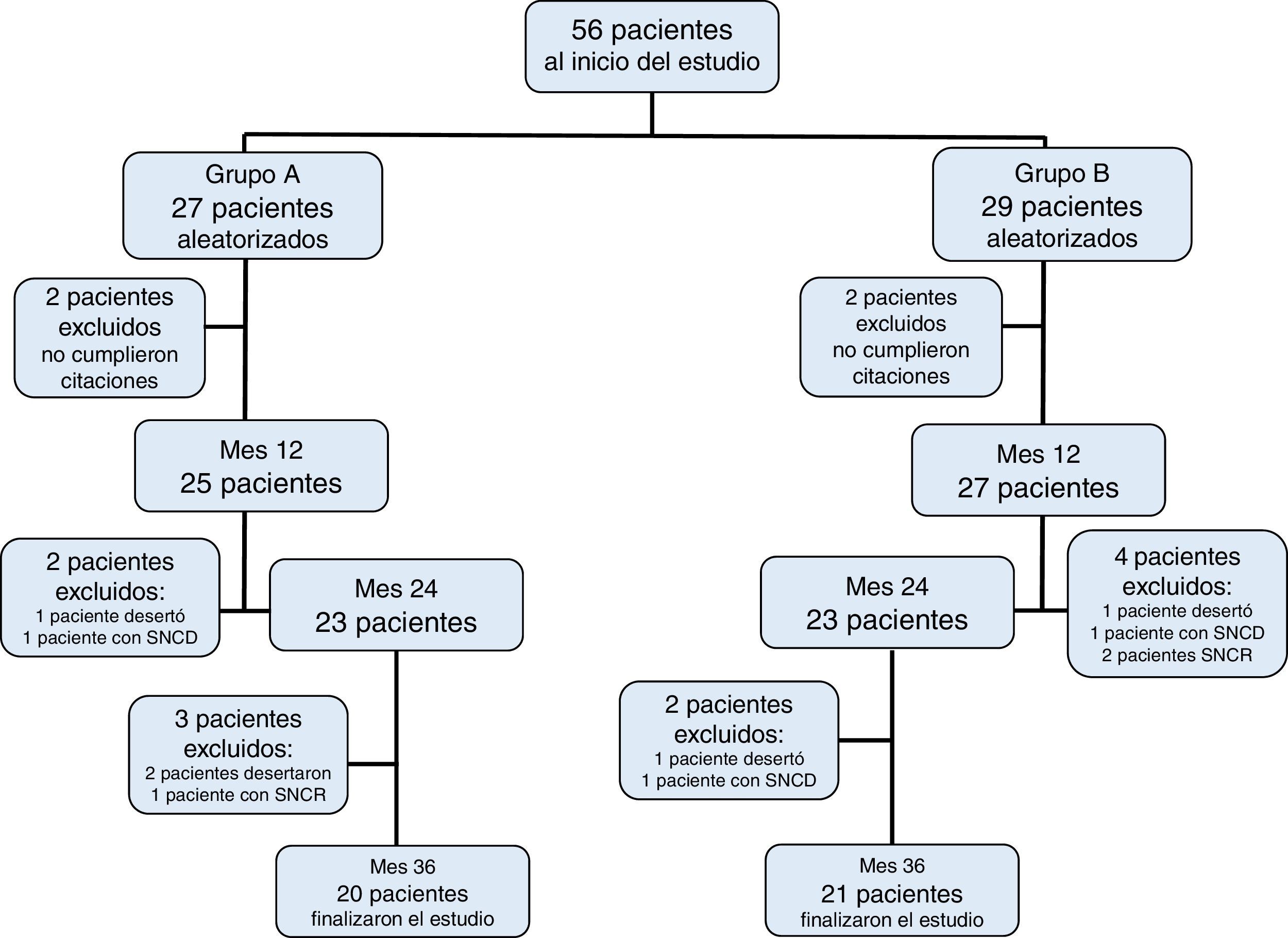
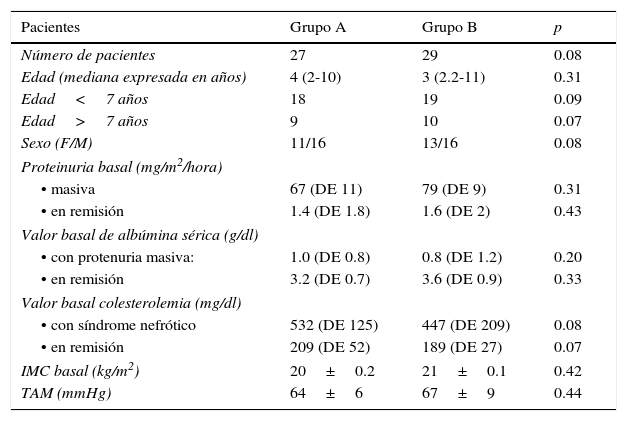
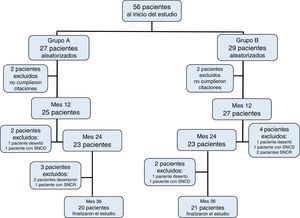
3ResultadosDe los 56 pacientes inicialmente incluidos, 41 cumplieron los 36 meses del estudio distribuidos de la siguiente forma: 27 pacientes dentro del grupo A, de los cuales fueron 11 mujeres (mediana de edad 4 años, r: 2 a 10 años); y 29 pacientes dentro del grupo B, de los cuales fueron 13 mujeres (mediana de edad 3 años, r: 2 a 11 años) (Tabla 1). La adherencia al tratamiento en la población total fue del 73%; la adhesión terapéutica por grupo fue del 74% en el grupo A y del 72% en el grupo B (p=0.4) (Figura 1).
Características de la población durante el estudio
| Pacientes | Grupo A | Grupo B | p |
|---|---|---|---|
| Número de pacientes | 27 | 29 | 0.08 |
| Edad (mediana expresada en años) | 4 (2-10) | 3 (2.2-11) | 0.31 |
| Edad<7 años | 18 | 19 | 0.09 |
| Edad>7 años | 9 | 10 | 0.07 |
| Sexo (F/M) | 11/16 | 13/16 | 0.08 |
| Proteinuria basal (mg/m2/hora) | |||
| • masiva | 67 (DE 11) | 79 (DE 9) | 0.31 |
| • en remisión | 1.4 (DE 1.8) | 1.6 (DE 2) | 0.43 |
| Valor basal de albúmina sérica (g/dl) | |||
| • con protenuria masiva: | 1.0 (DE 0.8) | 0.8 (DE 1.2) | 0.20 |
| • en remisión | 3.2 (DE 0.7) | 3.6 (DE 0.9) | 0.33 |
| Valor basal colesterolemia (mg/dl) | |||
| • con síndrome nefrótico | 532 (DE 125) | 447 (DE 209) | 0.08 |
| • en remisión | 209 (DE 52) | 189 (DE 27) | 0.07 |
| IMC basal (kg/m2) | 20±0.2 | 21±0.1 | 0.42 |
| TAM (mmHg) | 64±6 | 67±9 | 0.44 |
F: Femenino; M: masculino; IMC: índice de masa corporal; TAM: tensión arterial media.
El tiempo medio de control para la población fue de 36 meses (r: 34 a 38 meses), y durante todo el protocolo la presencia de edemas concordó con las recaídas, aunque su magnitud y, eventualmente, su desaparición fue aleatoria, y no siempre fue coincidente con la remisión.
En el grupo A la edad promedio de inicio del síndrome nefrótico fue de 3.7 años (DS 1.6) y la TIA de recaídas fue de 36/100 persona-año. En el grupo B fue de 4.2 años (DS 2.1) y la TIA de recaídas fue de 66/100 persona año (p=0.04).
En el grupo A, el tiempo medio transcurrido entre el diagnóstico del síndrome nefrótico y el inicio del tratamiento fue de 10±3 días y en el grupo B fue de 13±2 días (p=0.07). A su vez, el tiempo medio transcurrido entre el tratamiento inicial y la remisión en el grupo A fue de 14±3 días y en el grupo B de 11±2 días (p=0.08). Finalmente, el tiempo medio transcurrido desde el fin del tratamiento inicial hasta la primera recaída en el grupo A fue de 114±7 días para la población total y de 102±5 días para los mayores de 7 años, y en el grupo B fue de 75±9 días para la población total y de 67±3 para los mayores de 7 años (p=0.01).
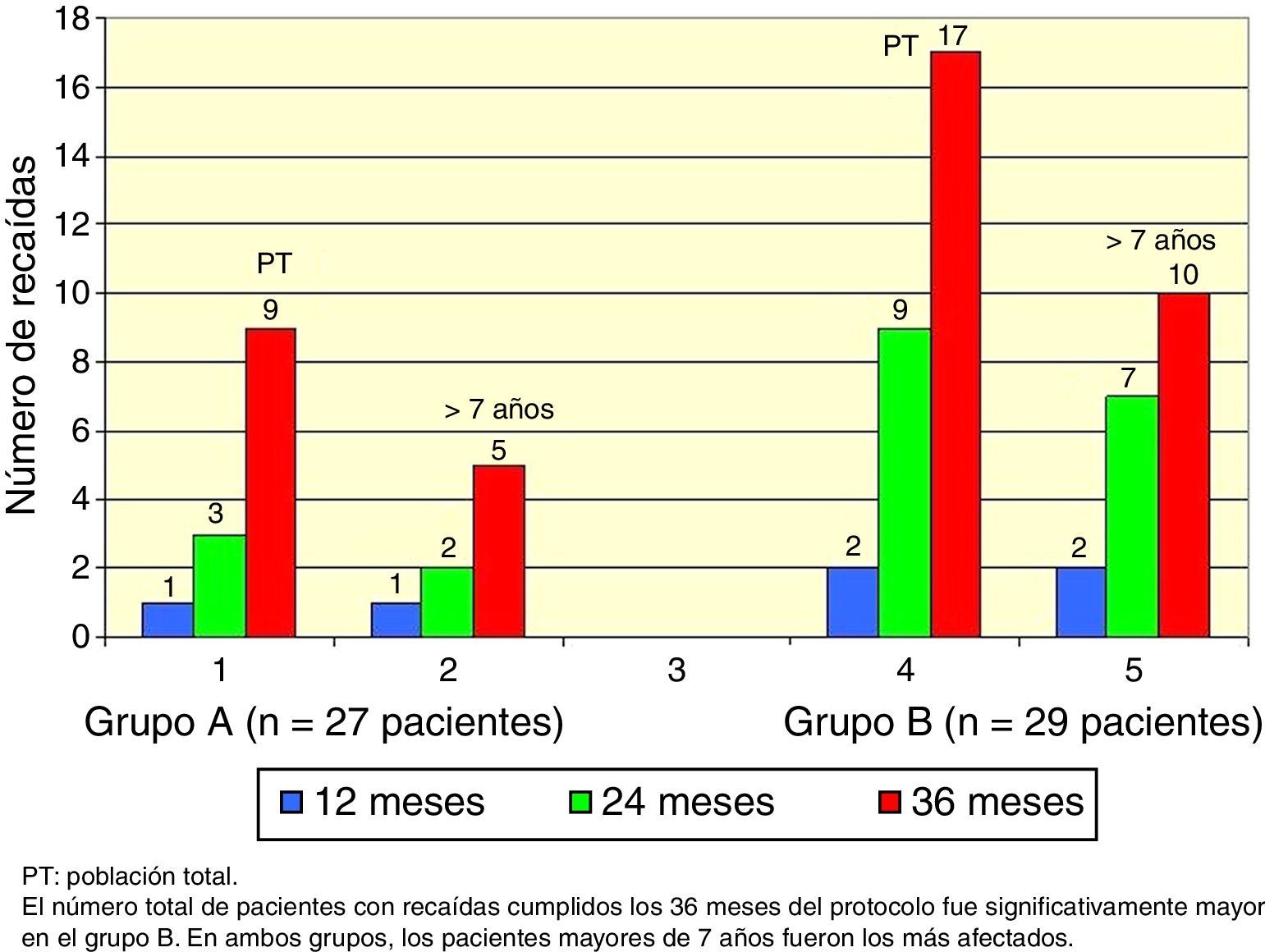
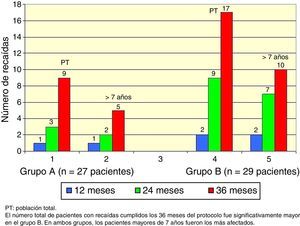
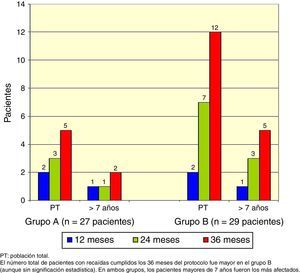
El total acumulado de recaídas fue de 9 en el grupo A y 17 en el grupo B (test exacto de Fisher, p=0.048). En ambos grupos, los pacientes mayores de 7 años fueron los más afectados (Figura 2).
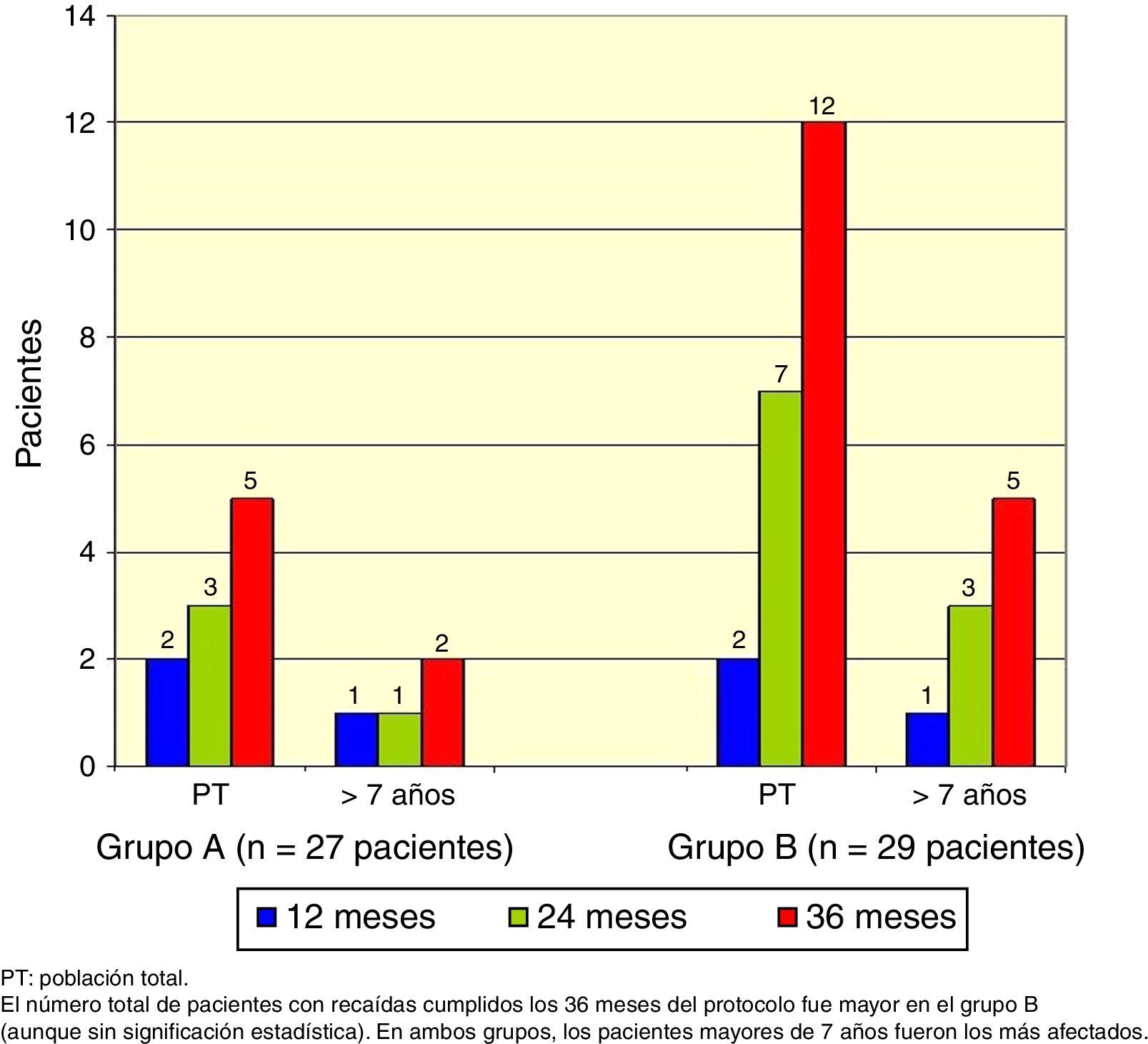
El número total de pacientes con recaídas fue menor en el grupo A (3 pacientes) que en el grupo B (7 pacientes), pero esta diferencia no fue significativa (test exacto de Fisher, p=0.18), y nuevamente los pacientes mayores de 7 años fueron los más afectados (Figura 3).
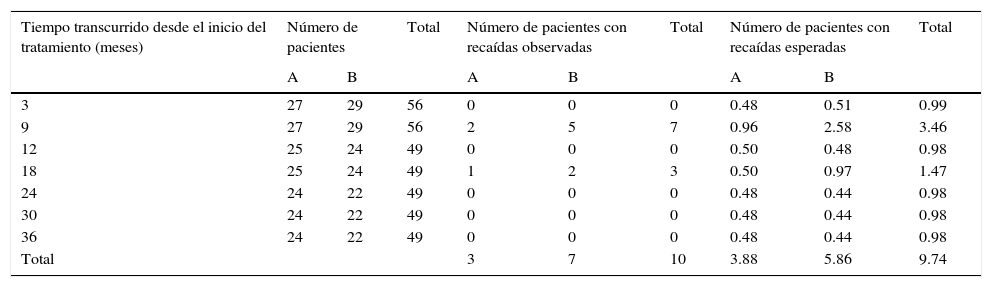
La prueba ordinal logarítmica (χ2=4.1, p<0.05) mostró diferencias significativas en la distribución de las recaídas para los pacientes del grupo A contra los pacientes del grupo B (Tabla 2).
Ilustración de los cálculos para la estadística ordinal logarítmica (log-rank) para la comparación de las distribuciones de supervivencia actuarial entre los pacientes de los grupos A y B
| Tiempo transcurrido desde el inicio del tratamiento (meses) | Número de pacientes | Total | Número de pacientes con recaídas observadas | Total | Número de pacientes con recaídas esperadas | Total | |||
|---|---|---|---|---|---|---|---|---|---|
| A | B | A | B | A | B | ||||
| 3 | 27 | 29 | 56 | 0 | 0 | 0 | 0.48 | 0.51 | 0.99 |
| 9 | 27 | 29 | 56 | 2 | 5 | 7 | 0.96 | 2.58 | 3.46 |
| 12 | 25 | 24 | 49 | 0 | 0 | 0 | 0.50 | 0.48 | 0.98 |
| 18 | 25 | 24 | 49 | 1 | 2 | 3 | 0.50 | 0.97 | 1.47 |
| 24 | 24 | 22 | 49 | 0 | 0 | 0 | 0.48 | 0.44 | 0.98 |
| 30 | 24 | 22 | 49 | 0 | 0 | 0 | 0.48 | 0.44 | 0.98 |
| 36 | 24 | 22 | 49 | 0 | 0 | 0 | 0.48 | 0.44 | 0.98 |
| Total | 3 | 7 | 10 | 3.88 | 5.86 | 9.74 | |||
X2=4.1 (p<0.05). La extensión decimal explica la minima diferencia en los totales.
Finalizado el estudio, la dosis media acumulada total por paciente en el grupo A fue de 5,243mg/m2 y en el grupo B de 4,306mg/m2 (p=0.3), sumando el corticoide administrado durante el esquema inicial (grupo A, 4,802mg/m2 y grupo B, 3,402mg/m2) y las recaídas tratadas (grupo A, 441mg/m2 y grupo B, 904mg/m2).
El valor final de cortisol sérico matinal en el grupo A fue de 14μg/dl y en el grupo B fue de16μg/dl (p=0.4).
En el grupo A se realizó una biopsia renal en tres niños; los dos pacientes con SNCD tuvieron un diagnóstico histológico de enfermedad por cambios mínimos (ECM), mientras que el tercer paciente con SNCR presentó proliferación mesangial.
En el grupo B se realizó la biopsia renal en cuatro niños; en los dos pacientes con SNCR, el diagnóstico histológico fue de esclerosis focal y segmentaria, y de proliferación mesangial, respectivamente. En los otros dos pacientes con SNCD, el diagnóstico histológico fue de ECM.
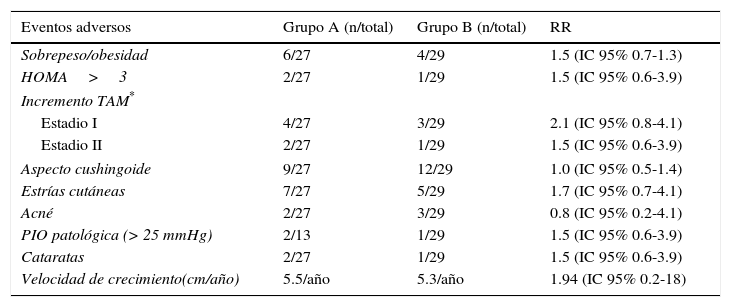
El riesgo de presentar toxicidad esteroide fue leve y no hubo diferencias significativas entre ambos grupos (Tabla 3).
Toxicidad esteroide en ambos grupos
| Eventos adversos | Grupo A (n/total) | Grupo B (n/total) | RR |
|---|---|---|---|
| Sobrepeso/obesidad | 6/27 | 4/29 | 1.5 (IC 95% 0.7-1.3) |
| HOMA>3 | 2/27 | 1/29 | 1.5 (IC 95% 0.6-3.9) |
| Incremento TAM* | |||
| Estadio I | 4/27 | 3/29 | 2.1 (IC 95% 0.8-4.1) |
| Estadio II | 2/27 | 1/29 | 1.5 (IC 95% 0.6-3.9) |
| Aspecto cushingoide | 9/27 | 12/29 | 1.0 (IC 95% 0.5-1.4) |
| Estrías cutáneas | 7/27 | 5/29 | 1.7 (IC 95% 0.7-4.1) |
| Acné | 2/27 | 3/29 | 0.8 (IC 95% 0.2-4.1) |
| PIO patológica (> 25 mmHg) | 2/13 | 1/29 | 1.5 (IC 95% 0.6-3.9) |
| Cataratas | 2/27 | 1/29 | 1.5 (IC 95% 0.6-3.9) |
| Velocidad de crecimiento(cm/año) | 5.5/año | 5.3/año | 1.94 (IC 95% 0.2-18) |
HOMA: homoeostasis model assessment; TAM: tensión arterial media; PIO: presión intraocular; RR: riesgo relativo.
Las alteraciones en el metabolismo fósforo/calcio no fueron significativas: para el grupo A, la calcemia fue de 7.9±0.9mg/dl, y para el grupo B, de 8.2±2.1mg/dl (p=0.6). La fosfatemia en el grupo A fue de 4.8±1.1mg/dl y en el grupo B, de 5.2±1.8mg/dl (p=0.09).
En el grupo A, la FAL fue de 339±132mg/dl y en el grupo B de 430±112mg/dl (p=0.06).
La PTH en el grupo A fue de 41±16 pg/ml y en el grupo B de 32±11 pg/ml (p=0.08). En el grupo A, la concentración de 25-OH vitamina D fue de 26±4 ng/ml y en el grupo B de 29±5 ng/ml (p=0.29).
Finalmente, el contenido mineral óseo fue de 0.76±0.11g/cm2 con un puntaje Z de 1±1 en el grupo A (9 pacientes), y en el grupo B (10 pacientes), el contenido mineral óseo fue de 0.80±0.08g/cm2 (p=0.26) y un puntaje Z de -1±0.5 (p=0.9). En ningún paciente se realizó un estudio genético específico.
4DiscusiónEl planteamiento para esta investigación buscó justificar el uso de un esquema terapéutico prolongado para compararlo con el tratamiento habitual. Se comprobó que los pacientes del grupo A presentaron un menor número de recaídas, sin un aumento significativo de la dosis acumulada esteroide. Aunque no se encontraron diferencias significativas en el número de pacientes con recaídas entre las dos poblaciones aleatorizadas, el valor del cortisol plasmático final en ambos grupos demostró una adecuada supresión corticoide12.
El ISKDC estableció un régimen diario de 8 semanas con glucocorticoides. Posteriormente, otros esquemas se extendieron hasta 12 semanas13,14, y aunque aún no hay un consenso con respecto a la duración del tratamiento15, en este trabajo se observó que el esquema prolongado superior a 3 meses reduce la tasa de recurrencias, lo que coincide con lo informado por Bagga y colaboradores (1999)16 y Hiraoka y colaboradores (2000)17. Además, acorde con los trabajos de Ueda y colaboradores18 y Ksiazek y Wyszynska19, se obtuvo un índice de remisión significativo desde el primer episodio. Por otra parte, aunque los tiempos de seguimiento en los estudios de Sinha y colaboradores20, Yoshikawa y colaboradores21 y Hoyer22 fueron diferentes a los establecidos en esta investigación, se considera que la variación en cuanto al tamaño de la población estudiada podría ser responsable de las discrepancias con los resultados finales. Al respecto, resulta ostensible que el tamaño poblacional demostró variaciones sustanciales con relación a esta experiencia.
En cuanto al sexo y la edad como variables influyentes sobre la evolución del SNCS23,24, a diferencia del estudio Takeda y colaboradores25, no se encontró una relación significativa en la incidencia de recaídas asociadas con el sexo, pero sí con la edad promedio. En ambos grupos, los pacientes mayores de 7 años presentaron un incremento en la frecuencia de recaídas.
Con respecto a la toxicidad por corticoides, se sabe que se encuentra relacionada con la dosis acumulada26,27. Sin embargo, no se observaron diferencias importantes entre ambos grupos con relación al daño oftalmológico28,29, a la obesidad central y a la insulino-resistencia30; y si bien varios pacientes presentaron facies cushingoide, este evento fue transitorio y reversible31.
Tampoco se encontró toxicidad esteroide sobre el metabolismo mineral (osteopenia)32, y aunque se sabe que el aumento tanto del contenido como de la densidad mineral ósea son lineales solo en la población prepúber, se aminoró este sesgo en las mujeres y varones púberes incluidos, estudiando por separado la densidad y el contenido mineral óseo y adecuando los resultados a las variables antropométricas y de sexo. Además, para atenuar la eventual reducción de la masa ósea, la población recibió carbonato de calcio y vitamina D según normas establecidas14.
Finalmente, los registros de hipertensión arterial posiblemente asociada a la acción corticoide sobre la angiotensina II endógena (los pacientes del grupo A presentaron un incremento porcentual hasta del 30% para el estadio I), fueron transitorios y respondieron al uso de nifedipina33.
No se evaluaron los cambios de conducta descritos en los pacientes que reciben terapia esteroide (euforia leve, insomnio y aumento del apetito) aunque, según referencias bibliográficas, los mismos pueden alcanzar una frecuencia de hasta el 25%34.
Este trabajo presentó ciertas limitaciones. En primer término, aunque el tamaño muestral fue el resultado de las pautas estadísticas pre-establecidas, resulta evidente que el número de pacientes que recayó fue relativamente pequeño en cada grupo, lo que limitó la observación de diferencias.
Asimismo, la falta de diagnóstico histológico en todos los pacientes pudo encubrir etiologías distintas del síndrome nefrótico primario35,36. No obstante, se siguieron pautas internacionales establecidas sobre no indicar la biopsia renal inicial a pacientes pediátricos con SNCS37,38.
En conclusión, aunque existen antecedentes de tratamientos esteroides extendidos2,3, de acuerdo con la experiencia de este estudio, el aumento del número de recaídas observadas en los niños mayores de 7 años permite pensar si en este grupo sería necesaria la implementación de esquemas terapéuticos prolongados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.