Trichinella spiralis es un nemátodo tisular que se aloja en el músculo esquelético de humanos y otros mamíferos y causa una serie de alteraciones fisiológicas. Las proteínas de los productos de excreción-secreción de T. spiralis juegan un papel importante en la aparición y regulación de estas alteraciones. Sin embargo, aún no se conoce el efecto de estos productos en la infección e invasión del parásito al hospedero.
MétodosMediante un análisis electroforético en una dimensión, Western blot y espectrometría de masas, se evaluaron las diferencias y similitudes entre proteínas antigénicas y de superficie de cuatro aislados de T. spiralis obtenidos de hospederos accidentales (perros) y la cepa de referencia aislada de cerdos (MSUS/MEX/91/CM).
ResultadosUtilizando ontología de genes, se encontraron cinco proteínas exclusivas de los hospederos accidentales. Después del análisis, se encontró que estas proteínas forman parte de la matriz extracelular del parásito, cuentan con actividad catalítica y están implicadas en la adhesión a las células del hospedero. La actividad antigénica de las cuatro cepas aisladas de hospederos accidentales es idéntica a la reportada para T. spiralis, visualizándose el triplete antigénico característico de 43, 45 y 47 kDa.
ConclusionesLas proteínas exclusivas de los hospederos accidentales proveen información para entender el mecanismo de acción de este parásito para penetrar el músculo y evadir la respuesta inmune en el hospedero.
Trichinella spiralis is an intestinal and tissue nematode specific for mammalian skeletal muscle, causing a series of physiological alterations. T. spiralis excretory-secretion products play an important role in the appearance and regulation of these alterations. However, the effect of these products on the infection and invasion of the parasite to the host is unknown.
MethodsDifferences and similarities between antigenic proteins and surface proteins of four accidental hosts isolates (dogs) of T. spiralis and the reference strain isolated from pigs (MSUS/MEX/91/CM) were assessed by electrophoresis, western blot and mass spectrometry.
ResultsUsing gene ontology, five proteins exclusive to the accidental hosts were analyzed. The results showed that these proteins are part of the extracellular matrix of the parasite, present catalytic activity, and bind to host cells. The antigenic activity the four strains showed the antigenic triplet characteristic of T. spiralis of 43, 45 and 47 kDa.
ConclusionsFive proteins exclusive to dog isolates provided information to understand the mechanism of action of this parasite to penetrate the muscle and evade the immune response in the host.
La triquinelosis es una enfermedad zoonótica causada por nemátodos del género Trichinella, constituido por ocho especies y cuatro genotipos (T. spiralis, T. nativa, T. murrelli, T. britovi, T. nelsoni, T. pseudospiralis, T. papue, T. zimbabwensis, T-6, T-8, T-9 y T-12)1–3. Estas especies se encuentran distribuidas alrededor del mundo, afectando a carnívoros, humanos y hospederos accidentales4. De 2004 a 2009, ocurrieron 15 brotes de triquinelosis humana en China, con 1387 casos y cuatro defunciones. En México, particularmente en Zacatecas, se reportaron aproximadamente 758 casos de triquinelosis humana durante el periodo entre 1952 y 1997. La mayoría de los brotes ocurrieron debido al consumo de carne de cerdo cruda o insuficientemente cocida5. De 1970 a 1990 se reportaron ocho casos de triquinelosis en niños, cuyo diagnóstico se realizó mediante antecedentes epidemiológicos, clínicos y por exámenes de laboratorio. La mayor frecuencia se presentó en el grupo de 10 a 14 años proveniente de un nivel socioeconómico bajo6. Actualmente, existen alrededor de 11 millones de personas infectadas por nemátodos del género Trichinella spp7.
La importancia de la triquinelosis en hospederos accidentales como el perro se demostró en estudios realizados en China, donde se analizaron 13 provincias. En las carnicerías municipales se encontró una prevalencia del 16.2%, con un rango de 1.2 a 44.8%, mientras que la prevalencia encontrada en los mercados fue del 3.5%, lo que representó un serio problema de salud pública.
En países como Finlandia se reportó el riesgo de triquinelosis en perros domésticos en el 19.4%, mientras que la infección con Trichinella nativa se encontró con mayor frecuencia en perros de vida libre multiparasitados con otras especies de Trichinella. Esto incrementa la posibilidad de contagio cuando la carne de estos animales, cruda o mal cocida, es ingerida por los humanos y huéspedes sinantrópicos8,9. De esta manera, la posibilidad de contraer esta parasitosis se incrementa al tener más hospederos con potencial de infección, y abre nuevas rutas de contagio para los humanos.
Es importante puntualizar que la triquinelosis es una zoonosis potencialmente mortal, por lo que es importante conocer todas las probables fuentes de contagio y el mecanismo de infección del parásito, así como analizar las proteínas involucradas en la patogenicidad e infección. Debido a que es una enfermedad que aún es mal diagnosticada y confundida con algunas enfermedades gastrointestinales, lo anterior proveerá de herramientas adecuadas para su tratamiento.
2Métodos2.1Animales y tratamientoSe infectaron ratas de la cepa Wistar con aproximadamente 1000 larvas L1 por vía intragástrica. Treinta días post-infección, los animales fueron sacrificaron para extraer las larvas infectivas del músculo esquelético mediante digestión artificial, utilizando pepsina-HCl al 1% a 37°C en agitación constante durante 3h.
El manejo de los animales se llevó a cabo en función de las normas oficiales y de los lineamientos del Comité de Ética del Hospital Infantil de México Federico Gómez.
2.2Obtención de productos de excreción-secreción de larvas L1 de Trichinella spp.Las larvas obtenidas por digestión artificial se mantuvieron en cajas de cultivo bajo una atmósfera de 5% de CO2 a 37°C durante 20 días. Posteriormente, se determinó la concentración de los productos de excreción-secreción (PES).
2.3Electroforesis de los productos de excreción-secreción de larvas de T. spiralisSe analizaron 2.5μg de proteína mediante electroforesis en geles de acrilamida/bisacrilamida (SDS-PAGE) al 10%. Los geles fueron teñidos con plata. Las muestras de proteína posteriormente se analizaron por Western blot.
2.4Preparación de las muestras de proteínaSe añadieron 500μl de amortiguador de lisis (4% SDS, 100mM DTT, 100mM de Tris pH 8.6 y cóctel inhibidor de proteasas y fosfatasas, Halt, Thermo Scientific) a las muestras de PES. La mezcla fue incubada a 40°C durante 30min para reducir las proteínas. Posteriormente, se agregó Tris a una concentración final de 300mM y yodo acetamida (IAM) 200mM para alquilar la mezcla de proteínas, la cual se incubó a temperatura ambiente y en oscuridad por 30min. Las proteínas se precipitaron añadiendo nueve volúmenes de etanol absoluto, incubando a -20°C toda la noche. Las proteínas se solubilizaron en cloruro de guanidinio 50mM y Tris 20mM. La digestión proteolítica se realizó con tripsina 1:50, incubando toda la noche a 37°C.
La mezcla de péptidos fue acidificada al 0.1% con ácido trifluoroacético (TFA) y desalada en cartuchos Sep-Pak® C18. Los péptidos se lavaron tres veces con 0.1% de TFA, y posteriormente fueron eluidos con 1ml de acetonitrilo al 60% y TFA al 0.1%. La solución eluida se secó por completo usando una centrifuga SpeedVac® y los péptidos secos fueron congelados a -80°C.
2.5Identificación de proteínas mediante cromatografía liquida acoplada a espectrometría de masasLa mezcla de péptidos fue resuspendida en 50μl de ácido fórmico al 0.1% y colocada en un vial de inyección para ser separada en un Ultimate 3000 RSLC nano HPLC (Thermo Scientific®) por una columna de preconcentración de C18 PepMap 100, 5μm, 100Å (Thermo Scientific®) conectada a columna analítica C18 de 75μm de diámetro interior y 15cm de longitud (Agilent Technologies®). Los péptidos fueron eluidos con un gradiente no lineal de 2% a 40% de solución B (0.1% de ácido fórmico en acetonitrilo) en 240min a 250 nl/min, y analizados en línea en un espectrómetro de masas de tipo cuadrupolo-TOF Impact II (Bruker Daltonics®), el cual fue operado en modo positivo con una fuente CaptiveSpray®.
2.6Análisis de datos proteómicosLos espectros de masas fueron procesados mediante el programa Data Análisis (Bruker Daltonics®) y comparados con la base de datos de proteínas SwissProt®, utilizando el motor de búsqueda Mascot®. Los datos se buscaron con una tolerancia de masa de péptido de 7ppm, y con una tolerancia de 0.05Da y una longitud mínima de péptido de cinco aminoácidos para los productos de fragmentación. La carbamidometilación de cisteínas se consideró como modificación fija, y la oxidación de metioninas, como variable. Se permitieron hasta dos omisiones de corte de la proteasa tripsina. La comparación de las proteínas identificadas en cada una de las réplicas en la muestra control y experimental se realizó mediante diagramas de Venn (http://genevenn.sourceforge.net/usm.edu, implementado por Mehdi Pirooznia). Solamente las proteínas que estuvieran en las tres réplicas de cada muestra se tomaron como válidas para la comparación entre la muestra control y la experimental.
2.7Caracterización de proteínas por ontología de genesLas proteínas exclusivas de hospederos accidentales fueron categorizadas usando Web Gene Ontology Annotation Plot (http://wego.genomics.org.cn/cgi-bin/wego/index.pl)10,11. Los datos de estas proteínas fueron analizados y comparados, mostrando las funciones biológicas características en un gráfico.
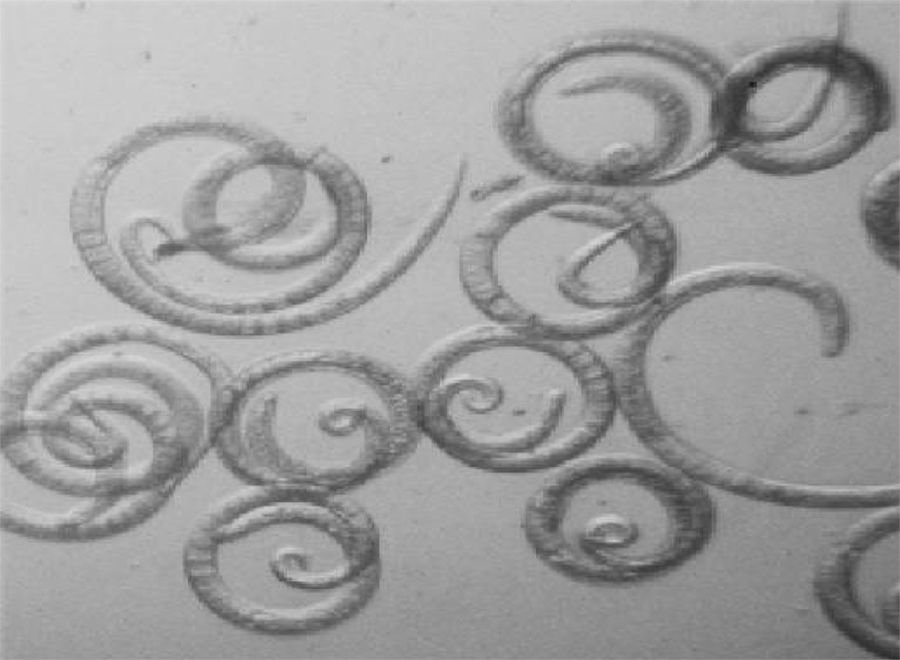
3Resultados3.1Animales y tratamientoSe reprodujo el ciclo biológico de Trichinella spiralis en ratas de la cepa Wistar inoculadas vía intragástrica con larvas L1. Se obtuvieron 20,000 larvas L1/Ml de los aislados Z1, Z2, Z3 y Z4 de T. spiralis, así como de la cepa obtenida de cerdo (fig. 1).
3.2Obtención de productos de excreción–secreción de larvas L1 de T. spiralis y las cepas obtenidas de hospederos accidentalesLos PES se obtuvieron semanalmente, midiendo la concentración de proteínas en el medio de cultivo con el espectrofotómetro Epoch Gen5®. El rango de concentración osciló entre 0.5 y 4.5μg/μl.
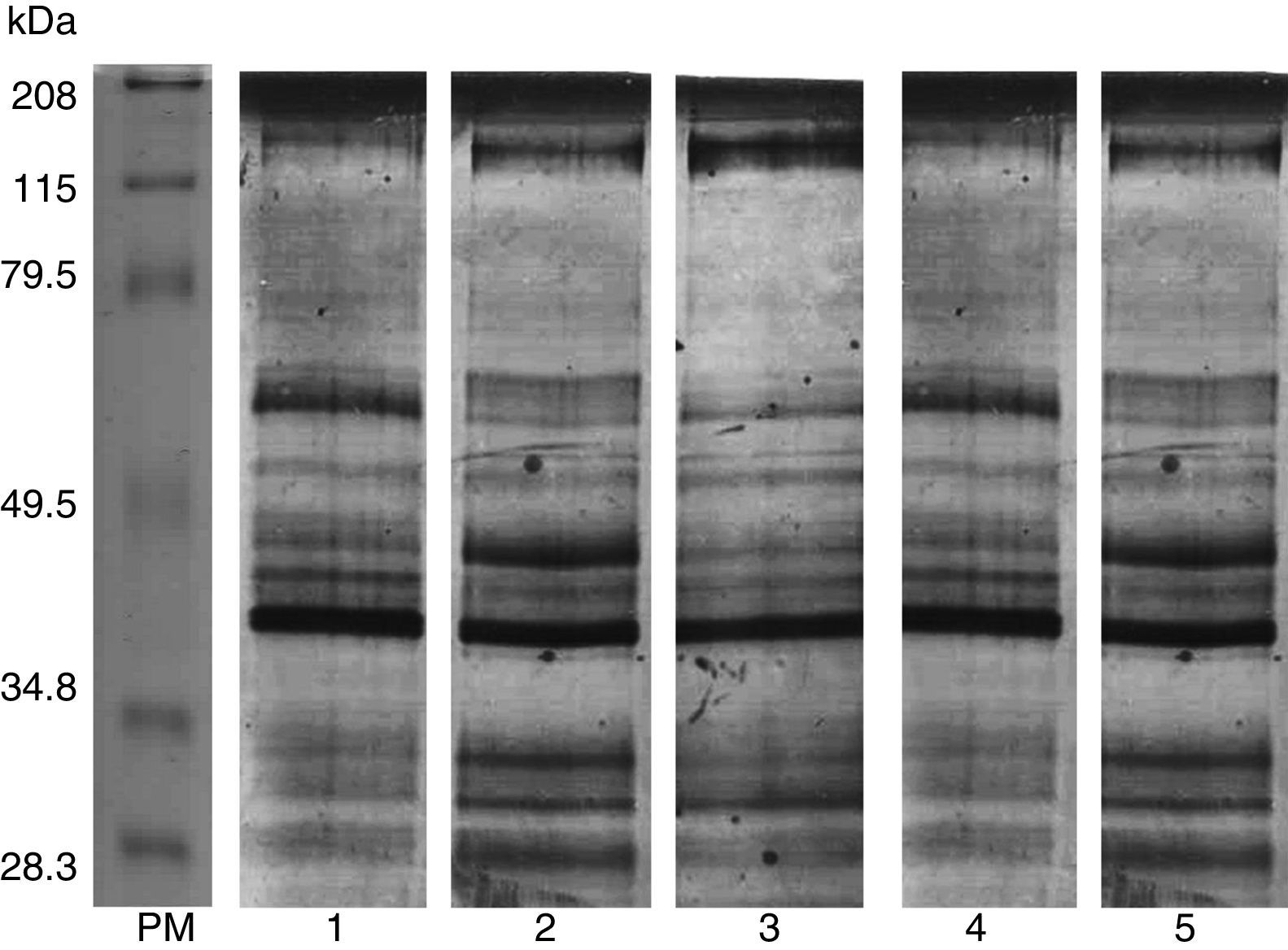
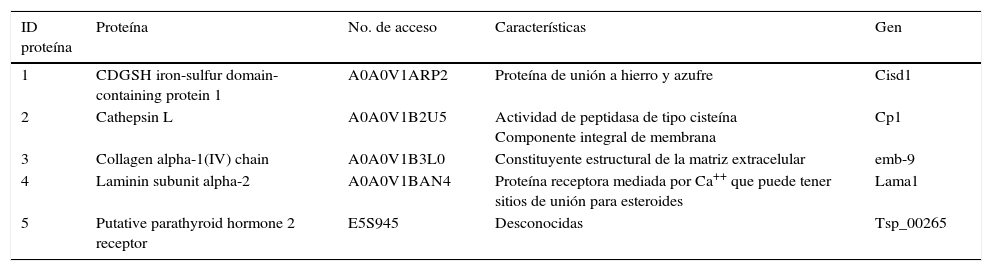
3.3Electroforesis de los productos de excreción-secreción de larvas de T. spiralisSe realizó la electroforesis para conocer el total de proteínas expresadas en los PES de cada cepa y, en función del perfil proteico, conocer si existían diferencias o similitudes entre ellas, tomando como punto de comparación la cepa de T. spiralis obtenida de cerdo (fig. 2).
Electroforesis de los productos de excreción-secreción. 1. PES de la cepa de referencia Trichinella spiralis; 2. PES Z1; 3. PES Z2; 4. PES Z3; 5. PES Z4. Todos los PES detectados por electroforesis al 10% y teñidos con plata. Se observa que existen diferencias y similitudes en el perfil proteico.
Se inocularon conejos para obtener anticuerpos policlonales anti-PES de cada cepa. Se obtuvo el suero y se realizó la técnica de ELISA para verificar la presencia de dichos anticuerpos. El punto de corte fue de 0.995nm. Se consideraron como positivos aquellos sueros que sobrepasaron este umbral, para utilizarlos para el análisis por Western blot.
En la figura 3 se muestra el triplete antigénico característico de T. spiralis de 43, 45 y 47 kDa, corroborando que, efectivamente, Z1, Z2, Z3, Z4 y la cepa de referencia comparten proteínas antigénicas.
Western blot. Se utilizaron PES de los aislados y la cepa de referencia como antígenos y los sueros obtenidos de los conejos inmunizados como anticuerpos. Primero se probaron como antígenos los PES de Trichinella spiralis, y se retaron con los sueros de T. spiralis, suero de cepa Z1, suero de cepa Z2, suero de cepa Z3 y suero de cepa Z4. Posteriormente, se analizó la cepa Z1, retándola en el mismo orden con los diferentes sueros, y así sucesivamente con Z2, Z3 y Z4. Las flechas indican las proteínas antigénicas compartidas y expresadas.
Se encontraron diferencias en la expresión de proteínas de alto peso molecular, entre 110 y 180 kDa. Estos resultados mostraron la diferente antigenicidad entre las muestras analizadas. La diferencia entre las proteasas expresadas y el perfil proteínas en los PES permitió demostrar que la expresión de proteínas en los distintos aislados del parásito se relaciona con la función del propio aislado y del hospedero que parasita.
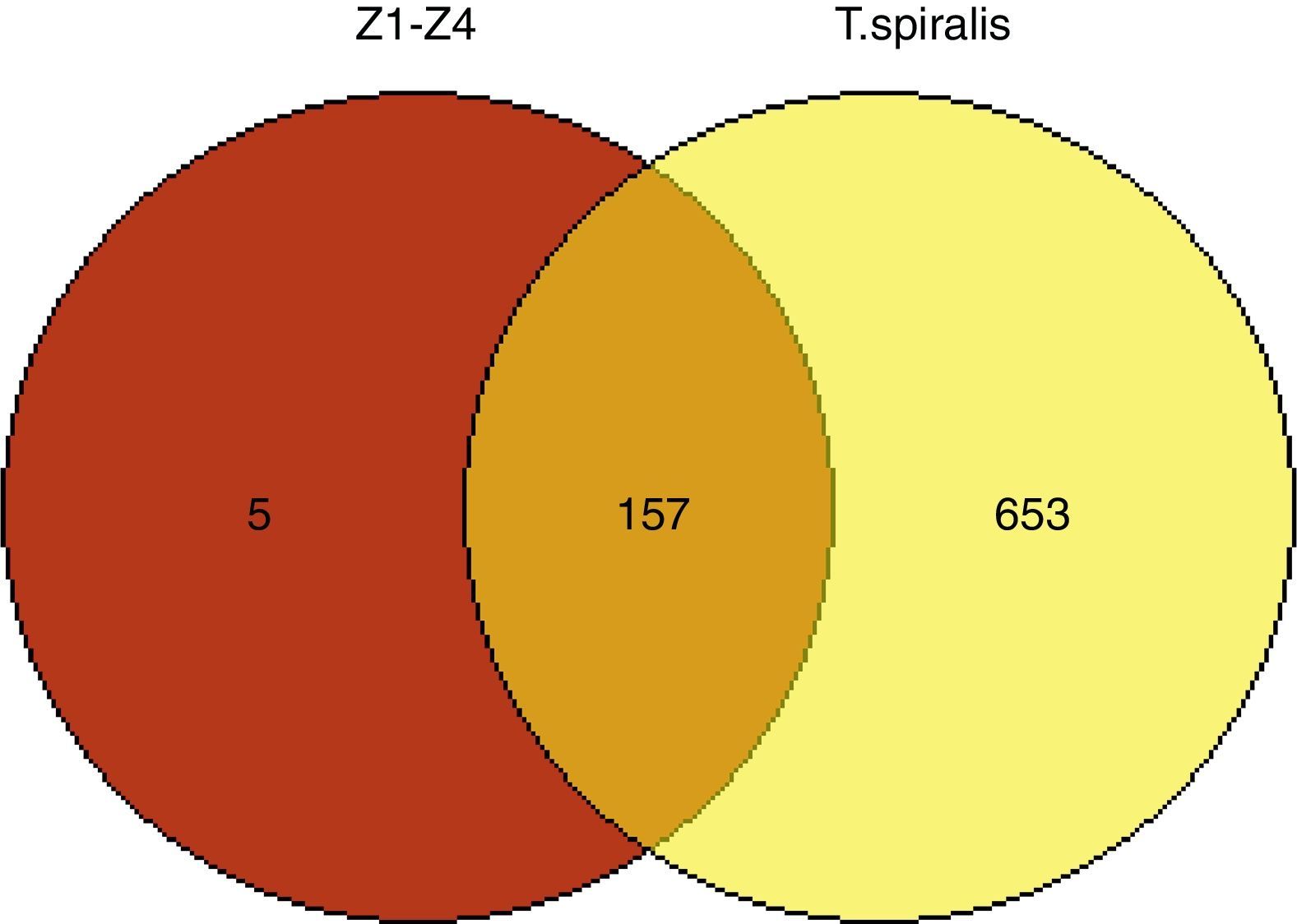
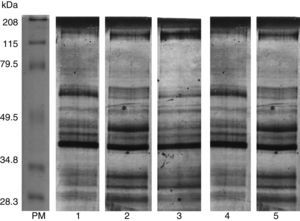
3.5Identificación y análisis de proteínas mediante cromatografía líquida acoplada a masasSe identificaron cinco proteínas exclusivas para las muestras de T. spiralis provenientes de hospederos accidentales en relación con la cepa de referencia obtenida de cerdo (fig. 4). Estas proteínas exclusivas podrían conferir mayor patogenicidad al parásito, ya que tienen funciones proteolíticas. La capacidad de estas cepas para penetrar el músculo esquelético y establecer la enfermedad es mayor comparada con la cepa de referencia (tabla 1).
Análisis de proteínas. Se muestra un diagrama de Venn, donde se representan las 157 proteínas compartidas entre la cepa de T. spiralis de hospederos accidentales y T. spiralis recuperada de cerdos, evidenciando que solamente existen cinco proteínas exclusivas para las muestras de hospederos accidentales. Se compararon únicamente las proteínas presentes en las cuatro cepas provenientes de hospederos accidentales contra el proteoma de T. spiralis.
Características de las proteínas exclusivas de los hospederos accidentales
| ID proteína | Proteína | No. de acceso | Características | Gen |
|---|---|---|---|---|
| 1 | CDGSH iron-sulfur domain-containing protein 1 | A0A0V1ARP2 | Proteína de unión a hierro y azufre | Cisd1 |
| 2 | Cathepsin L | A0A0V1B2U5 | Actividad de peptidasa de tipo cisteína Componente integral de membrana | Cp1 |
| 3 | Collagen alpha-1(IV) chain | A0A0V1B3L0 | Constituyente estructural de la matriz extracelular | emb-9 |
| 4 | Laminin subunit alpha-2 | A0A0V1BAN4 | Proteína receptora mediada por Ca++ que puede tener sitios de unión para esteroides | Lama1 |
| 5 | Putative parathyroid hormone 2 receptor | E5S945 | Desconocidas | Tsp_00265 |
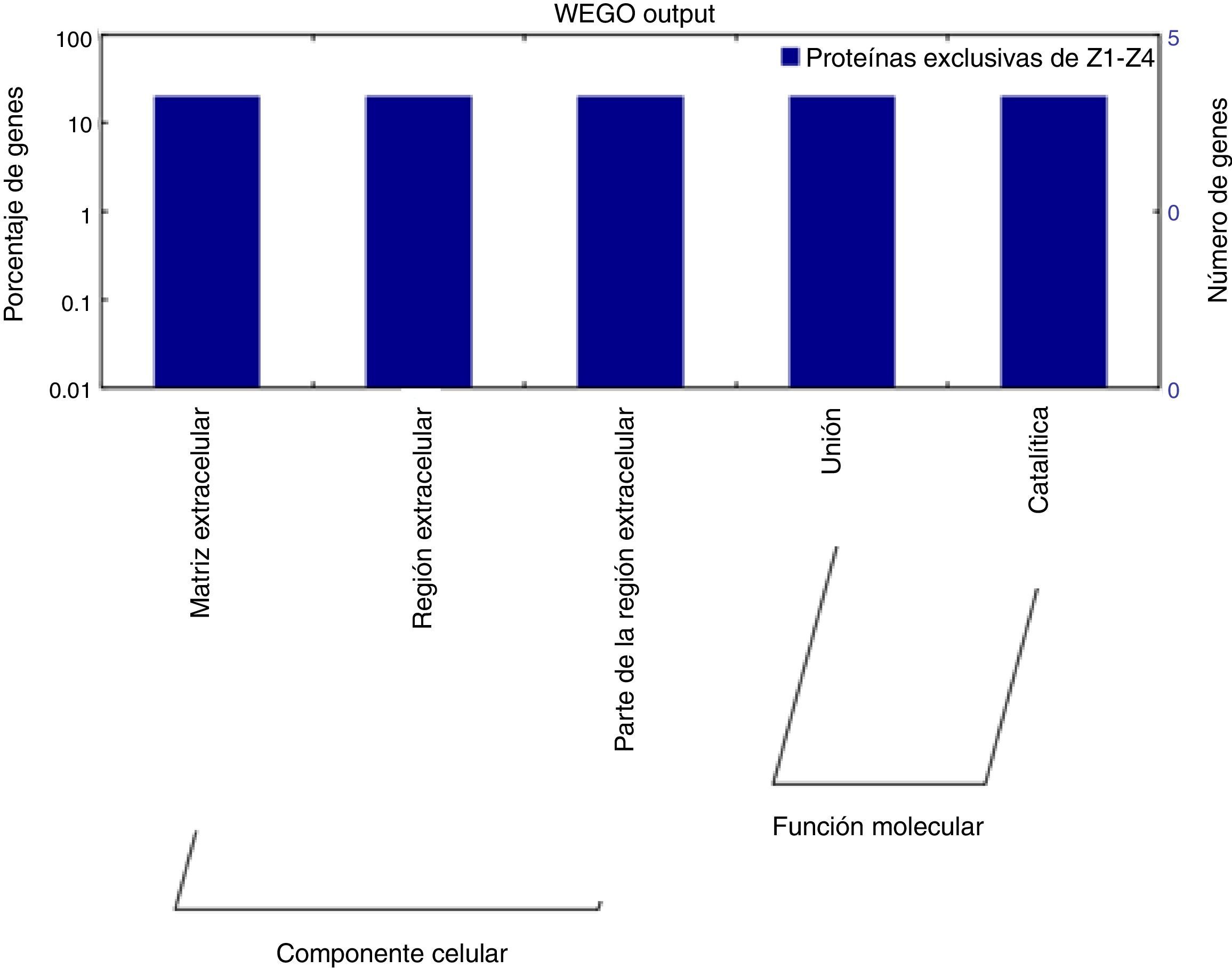
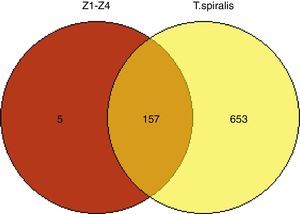
Para entender mejor las funciones de las proteínas identificadas, se utilizó el programa WEGO, categorizando las proteínas en dos grupos: aquellas que poseen funciones moleculares y las que están inmersas en procesos biológicos (fig. 5). Las cinco proteínas analizadas en este estudio forman parte de la matriz extracelular del parásito, y poseen actividad catalítica y de unión a las células del hospedero.
Ontología de genes de los PES de T. spiralis y cuatro cepas obtenidas de hospederos incidentales. Las proteínas identificadas tienen funciones moleculares correspondientes a la formación de la matriz extracelular del parásito, actividad catalítica y unión a las células del hospedero.
Las proteínas identificadas tienen funciones moleculares correspondientes a la formación de la matriz extracelular del parásito, actividad catalítica y unión a las células del hospedero.
4DiscusiónLas proteínas presentes en los PES juegan un papel importante en la invasión, la evasión del sistema inmune y la adaptación entre parásitos y la respuesta inmune del hospedero12.
En un análisis realizado por Nagano y colaboradores, en el 2009, se encontraron tres proteínas principales: 43, 53 y 45 kDa13. Los autores establecieron que estas glicoproteínas son mayormente reconocidas por el hospedero durante la infección. Ortega y colaboradores, en 1989, encontraron 28 proteínas en un rango de peso molecular entre 11 y 200 kDa14. La presente investigación coincide con los resultados obtenidos por los autores mencionados, ya que los PES de los aislados Z1, Z2, Z3, Z4 y de la cepa de referencia mostraron proteínas en un rango de 28 hasta 200 kDa, además de presentar las glicoproteínas de 43 y 45 kDa.
El análisis proteómico mostró proteasas que participan en la interacción huésped-parásito. Este dato es de gran relevancia, ya que muchos patógenos utilizan estas proteínas para facilitar la entrada de los parásitos a la célula blanco del hospedero, iniciándose la infección y evasión de la respuesta inmunitaria. También se encontraron proteínas extracelulares y de unión a las células del hospedero.
Con relación al Western blot, todos los aislados presentaron el triplete de proteínas 43,45 y 47 kDa, correspondiente a las glicoproteínas que contienen tivelosa como agente antigénico. Estas proteínas ya han sido caracterizadas molecularmente y se sabe que son importantes en la formación de la célula nodriza y en la transformación de las células musculares14.
Cabe destacar que se encontró una expresión diferencial de proteínas que tienen alto peso molecular, entre 110 y 180 kDa.
Este trabajo permitió analizar las características antigénicas de T. spiralis e identificar proteínas, compartidas y exclusivas, de cepas obtenidas de hospederos accidentales (no reportados anteriormente) contra la cepa de referencia aislada de cerdos (hospedero habitual de este nemátodo).
Fue importante analizar la participación de este nuevo hospedero en el ciclo biológico de T. spiralis, ya que podría ser una vía indirecta de transmisión de esta enfermedad para el hombre al infectar a cerdos ferales utilizados para consumo humano. En este trabajo se presentan las bases para futuras investigaciones encaminadas a conocer los mecanismos de transmisión indirecta a humanos.
El análisis de los PES de larvas de T. spiralis obtenidas de hospederos accidentales mostró la presencia de cinco proteínas diferentes a las reportadas en la cepa de referencia aislada de cerdo.
De acuerdo con el análisis por Western blot, estas proteínas tienen mayor patogenicidad con relación a la cepa de referencia, y presentan un patrón diferente de proteasas, lo que les confiere mayor poder invasivo. El análisis de estas proteínas es importante, ya que se puede transferir la información genética para su traducción desde hospederos accidentales hacia hospederos habituales de este parásito, y de ser así, muy frecuentemente la infección a humanos sería más severa y letal.
En las cepas aisladas de perro se presentan proteínas de mayor invasión a las células del hospedero, por lo que el análisis y uso de estas proteínas podría servir como diagnóstico temprano al no presentar reacción cruzada con otros helmintos, como es el caso de la cepa de T. spiralis aislada de cerdos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.