Introducción: Se presenta la evaluación de la asociación entre la reserva de hierro (Fe) y los polimorfismos del gen de la hemocromatosis (HFE) en neonatos de alto riesgo perinatal.
Métodos: Se incluyó una serie de neonatos de alto riesgo perinatal en los que se evaluó la reserva de Fe con la medición de la ferritina sérica (FS). Se dividieron en tres grupos: sobrecarga de Fe (SoFe), con FS >1,000 μg/l; reserva normal de Fe, con FS de 154-1,000 μg/l; y reserva baja de Fe, con FS <154 μg/l. Mediante PCR en tiempo real se buscaron las mutaciones C282Y, H63D y S65C del gen HFE.
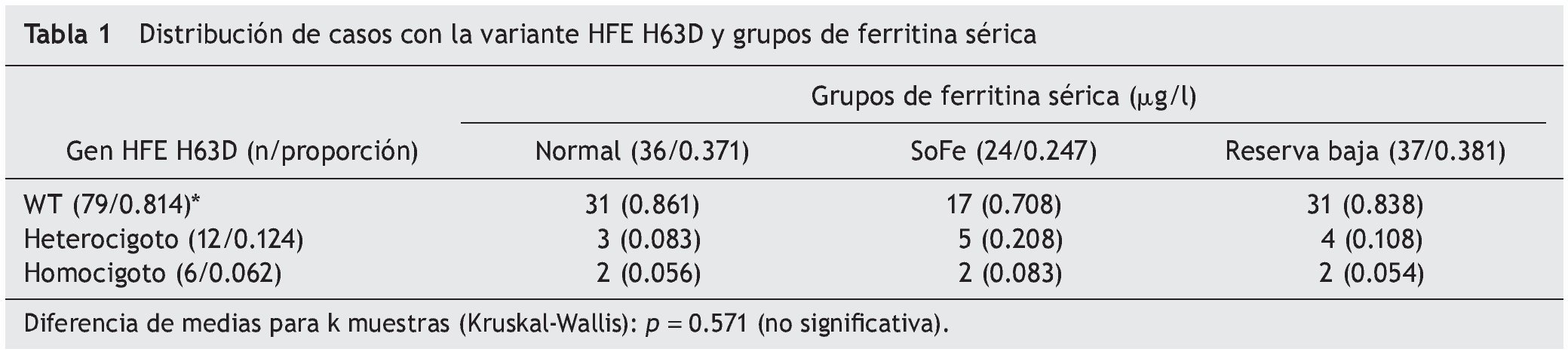
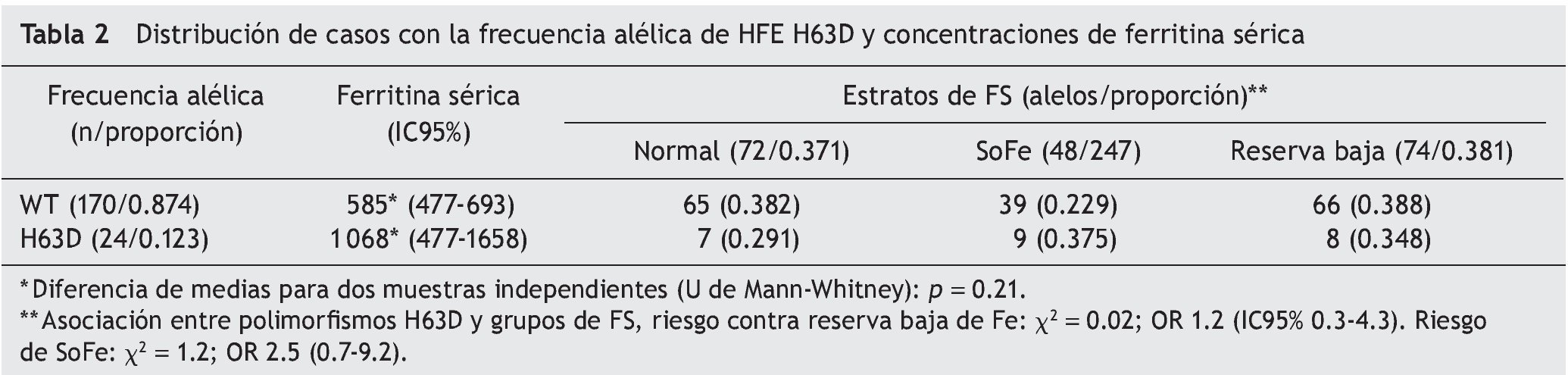
Resultados: Se estudiaron 97 neonatos. De ellos, 24 casos presentaron SoFe (proporción 0.247) y FS de 1,789 μg/l (IC 95% 1,376-2,201); 36 casos, reserva normal de FS (0.371), FS de 461 μg/l (389-533); y 37 casos, reserva baja de FS (0.381) y FS 82 μg/l (69-96). No hubo casos detectados para las mutaciones C282Y o S65C. Se identificó la variante H63D HFE en 18 neonatos (frecuencia génica de 0.185): la condición de heterocigoto (H63D/WT) en doce casos (frecuencia génica 0.124) y de homocigoto (H63D/H63D) en seis casos (frecuencia génica 0.062). La frecuencia alélica de H63D fue de 0.092. Los variante H63D HFE no mostró asociación con los neonatos de reserva normal de Fe contra reserva baja (OR 1.2; IC 95% 0.3-4.3) ni los de reserva normal contra neonatos con SoFe (OR 2.5; 0.7-9.2).
Conclusiones: Cerca del 25% de neonatos de alto riesgo tendrá sobrecarga de Fe. Aún con el posible sesgo de selección, las variantes del gen HFE no influyen sobre el estado de la reserva de Fe.
Background: The association between iron stores (Fe) and HFE gene polymorphisms on high-risk neonates is shown.
Methods: We included newborns with high perinatal risk. Newborns were divided into three groups for measurements of serum ferritin (SF): iron overload (IO) with SF 1000 μg/L, normal iron stores (NIS) with SF 154-1000 μg/L and low iron stores (LIS) with SF <154 μg/L. We used real-time PCR for identification of polymorphisms C282Y, H63DE, and S65C of the HFE gene.
Results: We studied 97 newborns with IO in 24 cases (ratio 0.247) and SF 1789 μg/L (95% CI 1376-2201), NIS in 36 cases (0.371), and SF of 461 μg/L (389-533) and LIS in 37 cases (0.381) and SF 82 μg/L (69-96). There were no cases detected for C282Y or S65C mutations. We identified 18 neonates with H63D HFE variant (gene frequency 0.185) with heterozygous condition (H63D/ WT) in 12 cases (gene frequency 0.124) and homozygote (H63D/H63D) in six cases (gene frequency 0.062). H63D allele frequency was 0.092. The HFE H63D variant showed no association for comparing infants with NIS vs. LIS (OR 1.2, 95% CI 0.3-4.3) and NIS vs. IO newborn infant (OR 2.5, 0.7-9.2).
Conclusions: In high-risk neonates ∼25% show IO even with the possible selection bias. HFE gene variants do not influence on the neonatal iron stores.
1. Introducción
El contenido corporal de hierro (Fe) en el recién nacido de término es de aproximadamente 75 mg/kg; de esto, el 60% se acumula en el tercer trimestre del embarazo1. El Fe se distribuye en el 75-80% en forma de hemoglobina eritrocitaria. Cerca del 10% se encuentra en los tejidos formando parte de la mioglobina y citocromo, y el 10-15% restante se almacena en su forma soluble, como ferritina, o insoluble, como hemosiderina. Ambas se encuentran particularmente en el sistema retículo endotelial, principalmente en el hígado y bazo2.
La ferritina sérica (FS) es la mejor aproximación en la medición de la reserva corporal de Fe3. Los valores de FS en el feto y neonato son distintos a los referidos para otras edades1,4. El Fe corporal, estimado por las concentraciones de FS, está influenciado por el efecto de diversas variables del macroambiente, con impacto diverso5. Se incluye el estado de la reserva corporal materna de Fe al inicio del embarazo y el estado que guarda durante el parto6-8; la edad gestacional3, el tiempo de pinzado del cordón umbilical9, la ordeña del cordón umbilical10, la recolección de sangre placentaria con fines de almacenamiento. En la etapa neonatal, se agrega la velocidad de crecimiento corporal y el tipo de lactancia otorgada2,8. Lo anterior sin considerar la presencia las diferentes complicaciones neonatales, como el nacimiento pretérmino4, la pérdida iatrogénica de sangre por la toma repetida de muestras para estudios de laboratorio2 o, bien, la transfusión eritrocitaria11,12.
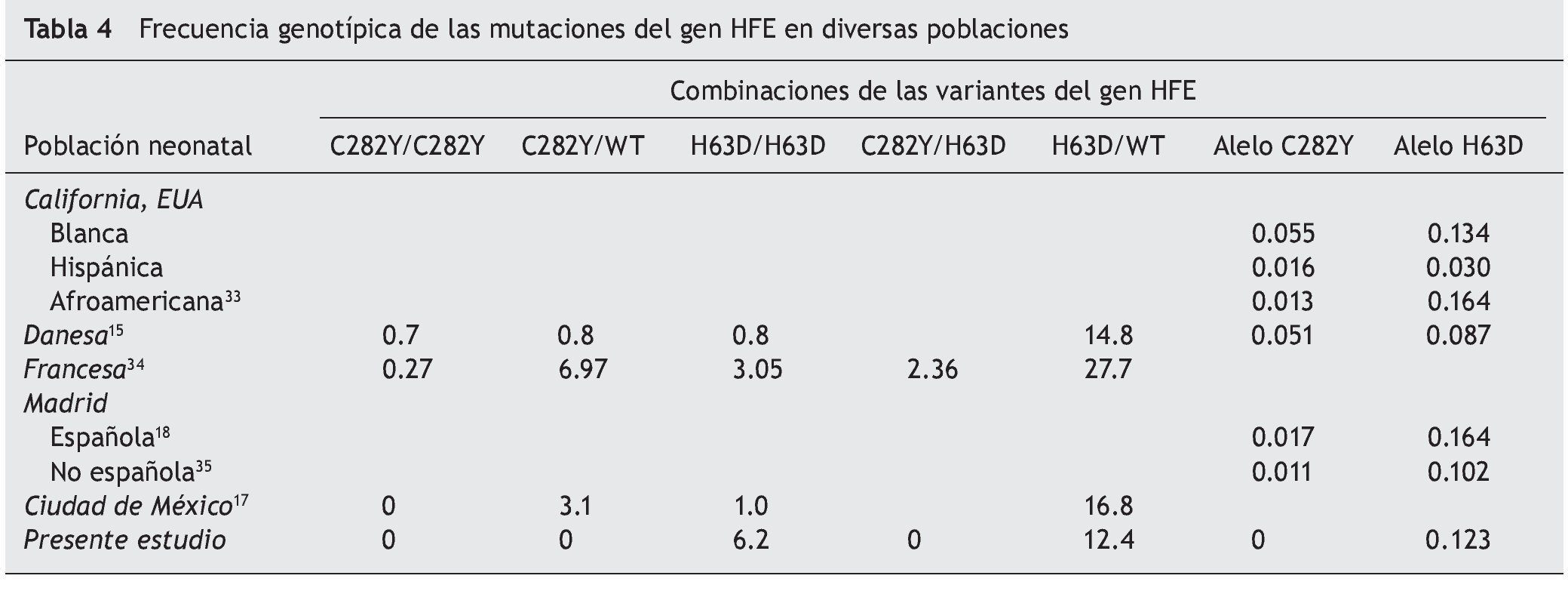
La absorción intestinal del Fe a nivel de las criptas duodenales está regulada por el control de complejos mecanismos moleculares2,13, que incluyen al gen de la hemocromatosis (HFE). Las dos mutaciones más conocidas del gen HFE, C282Y y H63D, están asociadas con la condición patológica, la hemocromatosis hereditaria (HH), que es una enfermedad de transmisión autosómica recesiva con síntomas relacionados a la sobrecarga de Fe, y daño en órganos parenquimatosos14. La prevalencia de las mutaciones del gen HFE varía de acuerdo con el origen étnico de la población. La de mayor impacto, C282Y, es común en el norte de Europa, con una frecuencia alélica de 0.082 a 0.01315, mientras que en México es menor al 0.00216. Para la variante H63D, que presenta distribución multiétnica, la frecuencia alélica varía entre el 0.224 al 0.022, mientras que en México se reporta una frecuencia de 0.093 al 0.136.
La asociación entre el gen HFE y la reserva neonatal de Fe ha sido evaluada previamente. En neonatos atendidos en la Ciudad de México, la frecuencia alélica reportada de la mutaciones C282Y y H63D fue de 0.013 y 0.102, respectivamente17. Esta información concuerda con lo reportado para los recién nacidos de la comunidad de Madrid18, con frecuencia alélica para C282Y de 0.017 (IC95% 0.011-0.023), y para H63D de 0.164 (IC95% 0.148-0.180). Aunque la información sobre el impacto en el periodo neonatal es escasa, se ha intentado asociar con el peso al nacimiento o el desarrollo ulterior de leucemia19.
Así, el objetivo del presente reporte fue evaluar la asociación entre las concentraciones de la FS y los polimorfismos del HFE en recién nacidos, independientemente de sus condiciones clínicas y antecedentes de transfusión.
2. Métodos
Se presenta una serie de casos conformada por recién nacidos con edad gestacional de 28-37 semanas, atendidos en la Unidad de Cuidados Intensivos Neonatales, quienes fueron sometidos a la evaluación de la reserva de Fe por diferentes complicaciones neonatales. Se incluyeron independientemente de la patología infecciosa o etapa del manejo ventilatorio. También fueron incluidos aquellos con diagnóstico de colestasis y tratamiento transfusional proporcionado.
De la muestra remanente de sangre con EDTA empleada para la realización de la citometría hemática, se efectuó la determinación de ferritina sérica (FS) y la obtención de DNA. La FS se determinó por el método inmunoenzimático de fluorescencia (ELFA) mediante un reactivo comercial (mini VIDAS, bioMérieux). Sobre la base de resultados se formaron tres grupos de FS: sobrecarga de Fe (SoFe), con valores superiores a los 1000 μg/l; reserva normal de Fe, con valores de FS entre 154-1000 μg/l; y, finalmente, los casos con reserva baja de Fe, cuando los valores de FS neonatal fueron menores de 154 μg/l. Estos grupos se adaptaron para neonatos de término de bajo riesgo7 y para aquellos neonatos con hemocromatosis neonatal20.
Se extrajo el DNA genómico con un reactivo comercial (High Pure PCR Template Preparation Kit, Roche Applied Science). Por PCR en tiempo real, se amplificaron las secuencias específicas para las mutaciones de HFE C282Y, H63DE y S65C (Lightmix in-vitro diagnostic Kit HFE, Tib MolBiol). Con estos resultados se estratificaron los casos para las tres variantes evaluadas en condición normal (WT), heterocigoto (Hte) u homocigoto (Hom). En el diseño del estudio no se consideró la recolección de muestras maternas.
Se representaron las proporciones de los casos identificados. Los valores de FS se reportaron en promedios e intervalos de confianza del 95%. Los polimorfismos de HFE se muestran en sus frecuencias alélicas y génicas.
Las diferencias entre los grupos de FS y cada condición de la frecuencia génica de HFE se compararon mediante la prueba de diferencia de medias para k muestras (Kruskall-Wallis). Para comparar los valores de FS y la frecuencia alélica de las variantes de HFE, se empleo la prueba de diferencia de medias (U de Mann-Whitney).
3. Resultados
Se estudiaron 97 neonatos de edad promedio de 23 días (IC95% 12-44 días). De acuerdo con los valores de las concentraciones de FS, se identificaron los siguientes resultados: SoFe en 24 casos (proporción 0.247) y promedio de FS 1789 μg/l (IC95% 1,376-2,201 μg/l); reserva normal de FS en 36 casos (proporción 0.371) y promedio de FS 461 μg/l (IC95% 389-533 μg/l); finalmente, reserva baja de FS en 37 casos (proporción 0.381) y promedio de FS 82 μg/l (IC95% 69-96 μg/l). Respecto de los polimorfismos de HFE, no se detectaron casos para las mutaciones C282Y ni S65C. Se identificaron 18 recién nacidos con la variante HFE H63D (frecuencia génica de 0.186). La condición de heterocigoto (H63D/WT) se identificó en doce casos (frecuencia génica 0.124) y la condición de homocigoto (H63D/H63D) en seis casos (frecuencia génica 0.062). La frecuencia del alelo mutado H63D fue de 0.124.
Se observó que para cada estrato de reserva normal, elevada y baja de Fe, la ocurrencia de la variante natural de HFE se distribuyó en proporciones de 0.861, 0.708 y 0.838, respectivamente, sin diferencia estadísticamente significativa (prueba de Kruskal Wallis, p = 0.571). Para la variante de heterocigota de HFE (H63D/WT), la proporción resultó mayor para el estrato de SoFe (0.208) con respecto a los grupos de reserva normal y con reserva baja (proporción 0.083 y 0.333, respectivamente), sin diferencias estadísticamente significativas. Finalmente, para la condición de homocigoto HFE H63D/H63D, la distribución de casos resultó igual para los tres grupos de FS (tabla 1).
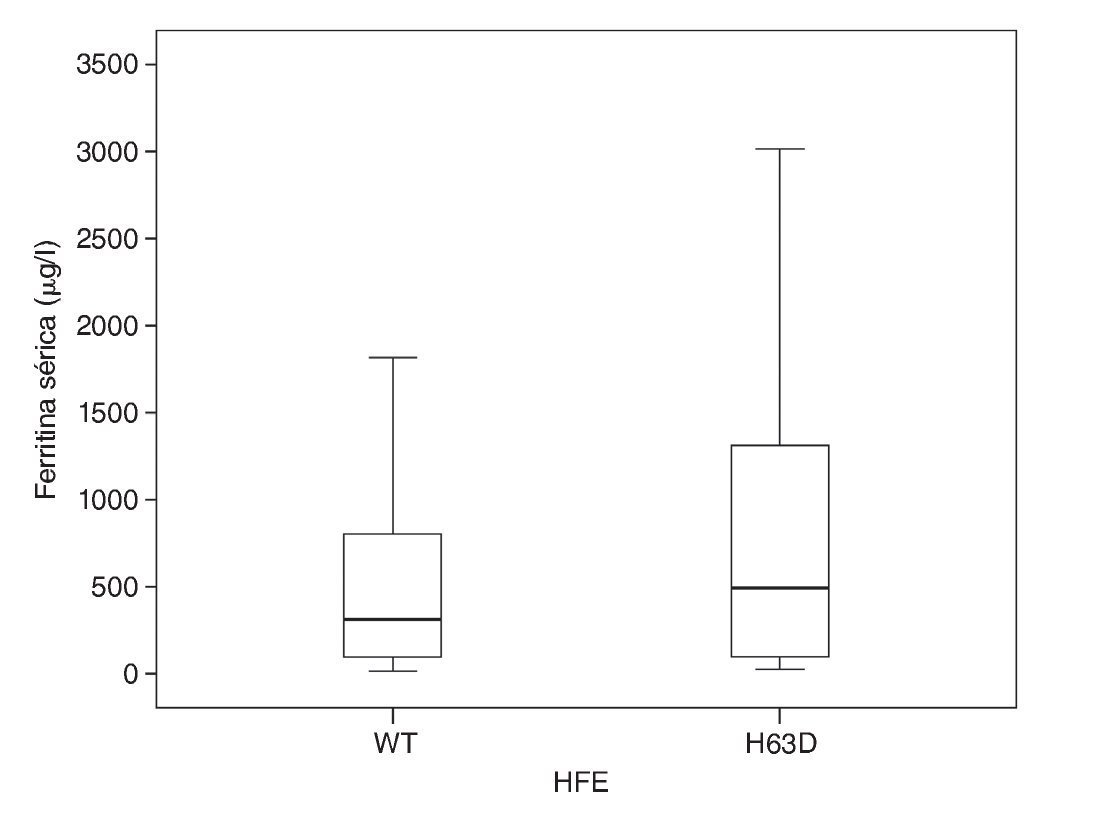
En la comparación de la distribución de los valores de FS con la variante natural del gen HFE y del alelo HFE H63D, se observó que, si bien hay diferencia en la media de los valores de FS entre ambos grupos, el grupo de casos con el alelo H63D presentó mayor dispersión en los valores de FS (fig. 1). En la comparación de las frecuencias percentilares (percentil 25 vs percentil 50 y 75), tampoco se documentaron diferencias estadísticamente significativas (χ2 = 0.007, p = 0.934).
Figura 1. Distribución de valores de ferritina sérica de acuerdo con el alelo H63D del gen HFE.
Considerando la frecuencia alélica (tabla 2) y la distribución en grupos de los valores de FS, se observó que para la condición natural del gen HFE y el alelo H63D, los valores de FS fueron en promedio de 585 μg/l (IC95% 477-693) y de 1,068 μg/l (IC95% 477-1658), respectivamente, sin diferencias estadísticamente significativas (U de Mann-Whitney, p = 0.21).
Al comparar la frecuencia alélica de HFE H63D por grupo, se observó una proporción de alelos mutados similar con respecto a la FS (0.291, 0.375 y 0.348, respectivamente). Se evaluó si el estado de los polimorfismos de H63D pudo ser un factor protector de la reserva baja de Fe o bien de riesgo para la sobrecarga de Fe, con resultados estadísticamente no significativos. Los resultados de la asociación entre polimorfismos H63D al comparar los recién nacidos con reserva normal de Fe contra aquellos con reserva baja de Fe fueron χ2 0.02; OR 1.2; IC95% 0.3-4.3, y al comparar a los casos con reserva normal contra neonatos con SoFe, χ2 = 1.2; OR 2.5; IC95% 0.7-9.2.
4. Discusión
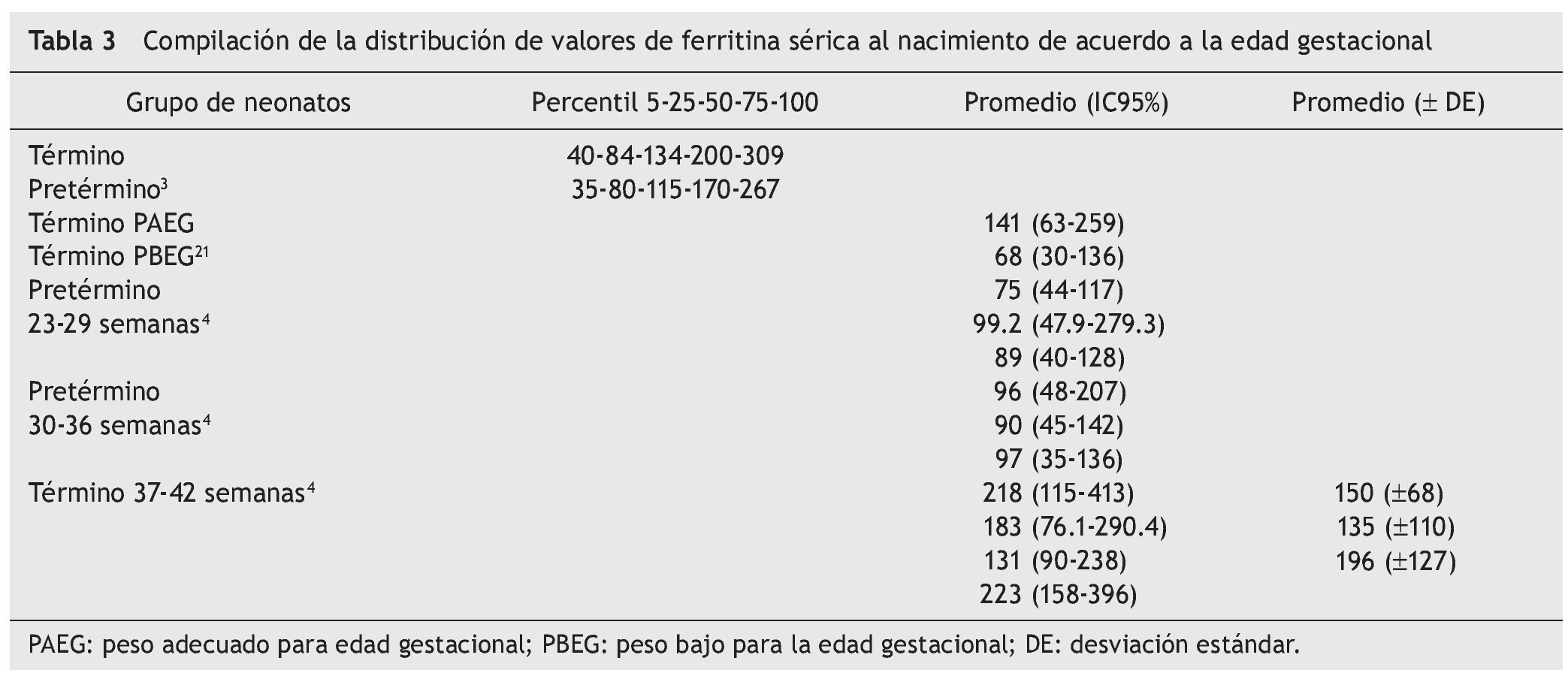
El efecto de las diversas variables que modifican la reserva de Fe tiene diferente peso para cada condición5. La distribución de los valores de FS de acuerdo con la edad gestacional al nacimiento presenta diferencias evidentes4. Entre las 23-29 semanas de gestación, la mediana de FS es de 88.1 μg/l (percentil 5-95 de 44.0 a 74 μg/l); para los neonatos entre la semana 30 a 36 de nacimiento, los valores son de 115.4 μg/l (percentil 5-95 de 55.6 a 182.1 μg/l); y para los que nacieron entre la semana 37 a 42, los valores de FS son de 165.8 μg/l (percentil 5-95 de 90.8 a 293.4 μg/l). Estos últimos valores son similares a los reportados por nuestro grupo7, con FS de 145 μg/l (24-139 μg/l). Además, los neonatos de término con peso bajo al nacer muestran valores más bajos de FS comparados con los neonatos eutróficos21. La compilación de resultados sobre los valores de FS al nacimiento señala el efecto definitivo de la edad gestacional, pero con amplia variabilidad para edades similares (tabla 3). Más que una diferencia relacionada con el método analítico, se relaciona con efecto de las variables clínicas perinatales2,4.
Al igual que para otras edades1, no existen criterios establecidos para la definición de SoFe. De manera arbitraria se eligieron valores de FS superiores a 1,000 μg/l, mientras que la reserva normal se consideró con valores de FS entre 154 y 1,000 μg/l, y la reserva baja de Fe aquellos por debajo de 154 μg/l.
Sin embargo, se han empleado otros criterios: en niños nacidos con menos de 32 semanas de gestación y evaluados a su egreso hospitalario, la deficiencia de Fe (FS <76 μg/l) se presentó en el 23% de los casos, mientras que la sobrecarga de Fe (FS >400 μg/l) afectó al 19%22. En el presente estudio, en el análisis de regresión logística se observó el efecto de la transfusión eritrocitaria previa (OR 1.41, IC95% 1.2-1.6); entre los neonatos que recibieron más de tres eventos de transfusión eritrocitaria, el 50% desarrolló SoFe22. Hasta el 70% de los neonatos con enfermedad hemolítica isoinmune presentan SoFe al nacimiento, persistiendo el 50 y el 18% hacia el primer y tercer mes de edad, respectivamente11.
El impacto clínico de la SoFe se ha evaluado en términos de diversas complicaciones, como colestasis hepática12, alteraciones en el neurodesarrollo23, enfermedades relacionadas con el daño tisular oxidativo24 y, aunque la evidencia es aún inconsistente, como factor de riesgo para el desarrollo ulterior de leucemia infantil19. De igual manera, la disminución de la reserva en la etapa fetal o neonatal puede alterar la estructura cerebral neuroquímica y conducir a una disfunción cognitiva a largo plazo y alteraciones motoras que no pueden ser corregidas con la suplementación con Fe25, o bien, la maduración auditiva anormal26.
La evaluación del estado de la reserva neonatal de Fe y las mutaciones del gen HFE en neonatos con diferentes problemas clínicos, que incluyen el peso bajo al nacimiento, se ha llevado a cabo sin tener suficiente evidencia para demostrar asociación clínica o estadística significativa27, de manera similar a lo presentado en este reporte. Una explicación tentativa de estas diferencias podría ser el efecto de la frecuencia poblacional de los polimorfismos del gen HFE. El estudio de diferentes poblaciones de neonatos en tantas áreas geográficas es notablemente similar, señalando el origen multiétnico de la variante HFE H63D, incluido el observado en nuestro país (tabla 4). Este hecho contrasta con lo reportado por la Encuesta Nacional de Nutrición28 respecto a que la prevalencia de la deficiencia de Fe es muy elevada, tanto para población adulta (18.1%) como para la etapa infantil29 (13-26%). De esto surge el cuestionamiento del esperado efecto protector de esta mutación. Si bien hay indicios de que el efecto de las mutaciones de HFE en la madre puede influir en la reserva fetal y neonatal de hierro, esto solamente se ha demostrado en modelos en animales30. Los estudios clínicos no han podido demostrar diferencias entre los valores de hemoglobina materna y la saturación de transferencia fetal17.
Sin considerar las condiciones clínicas particulares, como el caso de la transfusión eritrocitaria12, los neonatos con mutaciones de HFE muestran una mayor ocurrencia de casos con sobrecarga de hierro. Se requieren estudios poblacionales más amplios para determinar la ocurrencia de genes de HFE en la población neonatal abierta, así como la asociación de HFE y la SoFe. También se debe evaluar el impacto de la SoFe, los genes de HFE y la salud neonatal y, de encontrar alguna asociación, el impacto de las intervenciones preventivas y correctivas en la etapa preclínica (acumulación) y clínica (daño tisular).
En conclusión, el presente reporte señala la amplitud de las concentraciones de FS en neonatos de alto riesgo, sin considerar el antecedente de transfusión eritrocitaria o la pérdida iatrogénica de sangre para estudios de laboratorio. Solamente poco más de la tercera parte de estos neonatos tendrán reservas normales de Fe; aproximadamente el 25% tendrá sobrecarga de Fe y los restantes casos serán deficientes de Fe. Aún con el posible sesgo derivado del tamaño muestral, las variantes del gen HFE no tienen influencia en el estado de la reserva de Fe. Deberá definirse si en grupos selectos, como los neonatos con colestasis neonatal o enfermedad hemolítica perinatal11, pudiera tener alguna relevancia la evaluación de la posible asociación o impacto en las prácticas de suplementación con hierro31 o la búsqueda de las variantes del HFE en el tamiz neonatal32-35.
Recibido el 13 de septiembre de 2013;
aceptado el 3 de abril de 2014
* Autor de correspondencia.
Correo electrónico: baptistagh@gmail.com (H.A. Baptista González).