En pediatría, la hepatitis autoinmune y la colangitis esclerosante son patologías de afección hepática cuyo mecanismo de daño es inmunológico.
La hepatitis autoinmune es una enfermedad de etiología desconocida, caracterizada por hepatitis de interfase, hipergammaglobulinemia, autoanticuerpos circulantes y una respuesta favorable a la inmunosupresión. Es una enfermedad eminentemente pediátrica, con una afección prevalente hacia mujeres jóvenes. La terapia debe ser instituida con prontitud para prevenir el deterioro rápido, promover la remisión de la enfermedad y la supervivencia a largo plazo. La falta persistente de respuesta o la falta de adherencia al tratamiento dan como resultado una enfermedad hepática terminal. Los pacientes que desarrollan esta patología, y aquellos con insuficiencia hepática fulminante en el momento del diagnóstico, requerirán trasplante hepático.
In pediatrics, autoimmune hepatitis and sclerosing cholangitis are liver disorders with an immunological damage mechanism.
Autoimmune hepatitis is a disease of unknown etiology characterized by interface hepatitis, hypergammaglobulinemia, circulating autoantibodies and a favorable response to immunosuppression. It is an eminently pediatric disease with a prevalent condition in young women. Therapy should be instituted promptly to prevent rapid deterioration, promote remission of disease and long-term survival. The persistent lack of response or lack of adherence to treatment results in terminal liver failure; these patients, and those with fulminant hepatic insufficiency at the time of diagnosis, will require liver transplantation.
La hepatitis autoinmune (HAI) es una enfermedad inflamatoria hepática, caracterizada por un incremento en transaminasas, hipergammaglobulinemia policlonal, títulos séricos altos de autoanticuerpos no órgano-específicos y específicos de hígado, en ausencia de otra enfermedad hepática, caracterizada histológicamente por hepatitis de interfase1,2.
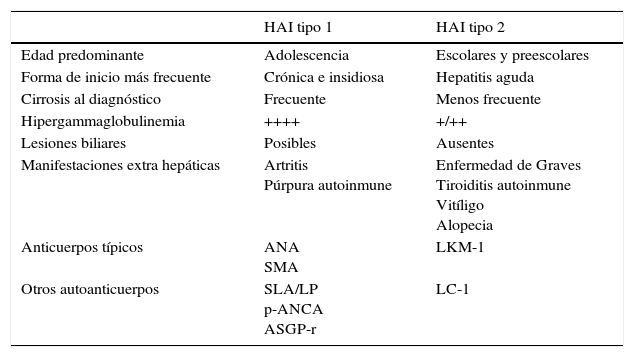
2ClasificaciónLa HAI se clasifica en dos subtipos según el tipo de anticuerpos séricos detectados en el momento del diagnóstico (tabla 1)3,4.
- a)
Hepatitis autoinmune tipo 1. Se caracteriza por la presencia de autoanticuerpos antinucleares (ANA) y/o anti músculo liso (smooth muscle antibody, SMA), el cual puede detectarse solo o en compañía de los antinucleares.
- b)
Hepatitis autoinmune tipo 2. Se caracteriza por la presencia de los autoanticuerpos antimicrosomas del hígado y riñón tipo 1(liver kidney microsome antibody, LKM1) o anti citosol hepático tipo 1 (anti LC-1).
- c)
Se ha propuesto también la HAI tipo 3, caracterizada por la presencia de anticuerpos frente a un antígeno soluble hepático (soluble liver antigen, SLA), también denominado antígeno hepatopancreático (liver/pancreatic antigen, L/P). Se describe solo, o en asociación con otros autoanticuerpos, principalmente SMA, por lo que algunos autores lo consideran una variante de la HAI tipo 15.
Diferencias entre los dos subtipos de hepatitis autoinmune en niños4
| HAI tipo 1 | HAI tipo 2 | |
|---|---|---|
| Edad predominante | Adolescencia | Escolares y preescolares |
| Forma de inicio más frecuente | Crónica e insidiosa | Hepatitis aguda |
| Cirrosis al diagnóstico | Frecuente | Menos frecuente |
| Hipergammaglobulinemia | ++++ | +/++ |
| Lesiones biliares | Posibles | Ausentes |
| Manifestaciones extra hepáticas | Artritis Púrpura autoinmune | Enfermedad de Graves Tiroiditis autoinmune Vitíligo Alopecia |
| Anticuerpos típicos | ANA SMA | LKM-1 |
| Otros autoanticuerpos | SLA/LP p-ANCA ASGP-r | LC-1 |
HAI: hepatitis autoinmune; ANA: anticuerpos antinucleares; SMA: anticuerpos antimúsculo liso; SLA/LP: anticuerpo contra el antígeno soluble hepático/antígeno hepatopancreático; p-ANCA: anticuerpo anticitoplasma de neutrófilos atípicos; ASGP-r: anticuerpo contra el receptor aislado de glucoproteína; LKM-1: anticuerpo antimicrosomas de hígado y riñón; LC-1: anticuerpo anticitosol hepático tipo 1.
Recientemente se ha descrito la hepatitis autoinmune seronegativa, la cual se debe sospechar en niños con datos clínicos o bioquímicos de enfermedad hepática crónica de causa desconocida y con histopatología compatible de HAI. En este caso, el tratamiento inmunosupresor se debe iniciar rápidamente a pesar de la falta de marcadores serológicos e incluso en niños con niveles normales o bajos de gammaglobulinas séricas6.
3EpidemiologíaLa enfermedad se encuentra en todas las regiones geográficas del mundo; la prevalencia en niños se desconoce. Como ocurre en otras enfermedades autoinmunes, el pico de incidencia se sitúa en la edad prepuberal, aunque puede ser diagnosticada en cualquier edad. 40% de los pacientes con HAI1 y 80% de los HAI2 se diagnostican en la infancia7. En los últimos años se ha reportado una incidencia creciente de esta enfermedad en niños y adolescentes8.
En niños mexicanos, se observa una edad promedio de 10 años al momento del diagnóstico para HAI1 y de 6 años para HAI2, con predominio del sexo femenino 3:19.
4EtiopatogeniaLa etiología de la HAI aún es desconocida; se trata de una enfermedad compleja, en la que los factores ambientales y la susceptibilidad genética del huésped conducen a la pérdida de auto-tolerancia y posteriormente al desarrollo de la enfermedad10.
4.1Factores genéticosLa susceptibilidad genética está parcialmente determinada por la presencia de moléculas especificas del complejo mayor de histocompatibilidad de clase II (major histocompatibility complex II, MCH II), y más directamente con el antígeno leucocitario humano (human leukocyte antigen, HLA)11. Las principales asociaciones son HLA-DR3 y HLA-DR4 (DRB1 * 03 y DRB1 * 04) en europeos y norteamericanos. En Japón, Argentina y México, la susceptibilidad está relacionada con DRB1 * 0405 y DRB1 * 0404. En niños, HLA-DRB1 * 1301 se relaciona con la susceptibilidad a HAI, determinando el pronóstico y la respuesta al tratamiento (tabla 2)12–18.
Asociación de HLA y hepatitis autoinmune en niños
| Referencia | Número total de pacientes / controles (Número de niños) | HLA evaluado | Conclusiones |
|---|---|---|---|
| Fortes et al15. | 41/111 (13) | HLA-A, -B, -C, -DR y DQ | En cuanto a HLA-A y –C, no hubo diferencias significativas entre los grupos. Para HLA clase I se observó un aumento en la frecuencia de B * 08, B * 18, B * 45 y B * 50; HLA B * 40 fue más frecuente en controles sanos. Para HLA clase II, se observó un aumento en la frecuencia de HLA-DQB1 * 02, -DQB1 * 04, HLA-DRB1 * 03, DRB1 * 13 y DRB3. HLA-DRB1 * 1301 y -DRB1 * 0301 fueron más frecuentes en niños |
| Fainboim et al16. | 52/197 (todos) | HLA-A, -B, -C, -DR y -DQ | No se encontraron asociaciones significativas con antígenos HLA clase I. El grupo HLA-DR6 (HLA-DRB1) mostró mayor frecuencia, principalmente HLA-DRB1 * 1301. Los análisis de HLA-DQ mostraron una asociación de HLA-DQB1 * 0603 |
| Pando et al17. | 206/208 (122) | HLA-DR y -DQ | Las frecuencias de HLA-DRB1 * 1301, -DRB1 * 0301, -DQA1 * 0103, -DQB1 * 0603 aumentaron significativamente en los pacientes con HAI. HLA-DRB1 * 1301 se asoció con una edad más temprana al inicio de la enfermedad, siendo el alelo asociado con la HAI en niños. HLA-DRB1 * 1302 funcionaba como un factor de protección |
| Bittencourt et al18. | 139/129 (74) | HLA-DRB y -DQB1 | En la HAI tipo 1 hubo un aumento significativo en los alelos HLA-DRB1 * 13, -DRB1 * 03, -DRB3 y -DQB1 * 06 en los pacientes. HLA-DRB1 * 13 fue más frecuente en niños que en adultos. La baja frecuencia de HLA-DQB1 * 0301 puede indicar un papel protector de este alelo. En HAI tipo 2, se observó un aumento significativo en DRB1 * 07, DRB1 * 03, DRB4 y DQB1 * 02 |
HLA: antígeno leucocitario humano; HAI: hepatitis autoinmune.
El mecanismo fisiopatológico consiste en una respuesta inflamatoria dada por linfocitos T, principalmente T cooperadores, linfocitos B, macrófagos y células NK (natural killer). El factor desencadenante o los factores que estimulan esta respuesta inflamatoria aún no se conocen19.
Algunos estudios han demostrado que los pacientes con HAI tienen disminución en el número y la función de los linfocitos T CD4+ CD25+, que se conocen como células T reguladoras. Estas células suprimen la proliferación y las respuestas de las citocinas de los linfocitos efectores CD4+ y CD8+ y disminuyen la regulación de las funciones de los macrófagos, las células dendríticas, las células NK y linfocitos B20–22.
Los marcadores de superficie involucrados en mecanismos antiinflamatorios son: el antígeno 4 del linfocito T citotóxico (cytotoxic T-lymphocyte antigen 4, CTLA-4), el factor regulador de la transcripción FOXP3 y la molécula de adhesión celular CD62L22,23. En pacientes con HAI, las células T NK se encuentran en números reducidos, produciendo niveles más bajos de interleucina 4 (IL-4) e IL-2, lo cual resulta en la reducción de la expresión superficial de CTLA-4 en células T CD4 +, desempeñando un papel fundamental en la autoagresión hepática24. Otra posibilidad implica la presencia de células T auto-reactivas CD4+ y / o CD8+, que podrían dañar las células hepáticas. Estas células están presentes en personas sanas, pero se encuentran diez veces incrementadas en pacientes con HAI25.
Se ha encontrado expresión aumentada de la proteína de membrana Fas en la superficie de los linfocitos en pacientes con HAI; este podría ser un mecanismo clave para la autoinmunidad. Fas (CD95) es parte de la familia del factor de necrosis tumoral e induce apoptosis a través del compromiso con su ligando (FasL / CD95L)26.
4.3Factores ambientalesEntre los fármacos asociados al desarrollo de HAI se encuentran nitrofurantoina, minociclina, metildopa, diclofenaco, atorvastatina, propiltiuracilo, isoniazida, agentes anti-retrovirales para el virus de la inmunodeficiencia humana y agentes anti factor de necrosis tumoral alfa (TNF). El consumo de algunos productos herbolarios se ha propuesto como agentes predisponentes. La causa exacta de la HAI inducida por fármacos no se conoce, pero puede deberse al efecto hepatotóxico de estos compuestos químicos. Los virus como la hepatitis A, B o C, además del sarampión, citomegalovirus y virus Epstein Barr han sido implicados como desencadenantes27–30.
5ClínicaEl curso clínico de la HAI se caracteriza por un amplio espectro de síntomas, que oscilan de ligeros a graves, con o sin manifestaciones extra-hepáticas. En aproximadamente la mitad de los pacientes, el inicio es semejante a una hepatitis vírica; pueden existir manifestaciones como astenia, nausea, vómito, anorexia, dolor abdominal seguido de ictericia, incluso en forma fulminante con insuficiencia hepática aguda. Puede presentarse de forma insidiosa, con síntomas inespecíficos como ictericia recidivante, cefalea, anorexia, pérdida de peso y retraso de aparición de la menarquia o amenorrea, con manifestaciones de hipercortisismo, que dura varios meses e incluso años antes del diagnóstico. Algunos pacientes no tienen antecedentes de ictericia y el diagnóstico se realiza por complicaciones de hipertensión portal, como esplenomegalia o sangrado de tubo digestivo por várices. La exploración física refleja la duración y gravedad de la enfermedad; 25% de los pacientes presentan una exploración clínica normal, aunque la hepatolomegalia es el hallazgo más común. La esplenomegalia suele acompañar la existencia de cirrosis, así como la presencia de estigmas hepáticos7,9,31–34.
5.1Enfermedades autoinmunes asociadas40% de los pacientes con HAI cursa con otra enfermedad autoinmune asociada35. Las mas frecuentes son: tiroiditis autoinmune, lupus eritematoso, vítiligo, enfermedad inflamatoria intestinal, enfermedad celíaca, diabetes mellitus tipo 1, enfermedad mixta del tejido conectivo, artritis, síndrome de Sjögren, trombocitopenia inmune primaria, anemia hemolítica, esclerosis múltiple, síndrome poliglandular autoinmune35–41. Se deben indagar detalladamente los antecedentes familiares y personales.
6DiagnósticoSe requiere un alto índice de sospecha de la enfermedad, ya que no hay síntomas específicos ni ninguna exploración complementaria que sea patognomónica de la enfermedad; no obstante, la combinación de parámetros característicos y la exclusión de otras entidades puede ayudar a establecer el diagnóstico.
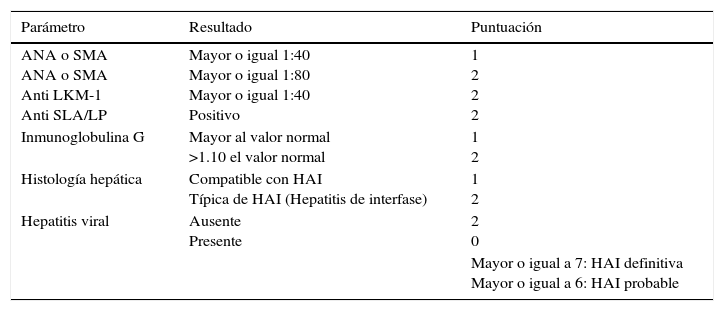
6.1Criterios diagnósticosLos criterios iniciales se publicaron en 1993 por el Grupo Internacional de la Hepatitis Autoinmune. En 2008, el mismo grupo propuso los criterios simplificados (tabla 3)42, que han sido validados y han demostrado tener adecuada sensibilidad y especificidad para el reconocimiento temprano de la enfermedad y el inicio oportuno del tratamiento inmunosupresor43–45.
Criterios diagnósticos simplificados42
| Parámetro | Resultado | Puntuación |
|---|---|---|
| ANA o SMA ANA o SMA Anti LKM-1 Anti SLA/LP | Mayor o igual 1:40 Mayor o igual 1:80 Mayor o igual 1:40 Positivo | 1 2 2 2 |
| Inmunoglobulina G | Mayor al valor normal >1.10 el valor normal | 1 2 |
| Histología hepática | Compatible con HAI Típica de HAI (Hepatitis de interfase) | 1 2 |
| Hepatitis viral | Ausente Presente | 2 0 |
| Mayor o igual a 7: HAI definitiva Mayor o igual a 6: HAI probable |
ANA: anticuerpos antinucleares; SMA: anticuerpos antimúsculo liso; LKM-1: anticuerpo antimicrosomas de hígado y riñón; SLA/LP: anticuerpo contra el antígeno soluble hepático/antígeno hepatopancreático; HAI: hepatitis autoinmune.
Clásicamente se encuentra elevación de las transaminasas e hipergammaglobulinemia. Estos hallazgos no sólo sirven para el diagnóstico, sino que son importantes indicadores pronósticos. Por lo regular, el patrón de afección es de citólisis, pero también puede presentarse un patrón de colestasis con bilirrubina directa, gamma glutamil transpeptidasa y fosfatasa alcalina elevadas. En ocasiones se puede observar déficit de IgA y descenso en proteínas del complemento C3 y C42,27.
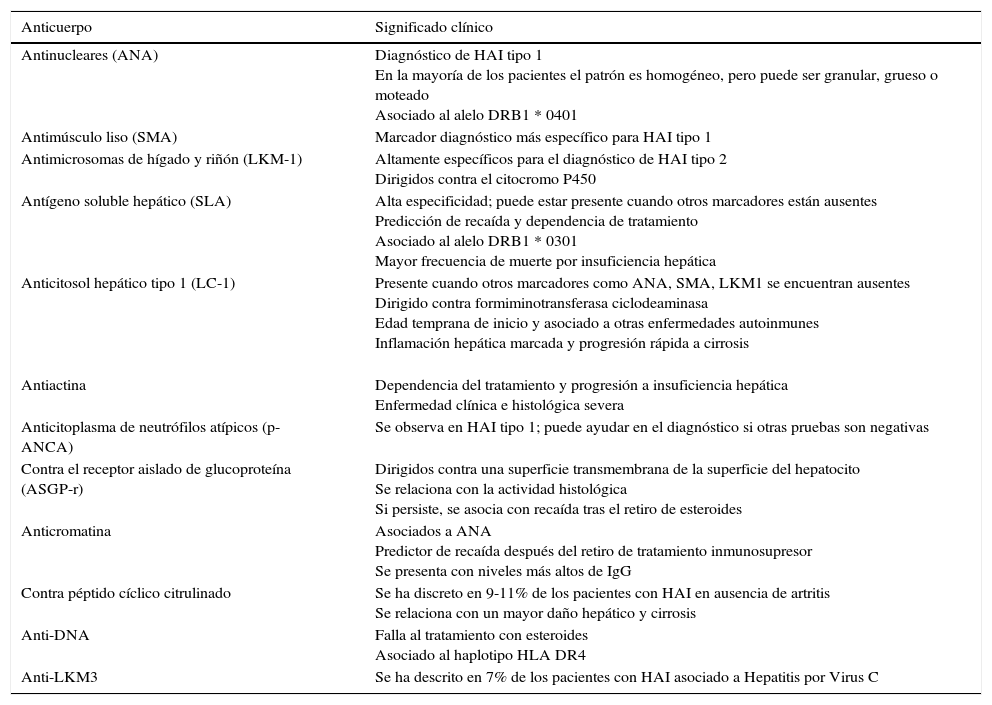
6.3AutoanticuerposSu detección constituye una importante herramienta diagnóstica que permite la clasificación en los diversos tipos de HAI (tabla 4)28,46–51.
Autoanticuerpos en hepatitis autoinmune
| Anticuerpo | Significado clínico |
|---|---|
| Antinucleares (ANA) | Diagnóstico de HAI tipo 1 En la mayoría de los pacientes el patrón es homogéneo, pero puede ser granular, grueso o moteado Asociado al alelo DRB1 * 0401 |
| Antimúsculo liso (SMA) | Marcador diagnóstico más específico para HAI tipo 1 |
| Antimicrosomas de hígado y riñón (LKM-1) | Altamente específicos para el diagnóstico de HAI tipo 2 Dirigidos contra el citocromo P450 |
| Antígeno soluble hepático (SLA) | Alta especificidad; puede estar presente cuando otros marcadores están ausentes Predicción de recaída y dependencia de tratamiento Asociado al alelo DRB1 * 0301 Mayor frecuencia de muerte por insuficiencia hepática |
| Anticitosol hepático tipo 1 (LC-1) | Presente cuando otros marcadores como ANA, SMA, LKM1 se encuentran ausentes Dirigido contra formiminotransferasa ciclodeaminasa Edad temprana de inicio y asociado a otras enfermedades autoinmunes Inflamación hepática marcada y progresión rápida a cirrosis |
| Antiactina | Dependencia del tratamiento y progresión a insuficiencia hepática Enfermedad clínica e histológica severa |
| Anticitoplasma de neutrófilos atípicos (p-ANCA) | Se observa en HAI tipo 1; puede ayudar en el diagnóstico si otras pruebas son negativas |
| Contra el receptor aislado de glucoproteína (ASGP-r) | Dirigidos contra una superficie transmembrana de la superficie del hepatocito Se relaciona con la actividad histológica Si persiste, se asocia con recaída tras el retiro de esteroides |
| Anticromatina | Asociados a ANA Predictor de recaída después del retiro de tratamiento inmunosupresor Se presenta con niveles más altos de IgG |
| Contra péptido cíclico citrulinado | Se ha discreto en 9-11% de los pacientes con HAI en ausencia de artritis Se relaciona con un mayor daño hepático y cirrosis |
| Anti-DNA | Falla al tratamiento con esteroides Asociado al haplotipo HLA DR4 |
| Anti-LKM3 | Se ha descrito en 7% de los pacientes con HAI asociado a Hepatitis por Virus C |
HAI: hepatitis autoinmune; HLA: antígeno leucocitario humano.
La biopsia hepática es necesaria para el diagnóstico de HAI, para determinar el estadio de fibrosis y la actividad inflamatoria, así como para comprobar la remisión y ausencia de actividad antes de suspender el tratamiento inmunosupresor. Es importante señalar que los valores de aminotransferasas y de IgG no reflejan el grado de daño tisular52.
La lesión típica consiste en un infiltrado inflamatorio de células mononucleares y plasmáticas que sobresale de la placa limitante entre el espacio porta y el lobulillo (hepatitis de interfase). Esta lesión puede extenderse formando puentes de necrosis con actividad inflamatoria entre diferentes espacios porta, que son remplazados posteriormente por tractos fibrosos. El infiltrado inflamatorio también puede estar presente de forma predominante en los sinusoides hepáticos (hepatitis acinar), como regeneración hepática con formación de rosetas53,54.
6.5Diagnóstico diferencialEl diagnóstico diferencial de HAI en niños y adolescentes es bastante amplio y requiere una atención meticulosa. La hepatitis viral crónica, principalmente hepatitis B y C, puede producir un cuadro clínico similar; la enfermedad de Wilson debe ser excluida. La colangitis esclerosante debe ser descartada, y debido a que estos pacientes pueden representar una proporción considerable de niños con enfermedad hepática autoinmune, la colangiografía se debe realizar cuando se sospeche HAI. La enfermedad hepática asociada a deficiencia de alfa 1 antitripsina puede semejar HAI en la edad pediátrica. Los niños con hígado graso no alcohólico pueden presentar títulos bajos de autoanticuerpos; la diferencia clínica es sencilla, aunque a veces se requiere de una biopsia hepática para distinguir estos dos trastornos1,55–57.
7TratamientoLa piedra angular del tratamiento en HAI está representada por el tratamiento inmunosupresor con corticosteroides. Alrededor del 80% de los casos responden positivamente a esta terapia. El esquema de tratamiento consiste en prednisona a una dosis de 2mg/kg/día (máximo 60mg/día), que se reduce progresivamente con base en la respuesta bioquímica dentro de 4 a 8 semanas, hasta una dosis de mantenimiento de 2.5-5mg. El objetivo es lograr una reducción de los niveles de transaminasas del 80% en las primeras 8 semanas, mientras que una normalización completa se puede obtener en los meses siguientes. Después de 6-9 meses de terapia, se ha informado de que 75-90% de los pacientes muestran resultados normales en sus pruebas de función hepática. En la primera fase del tratamiento se recomienda una estrecha vigilancia con una evaluación semanal de las pruebas de función hepática para ajustar la terapia en consecuencia58,59.
La azatioprina se añade al tratamiento corticoesteroide como agente ahorrador de esteroides. El régimen combinado de prednisona y azatioprina disminuye la frecuencia de los efectos secundarios inducidos por los corticosteroides. La dosis inicial de 0.5mg/kg/día puede incrementarse gradualmente hasta 2mg/kg/día en ausencia de signos de toxicidad para el logro y mantenimiento del control de la enfermedad. En vista de los efectos secundarios mínimos de los corticosteroides a una dosis baja incluso a largo plazo, se sugiere continuar con la terapia combinada para mantener la remisión de la enfermedad. Una dosis de mantenimiento de 1-1.5mg/kg/día de azatioprina, asociada con una dosis baja de esteroides, parece ser un programa de tratamiento eficaz y seguro a largo plazo59,60.
7.1Respuesta al tratamiento y seguimientoEl objetivo del tratamiento es el control de la enfermedad para evitar el desarrollo de cirrosis y sus complicaciones.
Se considera que la enfermedad está en remisión cuando los niveles de transaminasas e inmunoglobulina G (IgG) se normalizan y los autoanticuerpos se negativizan o se encuentran con títulos bajos. La resolución del daño histológico es más lenta que la normalización serológica, y la remisión bioquímica puede no reflejar la resolución histológica. Las recaídas se caracterizan por un aumento de los niveles de transaminasas e IgG con positividad y títulos altos de autoanticuerpos, se describe hasta en el 40% de pacientes y requiere tratamiento con dosis alta de esteroides61.
No hay indicaciones claras sobre la duración de la terapia inmunosupresora, pero después de 3 años de remisión bioquímica y en presencia de una resolución histológica de la enfermedad, es posible descontinuar gradualmente la terapia mientras se continúa con una monitorización serológica cercana. Es aconsejable evitar los intentos de suspensión de la terapia durante el período puberal y durante los primeros 3 años después del diagnóstico debido a la alta frecuencia de recaídas reportadas en estas fases62.
Las biopsias de seguimiento se recomiendan antes de retirar la terapia inmunosupresora o en pacientes con remisión incompleta con terapia estándar para excluir un diagnóstico alternativo o toxicidad farmacológica y evaluar el índice de actividad de la hepatitis para la estatificar la enfermedad y decidir si es necesario escalar el tratamiento63.
En los pacientes que reciben tratamiento con corticosteroides a largo plazo se recomienda una evaluación de la densidad ósea al inicio y anualmente. Se recomiendan terapias complementarias, como ejercicio regular y suplementar vitamina D y calcio58.
7.2HAI de difícil tratamientoEn aproximadamente 10% de los pacientes, la inmunosupresión habitual es incapaz de inducir y mantener la remisión de la enfermedad o no es bien tolerada a largo plazo debido a sus efectos secundarios. Si el paciente no ha respondido al tratamiento de primera línea, deben considerarse otras terapias. Es importante asegurar que los pacientes presentan adecuada adherencia al tratamiento, en particular los adolescentes, que tienen menos probabilidades de estar conformes con la terapia64. La presencia de cirrosis en el momento del inicio del tratamiento confiere mayor riesgo de fracaso del tratamiento53.
La budesonida es un esteroide sintético con alto metabolismo de primer paso en el hígado, con efectos secundarios sistémicos mínimos en comparación con los esteroides convencionales, que actúa como antiinflamatorio e inmunosupresor65. La budesonida oral con azatioprina puede inducir y mantener la remisión en pacientes pediátricos con HAI y puede considerarse una terapia alternativa a la prednisona. Este tratamiento causa menos efectos secundarios; sin embargo, puede ser menos eficaz que la prednisona para inducir la remisión66. No debe utilizarse en pacientes con cirrosis en los que la hipertensión portal reducirá el metabolismo de primer paso; también tiene la desventaja de administrarse cada 8 horas en comparación con la prednisolona, que puede administrarse una vez al día67.
El micofenolato es un inhibidor no competitivo de la inosina monofosfato deshidrogenasa, que bloquea la síntesis de novo de purinas. El micofenolato tiene una acción selectiva sobre la activación de linfocitos, con marcada reducción de la proliferación de linfocitos T y B. Se ha propuesto como terapia de segunda línea útil para niños y adolescentes con HAI que no responden al tratamiento convencional con esteroides y azatioprina68. Aunque el micofenolato el parece ser un agente prometedor que es especialmente útil como terapia de rescate en pacientes problemáticos, una desventaja significativa es su alto costo69.
La ciclosporina inhibe la activación de células T; se ha estudiado en niños y muestra resultados alentadores, por lo que puede considerarse una terapia alternativa a los esteroides en pacientes que no logran una remisión completa. La principal limitación de la ciclosporina son sus posibles efectos secundarios, como nefrotoxicidad, hipertensión y riesgo de malignidad. Por lo tanto, se necesitan ensayos multicéntricos que incluyan un gran número de niños tratados durante un período largo de tiempo para identificar la indicación clara y el perfil de seguridad de la ciclosporina para uso en niños70,71.
El tacrolimús conduce a la inhibición de la síntesis de citocinas (IL-2, IL-3 e interferón alpha (IFN-α)), la expresión del receptor de IL-2 y en la generación de células T citotóxicas. Hay pruebas limitadas de su uso en el tratamiento de la HAI en niños, pero algunos informes muestran que puede ser útil en asociación con esteroides en casos refractarios al tratamiento estándar. Se requiere especial atención con el monitoreo regular de los niveles séricos de tacrolimús para prevenir efectos secundarios debido a una alta concentración sanguínea, como convulsiones y nefrotoxicidad72–74.
El rituximab es un anticuerpo monoclonal quimérico anti-CD20, un marcador de superficie expresado en células B, inicialmente desarrollado para el tratamiento del linfoma de células B. El rituximab ha demostrado ser eficaz para el tratamiento de enfermedades autoinmunes, lo que sugiere que también podría ser eficaz en pacientes con HAI, la experiencia en el tratamiento de HAI es limitada, por lo que es necesario realizar ensayos clínicos controlados antes de que rituximab se pueda recomendar como un tratamiento alternativo en HAI75–77.
Infliximab, etanercept y adalimumab son agentes anti-TNF-α comúnmente utilizados para el tratamiento de enfermedades inmunomediadas como artritis reumatoide, psoriasis y enfermedad inflamatoria intestinal78. Existen algunas evidencias emergentes de que los anticuerpos anti-TNF son capaces de inducir la remisión en pacientes con HAI en quienes se han agotado las opciones terapéuticas estándar o alternativas; sin embargo, el desarrollo de HAI también se ha observado durante el tratamiento con anticuerpos anti-TNF79–81. Estudios futuros tendrán que definir el papel de los anticuerpos anti-TNF en casos de HAI difíciles de tratar.
El ácido ursodesoxicólico es un ácido biliar hidrofílico con capacidades inmunomoduladoras a través de la reducción de la expresión hepática del HLA-1 y suprime la producción de inmunoglobulina y citocinas82,83. Considerando el perfil de efectos secundarios relativamente benigno del ácido ursodesoxicólico, su uso puede considerarse en pacientes con menor actividad de la enfermedad en un intento de inducir la remisión; sin embargo, la experiencia en niños es limitada. En pacientes con HAI más activa, el ácido ursodesoxicólico puede permitir la reducción de la dosis de inmunosupresores, particularmente corticosteroides84.
7.3Trasplante hepáticoLa HAI representa la indicación para trasplante hepático en 2-3% de los receptores pediátricos58. En general, los casos de HAI que requieren trasplante hepático son pacientes con hepatitis fulminante que no responden al tratamiento farmacológico estándar y, en raras ocasiones, pacientes con enfermedad hepática progresiva a pesar del adecuado tratamiento inmunosupresor. El riesgo de recurrencia de HAI después del trasplante hepático parece ser mayor en aquellos pacientes que han sido trasplantados durante la fase activa de la enfermedad; no obstante, la recurrencia de HAI también puede ocurrir muchos años después85–87. Se recomienda mantener la terapia con esteroides a largo plazo en pacientes que han sido sometidos a un trasplante por HAI88. La supervivencia postrasplante hepático en HAI es buena, con tasas de supervivencia a 5 años de 90-95%89.
8PronósticoLa HAI es una causa importante de enfermedad hepática en niños, teniendo un curso particularmente agresivo en pacientes jóvenes. En aquellos pacientes que responden bien al tratamiento el pronóstico es bueno, pero hay que asegurar el cumplimiento de la terapia inmunosupresora. Se debe educar a los padres y a los adolescentes para el conocimiento de la enfermedad y su carácter crónico, ya que posiblemente los pacientes necesiten tratamientos prolongados o de por vida, así como que la suspensión o el no cumplir de forma adecuada el tratamiento conlleva un alto riesgo de recaída90,91.
Dado que su modo de presentación es variable, se debe sospechar HAI en todos los casos de enfermedad hepática en los que se excluyen las etiologías comunes para que el tratamiento apropiado se pueda iniciar rápidamente.
Las futuras terapias de HAI se realizarán mediante intervención molecular dirigida a los mecanismos del ataque autoinmune. Se encuentran en investigación nuevas modalidades de tratamiento, uno de los objetivos actuales es restaurar la función de células T-reguladoras autológas y su uso como una forma de inmunoterapia92,93. Otra opción de intervención específica es el uso de moléculas que inhiben competitivamente la unión de autoantígenos a las células presentadoras, reduciendo la presentación de antígenos y la consecuente activación de linfocitos, basado en el uso de anticuerpos monoclonales contra las citocinas implicadas en la génesis de la enfermedad hepática94.
9ConclusionesLa HAI es una enfermedad eminentemente pediátrica, con un aumento en la incidencia en los últimos años, por lo que debe sospecharse especialmente en pacientes en edad escolar y adolescentes con hepatomegalia y/o ictericia. La presentación puede ser insidiosa, por lo que debe formar parte del diagnóstico diferencial al evaluar síntomas inespecíficos como cefalea, anorexia, pérdida de peso, entre otros. La referencia oportuna a centros especializados para el diagnóstico debe realizarse en pacientes en quien se sospecha HAI, aun cuando estén asintomáticos, pero con hallazgos bioquímicos compatibles, principalmente elevación de las transaminasas e hipergammaglobulinemia. El tratamiento temprano evitará la progresión de la enfermedad, el desarrollo de complicaciones y mejorará la supervivencia de los pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio/artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.