Resumen de la historia clínica (A-11-35)
Paciente femenino de 4 años 4 meses de edad, que fue referida de un hospital de segundo nivel por cardiopatía compleja y atresia de esófago.
Antecedentes perinatales y patológicos
Producto de gesta I, control prenatal regular, nació por cesárea por oligohidramnios, peso 2,400 g, talla 48 cm, con Apgar 8/9. Se detectó al nacimiento atresia esofágica y cianosis, por lo que se trasladó a un hospital pediátrico donde se realizó gastrostomía y fístula esófago cervical izquierda. Se detectó tetralogía de Fallot extrema y se realizó fístula de Blalock-Taussig.
Padecimiento actual
04 marzo 09 (ingreso). Al año 11 meses de edad se refirió al Hospital Infantil de México Federico Gómez (HIMFG). Por consulta externa de Cardiología se inició abordaje con electrocardiograma, ecocardiograma, tomografía de tórax, cateterismo cardiaco. El caso se presentó en la sesión médico quirúrgica para decidir si era candidata a corrección total con colocación de tubo valvulado.
9 agosto 10. Se ingresó de manera programada para el procedimiento quirúrgico, en el cual se colocó un tubo Hancock de 12 mm de ventrículo derecho a confluencia de ramas pulmonares, ventriculotomía de 10 mm, comunicación interauricular de 7 mm, persistencia de conducto arterioso de 2 mm, y se ligó. El tiempo de bomba fue de 2 horas 15 minutos. El pinzamiento, de 1 hora 40 minutos. El tiempo quirúrgico, de 3 horas 30 minutos. Se presentó sangrado transoperatorio de 410 ml. Se inició reposición con hemoderivados por persistencia de hipotensión. Se manejó con aminas (dobutamina 7 μg/kg/min, dopamina 5 μg/kg/min, adrenalina 0.35 μg/kg/ min). Ingresó a terapia intensiva inestable, con síndrome de bajo gasto cardiaco (SBGC), además de persistencia de sangrado de más de 10 ml/kg/hora a través de las sondas (pleural y mediastinal) a pesar de la administración de factor VII y hemoderivados, por lo que ameritó exploración quirúrgica otra vez. Durante las primeras 72 horas de postoperatorio, presentó criterios de disfunción orgánica múltiple como consecuencia del SBGC y del choque hemorrágico, predominando la coagulopatía, la disminución progresiva del volumen urinario con disminución del índice de Schwartz y aumento de creatinina e hiperuricemia. Se manejó con infusión de furosemide, con respuesta parcial. Presentó también datos persistentes de síndrome de respuesta inflamatoria sistémica (SRIS) y biometría hemática (BH) con cifras de leucocitos 3,200, neutrófilos 36%, linfocitos 46%, bandas 28%, plaquetas de 49,000, procalcitonina de 54.47 ng/ml, por lo que se agregó cobertura con cefepime (150 mg/kg/día) y amikacina (15 mg/kg/día). La evolución fue tórpida. Se realizó la extubación programada al sexto día, con fracaso de la misma. Se acentuaron nuevamente los datos de falla cardiaca, por lo que se continuó el soporte con inotrópicos. Se intentó nueva extubación a las 48 horas utilizando ventilación no invasiva con presión positiva con buena respuesta. Sin embargo, a las 72 horas, se presentó nuevamente SRIS. En la Rx tórax se observó consolidación basal derecha. Una nueva BH con cifras de leucocitos 49,100, neutrófilos 89%, linfocitos 2%, bandas 8%, plaquetas 81,000, proteína C reactiva de 28.7 mg/dl, con descompensación hemodinámica y ventilatoria. Por ello, se intubó otra vez y se reinició dobutamina a 5 μg/kg/min. Se realizaron diversos cultivos. El broncoaspirado para formas invasivas resultó positivo para blastoconideas y pseudomicelios, con progresión del infiltrado bilateral y algodonoso. Se inició anfotericina liposomal (3 mg/kg/día). El proceso infeccioso condicionó nuevamente estado de choque. Requirió reanimación nuevamente, con cargas de solución cristaloide a 20 ml/kg y reinicio de soporte vasopresor. Al manejo, se agregó meropenem (100 mg/kg/día). Presentó de manera súbita hemorragia pulmonar y deterioro de sus condiciones respiratorias, con un patrón restrictivo. Un nuevo ecocardiograma reportó fracción de eyección 56%, de acortamiento 28%, movimiento septal paradójico, dilatación de vena cava inferior, conexión de tubo a nivel de confluencia de ramas con gradiente de 50 mmHg, sin condicionar obstrucción, dilatación de vena cava inferior. Se reportó Ag manano cándida: 750 ng/ml.
Radiografía (RX) de tórax. Imagen de ocupación en todo hemitórax derecho, broncograma aéreo sin visualizar ángulo costo diafragmático.
Con inestabilidad hemodinámica, datos de hipodinamia clínica, oliguria, lactato de 2, HCO3 16, déficit de base de -8, saturación venosa de 65% e hipotensión refractaria a líquidos.
Se incrementó la dosis de dobutamina a 8 μg/kg/min. Se inició milrinona (0.7 μg/kg/min) y adrenalina (0.3 μg/kg/ min); ventilatorio con presión inspiratoria pico de 20, presión positiva al final de la espiración de 7, FiO2 100%, kirby 60, índice de oxigenación de 22.
Se intentó ventilación de alta frecuencia oscilatoria, con mínima respuesta y gran repercusión hemodinámica, por lo que se cambió a ventilación convencional. Presentó incremento de azoados, oliguria, acidosis metabólica persistente, mala perfusión generalizada. Progresó con falla orgánica múltiple y paro cardiorrespiratorio que no respondió a maniobras avanzadas de reanimación.
Presentación del caso
Imaginología (Dra. Mariana Sánchez Curiel)
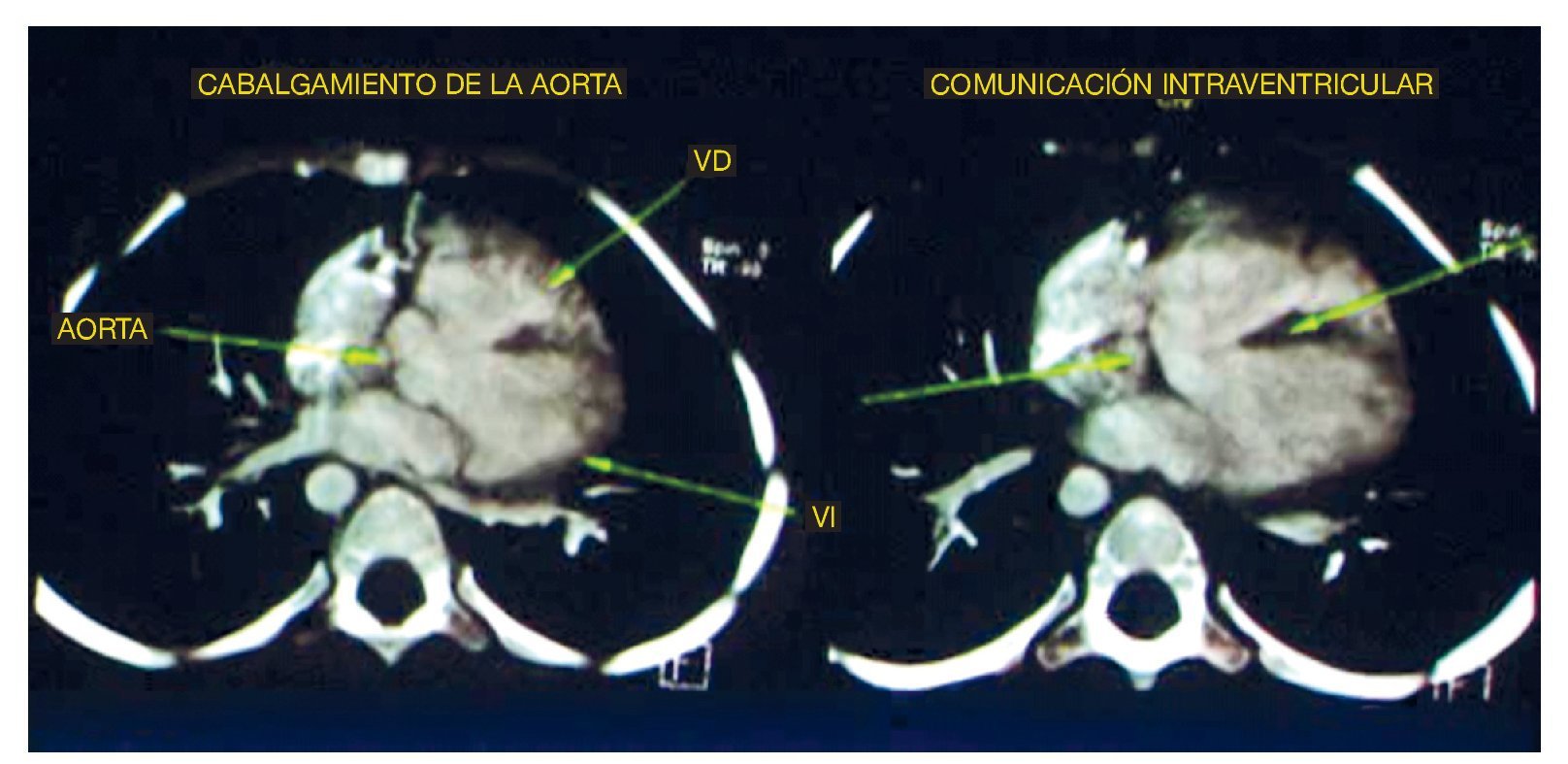
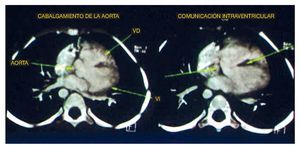
El primer estudio realizado fue una angiotomografía de corazón. Se encontró con un situs solitus, levocardia, adecuado drenaje venoso y una concordancia atrioventricular y ventriculoarterial normal. En las reconstrucciones axiales se observaron los cuatro hallazgos básicos de la tetralogía de Fallot: la emergencia de la aorta a nivel del ventrículo izquierdo y el cabalgamiento que existe de la misma a través del septo interventricular. El tabique se observó como la imagen hipodensa lineal central, que además mostró un defecto importante en su porción proximal relacionado con una comunicación interventricular (CIV); así mismo, en la emergencia de la aurícula derecha se observó la ausencia del tronco de la pulmonar. Sin embargo, la rama derecha y la rama izquierda mostraron un calibre y perfusión adecuados (fig. 1).
Figura 1 Se observan dos de los cuatro componentes de la tetralogía de Fallot: cabalgamiento de la aorta y comunicación interventricular. VD: ventrículo derecho; VI: ventrículo izquierdo.
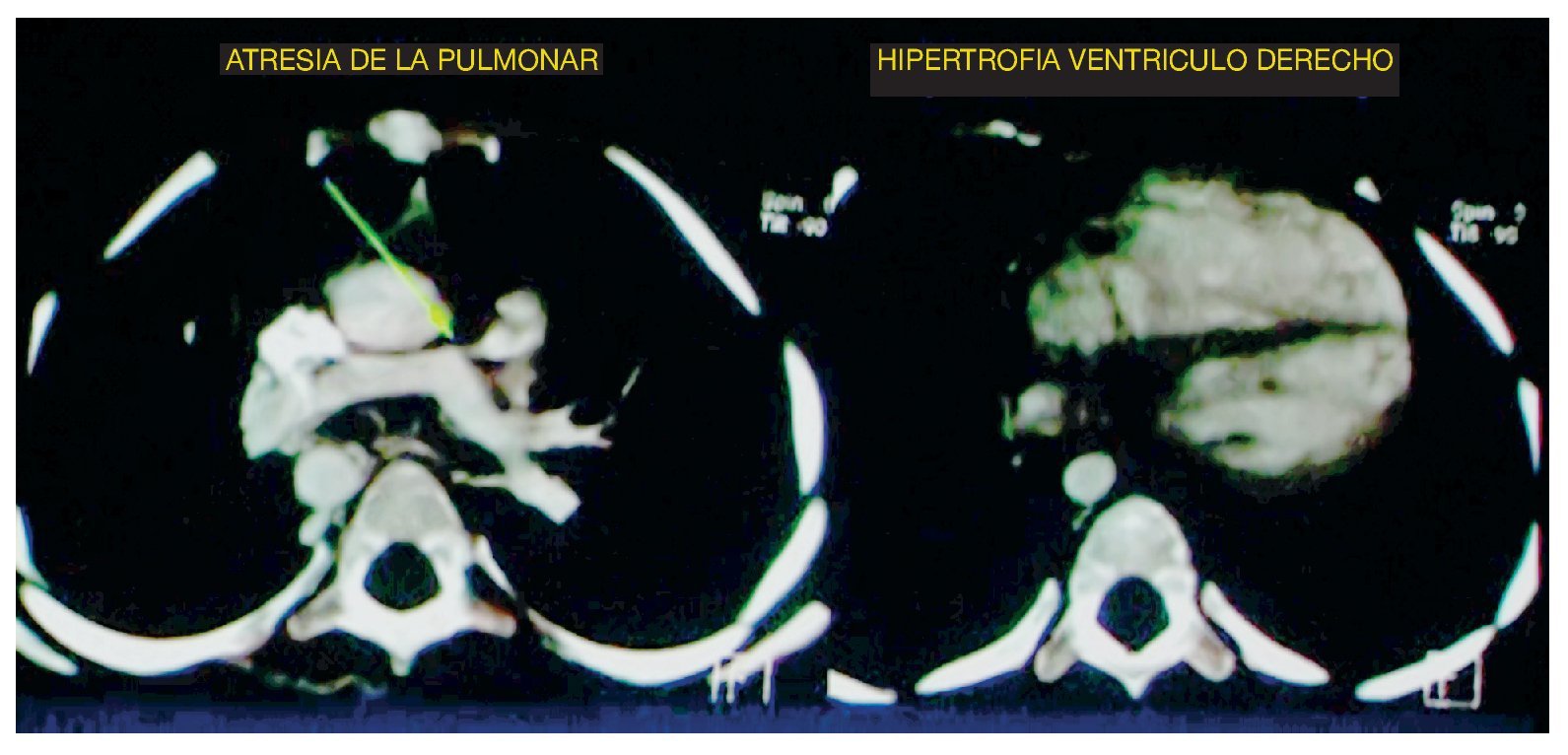
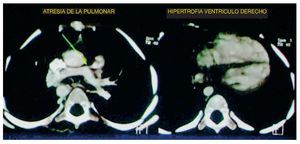
A nivel de cortes más caudales se pudo observar que la relación entre el ventrículo derecho y el ventrículo izquierdo era prácticamente la misma. Se debe recordar que el ventrículo izquierdo debería ser de mayor tamaño, puesto que maneja presiones, y el septum con una concavidad en este caso se encontró rectificado, lo cual habla de una hipertrofia al ventrículo derecho (fig. 2).
Figura 2 Se observan los otros dos componentes de la tetralogía de Fallot: ausencia del tronco pulmonar e hipertrofia ventricular derecha.
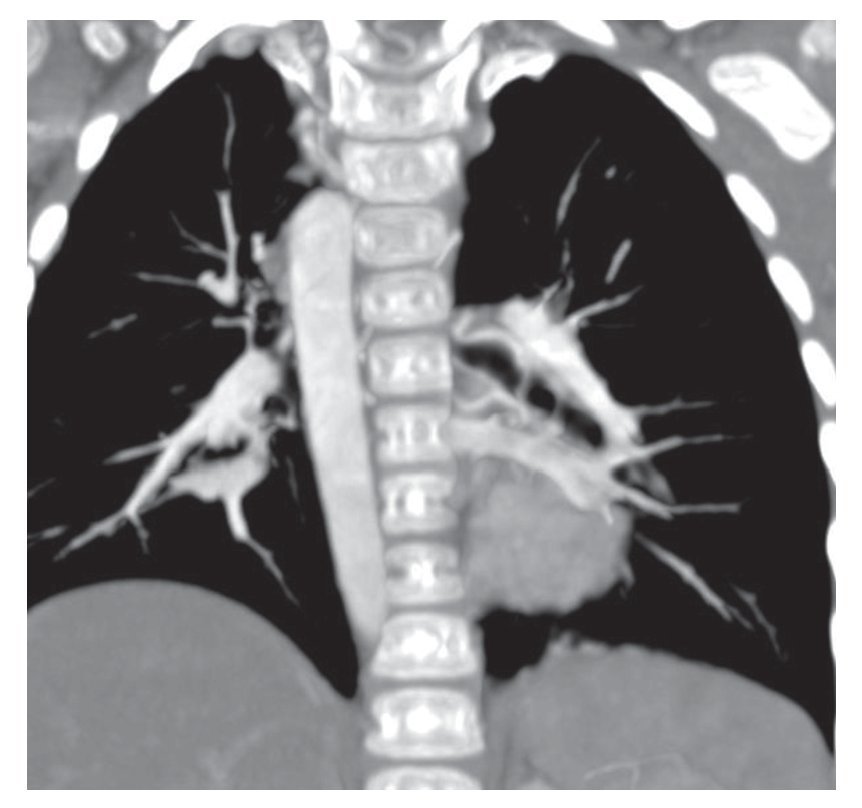
Asociado con esto se observó la presencia de un arco aórtico derecho. En la reconstrucción coronal se muestra el trayecto de la aorta torácica a nivel del lado derecho del paciente. En la reconstrucción volumétrica se ejemplificó mejor, inclusive desde el origen del cayado (fig. 3). En esta tomografía no fue posible valorar la permeabilidad, ni el calibre ni el trayecto de la fístula de Blalock-Taussig.
Figura 3 Arco aórtico derecho.
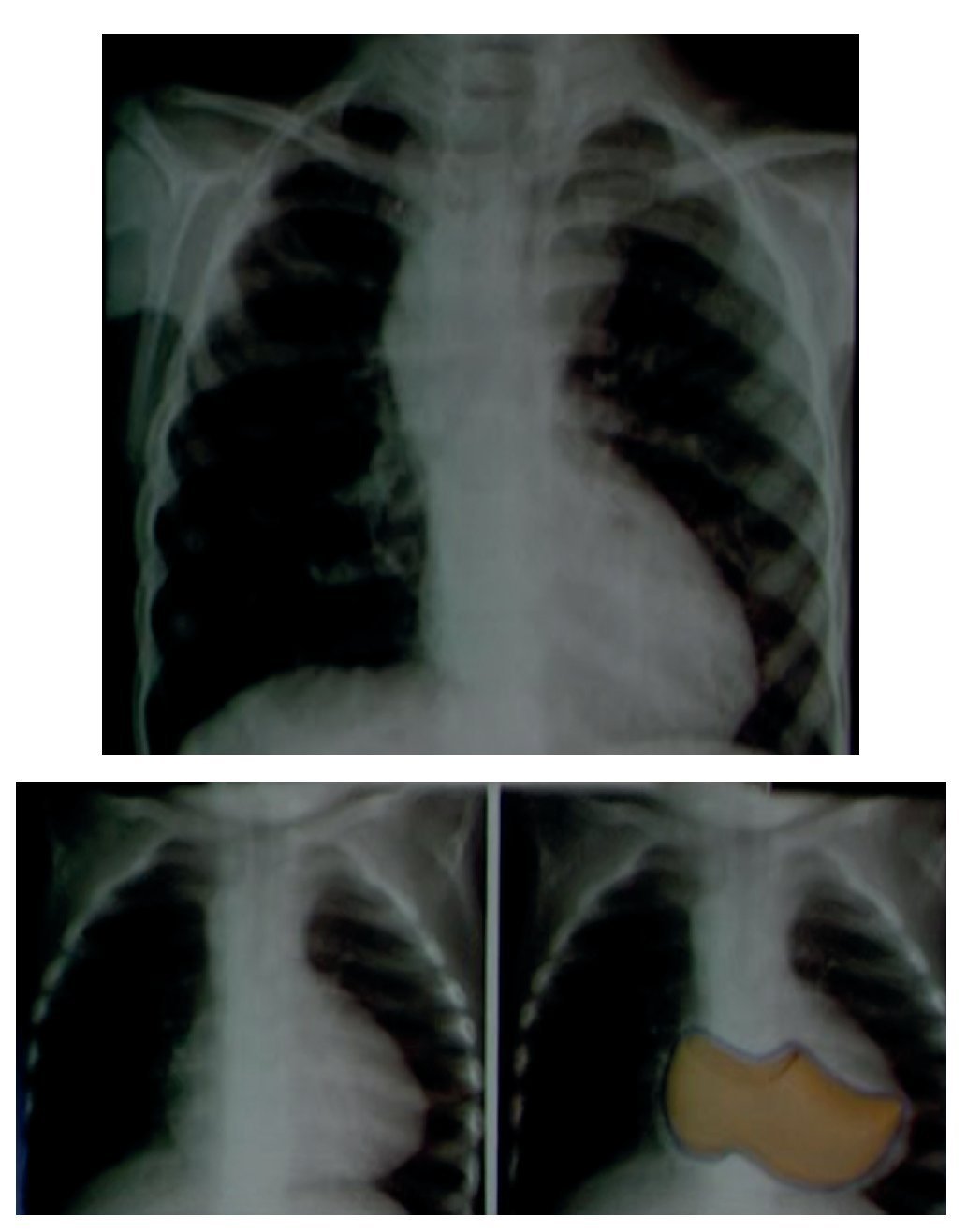
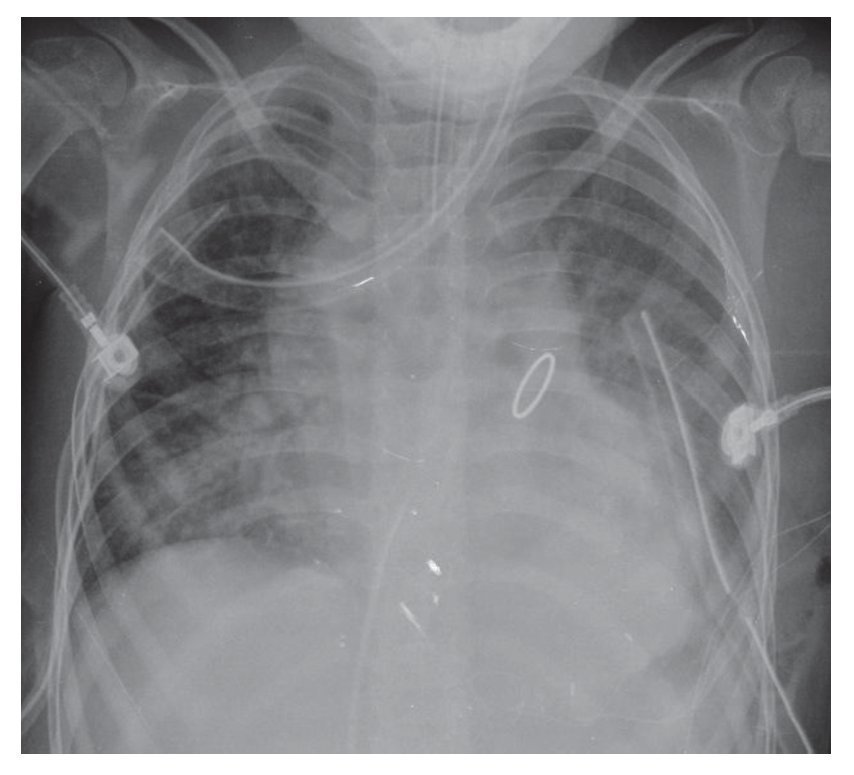
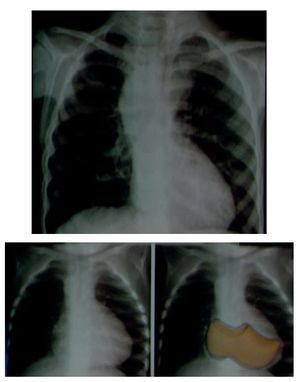
En una placa anteroposterior de tórax, la silueta característica de la tetralogía de Fallot es la imagen del "zapato sueco". El ápex corresponde a la punta y el talón al crecimiento de las cavidades derechas (fig. 4).
Figura 4 Imagen en "zapato sueco" característica de la tetralogía de Fallot, en la placa anteroposterior de tórax.
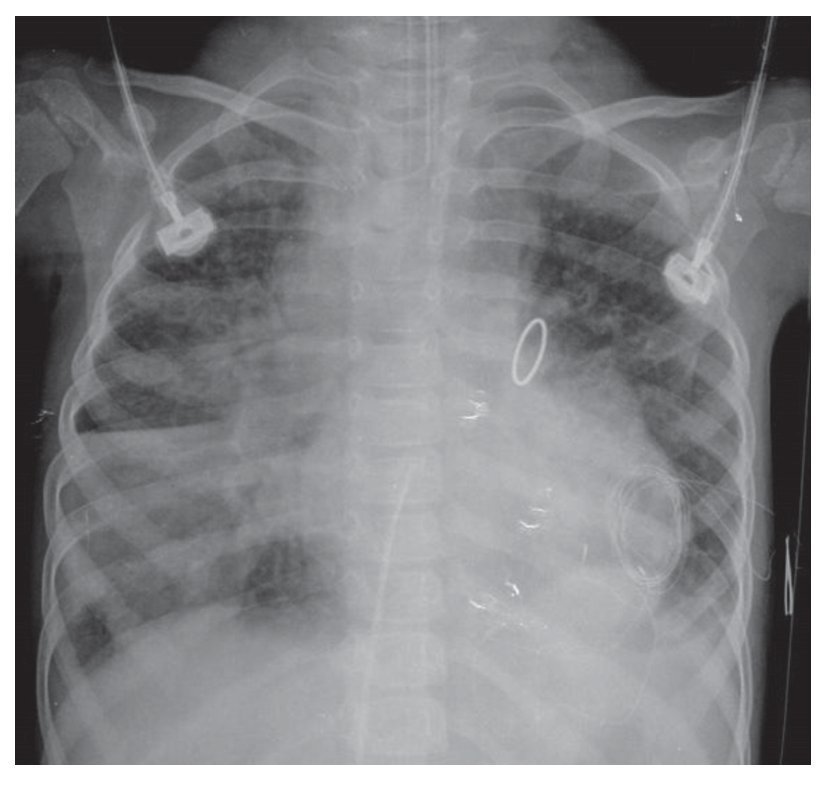
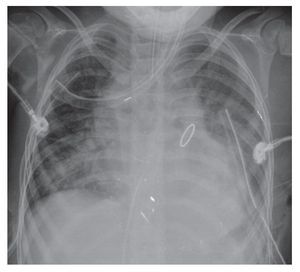
Para el 2010, un año después, la paciente contó con otra proyección anteroposterior de tórax. En esta se observó nuevamente el arco aórtico del lado derecho, el levantamiento del ápex sugestivo del crecimiento de las cavidades derechas, la prominencia del intersticio de forma generalizada y difusa; otro cambio importante fue un índice cardiotorácico aumentado, es decir, una cardiomegalia a expensas de, prácticamente, todas las cavidades. Esta imagen circular, redondeada, hiperdensa corresponde, muy probablemente, a la válvula de reposición que se menciona en la historia clínica. Lo más importante es que, en forma bilateral, se observó un infiltrado alveolar difuso ocupando la región basal, con mayor predominio en el lado derecho, y la presencia de derrame pleural bilateral. Incluso, en el extremo distal se observaron dos catéteres de drenaje y una sonda endotraqueal en adecuada posición, por arriba de la bifurcación carinal (fig. 5).
Figura 5 Radiografía anteroposterior de tórax, postope ratorio.
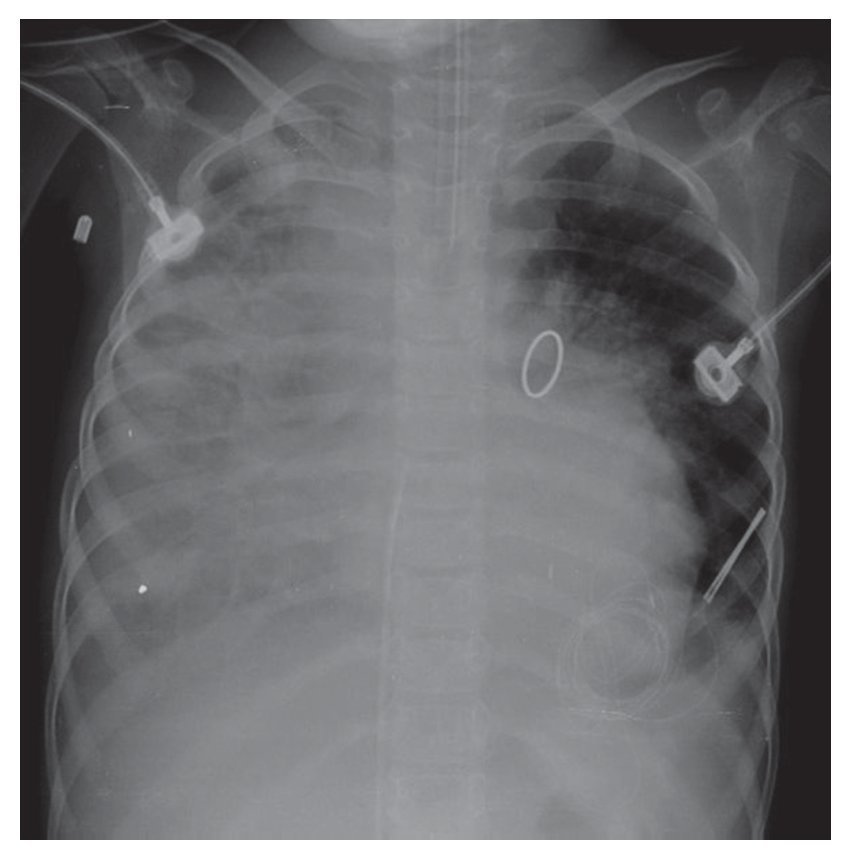
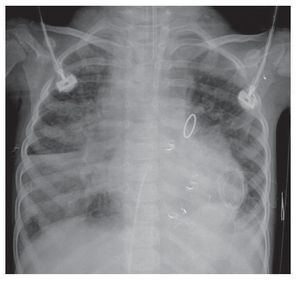
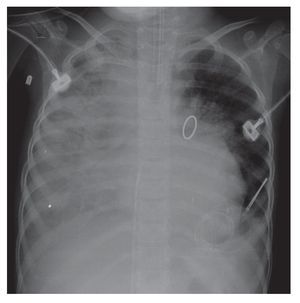
La evolución de la imagen mostró la organización de la consolidación basal derecha, que se hizo más evidente; incluso, se encontró asociada con una atelectasia pasiva ipsilateral. La congestión alveolar bilateral fue mucho más importante y borró, de este lado, el ángulo ipsilateral. Muy probablemente la paciente presentaba ya datos de sobrecarga pulmonar, es decir, de edema (fig. 6). En esta última radiografía se observó la imagen de "corazón peludo" —que es la prominencia bilateral de ambos hilios—, imagen característica del edema versus la hemorragia. También, la ocupación total del hemitórax derecho por este pulmón blanco, que pudiera relacionarse con la consolidación antes mencionada (fig. 7).
Figura 6 Consolidación basal derecha y congestión alveolar bilateral.
Figura 7 Progresión en proceso neumónico con prominencia bilateral en ambos hilios (sugestivo de hemorragia), así como ocupación total del hemitórax derecho.
Ecocardiografía (Dra. Paola Vidal Rojo, Cardiología)
El estudio realizado concluyó el diagnóstico de tetralogía de Fallot con todos sus componentes: cabalgamiento aórtico, comunicación interventricular, estenosis valvular pulmonar e hipertrofia del ventrículo derecho, además de un arco aórtico derecho (asociado con Fallot en aproximadamente el 25% de los niños), una presión del ventrículo derecho de 40 mmHg, función sistólica conservada y una fístula de Blalock-Taussig permeable.
Discusión
Departamento de Cirugía de Tórax y Endoscopia (Dr. Gustavo Teyssier Morales)
Se discute el caso de un paciente femenino de 4 años de edad, que fue referida de un hospital pediátrico del estado de Puebla a este instituto para la corrección de tetralogía de Fallot.
Producto de madre de 24 y padre de 37 años, sin antecedentes de importancia. El embarazo cursó con control médico. Producto de la primera gesta, pesó 2,400 g, con una calificación de Apgar de 8/9. Al nacer se detectó atresia de esófago. Aparentemente era una atresia de esófago tipo I, lo que significa que la paciente tenía dos cabos esofágicos ciegos sin conexión con la vía aérea, por lo que, al nacimiento, se realizaron la esofagostomía y la gastrostomía sin abordaje torácico. Se debe recordar que, generalmente, en los pacientes con atresia de esófago tipo 1, la brecha entre los dos cabos esofágicos es una brecha amplia, lo cual hace la plastia esofágica primaria algo imposible en la mayoría de los casos.
También se le diagnosticó tetralogía de Fallot en el hospital de referencia. A los 5 días de vida se operó de una fístula sistémico-pulmonar de Blalock-Taussig, sin complicaciones.
La paciente se conoció en la consulta externa de Cardiología de este instituto a la edad de 1 año 11 meses. Se encontraba con un déficit de peso del 15%, desnutrición aguda grado 1 (con un peso para la edad en el percentil 50). También presentaba cianosis generalizada y un soplo sistólico grado 4/6 con frémito.
Aproximadamente seis meses después de su primera visita al hospital se realizó una angiotomografía, que mostró ramas pulmonares confluentes, de buen calibre, la radiografía de tórax con cardiomegalia y la reducción del flujo pulmonar y arco aórtico derecho, y un ecocardiograma que informó de las características de tetralogía de Fallot, estenosis infundibular pulmonar con valor Z score de -7, crecimiento de las cavidades derechas y con ramas pulmonares normales, la fístula de Blalock-Taussig permeable y con imágenes sugestivas de colaterales pleurales.
A los 3 años 4 meses de vida se realizó el cateterismo y se encontró la fístula Blalock-Taussig estenosada en su origen pulmonar, con un mejor diámetro en el otro extremo subclavio. Presentó flujo escaso y lento; se encontró un flujo de circulación pleural, por lo cual se presentaría el caso en la sesión quirúrgica para la corrección.
Un año después, el 9 de agosto, la paciente ingresó al quirófano, donde se realizó la corrección con tubo valvulado. Se encontró abundante red colateral, un tronco de arteria pulmonar de 3 mm, una rama derecha de 7 mm y una izquierda de 6 mm, y CIV por desalineación de 8 mm. Se colocó un tubo valvulado tipo Hancock, del ventrículo derecho a la confluencia de las ramas pulmonares. Se dejó una CIV de 3 mm y se cerró la PCA. Como primera complicación se presentó hemorragia intensa que condicionó choque; requirió de nueva exploración quirúrgica.
Es necesario considerar varios factores que pudieron influir para la tan mala evolución de esta paciente, y explicar un poco el sangrado post quirúrgico. Primero, se debe tomar en cuenta que es una paciente de 4 años de edad, que cursó por un estado de hipoxemia crónica, secundario a lo cual pueden ocurrir diversos trastornos de la coagulación, como disminución de la cuenta plaquetaria, alteración de la función plaquetaria. También existe un déficit de factores de la coagulación dependientes de la vitamina K, y del factor V, un aumento en la actividad fibrinolítica y un déficit del factor de Von Willebrand. En segundo lugar, se debe considerar el sangrado masivo. La paciente sangró aproximadamente tres volúmenes circulantes durante la cirugía, que se repusieron con sangre reconstituida con plasma fresco, concentrado eritrocitario, plaquetas, albúminas y cristaloides. Los efectos de la transfusión masiva son bien conocidos y diversos; abarcan desde la coagulopatía y trombocitopenia, secundarios a la dilución y al deterioro de los factores de la coagulación de las unidades preservadas, hasta alteraciones electrolíticas, como hipocalcemia, hipokalemia, hipomagnesemia, daño pulmonar secundado de la transfusión masiva, daño renal secundario de la transfusión masiva, síndrome de respuesta inflamatoria, falla orgánica múltiple e, incluso, la muerte.
Se debe recordar que, además de los eventos adversos que se observan en el post-operatorio de la cirugía cardiaca, existe la reacción inflamatoria sistémica inducida por el contacto de la circulación sistémica con el sistema de circulación extracorpórea, que ocasiona activación del complemento, activación de neutrófilos, liberación de citocinas que ocasionan trastornos en la microcirculación, coagulopatías, fiebre y disfunción orgánica. Todo esto conforma el síndrome de post perfusión.
El último factor que tomar en cuenta como causa del sangrado de nuestro paciente es la gran circulación colateral que se encontró durante la cirugía, producto de la hipoxemia crónica que padeció en los años previos a la corrección de su patología.
Durante los primeros 5 días post quirúrgicos, la paciente evolucionó de manera tórpida hacia la mejoría, con saturaciones arteriales altas que mostraban una adecuada perfusión pulmonar y un buen funcionamiento del tubo valvulado, lo que permitió la disminución del aporte aminérgico. Se inició la cobertura antimicrobiana con cefepime y amikacina, porque presentó de nuevo respuesta inflamatoria sistémica. Desarrolló derrame pleural de 190 ml, por lo cual se colocó una sonda pleural derecha. No se contó con un análisis citoquímico ni con la descripción de las características del líquido puncionado, lo que orientaría a saber si la paciente había desarrollado un derrame para-neumónico infeccioso o un trasudado, secundario a la alteración en las presiones hidrostáticas de un paciente con inestabilidad hemodinámica que había recibido tal volumen de líquidos intravenosos.
El 15 de agosto se intentó la extubación programada que fracasó por la inestabilidad ventilatoria y hemodinámica. Finalmente, cuatro días después se logró la extubación. La paciente mantenía presiones venosas centrales entre 5 y 7, presiones parciales de oxígeno en la gasometría mayores a 60, lo que indicaba una adecuada perfusión y funcionamiento del tubo valvulado
Cuatro días después, la paciente inició con SRIS, 49,000 leuco citos, 90% de neutrófilos, bandemia, trombocitopenia y fiebre; evolucionó hacia un choque séptico, y requirió nuevamente de intubación endotraqueal y apoyo aminérgico. Se inició cobertura con vancomicina, por una probable lesión dérmica infectada. Se registraron formas invasivas en orina y en broncoaspirado, por lo que se inició anfotericina liposomal. En la siguiente semana el deterioro hemodinámico secundario al choque séptico continuó, y requirió cada vez mayor aporte ventilatorio. Se amplió la cobertura antimicrobiana con meropenem hasta que, finalmente, el día 28 de agosto presentó choque mixto, falla orgánica múltiple, y falleció1,2.
Con respecto a la evolución renal, la paciente presentaba desde la etapa pre-quirúrgica un síndrome cardio-renal crónico, secundario a la hipoperfusión renal, que conllevó al deterioro paulatino de la función del riñón. Además, durante el periodo post quirúrgico tuvo múltiples factores de riesgo para presentar insuficiencia renal, como el sangrado masivo, la transfusión masiva, el estado de hipotensión prolongada, el estado de choque y la sepsis. Desde el post operatorio temprano mostró datos de insuficiencia renal, secundaria a necrosis tubular aguda; presentó oliguria tratada con diuréticos y, aunque aparentemente mejoró en los días subsecuentes, pudo ser una fase poliúrica a la insuficiencia renal que dio paso a una insuficiencia renal claramente establecida, ya que presentó retención de azoados, acidosis metabólica e hipervolemia. A mi parecer, esta paciente debió haber recibido algún manejo dialítico desde etapas tempranas y fallo renal. Sin embargo, y aunque no está asentado en el resumen, no se inició. Probablemente por falta de métodos dialíticos de recambio lento, que hubieran sido los ideales, en el hospital.
Con todo esto, los diagnósticos finales son los siguientes.
• Cardiopatía congénita cianógena tipo tetralogía de Fallot
• Atresia esofágica tipo 1
• Operada de fístula de Blalock-Taussig, esofagostomía y gastrostomía
• Operada de corrección total con un tubo valvulado
• Sepsis por hongos con foco pulmonar
• Insuficiencia renal aguda
• Choque séptico y choque cardiogénico
Coordinadora (Dra. Maribelle Hernández Hernández)
Es importante recalcar que la mejor oportunidad que tienen estos pacientes es una referencia temprana, para que los métodos de evaluación y de intervención sean también oportunos y se pueda evitar una serie de complicaciones. En la variante específica de esta cardiopatía la diversidad de variables anatómicas obligó a efectuar una evaluación más acuciosa, con diversos estudios de imagen por parte del servicio de Cardiología.
Cardiología (Dr. Iñaki Navarro Castellanos)
La mayoría de este tipo de pacientes es referida al hospital de forma tardía.
Este caso se comenzó a abordar cuando contaba con 1 año 11 meses de edad, realizando dos estudios diagnósticos complementarios: tomografía y, posteriormente, cateterismo.
Actualmente, la mayoría de los centros solo realizan un estudio, y el mejor es el cateterismo. Si se requiere algún estudio previo para valorar la anatomía, se recomienda la resonancia magnética, ya que esto disminuye los riesgos de radiación3.
Por otro lado, esta paciente tenía factores de riesgo pre-quirúrgicos. Algunos no se descartaron, como la posibilidad de algún factor genético; por ejemplo una lesión 22q11, que se asocia hasta en el 22% de los pacientes con tetralogía de Fallot4.
En la experiencia del hospital, la mortalidad tampoco es alta (alrededor del 10%).
Coordinadora (Dra. Maribelle Hernández Hernández)
Durante la evolución de esta paciente se presentaron diversas complicaciones. Sin duda, lo que marcó una diferencia fueron los procesos infecciosos.
Se solicita la opinión del departamento de Infectología en relación con el esquema de tratamiento que recibió la paciente, y como segundo punto, en aquellos niños que se someten a trauma intenso y estrés, como fue el período postoperatorio de esta paciente, donde se desarrolló un SRIS de manera temprana. ¿Cómo se puede determinar el efecto de una infección para ofrecer un diagnóstico y tratamiento oportuno?
Infectología (Dra. Martha Josefina Avilés Robles)
Con respecto a la cobertura antimicrobiana, siempre se debe catalogar si se trata de una neumonía nosocomial asociada al ventilador, temprana o tardía, porque esto habla de los microorganismos causales. En esta paciente, la cual presentaba una neumonía tardía, era muy importante cubrir a los bacilos Gram negativos, particularmente entero-bacterias, Pseudomonas y Staphylococcus aureus meticilino resistentes. Todos los informes de la literatura internacional hablan de estos microorganismos como los más frecuentes. Varían en cuanto a orden de frecuencia, dependiendo de la flora que predomine en el nosocomio, pero necesariamente, ante una neumonía nosocomial, se deben cubrir estos microorganismos5.
Si la evolución no es adecuada, se debe considerar también la epidemiología propia del hospital. Una cuestión importante es que, actualmente, se ha informado de más bacterias multirresistentes, especialmente de Pseudomonas. En algún momento se han llegado a presentar en el HIMFG. Otro punto, que en estos momentos no es problema en el HIMFG pero que también es importante considerar, son los microorganismos como Acinetobacter, que cada vez tienen más presencia en las infecciones nosocomiales; principalmente en las terapias intensivas, en los pacientes multi-invadidos y en los pacientes con cirugías amplias y complejas.
En cuanto a la cobertura empírica con la que se inició, cefalosporina de cuarta generación más aminoglucósido, es la terapéutica que, de manera general, se recomienda actualmente. Esto puede variar dependiendo de si se tiene en algún hospital mayor incidencia de alguna bacteria en particular. De lo contrario, se inicia con el esquema comentado y se puede progresar a carbapenémico.
En el caso de sospechar de otro tipo de microorganismos, como en este caso cuando se sospechó la celulitis, se debe ampliar la cobertura de los cocos Gram positivos e incluso, con la evidencia indirecta que se tenía de hongos, se debe agregar cobertura empírica.
En relación con los marcadores de inflamación que puedan aportar evidencia para sospechar una infección versus la respuesta metabólica, que es tan importante después de la cirugía, hay varios estudios. El marcador que más apunta como de utilidad es la procalcitonina. En general, se han estudiado otros marcadores, como proteína C reactiva, interleucina-6 e interleucina-8. Actualmente se están utilizando otras técnicas moleculares, como micro-ADN o fragmentos bacterianos, que tal vez podrían ser de utilidad; sin embargo, son todavía muy lejanos para poder aplicarlos en el día a día.
Respecto de la procalcitonina es importante saber que, si bien orienta de la presencia de una infección bacteriana, también se ha documentado que se encuentra elevada (aunque en rangos bajos) por otro tipo de cuestiones, principalmente en las pancreatitis, traumas, en pacientes quemados, cirugías extensas, entre otros. Con todo esto, lo que se ha visto es que se pueden sugerir límites de corte para considerar qué tan probable es una infección bacteriana. Generalmente, a < 0.2 pg/ml se dice que la infección bacteriana es poco probable. De 0.2 a 2-5 pg/ml se dice que es una infección bacteriana probable. Sin embargo, prácticamente todos los estudios refieren que cuando se encuentra > 5-10 pg/ml es muy alta la posibilidad y puede apoyar la sospecha de una infección bacteriana; esto siempre complementado con la evolución clínica y la evolución radiológica. Los Centros para el Control y Prevención de Infecciones, en Atlanta, y otro tipo de organizaciones, como la Academia Latinoamericana de Infectología Pediátrica, se basan en los criterios clínicos y radiológicos, y sobre todo en la cantidad de leucocitos y en la evidencia microbiológica para apoyar el diagnóstico de neumonía nosocomial. Todavía no se apoyan en la determinación de la concentración de procalcitonina como una evidencia franca para la infección, aunque es el marcador que más se está investigando para que, en un futuro, pueda dar un mayor apoyo del diagnóstico6-8.
Hallazgos del Departamento de Patología (Dr. Mario Perezpeña Diazconti)
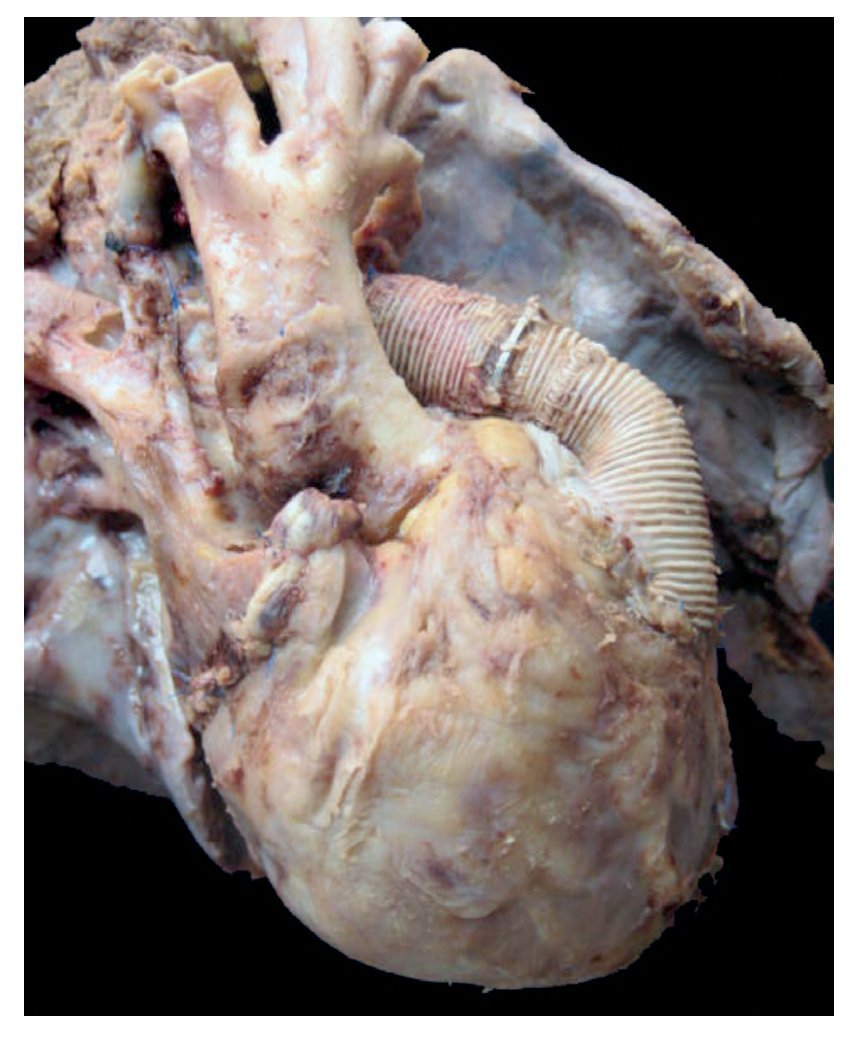
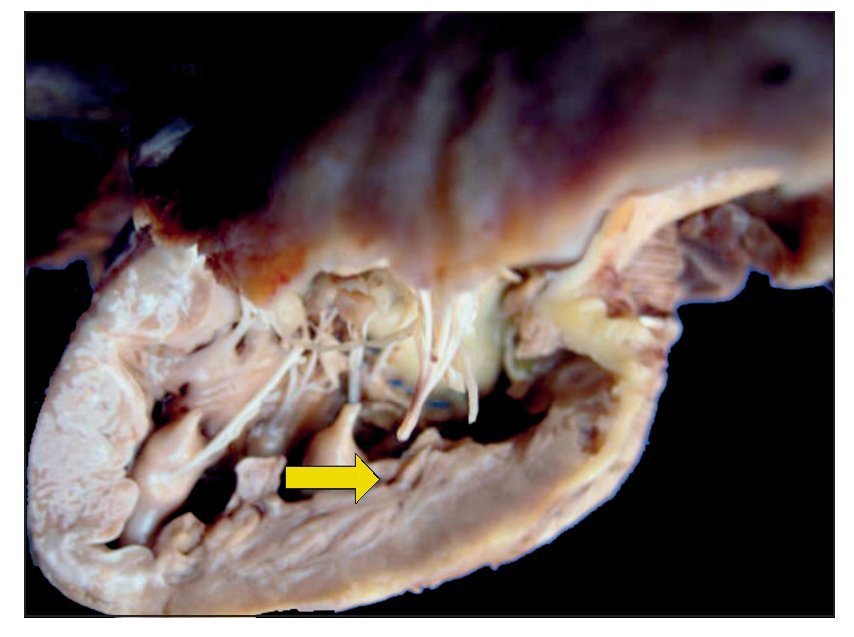
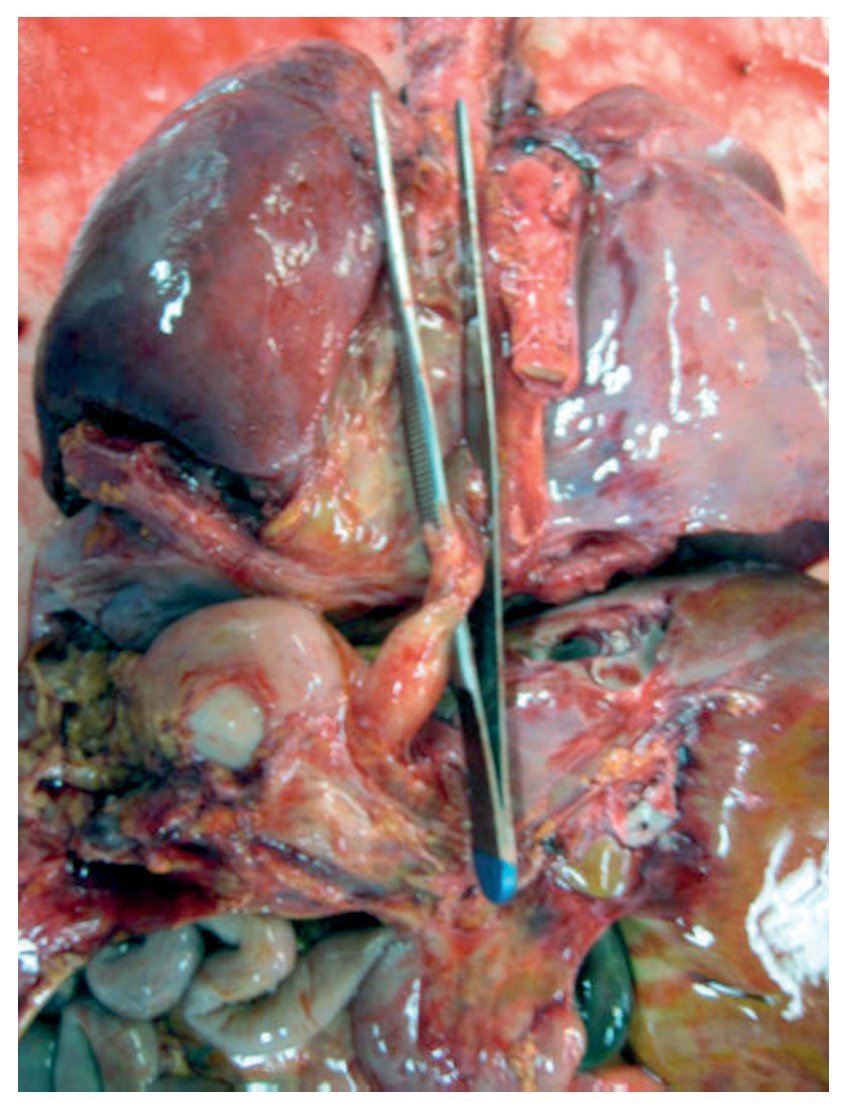
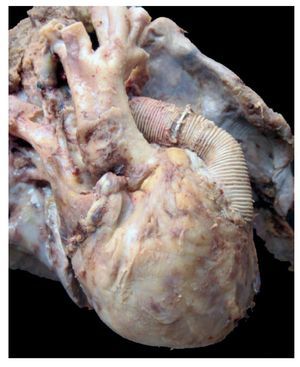
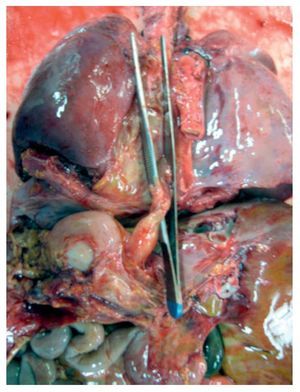
En primer lugar se muestran los hallazgos del corazón, aunque en el caso de esta autopsia no se trató del órgano con el daño principal. Todo el bloque cardiopulmonar estaba aumentado de tamaño y de peso: los dos pulmones con peso observado (PO) de 650 g para un peso esperado (PE) de 147 g y el corazón pesó 350 g para un esperado de 77 g. Se puede observar el tubo valvulado con el anillo metálico implantado del ventrículo hacia la emergencia de las arterias pulmonares, como se describió en la historia clínica (fig. 8).
Figura 8 Se corrigió la cardiopatía con tubo valvulado de Hancock de 12 mm, que conectó el ventrículo derecho con la confluencia de las ramas pulmonares.
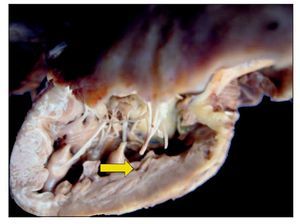
No se encontró ninguna alteración en las suturas, no hubo restos de hemorragia, ni coágulos; es decir, técnicamente no había ningún problema en el momento del estudio. A la apertura de la cavidad se pudo observar este implante que cerró la comunicación interventricular. Se presenta hipertrofia del ventrículo derecho. Se puede observar, en el fondo, el parche interventricular y la hipertrofia de la pared (fig. 9).
Figura 9 La comunicación interventricular de 7 mm fue reparada con parche de pericardio (flecha).
Histológicamente, el ventrículo derecho muestra pleomorfismo nuclear, algunos núcleos hipercromáticos y un poco de edema que está relacionado con la hipertrofia. En el ventrículo izquierdo también se observa algo de edema entre las miofibrillas, algún cambio en el tamaño y forma de los núcleos, también debido a hipertrofia.
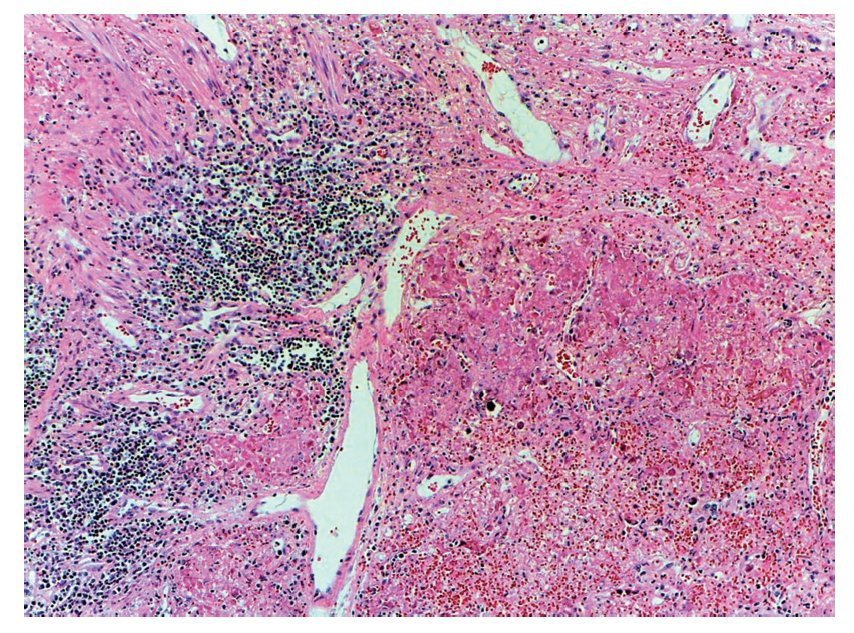
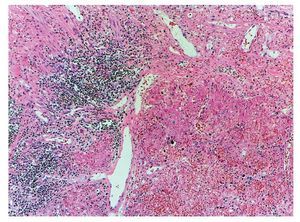
Sin embargo, el daño más importante es en los pulmones. Presentan una superficie de aspecto sólido que tiene extensas zonas de color café rojizo y otras áreas de color gris o café claro; esto está representado por un daño muy grave, que es una neumonía necrosante, que afectó prácticamente todo el pulmón del lado derecho. Se observó el remanente de un bronquiolo donde vemos el epitelio desprendido. Este material eosinófilo ocupa la luz y en el resto, como se puede observar, no se reconoce el parénquima pulmonar. Hay extensas zonas de hemorragia asociadas con zonas con intenso infiltrado inflamatorio de mononucleares. En otras áreas, insistiendo en que todo el parénquima pulmonar está necrosado, no es reconocible el pulmón. Resulta una neumonía muy grave con áreas de hemorragia reciente (fig. 10).
Figura 10 Neumonía necrosante. No fue posible identificar la morfología pulmonar debido a la extensa necrosis provocada por el agente etiológico. Además, se presentaron zonas de hemorragia reciente y cúmulos de células inflamatorias.
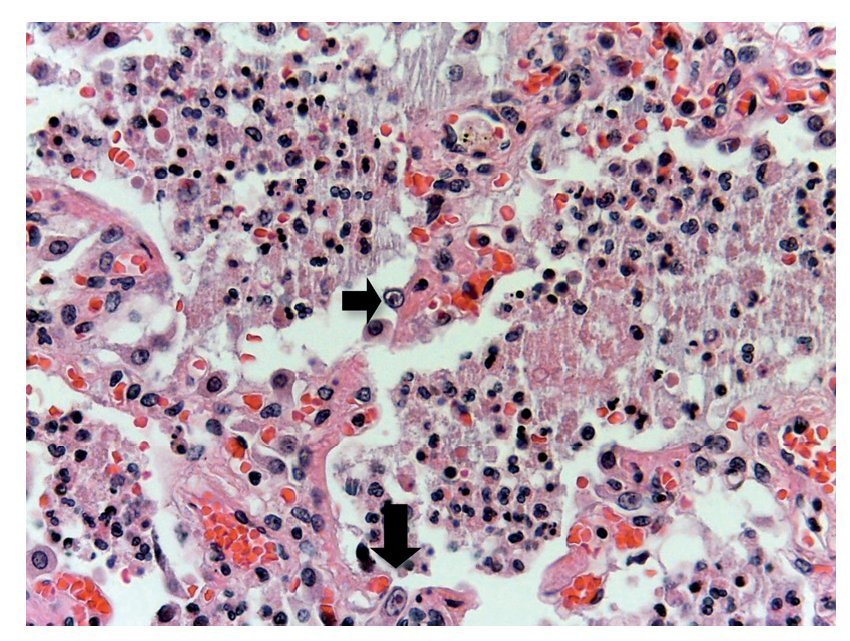
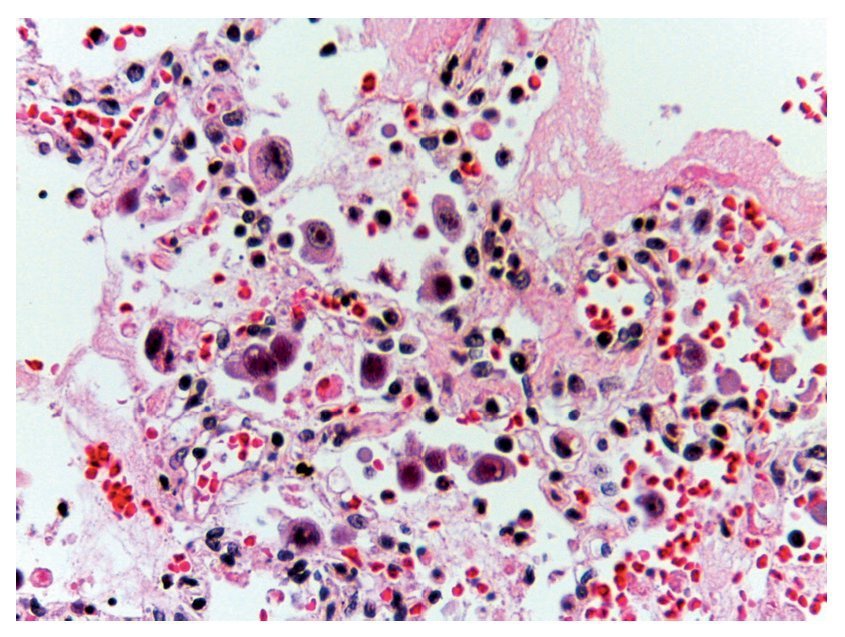
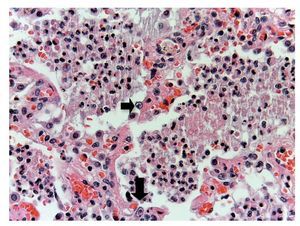
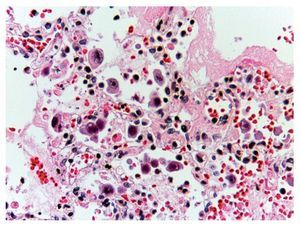
En otras áreas donde aún se conserva un poco el parénquima, es posible reconocerlo; se encuentra edema, hemorragia y otras zonas con espacios alveolares ocupados por infiltrado inflamatorio de leucocitos polimorfonucleares asociados con una etiología bacteriana. En otras zonas está ocupado todo el espacio alveolar por estos leucocitos polimorfonucleares. Se comienza a notar la presencia de estas células que corresponden a citomegalovirus (fig. 11). Por lo que se sospecha de que el origen de esta neumonía necrosante tan grave es un citomegalovirus (CMV). Hay una gran cantidad de estas células por todos lados, especialmente en las zonas de necrosis. Prácticamente parece un cultivo de citomegalovirus. Las células son grandes, el núcleo es muy grande con un halo claro y el nucléolo es de color rojo intenso. Característicamente, el citoplasma muestra algunos gránulos de color azul, que corresponden también a partículas virales (fig. 12).
Figura 11 Los espacios alveolares fueron ocupados por leucocitos polimorfonucleares y detritus celular. Se notó la presencia de células grandes, con núcleo claro, nucléolo prominente y abundante citoplasma (flechas).
Figura 12 Abundantes células de citomegalovirus. Células infectadas con inclusión intranuclear basofílica grande y halo claro. El citoplasma es abundante con pequeñas inclusiones basófilas. Se ha referido el 50% de los casos fatales en neumonía por CMV.
Como se sospechaba, en el lado izquierdo del pulmón se pueden notar las paredes alveolares. En este caso, con el espacio alveolar relleno de líquido que corresponde a edema, algo de hemorragia y otras zonas donde hay enfisema por ruptura de las paredes, generando estos grandes espacios aéreos.
Se muestra el cabo distal del esófago, que no tiene comunicación con la parte superior (fig. 13).
Figura 13 Se muestra el bloque toracoabdominal con el cabo distal de esófago (pinza).
Intencionadamente se buscó la presencia de hongos en los pulmones con la tinción de Pas y Grocot, pero no hubo evidencia de ninguna estructura micótica en cualquier corte.
En otros órganos se observó lo siguiente: el remanente del esófago con infiltrado inflamatorio, la unión esofagogástrica sin ninguna otra alteración, la mucosa del estómago con algunas áreas congestivas. La zona de la gastrostomía histológicamente mostró algo de infiltrado inflamatorio de polimorfonucleares, y la mucosa se encontró conservada, prácticamente sin alteración.
El hígado se encontró aumentado de tamaño y de peso, con un color verde amarillento y congestión como datos de choque final. Los dos riñones también estaban aumentados de tamaño y de peso, y mostraron extensa congestión en la zona de la corteza, la presencia de algunos cilindros hemáticos en algunos túbulos y material eosinófilo en la luz de los mismos. La zona de la médula, también muy congestiva y, como efecto secundario a la administración de diuréticos, la presencia de calcificaciones que eran extensas. El bazo estaba aumentado de tamaño y de peso, y mostraba una congestión masiva. El timo estaba disminuido de tamaño y con pérdida del número de elementos linfoides asociados con un evento de choque final. Bandas de contracción en la musculatura lisa del tubo digestivo en intestino delgado y el colon, también asociados con un evento de choque.
Diagnósticos anatómicos finales:
Enfermedad principal
Malformaciones congénitas caracterizadas por cardiopatía congénita
• Tetralogía de Fallot extrema
• Atresia esofágica
Alteraciones concomitantes Procedimientos practicados fuera del HIMFG
• Estado post Blalock-Taussig derecho, modificado (09-04-2007)
• Atresia esofágica corregida con fístula esófago-cervical izquierda (09-04-2007)
• Estado post gastrostomía (09-04-2007)
Procedimientos practicados en HIMFG
• Estado post corrección total con tubo valvulado (09-08-2011)
• Estado post ligadura del conducto arterioso (09-08-2011)
• Estado post exploración quirúrgica torácica (09-08-2011; 23 h) con sangrado en sitio de unión de Blalock-Taussig
• Líquido en cavidad pleural derecha 150 ml serohemático
• Líquido en cavidad peritoneal 20 ml serohemático
• Neumotórax negativo
• Cardiomegalia (PO 350 g/ PE 77.5 g)
• Atresia pulmonar
• Comunicación interventricular
• Hipertrofia de ventrículo derecho
• Neumonía necrosante viral (CMV) y bacteriana
• Nefrocalcinosis secundaria a uso de diuréticos
• Desnutrición (PO 10,280 g/ PE 20,000 g)
• Atrofia cerebral (PO 1,100 g/ PE 1,204 g)
• Nefromegalia (PO 240 g/ PE 103 g ambos riñones)
• Esplenomegalia congestiva (PO 65 g/PE 49 g)
Datos anatómicos de choque
• Involución aguda del timo
• Miopatía visceral hipóxico isquémica en tubo digestivo
• Necrosis tubular aguda
Cultivos post mortem
• Hemocultivo con desarrollo de levaduras
• Colon con desarrollo de Proteus mirabilis, Klebsiella pneumoniae y Morganella morganii
• LCR, pulmones, bazo, hígado e intestino delgado sin desarrollo de microorganismos
Causa de muerte
Neumonía necrosante por citomegalovirus
Infectología (Dra. Martha Josefina Avilés Robles)
El citomegalovirus es un virus ubicuo. La primoinfección se da generalmente en edades tempranas. Hay varios estudios epidemiológicos que dicen, por ejemplo, que en Estados Unidos, en la etapa de la adolescencia, del 40 al 60% de la población ya tiene memoria inmunológica del virus, y el 80% para la edad adulta. También se han documentado variaciones dependiendo de la raza. Por ejemplo, en esos estudios, la raza hispana y los mexico-americanos estaban colonizados hasta en el 80%.
Otro punto importante es que cuestiones como el hacinamiento, los conglomerados y la pobreza favorecen la transmisión o la infección a edades más tempranas. En México, a los tres años de edad, más o menos el 90% de la población ya tuvo el "primer contacto" con el CMV. Se dice el "primer contacto", porque la manifestación más frecuente de la infección es la asintomática; de manera que, generalmente, nos infectamos pero no manifestamos la enfermedad. Como se sabe, este es un virus que se queda latente de por vida en el organismo. Mientras se es inmunocompetente, no surge la enfermedad. Pero un momento de inmunocompromiso puede favorecer la reactivación del virus. Probablemente esta paciente ya había tenido una primoinfección, y la gravedad de su enfermedad pudo causarle inmunocompromiso transitorio que favoreciera la reactivación de virus y la afección pulmonar.
Otra forma en la que pudo haber adquirido el CMV pudo ser por las transfusiones de hemoderivados que recibió. Aunque no se podrá saber con certeza, probablemente ya había tenido el contacto con el virus. Debido a la particularidad de este caso, se realizó una búsqueda en la literatura sobre esta entidad; existe documentación de casos aislados, incluso una pequeña serie de casos de neumonías por CMV en pacientes post-operados en terapias intensivas. Lo que se ha empezado a ver y a documentar es que el estado de inmunoparálisis, el factor de necrosis tumoral alfa y también la infusión exógena de catecolaminas pueden, en algún momento, reactivar el CMV cuando se encuentra de manera latente9.
No siempre esta reactivación se traduce en enfermedad a un órgano blanco, como en este caso en el que se desarrolló una neumonía. Hay que recordar que el pulmón es el principal órgano afectado por CMV. Si bien la neumonía por CMV no es una entidad que de manera habitual tengamos que considerar, sí tenemos que estar conscientes de que existe bibliografía en la que, por la respuesta inflamatoria generada por la liberación de células proinflamatorias, puede ocurrir la reactivación del CMV. Hay estudios en los que se monitorizó la carga viral de CMV por PCR o por anti-genemia, y se observó que existen elevaciones de la carga viral que pueden ser asintomáticas o llegar a traducirse en enfermedad10-12. Entonces, dado que la neumonía por CMV es una entidad muy infrecuente y solo existen algunos casos informados en la literatura, no se puede hacer una recomendación universal de iniciar manejo dirigido contra este virus. Sin embargo, debe considerarse en pacientes graves, como este caso, cuando se presenta una evolución atípica de una neumonía y cuando se ha dado una amplia cobertura antibiótica para bacterias y hongos, y pese a ello no se logra una mejoría clínica.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Recibido el 4 de diciembre de 2013;
aceptado el 12 de diciembre de 2013
* Autor para correspondencia.
Correo electrónico:maribellehdez@yahoo.com.mx (M. Hernández Hernández).